修回日期: 2013-10-25
接受日期: 2013-10-31
在线出版日期: 2013-11-28
目的: 调查基质细胞衍生因子α(stromal cell-derived factor-1α, SDF-1α)/趋化因子受体4(chemokine receptor 4, CXCR4)轴在骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells, BMSCs)治疗2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS)诱导的结肠炎中的作用.
方法: 从SD大鼠骨髓中分离BMSCs并使用流式细胞术鉴定. 通过慢病毒技术使BMSCs表达绿色荧光蛋白(green fluorescent protein, GFP; Ad-GFP-BMSCs)或共表达CXCR4和GFP(Ad-CXCR4-BMSCs), Western blot检测BMSCs转染前后CXCR4蛋白表达. 32只大鼠被随机分成4组(n = 8): 空白组、模型组、Ad-GFP-BMSCs组和Ad-CXCR4-BMSCs组. 采用TNBS诱导实验性结肠炎, 尾静脉注射Ad-CXCR4-BMSCs或Ad-GFP-BMSCs治疗结肠炎大鼠. 细胞治疗1 wk后收集结肠组织, 免疫荧光以及Western blot检测结肠部位GFP和SDF-1α表达.
结果: 慢病毒转染后BMSCs的存活率大约为90%, 80%的BMSCs能够稳定表达GFP蛋白. 相对空白组, 结肠炎大鼠结肠部位SDF-1α表达明显上升. 尾静脉注射治疗1 wk后, 与正常组比较, Ad-GFP-BMSCs组不能迁移至受损结肠并显著的下降炎症病理分数(3.50±0.53 vs 3.62±0.52, P>0.05). 与模型组比较, Ad-CXCR4-BMSCs能够显著的下降结肠炎疾病活动指数(2.71±0.28 vs 3.88±0.17, P<0.01)和病理炎症分数(2.25±0.71 vs 3.62±0.52, P<0.01). 与Ad-GFP-BMSCs组比较, Ad-CXCR4-BMSCs组结肠部位GFP蛋白表达明显增高(0.70 ± 0.34 vs 0.10 ± 0.12, P<0.01).
结论: SDF-1α/CXCR4轴在BMSCs归巢于受损的结肠部位中发挥重要的作用, 可能为炎症性肠病的细胞治疗提供潜在的方法和理论依据.
核心提示: 成功构建稳定过表达趋化因子受体4(chemokine receptor 4, CXCR4)的骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells, BMSCs), 证实上调CXCR4能促进外源性BMSCs向炎症肠道归巢进而增强对炎症性肠病(inflammaotoy bowel disease, IBD)的治疗作用, 并探讨其机制, 为临床有效应用BMSCs治疗IBD提供理论参考.
引文著录: 刘星星, 范恒, 段雪云, 唐庆, 寿折星, 左冬梅, 张丽娟, 曹丹, 邹舟. SDF-1α/CXCR4轴促进间充质干细胞归巢于实验性结肠炎受损结肠. 世界华人消化杂志 2013; 21(33): 3623-3630
Revised: October 25, 2013
Accepted: October 31, 2013
Published online: November 28, 2013
AIM: To investigate whether the stromal cell-derived factor-1α (SDF-1α)/chemokine receptor 4 (CXCR4) axis mediates the therapeutic effects of bone marrow-derived mesenchymal stem cells (BMSCs) for 2, 4, 6-trinitrobenzene sulfonic acid (TNBS)-colitis in rats.
METHODS: BMSCs were isolated from Sprague-Dawley (SD) rats and identified by flow cytometry. Lentivirus transfection was applied to over-express CXCR4/GFP (Ad-CXCR4-BMSCs) or null/GFP (Ad-GFP-BMSCs), and Western blot was applied to detect the protein expression of CXCR4 in BMSCs. Thirty-two SD rats were randomly divided into four groups (n = 8 for each group): a control group, a model group, an Ad-GFP-BMSCs group and an Ad-CXCR4-BMSCs group. Experimental colitis was induced with TNBS, and Ad-CXCR4-BMSCs or Ad-GFP-BMSCs were administered intravenously. One week after cell therapy, the colons were harvested. The expressions of GFP and SDF-1α in colon tissues were measured by Western blot and immunofluorescence.
RESULTS: The cell viability was approximately 90%, and 80% of BMSCs steadily carried the GFP protein after lentivirus transfection. Compared with the control group, the protein expression of SDF-1α was distinctly increased in injured colon in the model group. One week after cell therapy, Ad-GFP-BMSCs failed to colonize in the inflamed colon and had no beneficial effect on pathological inflammation score compared to the vehicle group (3.50 ± 0.53 vs 3.62 ± 0.52, P > 0.05). Compared with the model group, Ad-CXCR4-BMSCs signally down-regulated the disease activity index (2.71 ± 0.28 vs 3.88 ± 0.17, P < 0.01) and pathological inflammation score (2.25 ± 0.71 vs 3.62 ± 0.52, P < 0.01). Compared to the Ad-GFP-BMSCs group, the protein expression of GFP was significantly increased in the Ad-CXCR4-BMSCs group (0.70 ± 0.34 vs 0.10 ± 0.12, P < 0.01).
CONCLUSION: Our findings suggest that the SDF-1α/CXCR4 axis plays a crucial role in BMSCs migration toward injured colon, which may provide an attractive target for BMSCs-based therapies for IBD.
- Citation: Liu XX, Fan H, Duan XY, Tang Q, Shou ZX, Zuo DM, Zhang LJ, Cao D, Zou Z. SDF-1α/CXCR4 axis facilitates BMSCs homing toward injured colon in rats with experimental colitis. Shijie Huaren Xiaohua Zazhi 2013; 21(33): 3623-3630
- URL: https://www.wjgnet.com/1009-3079/full/v21/i33/3623.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i33.3623
炎症性肠病(inflammaotoy bowel disease, IBD)是以结肠黏膜慢性炎症和溃疡形成为主要病理特点的疾病, 主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD). 近年来大量证据表明异常的免疫和炎症应答是IBD发病的关键机制. 慢性炎症破坏了肠道上皮层并形成了黏膜溃疡, 抑制炎症的过程伴随着肠道组织重塑[1]. 通过干细胞技术和组织工程技术定向诱导特定的细胞以替代功能障碍的细胞或组织缺损, 这可能是治疗肠道疾病的根本办法[2]. 骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells, BMSCs)是一类具有自我复制能力的多潜能细胞, 在组织工程、细胞移植、基因治疗等方面已被广泛应用[3,4]. 但是外源性的BMSCs输入体内后向受损的肠道归巢的效率是非常低下的[5]. 大量研究表明基质细胞衍生因子1α(stromal cell-derived factor-1α, SDF-1α)与其特异性受体趋化因子受体4(chemokine receptor 4, CXCR4)能调控BMSCs归巢于受损组织[6,7]. 本研究通过重组慢病毒技术构建过表达CXCR4的BMSCs, 观察其向炎症结肠定向迁移情况, 并探讨BMSCs对IBD实验模型的黏膜修复、抗炎和免疫调节作用.
34只♀ SPF级SD大鼠, 购自湖北省疾病预防控制中心[许可证号: SCXK(鄂)2010-0057], 其中4周龄大鼠2只, 体质量150 g±20 g, 用于提取和培养BMSCs; 8-10周龄大鼠32只, 体质量250 g±30 g, 用于分组实验; 2,4,6-三硝基苯磺酸(Sigma, P2297); 10%胎牛血清(fetal calf serum, FBS, Gibco, P16000-044); 细胞培养用青霉素-链霉素混合液(Solarbio, P1400-100); LentivirusNull/CXCR4和LentivirusGFP/CXCR4(上海吉凯基因, GOSL29538); 细胞培养基(dulbecco's modified eagle medium, DMEM, 北京赛默飞世尔生物, SH30021.01B); 胰蛋白酶(杭州吉诺生物, P13010501); FITC标记抗体CD29、CD45、CD90、CD11b(Biolegend); 兔抗大鼠绿色荧光蛋白(green fluorescent protein, GFP)多克隆抗体(Chemicon, MAB3580); RIPA裂解液(Beyotime, P0012A); 兔抗大鼠CXCR4多克隆抗体(Abcam, ab2074); 兔抗大鼠SDF-1α多克隆抗体(Abcam, ab9797); 羊抗兔IgG二抗(Beyotime, A0208); 荧光显微镜(Nikon); 流式细胞仪(Becton-Dickinson Biosciences).
1.2.1 BMSCs的分离、培养和鉴定: 取4周龄♀大鼠颈椎脱臼处死, 750 mL/L乙醇浸泡15 min. 无菌条件下分离胫骨、股骨, 剪开胫骨、股骨干骺端, 再用1 mL注射器吸取预冷磷酸盐缓冲液(phosphate buffered saline, PBS)冲洗骨髓腔, 获得骨髓细胞悬液, 置于含有10%FBS和双抗(青霉素100 U/mL、链霉素100 U/L)的DMEM中, 37 ℃, 50 mL/L CO2培养箱中培养. 24 h后首次半量换液, 然后每3 d全量换液. 当黏附细胞长到80%融合时加入胰蛋白酶消化传代, 经3-4次传代后得到纯化的BMSCs后可用于后续实验. 取生长状态良好的3代BMSCs, 加入胰蛋白酶消化, PBS冲洗获得细胞悬液. 加入anti-CD29-PE-Cy7、anti-CD90-Alexa Fluor488、anti-CD45-PE、anti-CD11b-Flour647, 4 ℃, 孵化30 min, 送流式细胞仪检测, CellQuest TM软件分析实验结果.
1.2.2 结肠炎模型的建立: 禁食24 h后, SD大鼠给予10%水合氯醛(3 mL/kg)腹腔注射麻醉. 将聚乙烯导尿管缓缓插入大鼠肛门8 cm, 先后缓缓注入500 mL/L的乙醇溶液0.25 mL和TNBS 0.6 mL, 将大鼠提尾倒置30 s, 然后以特伦德伦伯卧位放置以避免液体流出. 待大鼠清醒后可自由饮食和进水.
1.2.3 慢病毒转染: 慢病毒构建由上海吉凯基因公司合成, 慢病毒载体元件顺序为Ubi-MCS-GFP, 克隆位点为Age I/Age I. LentivirusCXCR4/GFP能够共表达CXCR4和增强型GFP, LentivirusNull/GFP仅表达荧光标志物GFP. 第3代BMSCs经胰蛋白酶消化后按4×103/孔接种于含有10% FBS和DMEM的12孔培养板中, 37 ℃, 50 mL/L CO2培养24 h. 然后以20的感染复数(multiplicity of infection, MOI)进行慢病毒转染. 转染LentivirusCXCR4/GFP的细胞命名为Ad-CXCR4-BMSCs, 转染LentivirusNull/GFP的细胞命名为Ad-GFP-BMSCs, 并作为阴性对照组. 转染后的细胞置于荧光显微镜下观察细胞存活率、转染效率以及GFP蛋白表达.
1.2.4 疾病活动指数: 利用疾病活动指数(disease activity index, DAI)来评估TNBS诱导的结肠炎的严重程度. DAI是由体质量丢失比例、大便黏稠度和便血程度组成, 具体的评分标准如下[8]: (1)体质量丢失比例(0: <1%; 1: 1%-5%; 2: 5.1%-10%; 3: 10.1%-15%; 4: >15%); (2)大便黏稠度(0: 正常大便; 2: 软便; 4: 液状便); (3)便血程度(0: 无潜血; 2: 阳性潜血; 4: 肉眼血便).
1.2.5 实验分组及治疗: 在1 wk的驯化期后, 32只♀SD大鼠被随机分成4组(n = 8): 空白组、模型组、Ad-GFP-BMSCs组和Ad-CXCR4-BMSCs组. 在整个实验过程中, 每天记录大鼠的DAI, 每组大鼠都通过尾静脉注射治疗. 第1天, 除空白组外, 其余3组均给予TNBS诱导结肠炎. 第4天, 结肠炎组大鼠分别接受PBS、Ad-GFP-BMSCs(2×106/mL)或Ad-CXCR4-BMSCs(2×106/mL)各1 mL. 第11天, 大鼠禁食24 h后行麻醉剖腹手术. 迅速取下完整结肠并测量其长度, 然后末端结肠被纵向打开, 用生理盐水轻微冲洗结肠, 收集结肠并用于多种研究.
1.2.6 病理学评估: 迅速把末端结肠样本固定在4%的甲醛中并用石蜡包埋, 切片机制成厚约4 μm的结肠切片并用苏木精和曙红(hematoxylin and eosin, HE)染色, 然后进行病理学分析. 我们利用结肠炎症病理分数来评估结肠受损程度, 具体标准如下[9]: 400倍显微镜下, 0: 结肠黏膜含0-1个多形核细胞/高倍视野(polymorphonuclear cell/high power field, PMN/hpf); 1: 2-10 PMN/hpf; 2: 11-20 PMN/hpf; 3: 21-30 PMN/hpf; 4: >30 PMN/hpf.
1.2.7 免疫荧光检测: 用O.C.T混合物包埋结肠组织并储存于液氮中, 冰冻切片机制作厚8 μm的结肠冰冻切片. 冰冻切片混入丙酮固定10 min, PBS冲洗2次, 10%FBS封闭1 h. 冰冻切片加入羊抗大鼠GFP抗体4 ℃过夜, 随后加入FITC标记的二抗孵化, 标记的冰冻切片随后置于荧光显微镜下进行观察.
1.2.8 Western blot检测: 将RIPA裂解液加入BMSCs或结肠组织中充分裂解, 3000 r/min, 4 ℃离心15 min, 取上清获得蛋白萃取物. 将萃取蛋白在200 V电压下进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离并电转移至聚偏氟乙烯膜. 用包含5%脱脂奶粉的洗涤缓冲液进行蛋白封闭2 h, 先后加入抗-SDF-1α抗体和抗-GFP抗体, 4 ℃过夜, 然后分别加入酶标羊抗兔Ig-G2抗并进行化学发光分析.
统计学处理 实验计量数据以mean±SE表示, 两组间差异采用t检验, 多组间均数差异采用单因素方差分析, 采用SPSS18.0统计软件进行分析, P<0.05为差异有统计学意义.
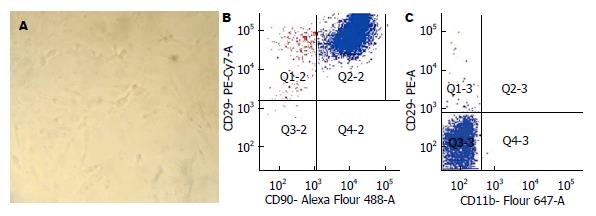
原代培养的BMSCs约5 h开始贴壁, 纯化后的细胞大部分呈梭型, 漩涡状生长. 经过消化、传代, 第3代BMSCs用于流式细胞术表型鉴定. 结果显示: BMSCs高表达CD29和CD90, 而几乎不表达CD45和CD11b(图1), 表明纯化后的细胞为BMSCs.
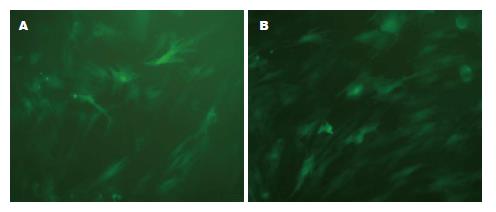
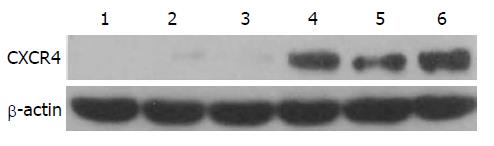
慢病毒转染后48 h, BMSCs的存活率大约为90%, 约80%的BMSCs能够稳定表达GFP蛋白(图2). 通过Western blot检测, 我们发现1-3代BMSCs几乎不能表达CXCR4, 但是在转染LentivirusCXCR4/GFP 48 h后, 3代Ad-CXCR4-BMSCs表达CXCR4蛋白量明显升高, 我们继续传代至第5代, Ad-CXCR4-BMSCs仍能稳定高表达CXCR4(图3).
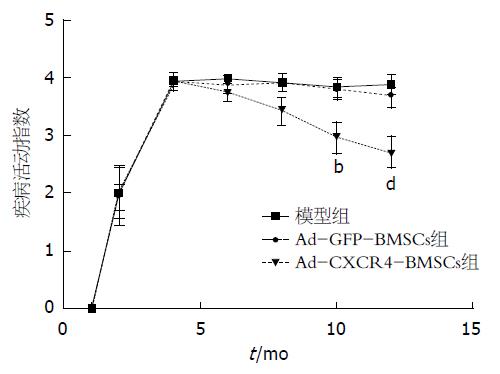
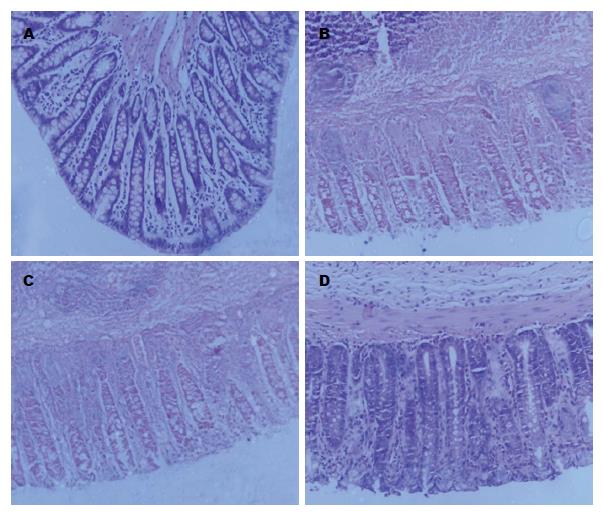
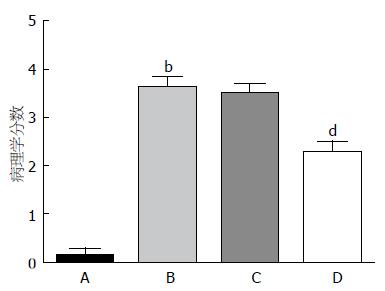
造模后第4 d, 结肠炎大鼠出现明显的体质量下降、腹泻、黏液脓血便、食欲下降、毛色欠光滑、活动迟缓等症状. 相对于空白组, 模型组的DAI分数显著上升(P<0.01). 与模型组相比, 尾静脉注射Ad-GFP-BMSCs并不能缓解大鼠的体质量下降、腹泻和血便等症状. 相反的是, 在第10天和第12天, Ad-CXCR4-BMSCs能够显著的下降DAI分数(P<0.01), 意味着结肠炎大鼠严重的症状得到了明显的改善(图4). 第12天, 我们可以观察到模型组大鼠结肠肠管长度变短, 管腔明显变粗, 肠壁变薄, 部分大鼠出现严重的肠壁间渗出和黏连. 对结肠进行病理学分析可见模型组大鼠结肠黏膜腺体排列不规则、水肿、充血、糜烂、浅表或线状溃疡. 黏膜层或黏膜下层可见大量的炎性渗透物如淋巴细胞和巨噬细胞聚集(图5). 通过显微镜半定量计数评分, 模型组的病理炎症分数较空白组显著增加(P<0.01). 与模型组比较, Ad-CXCR4-BMSCs能够显著的修复受损的肠道黏膜并下降病理炎症分数(P<0.01), 但Ad-GFP-BMSCs组和模型组之间比较病理炎症分数并无统计学差异(图6).
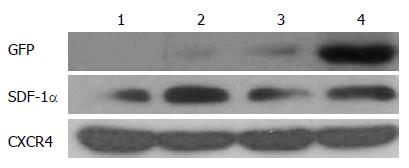
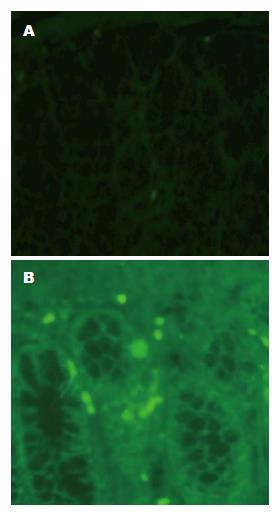
Western blot结果表明: 与正常组比较, 在受损的结肠部位SDF-1α蛋白表达显著升高(图7). 为了观察外源性BMSCs向受损结肠迁移效率, BMSCs被标记上GFP并通过尾静脉注射进SD大鼠. 免疫荧光结果显示GFP蛋白零星的表达于Ad-GFP-BMSCs组结肠, 但是却广泛的表达于Ad-CXCR4-BMSCs组结肠部位(图8). 通过Western blot也表明相对于Ad-GFP-BMSCs组, Ad-CXCR4-BMSCs组结肠部位GFP蛋白表达明显升高(P<0.01, 图7).
临床上IBD治疗的主要药物(如柳氮磺胺嘧啶、糖皮质激素、免疫抑制剂)并不能持续有效地缓解IBD的病情并会带来大量的不良反应, 因此科研者急需探索新的治疗方法. 在此项研究中, 我们首先探索了BMSCs在实验性结肠炎中的治疗效果以及潜在的作用机制. TNBS诱导的模型是一个稳定并广泛应用的结肠炎模型[5,10], 他在组织学及免疫学方面都非常类似于人类的CD, 主要表现为强烈的细胞浸润以及分泌大量的Th1型细胞因子比如干扰素-γ和肿瘤坏死因子-α[11]. 本研究通过直肠灌注TNBS迅速的建立起严重的结肠炎模型, 大鼠表现为急剧上升的DAI分数、严重的结肠病理学改变以及大量的炎性细胞浸润.
干细胞(stem cell, SC)是一类具有自我复制能力的多潜能细胞, 在一定条件下, 他可以分化成多种功能细胞. BMSCs是一种存在于骨髓中的非造血干细胞, 易于体外培养扩增, 并在培养过程中保持多分化潜能, 其具有遗传背景稳定, 体内植入排斥反应较弱等特点, 所以他被认为是一种用于组织工程和细胞治疗的理想细胞[12,13]. BMSCs作为一种新的治疗方法能治疗炎症介导的多种疾病[14-16]. 有研究证实, 静脉注射BMSCs能有效治疗TNBS诱导的炎症性肠病[17,18], 他能够显著减缓UC的症状, 抑制炎症因子分泌, 提高白介素-10的表达, 同时抑制Th1细胞活性[19]. 虽然BMSCs在再生医学中具有很大的治疗潜力, 但是也有大量研究表明系统释放的BMSCs到达受损组织的效率是非常低下的, 循环的BMSCs大部分停留于肺血管床[5,20,21]. 本实验也通过Western blot和免疫荧光技术证实了在Ad-GFP-BMSCs组大鼠结肠部位只能发现极其微量的GFP表达, 表明单纯通过尾静脉注射的BMSCs并不能有效的迁移至受损的结肠部位. DAI分数以及病理学分析也表明Ad-GFP-BMSCs并没有有效的缓解实验性结肠炎. 最近有研究进一步明确证实在TNBS诱导的结肠炎中, 静脉注射的BMSCs迅速的聚集在肺、心、肝、肾等组织器官而没有证据发现其归巢于结肠组织[5]. 外源性的BMSCs能否成功的到达受损的结肠黏膜就成了IBD细胞治疗的关键因素.
SDF-1α是趋化因子亚家族成员之一, 他在药物的趋化作用、肿瘤转移以及干细胞归巢中扮演者重要作用[22]. CXCR4属于G蛋白偶联的7次跨膜的趋化因子受体, 在体内许多细胞, 尤其在造血干/祖细胞的表面均有CXCR4的构成性表达. 目前认为SDF-1α是CXCR4的唯一生理配体, CXCR4也是SDF-1的唯一受体, 两者的亲和力很高[23]. 有研究显示SDF-1能特异的对CXCR4产生趋化作用, 表达CXCR4的干细胞能够沿着SDF-1α的浓度梯度迁移实现归巢过程[15,24]. 跟先前的报道相类似[25], 本实验也证实在TNBS诱导的结肠炎模型中, 受损结肠部位的SDF-1α表达持续升高. 但是外源性的BMSCs并不能表达足够量的CXCR4蛋白[26], 这将阻碍BMSCs有效的迁移和归巢于受损的结肠部位. 慢病毒载体是以人类免疫缺陷型病毒为基础发展起来的基因治疗载体, 他对分裂细胞和非分裂细胞均具有感染能力, 并可以在体内较长期的表达且安全性高. 慢病毒载体能够有效的转移并长期的表达外源基因, 其在基础实验研究中具有广阔的前景[27,28]. 本实验通过重组慢病毒技术成功的构建了Ad-CXCR4-BMSCs并使其过表达CXCR4蛋白. 同时该慢病毒载体技术能够共表达增强型GFP, GFP能够用来有效的示踪BMSCs在活体内的迁移[29]. 本研究发现Ad-CXCR4-BMSCs组大鼠临床症状及结肠病理变化都得到了显著的改善. 同时Western blot和免疫荧光技术也证实了Ad-CXCR4-BMSCs组结肠部位的GFP蛋白表达比Ad-GFP-BMSCs组升高, 这些都表明SDF-1α/CXCR4轴有效地提高了尾静脉注射的BMSCs迁移至受损结肠部位的效率. 在治疗机制方面, 越来越多的证据表明BMSCs能够通过分化成结肠上皮层或基质层细胞来修复肠道组织[10,30]. 另一方面, BMSCs也可能通过发挥抗炎和免疫调节功能来治疗炎症性肠病[31].
总之, 我们的实验阐明了相对于正常BMSCs, 静脉注射过表达CXCR4的BMSCs能够更有效的迁移至受损的结肠部位, 减轻和修复结肠损伤, 改善TNBS诱导的结肠炎症状. 这些结论可能给SDF-1α/CXCR4轴在BMSCs的IBD治疗提供新的思路和理论依据.
炎症性肠病(inflammaotoy bowel disease, IBD)的疗效迄今仍不理想, 迫切需要探寻新的有效治疗手段. 间充质干细胞(marrow-derived mesenchymal stem cells, MSCs)因具有多分化潜能, 在体内能参与损伤组织修复, 而广泛的应用与组织工程和细胞治疗. 但体外扩增的MSCs输入体内后向IBD归巢效率低下. 而已知基质细胞衍生因子α(stromal cell-derived factor-1α, SDF-1α)/趋化因子受体4(chemokine receptor 4, CXCR4)轴能调控MSCs的归巢. 本研究通过重组慢病毒技术构建过表达CXCR4的骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells, BMSCs), 观察其向炎症结肠定向迁移情况, 并探讨BMSCs对IBD实验模型的黏膜修复、抗炎和免疫调节作用.
高英堂, 研究员, 天津市第三中心医院
由于BMSCs经体外扩增后其表面的CXCR4表达明显下降, 导致归巢能力降低. 本文研究重点是利用慢病毒载体转染BMSCs使其过表达CXCR4蛋白. 重点观察SDF-1α/CXCR4轴能否促进BMSCs向炎症肠道归巢而增强对IBD的疗效.
SDF-1α/CXCR4轴在药物趋化作用、肿瘤转移和干细胞归巢中发挥重要作用, SDF-1α/CXCR4轴能广泛的应用与其他疾病及机制研究中, 值得借鉴和引用.
本研究首次通过慢病毒构建过表达CXCR4的BMSCs, 并探讨上调CXCR4的BMSCs能否促进其归巢于受损结肠从而增强IBD疗效.
本文不仅能为有效利用BMSCs临床治疗IBD提供理论参考, 而且有助于更深入理解BMSCs在IBD体内的归巢及治疗机制.
IBD被世界卫生组织列为难治性疾病, 寻求新的治疗方法成为当务之急, BMSCs具有很强的分化和免疫调节作用, 有望成为治疗IBD的新方法. BMSCs体外扩增后, 其表面CXCR4表达下调, 将导致BMSCs归巢能力下降, 本研究通过慢病毒使BMSCs过表达CXCR4, 成功诱导其向炎症肠道的迁徙, 增强BMSCs对IBD的治疗效果.
编辑: 田滢 电编:鲁亚静
| 1. | Andoh A, Bamba S, Fujiyama Y, Brittan M, Wright NA. Colonic subepithelial myofibroblasts in mucosal inflammation and repair: contribution of bone marrow-derived stem cells to the gut regenerative response. J Gastroenterol. 2005;40:1089-1099. [PubMed] [DOI] |
| 2. | Scharl M, McCole DF, Weber A, Vavricka SR, Frei P, Kellermeier S, Pesch T, Fried M, Rogler G. Protein tyrosine phosphatase N2 regulates TNFα-induced signalling and cytokine secretion in human intestinal epithelial cells. Gut. 2011;60:189-197. [PubMed] [DOI] |
| 3. | Shi M, Liu ZW, Wang FS. Immunomodulatory properties and therapeutic application of mesenchymal stem cells. Clin Exp Immunol. 2011;164:1-8. [PubMed] [DOI] |
| 4. | Boyd AS, Fairchild PJ. Approaches for immunological tolerance induction to stem cell-derived cell replacement therapies. Expert Rev Clin Immunol. 2010;6:435-448. [PubMed] [DOI] |
| 5. | Castelo-Branco MT, Soares ID, Lopes DV, Buongusto F, Martinusso CA, do Rosario A, Souza SA, Gutfilen B, Fonseca LM, Elia C. Intraperitoneal but not intravenous cryopreserved mesenchymal stromal cells home to the inflamed colon and ameliorate experimental colitis. PLoS One. 2012;7:e33360. [PubMed] [DOI] |
| 6. | Li M, Yu J, Li Y, Li D, Yan D, Qu Z, Ruan Q. CXCR4 positive bone mesenchymal stem cells migrate to human endothelial cell stimulated by ox-LDL via SDF-1alpha/CXCR4 signaling axis. Exp Mol Pathol. 2010;88:250-255. [PubMed] [DOI] |
| 7. | Yu J, Li M, Qu Z, Yan D, Li D, Ruan Q. SDF-1/CXCR4-mediated migration of transplanted bone marrow stromal cells toward areas of heart myocardial infarction through activation of PI3K/Akt. J Cardiovasc Pharmacol. 2010;55:496-505. [PubMed] [DOI] |
| 8. | Davaatseren M, Hwang JT, Park JH, Kim MS, Wang S, Sung MJ. Poly-γ-glutamic acid attenuates angiogenesis and inflammation in experimental colitis. Mediators Inflamm. 2013;2013:982383. [PubMed] [DOI] |
| 9. | Mitsuyama K, Matsumoto S, Rose-John S, Suzuki A, Hara T, Tomiyasu N, Handa K, Tsuruta O, Funabashi H, Scheller J. STAT3 activation via interleukin 6 trans-signalling contributes to ileitis in SAMP1/Yit mice. Gut. 2006;55:1263-1269. [PubMed] [DOI] |
| 10. | Ando Y, Inaba M, Sakaguchi Y, Tsuda M, Quan GK, Omae M, Okazaki K, Ikehara S. Subcutaneous adipose tissue-derived stem cells facilitate colonic mucosal recovery from 2,4,6-trinitrobenzene sulfonic acid (TNBS)-induced colitis in rats. Inflamm Bowel Dis. 2008;14:826-838. [PubMed] [DOI] |
| 11. | Newman R, Cuan N, Hampartzoumian T, Connor SJ, Lloyd AR, Grimm MC. Vasoactive intestinal peptide impairs leucocyte migration but fails to modify experimental murine colitis. Clin Exp Immunol. 2005;139:411-420. [PubMed] [DOI] |
| 12. | Parekkadan B, Milwid JM. Mesenchymal stem cells as therapeutics. Annu Rev Biomed Eng. 2010;12:87-117. [PubMed] [DOI] |
| 13. | Shi Y, Hu G, Su J, Li W, Chen Q, Shou P, Xu C, Chen X, Huang Y, Zhu Z. Mesenchymal stem cells: a new strategy for immunosuppression and tissue repair. Cell Res. 2010;20:510-518. [PubMed] [DOI] |
| 14. | Prockop DJ, Oh JY. Mesenchymal stem/stromal cells (MSCs): role as guardians of inflammation. Mol Ther. 2012;20:14-20. [PubMed] [DOI] |
| 15. | Liu H, Liu S, Li Y, Wang X, Xue W, Ge G, Luo X. The role of SDF-1-CXCR4/CXCR7 axis in the therapeutic effects of hypoxia-preconditioned mesenchymal stem cells for renal ischemia/reperfusion injury. PLoS One. 2012;7:e34608. [PubMed] [DOI] |
| 16. | Liang J, Huang W, Yu X, Ashraf A, Wary KK, Xu M, Millard RW, Ashraf M, Wang Y. Suicide gene reveals the myocardial neovascularization role of mesenchymal stem cells overexpressing CXCR4 (MSC(CXCR4)). PLoS One. 2012;7:e46158. [PubMed] [DOI] |
| 17. | Hayashi Y, Tsuji S, Tsujii M, Nishida T, Ishii S, Iijima H, Nakamura T, Eguchi H, Miyoshi E, Hayashi N. Topical implantation of mesenchymal stem cells has beneficial effects on healing of experimental colitis in rats. J Pharmacol Exp Ther. 2008;326:523-531. [PubMed] [DOI] |
| 18. | Ko IK, Kim BG, Awadallah A, Mikulan J, Lin P, Letterio JJ, Dennis JE. Targeting improves MSC treatment of inflammatory bowel disease. Mol Ther. 2010;18:1365-1372. [PubMed] [DOI] |
| 19. | Gonzalez-Rey E, Anderson P, González MA, Rico L, Büscher D, Delgado M. Human adult stem cells derived from adipose tissue protect against experimental colitis and sepsis. Gut. 2009;58:929-939. [PubMed] [DOI] |
| 20. | Barbash IM, Chouraqui P, Baron J, Feinberg MS, Etzion S, Tessone A, Miller L, Guetta E, Zipori D, Kedes LH. Systemic delivery of bone marrow-derived mesenchymal stem cells to the infarcted myocardium: feasibility, cell migration, and body distribution. Circulation. 2003;108:863-868. [PubMed] [DOI] |
| 21. | Schrepfer S, Deuse T, Reichenspurner H, Fischbein MP, Robbins RC, Pelletier MP. Stem cell transplantation: the lung barrier. Transplant Proc. 2007;39:573-576. [PubMed] [DOI] |
| 22. | Teicher BA, Fricker SP. CXCL12 (SDF-1)/CXCR4 pathway in cancer. Clin Cancer Res. 2010;16:2927-2931. [PubMed] [DOI] |
| 23. | Zaruba MM, Franz WM. Role of the SDF-1-CXCR4 axis in stem cell-based therapies for ischemic cardiomyopathy. Expert Opin Biol Ther. 2010;10:321-335. [PubMed] [DOI] |
| 24. | Theiss HD, Vallaster M, Rischpler C, Krieg L, Zaruba MM, Brunner S, Vanchev Y, Fischer R, Gröbner M, Huber B. Dual stem cell therapy after myocardial infarction acts specifically by enhanced homing via the SDF-1/CXCR4 axis. Stem Cell Res. 2011;7:244-255. [PubMed] [DOI] |
| 25. | Katsuta T, Lim C, Shimoda K, Shibuta K, Mitra P, Banner BF, Mori M, Barnard GF. Interleukin-8 and SDF1-alpha mRNA expression in colonic biopsies from patients with inflammatory bowel disease. Am J Gastroenterol. 2000;95:3157-3164. [PubMed] [DOI] |
| 26. | Kortesidis A, Zannettino A, Isenmann S, Shi S, Lapidot T, Gronthos S. Stromal-derived factor-1 promotes the growth, survival, and development of human bone marrow stromal stem cells. Blood. 2005;105:3793-3801. [PubMed] [DOI] |
| 27. | Zhang L, Liu HJ, Li TJ, Yang Y, Guo XL, Wu MC, Rui YC, Wei LX. Lentiviral vector-mediated siRNA knockdown of SR-PSOX inhibits foam cell formation in vitro. Acta Pharmacol Sin. 2008;29:847-852. [PubMed] [DOI] |
| 28. | Jiang J, Huang L, Yu W, Wu X, Zhou P, Li X. Overexpression of HTRA1 leads to down-regulation of fibronectin and functional changes in RF/6A cells and HUVECs. PLoS One. 2012;7:e46115. [PubMed] [DOI] |
| 29. | Mokbel AN, El Tookhy OS, Shamaa AA, Rashed LA, Sabry D, El Sayed AM. Homing and reparative effect of intra-articular injection of autologus mesenchymal stem cells in osteoarthritic animal model. BMC Musculoskelet Disord. 2011;12:259. [PubMed] [DOI] |
| 30. | Valcz G, Krenács T, Sipos F, Leiszter K, Tóth K, Balogh Z, Csizmadia A, Muzes G, Molnár B, Tulassay Z. The role of the bone marrow derived mesenchymal stem cells in colonic epithelial regeneration. Pathol Oncol Res. 2011;17:11-16. [PubMed] [DOI] |
| 31. | Parekkadan B, Upadhyay R, Dunham J, Iwamoto Y, Mizoguchi E, Mizoguchi A, Weissleder R, Yarmush ML. Bone marrow stromal cell transplants prevent experimental enterocolitis and require host CD11b+ splenocytes. Gastroenterology. 2011;140:966-975. [PubMed] [DOI] |