修回日期: 2013-08-25
接受日期: 2013-10-20
在线出版日期: 2013-11-08
目的: 探讨海藻酸钠微球栓塞治疗肝细胞癌(hepatocellular carcinoma, HCC)术后合并肝脓肿的临床特点、可能机制与其结局.
方法: 回顾性分析2008-01/2013-01我院收治的以海藻酸钠微球(kelp microgelation, KMG)栓塞治疗后合并肝脓肿的HCC患者的临床资料.
结果: 583例患者应用KMG栓塞治疗, 每例1-4次, 总计1749例次, 其中9例块状型HCC术后发生了肝脓肿. 典型临床表现为术后9-23 d内出现的不同程度的肝区疼痛症状, 同时伴或不伴驰张高热和寒战症状; 实验室检查可见白细胞显著升高, 影像检查可见肝内脓肿形成表现. 分析其可能机制: HCC与肝内胆管供血动脉分支之间血管解剖因素、KMG的理化特性、瘤体血供丰富程度、肿瘤负荷和栓塞剂量、栓塞技术、局部微环境与肠道菌群等为重要的影响因素. 依据影像检查结果, 及时实施充分引流并联合敏感抗生素系统、足量、足疗程抗炎综合治疗后, 在2 wk-2 mo内痊愈.
结论: 应用KMG经肝动脉栓塞治疗HCC时, 在富血供、块状型病例中, 使用剂量过大或栓塞过多正常组织时有可能导致肝脓肿发生, 值得引起临床关注.
核心提示: 海藻酸钠微球(kelp microgelation)为微球类长效栓塞剂, 栓塞后作用持久、组织坏死彻底. 在富血供、块状型肝细胞癌(hepatocellular carcinoma)病例中, 为避免严重并发症肝脓肿的发生, 应尽可能减少单次栓塞剂量、提高精准度分次栓塞, 避免过度; 术后密切随访, 出现脓肿后应及时、合理应用抗生素治疗, 具备穿刺引流条件时, 尽早实施引流.
引文著录: 李保国, 王海涛, 张炜浩, 郭志. 海藻酸钠微球栓塞治疗肝细胞癌术后合并肝脓肿9例. 世界华人消化杂志 2013; 21(31): 3422-3428
Revised: August 25, 2013
Accepted: October 20, 2013
Published online: November 8, 2013
AIM: To analyze the clinical characteristics, possible mechanisms and outcomes of liver abscess after transcatheter arterial embolization (TAE) with kelp micro gelatin (KMG) in patients with hepatocellular carcinoma (HCC).
METHODS: Clinical data for HCC patients who were treated with KMG embolization and later developed liver abscess at our hospital from January 2008 to January 2009 were retrospectively reviewed.
RESULTS: In total, 583 HCC patients underwent TAE with KMG. TAE was given to each patient 1 to 4 times, with a total of 1749 times. Nine patients with massive HCC developed liver abscess. Typical clinical manifestations were varying degrees of liver pain on postoperative days 9-23, with or without remittent fever and chills. Main laboratory finding was a significant increase in white blood cells, and imaging examinations revealed signs of liver abscess. Factors possibly causing the development of liver abscess included the anatomic characteristics of blood vessels between the branches of HCC feeding arteries and intrahepatic bile duct feeding arteries, the physical and chemical properties of KMG, a hypervascular tumor, tumor burden, dose of embolic agent, embolization technique, local microenvironment and intestinal flora. Based on imaging findings, the following treatments could be given: timely and adequate drainage combined with anti-inflammatory therapy using full dose of effective antibiotics for sufficient course. The 9 patients recovered in 2 weeks to 2 months after treatment.
CONCLUSION: The development of liver abscess should be monitored in HCC patients undergoing TAE with KMG, especially when the tumor is hypervascular or massive, or when the patient consumes an excessive dose of KMG or too much normal tissue was embolized.
- Citation: Li BG, Wang HT, Zhang WH, Guo Z. Liver abscess after transarterial embolization for hepatocellular carcinoma with kelp micro gelatin: Analysis of 9 patients. Shijie Huaren Xiaohua Zazhi 2013; 21(31): 3422-3428
- URL: https://www.wjgnet.com/1009-3079/full/v21/i31/3422.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i31.3422
海藻酸钠微球(kelp microgelation, KMG)是近年来逐渐在临床上推广使用的海藻酸盐类长效血管栓塞材料, 借助选择性肝动脉栓塞方法可显著改善不能手术的中晚期肝细胞癌(hepatocellular carcinoma, HCC)的生存获益[1]. 但是, KMG栓塞治疗后部分病例有可能继发肝脓肿等罕见的严重并发症也日益成为血管性介入治疗临床研究所关注的重要问题之一. 现将我院在2008-01/2013-01 KMG栓塞治疗术后合并肝脓肿的9例患者的病例资料总结报道如下.
选择2008-01/2013-01于我院采用KMG栓塞治疗的583例经肝穿刺活检明确诊断为HCC的患者, 按照BCLC分期标准为B期或C期不能接受手术治疗者的患者, 每例栓塞治疗1-4次, 总计1749例次; 其中9例患者术后发生了肝脓肿, 发生率占全部病例的1.54%(9/583), 男性8例, 女性1例, 年龄37-65岁, 平均年龄47岁.
1.2.1 HCC栓塞治疗: 选择性肠系膜上动脉和肝动脉造影后, 明确肿瘤大小、数目、分布范围, 主要供血动脉分支及分支数目, 血供丰富程度, 有无肝动脉-门静脉瘘等异常血管分流, 有无门静脉瘤栓或门静脉主干闭塞征象. 瘤体血管粗大、富血供者, 给予直径150-450 μm KMG栓塞; 瘤体血管纤细、乏血供者给予直径100-300 μm KMG栓塞. 块状型(5 cm<瘤体直径<10 cm)行单次完全性栓塞; 巨块型(瘤体直径>10 cm)HCC给予分次部分栓塞, 单次栓塞体积控制在不超过总体积的50%-60%, 1 wk后补充栓塞残余肿瘤血管并实现完全性栓塞. 栓塞程度均以瘤体栓塞区供血动脉出现返流、随访造影显示肿瘤血管床完全闭塞时停止.
1.2.2 合并肝脓肿临床诊断: KMG栓塞治疗术后短期内患者出现间断性或持续性肝区疼痛、高热, 复查血常规提示血液白细胞水平及中性粒细胞百分比例显著高于正常水平, CT平扫及增强检查可见肿瘤靶区内出现密度不均匀减低区或液性密度, 排除胆囊或其他脏器异位栓塞等原因后即可诊断.
1.2.3 肝脓肿治疗: 诊断明确后即在B超或CT引导下行脓腔穿刺引流并对同时引流的脓液和血液给予细菌培养及药敏试验, 根据药敏试验结果给予敏感抗生素抗炎治疗, 合并厌氧菌感染者联合甲硝唑3-4次/d经引流管冲洗脓腔; 同时辅以保肝及静脉高能量营养支持等处理. 待临床症状消失、复查CT提示脓腔闭合、连续3次血液常规检查白细胞水平及中性粒细胞百分比均在正常范围后撤除引流导管.
本组9例患者发生肝脓肿前的临床资料按病灶数目、形态大小、分布部位、有无门静脉癌栓、血供特点及栓塞剂直径、栓塞治疗次数、栓塞程度、单次栓塞剂使用剂量等分类列表如下(表1). (1)临床症状体征: 术后9-23 d内出现不同程度的肝区疼痛症状, 平均14.89 d±5.23 d; 同时伴有驰张高热和/或间断寒战, 体温最高可达40.5 ℃; 7例查体时有明确的肝区叩击痛; 1例合并黄疸症状; (2)实验室检查: 8例血白细胞>13×109/L(88.9%)、7例中性粒细胞百分比>85%(77.8%); 细菌培养结果6例为革兰阴性杆菌、2例革兰阳性球菌、另1例为革兰阴性球菌. (3)影像学检查: 8例患者CT扫描提示肝内单发类圆形低密度区, 范围与栓塞前肿瘤大小接近; 其中, 2例患者脓腔内见明显液气平面形成. 1例在病程中先后出现2个脓腔并且相互交通形成哑铃形不规则形密度不均匀减低区. 详细资料如表2.
| 编号 | 肿瘤特点 | 门脉瘤栓 | 血供特点 | KMG微球(mm) | 栓塞次数 | 单次栓塞程度 | 栓塞剂量(g) | ||
| n | 大小(cm) | 病灶位置 | |||||||
| 1 | 1 | 9.0 | 右叶 | 无 | 富血供 | 100-300 | 1 | 完全栓塞 | 1.55 |
| 2 | 2 | 7.5 | 左叶 | 有 | 富血供 | 100-300 | 1 | 完全栓塞 | 0.9 |
| 3 | 2 | 13 | 右叶 | 无 | 乏血供 | 150-450 | 2 | 部分栓塞 | 0.6 |
| 4 | 1 | 6 | 左叶 | 无 | 富血供 | 100-300 | 1 | 完全栓塞 | 0.8 |
| 5 | 2 | 10 | 右叶 | 有 | 富血供 | 150-450 | 2 | 部分栓塞 | 1.3 |
| 6 | 1 | 8.4 | 右叶 | 无 | 乏血供 | 100-300 | 1 | 完全栓塞 | 0.7 |
| 7 | 3 | 9.7 | 右叶 | 无 | 富血供 | 150-450 | 1 | 完全栓塞 | 1.9 |
| 8 | 2 | 11 | 右叶 | 无 | 富血供 | 150-450 | 2 | 部分栓塞 | 2.2 |
| 9 | 4 | 14.5 | 右叶 | 有 | 富血供 | 150-450 | 2 | 部分栓塞 | 2.7 |
| 编号 | 诊断时间(d) | 临床表现 | 脓肿个数 | 细菌类型 | WBC/N% | 痊愈时间(d) | |
| ×109/L | % | ||||||
| 1 | 17 | 疼痛、发热 | 1 | 大肠杆菌 | 19 | 87 | 26 |
| 2 | 21 | 发热 | 1 | 大肠杆菌 | 14.6 | 89 | 25 |
| 3 | 12 | 疼痛、发热、黄疸 | 1 | 屎肠球菌 | 17 | 88 | 31 |
| 4 | 19 | 发热 | 1 | 大肠杆菌 | 11 | 89 | 26 |
| 5 | 10 | 疼痛、发热 | 1 | 大肠杆菌 | 15 | 84 | 23 |
| 6 | 23 | 疼痛、发热 | 1 | 金黄色葡萄球菌 | 12.5 | 87 | 27 |
| 7 | 10 | 疼痛、发热 | 1 | 金黄色葡萄球菌 | 22 | 79 | 29 |
| 8 | 13 | 疼痛、发热40.5℃ | 2 | 铜绿假单胞菌 | 17.6 | 90 | 60 |
| 9 | 9 | 疼痛、发热 | 1 | 大肠杆菌 | 14 | 86 | 33 |
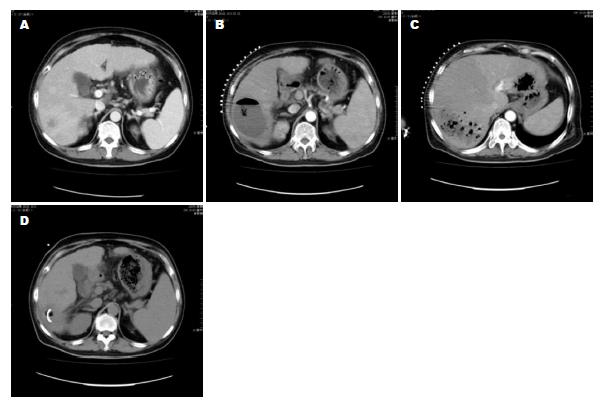
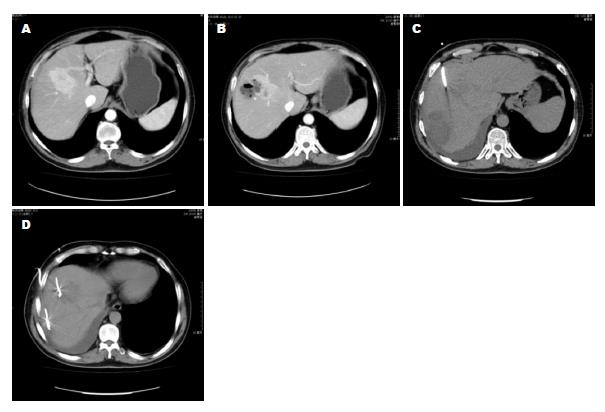
经上述治疗后, 8例单发脓肿在16-33 d内脓腔闭合, 症状完全缓解, 如图1. 另外1例因引流过程中发热症状持续时间较长, 复查CT又发现远隔部位出现新的脓肿, 脓腔造影显示两脓腔借胆道相互交通, 呈"哑铃形". 再次更换穿刺部位、置入新的引流管、扩大引流范围, 2 mo后痊愈, 如图2. 本组病例中, 无因脓肿扩散或器官功能衰竭死亡患者; 但出现肝脓肿以后, 再次栓塞治疗的时间均被延后.
经导管选择性肝动脉栓塞术(transcatheter arterial embolization, TAE)通过栓塞肿瘤供血动脉分支, 导致肿瘤缺血、缺氧产生坏死, 是目前不能手术的中晚期HCC的首选非手术治疗手段, 可显著提高HCC患者的生存率并延长生存时间[1]. 但是肿瘤病理解剖特征、栓塞材料特性与栓塞技术等多种因素都有可能影响栓塞治疗的临床获益并与栓塞后相关并发症的发生密切相关[1-5]. 现将本组使用KMG栓塞治疗后合并肝脓肿的病例特点及可能机制分析如下.
(1)瘤体负荷较大, 多发病灶、单个肝叶分布以及富血供为本组病例的典型特征. 本组9例患者栓塞治疗前肿瘤最大直径介于6-14.5 cm之间, 平均9.9 cm±2.6 cm; 形态学上均隶属于块状型HCC, 其中巨块型4例; 单发病灶3例, 多发6例; 仅2例为乏血供肿瘤; (2)单次栓塞剂使用剂量过大、完全性栓塞是本组病例的另一特点. 9例患者中5例块状型使用KMG进行了单次栓塞, 剂量均超过1.0 g; 另外4例分成2次进行栓塞, 每次KMG使用剂量也都在0.6 g以上, 最后均实现了完全性栓塞; (3)栓塞治疗后, 既有HCC相应的症状体征, 又具有肝脓肿典型的临床表现也是其特征之一. 9例患者均在使用KMG栓塞治疗后9-23 d内出现弛张高热、寒战以及上腹疼痛等典型的肝脓肿症状、体征; 实验室检查可见白细胞、中性粒细胞水平显著升高; 影像检查可见肿瘤区、瘤旁甚至远隔部位出现脓腔形成并在穿刺引流出脓液后证实.
3.2.1 HCC与肝内胆管之间的血管解剖因素: HCC与肝内胆管血供的解剖特点是肝脓肿发生的前提. 肝脏接受双重血管供应, 正常肝组织的血液供应绝大部分来自门静脉, 肝细胞癌组织的血供主要来自肝动脉[7]. 肝动脉分支常伸入到肿瘤中心, 以细小分支向中心延伸. 在块状型肝癌中, 癌组织与非癌组织之间有一条明显的界沟, 非癌侧的血管比较致密; 表面被一不甚完整的血管壳包围, 壳上血管彼此交织相通, 血管壳越大、缺损也越多[6]. 肝内胆管则由肝动脉的左、右分支形成的非轴性动脉网供血, 肝动脉的终末支一部分参与大、中Glisson鞘中稀疏的门脉周围血管丛, 大部分分支形成胆管周围毛细血管丛(peribiliary plexus, PBP)并作为胆管直接的血供来源[7]; PBP对维持胆管上皮细胞结构和功能的完整性起至关重要的作用[8,9]. 如果肝动脉的血液不能充足供应胆管, 胆管缺血缺氧, 胆管上皮很容易损伤、坏死而继发感染[10].
3.2.2 KMG的理化特性: KMG为永久性、适形栓塞材料, 栓塞同级血管时能彻底阻断血供. KMG是以海藻酸钠为主料制成的以固体形态存在的细小颗粒状生物可降解栓塞剂, 具有良好的生物相容性, 进入血管后KMG微球能自身膨胀并与血液中的钙离子络合并产生大分子链间交联固化, 使所有侧支血管闭塞, 将靶血管永久性栓塞、彻底阻断肿瘤供血, 且降解时间较长, 能够使靶区内肿瘤组织完全性坏死[11]. 但KMG栓塞提高栓塞效能的同时也增加了胆管发生不可逆性损伤的机会, 胆管供血动脉由于直接栓塞或因为异常交通支间接栓塞后使得胆管缺血、缺氧, 继而出现管腔变小或闭塞, 胆管黏膜坏死脱落, 管壁纤维化增厚; 导致病变部位以上胆管管腔增大, 管壁变薄, 甚至形成胆汁瘤而继发感染. 这一现象即使在使用碘化油、明胶海绵等栓塞材料时也可见报道, 但后两者的发生概率相对较低[12-16].
3.2.3 HCC瘤体血供、肿瘤负荷与栓塞剂剂量: 肿瘤的血供丰富程度、瘤体负荷大小共同决定栓塞剂的使用剂量[17]. 肿瘤负荷大、瘤体血供丰富、血管分支多, 单位体积内所需栓塞剂量也就越大. 碘油、明胶海绵等栓塞剂的相关研究表明, 栓塞剂在瘤内的初期积聚与HCC的血供有直接关系, 块状型、富血供HCC, 碘油沉积显著多于乏血供瘤体; 但碘化油和明胶海绵属短效、易降解栓塞材料, 受血流的冲刷、单核巨噬细胞吞噬系统的清除及丰富的侧支循环等因素作用, 使得块状型HCC栓塞治疗后, 栓塞剂有可能出现再次分布或在短期内被不同程度的清除而获得新的血供来源, 瘤体及瘤内与胆管供血动脉相互交通的血管分支不易出现持久或完全性栓塞、坏死程度相对较轻, 肝脓肿的发生并不多见[18-20]. 本组病例病灶直径都在5 cm以上, 4例直径超过10 cm, 仅2例为乏血供肿瘤; 基于上述临床实践证据结论: 在治疗4例巨块型HCC时, 为避免术后瘤体大量坏死后继发感染或其他严重并发症而提前确定了分次栓塞的治疗方案; 但治疗后也同样出现了肿瘤细胞大量坏死并伴有瘤区内胆管细胞坏死表现, 只是临床症状、体征较一次性栓塞的反应程度稍有减轻. 这也表明, 使用大剂量KMG栓塞治疗富血供、巨块型HCC时, 瘤体缺血、坏死的范围较同等程度的碘化油和明胶海绵等栓塞材料显著增大, 肝脓肿发生的风险也相应增加.
3.2.4 栓塞技术影响: 超选择、精准栓塞瘤体供血动脉可以减少对瘤体周围正常组织的损伤[21,22]. KMG微球同明胶海绵颗粒一样在X线下不能够像超液化碘油一样可实时显影、追踪, 可控性相对较差, 有可能返流至正常组织的血供分支, 导致异位栓塞, 也从而影响栓塞治疗的结局并增大肝脓肿发生的风险.
3.2.5 局部微环境与胆道、肠道菌群: 肝内胆管供血动脉分支或交通支异常栓塞之后, 正常胆管结构即被破坏, 缺血缺氧, 局部微环境发生改变; 无菌性坏死区为细菌生长提供了良好繁殖空间, 一旦胆道、肠道内寄生细菌逆行进入坏死区而免疫细胞又不能及时到达清除, 即可进行大量繁殖并导致肝脓肿的形成[23]. 本组病例细菌学检测结果表明: 大肠杆菌是最为常见的致病菌, 约占56%, 金黄色葡萄球菌、铜绿假单胞菌以及屎肠球菌也可在血液或脓液标本中培养获得, 其中有3例还同时伴有厌氧菌感染.
本研究结果显示应用KMG栓塞治疗HCC时, 在富血供、块状型尤其是巨块型HCC患者中, 当使用剂量过大或同时栓塞过多正常组织时, 有可能导致严重并发症肝脓肿的发生并影响患者的生活质量; 临床工作者应给予足够重视, 术后应根据临床表现及早识别并采取积极有效的治疗措施.
结合本中心临床应用经验, 建议可从以下几个方面预防: (1)块状型尤其巨块型HCC宜采取短周期、分次栓塞, 减少单次用量; (2)富血供HCC应选择相应直径的KMG, 尽可能减少使用剂量、避免过度栓塞; (3)栓塞前仔细造影明确肿瘤血供特点及供血范围, 尽可能实施精准栓塞, 减少对正常结构损伤; (4)有感染或脓肿形成证据时, 及早实施穿刺引流; 结合药敏试验结果, 及时、足量、足疗程使用敏感抗生素; (5)运用循证临床实践思维, 采集最佳证据, 结合患者实际情况考虑使用.
回顾性分析采用海藻酸钠微球栓塞治疗肝细胞癌术后发生了肝脓肿的9例患者的临床资料, 分析其可能机制并提出有效预防及改善患者预后的实用处理办法.
禄韶英, 博士, 副教授, 西安交通大学医学院第一附属医院普外科
海藻酸钠微球(kelp microgelation, KMG)是近年来逐渐在临床上推广使用的海藻酸盐类长效血管栓塞材料, 可显著改善不能手术的中晚期肝细胞癌(hepatocellular carcinoma, HCC)的生存获益, 但目前对其使用后相关并发症的专门研究报道较少, 而肝脓肿又属于严重并发症, 若不能及时明确诊断及实施有效治疗, 预后多较差.
Marelli等曾经报道, TAE作为治疗中晚期HCC的有效方法之一, 疗效并不劣于最常用的选择性肝动脉化疗栓塞术, 但相同的TAE治疗, 在栓塞材料不同时疗效却存在显著差异. 微球类材料栓塞持续时间长, 疗效优于碘化油、明胶海绵等. KMG为近几年才逐渐推广的国产微球类材料, 其并发症的相关报道较少.
失代偿期肝硬化患者低钠血症与肝肾综合征和肝性脑病的发生密切相关, 当血钠水平较低时, 肝肾综合征和肝性脑病发病率会随之增加, 导致患者预后较差. 因此在临床治疗中需要密切监测患者血钠水平, 以便及时评价患者病情和采取相应的治疗措施.
本文设计合理, 方法恰当, 结果可信, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 2. | Xie F, Zang J, Guo X, Xu F, Shen R, Yan L, Yang J, He J. Comparison of transcatheter arterial chemoembolization and microsphere embolization for treatment of unresectable hepatocellular carcinoma: a meta-analysis. J Cancer Res Clin Oncol. 2012;138:455-462. [PubMed] [DOI] |
| 3. | Guiu B, Deschamps F, Aho S, Munck F, Dromain C, Boige V, Malka D, Leboulleux S, Ducreux M, Schlumberger M. Liver/biliary injuries following chemoembolisation of endocrine tumours and hepatocellular carcinoma: lipiodol vs. drug-eluting beads. J Hepatol. 2012;56:609-617. [PubMed] [DOI] |
| 4. | Hemingway AP, Allison DJ. Complications of embolization: analysis of 410 procedures. Radiology. 1988;166:669-672. [PubMed] |
| 5. | Chung JW, Park JH, Han JK, Choi BI, Han MC, Lee HS, Kim CY. Hepatic tumors: predisposing factors for complications of transcatheter oily chemoembolization. Radiology. 1996;198:33-40. [PubMed] |
| 8. | Gaudio E, Onori P, Franchitto A, Pannarale L, Alpini G, Alvaro D. Hepatic microcirculation and cholangiocyte physiopathology. Ital J Anat Embryol. 2005;110:71-75. [PubMed] |
| 9. | Gaudio E, Franchitto A, Pannarale L, Carpino G, Alpini G, Francis H, Glaser S, Alvaro D, Onori P. Cholangiocytes and blood supply. World J Gastroenterol. 2006;12:3546-3552. [PubMed] |
| 10. | Beaussier M, Wendum D, Fouassier L, Rey C, Barbu V, Lasnier E, Lienhart A, Scoazec JY, Rosmorduc O, Housset C. Adaptative bile duct proliferative response in experimental bile duct ischemia. J Hepatol. 2005;42:257-265. [PubMed] [DOI] |
| 11. | 百 宏灿, 郑 瑞锋, 张 燕齐, 徐 建林, 杨 泉. 海藻酸钠微球栓塞剂脾动脉栓塞治疗脾功能亢进42例. 中国组织工程研究与临床康复. 2007;11:4422-4423. |
| 12. | Yu JS, Kim KW, Park MS, Yoon SW. Bile duct injuries leading to portal vein obliteration after transcatheter arterial chemoembolization in the liver: CT findings and initial observations. Radiology. 2001;221:429-436. [PubMed] |
| 14. | Sakamoto I, Aso N, Nagaoki K, Matsuoka Y, Uetani M, Ashizawa K, Iwanaga S, Mori M, Morikawa M, Fukuda T. Complications associated with transcatheter arterial embolization for hepatic tumors. Radiographics. 1998;18:605-619. [PubMed] |
| 15. | Ong GY, Changchien CS, Lee CM, Wang JH, Tung HD, Chuah SK, Chiu KW, Chiou SS, Cheng YF, Lu SN. Liver abscess complicating transcatheter arterial embolization: a rare but serious complication. A retrospective study after 3878 procedures. Eur J Gastroenterol Hepatol. 2004;16:737-742. [PubMed] [DOI] |
| 16. | Huang SF, Ko CW, Chang CS, Chen GH. Liver abscess formation after transarterial chemoembolization for malignant hepatic tumor. Hepatogastroenterology. 2003;50:1115-1118. [PubMed] |
| 17. | Takaki S, Sakaguchi H, Anai H, Tanaka T, Yamamoto K, Morimoto K, Nishiofuku H, Inoue M, Sueyoshi S, Nagata T. Long-term outcome of transcatheter subsegmental and segmental arterial chemoemobolization using lipiodol for hepatocellular carcinoma. Cardiovasc Intervent Radiol. 2012;35:544-554. [PubMed] [DOI] |
| 18. | Marelli L, Stigliano R, Triantos C, Senzolo M, Cholongitas E, Davies N, Tibballs J, Meyer T, Patch DW, Burroughs AK. Transarterial therapy for hepatocellular carcinoma: which technique is more effective? A systematic review of cohort and randomized studies. Cardiovasc Intervent Radiol. 2007;30:6-25. [PubMed] [DOI] |
| 19. | Maluccio MA, Covey AM, Porat LB, Schubert J, Brody LA, Sofocleous CT, Getrajdman GI, Jarnagin W, Dematteo R, Blumgart LH. Transcatheter arterial embolization with only particles for the treatment of unresectable hepatocellular carcinoma. J Vasc Interv Radiol. 2008;19:862-869. [PubMed] [DOI] |
| 20. | Song SY, Chung JW, Han JK, Lim HG, Koh YH, Park JH, Lee HS, Kim CY. Liver abscess after transcatheter oily chemoembolization for hepatic tumors: incidence, predisposing factors, and clinical outcome. J Vasc Interv Radiol. 2001;12:313-320. [PubMed] [DOI] |
| 21. | Shimohira M, Ogino H, Kawai T, Sakurai K, Nakagawa M, Shibamoto Y. Clinical usefulness of the triaxial system in super-selective transcatheter arterial chemoembolization for hepatocellular carcinoma. Acta Radiol. 2012;53:857-861. [PubMed] [DOI] |