修回日期: 2013-09-12
接受日期: 2013-09-17
在线出版日期: 2013-10-28
目的: 探讨血浆型谷胱甘肽过氧化物酶(glutathione peroxidase 3, GPX3)在食管鳞癌中的表达及其临床意义.
方法: 随机选取正常人食管黏膜标本37例、食管上皮内瘤变标本42例、食管鳞癌标本86例, 采用免疫组织化学方法对GPX3基因所表达的GPX3蛋白进行检测.
结果: GPX3在正常食管黏膜上皮的阳性表达率为75.7%, 显著高于食管上皮内瘤变的38.1%和食管鳞癌的18.6%(P<0.01), 并且食管上皮内瘤变的GPX3的阳性表达率显著高于食管鳞癌(P<0.05); GPX3在无淋巴结转移的食管鳞癌的阳性表达率为30.8%, 显著高于有淋巴结转移的食管鳞癌(8.5%), 且具有统计学意义(P<0.01).
结论: GPX3在食管上皮内瘤变、食管鳞癌中的表达显著低于在正常食管黏膜的表达, 且GPX3的表达与食管鳞癌淋巴结转移相关; GPX3可能在食管鳞癌的发生发展中起重要作用, 是食管鳞癌潜在的肿瘤标志物之一.
核心提示: 谷胱甘肽过氧化物酶(glutathione peroxidase 3, GPX3)在食管鳞癌及其癌前病变(上皮内瘤变)中存在低表达, 且GPX3的低表达与食管鳞癌的转移有明显相关性. 食管鳞癌是我国高发恶性肿瘤之一, GPX3的相关研究可为食管鳞癌的诊疗及预后判断提供新的思路.
引文著录: 沈磊, 贺远龙, 张巍巍, 耿长新. 血浆型谷胱甘肽过氧化物酶在食管鳞癌中的表达及临床意义. 世界华人消化杂志 2013; 21(30): 3252-3256
Revised: September 12, 2013
Accepted: September 17, 2013
Published online: October 28, 2013
AIM: To investigate the expression of glutathione peroxidase 3 (GPX3) in esophageal squamous cell carcinoma and to analyze its clinical significance.
METHODS: GPX3 protein expression was detected by immunohistochemistry in 42 cases of esophageal intraepithelial neoplasia, 86 cases of esophageal squamous cell carcinoma and 37 cases of normal esophageal mucosa tissue.
RESULTS: The expression of GPX3 in normal esophageal mucosa was significantly higher than that in esophageal intraepithelial neoplasia and esophageal squamous cell carcinoma (75.7% vs 38.1%, 18.6%, both P < 0.01). Moreover, the expression of GPX3 in esophageal intraepithelial neoplasia was significantly higher than that in esophageal squamous cell carcinoma (P < 0.05). The expression of GPX3 was significantly higher in esophageal squamous cell carcinoma without lymph node metastasis than in that with lymph node metastasis (30.8% vs 8.5%, P < 0.01).
CONCLUSION: The expression of GPX3 in esophageal intraepithelial neoplasia and esophageal squamous cell carcinomas is significantly lower than that in normal esophageal mucosa, and the expression of GPX3 is associated with lymph node metastasis. GPX3 may be used as a candidate marker for esophageal squamous cell carcinoma.
- Citation: Shen L, He YL, Zhang WW, Geng CX. Clinical significance of expression of glutathione peroxidase 3 in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(30): 3252-3256
- URL: https://www.wjgnet.com/1009-3079/full/v21/i30/3252.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i30.3252
食管癌是一种常见的消化系恶性肿瘤. 据相关文献报道, 2008年全球估计有48.23万例新发食管癌患者, 约40.7万患者死于食管癌[1], 其中食管鳞癌约占食管癌发病总数的90%. 食管癌的发生发展与多种基因密切相关, 近年来血浆型谷胱甘肽过氧化物酶(glutathione peroxidase 3, GPX3)在食管癌中的表达越来越受到重视. 既往研究报道表明GPX3在食管腺癌及Barrett食管病变中存在低表达[2,3], 但目前尚无GPX3在食管鳞癌及其癌前病变(上皮内瘤变)中表达水平的相关报道. 本研究旨在检测GPX3在食管上皮内瘤变及食管鳞癌中的表达水平, 初步探讨GPX3与食管鳞癌发生发展的关系, 以期为食管鳞癌的防治提供新思路.
随机选取青岛市市立医院及青岛大学医学院附属医院2009-01/2013-03的食管上皮内瘤变组织标本42例, 其中男26例, 女16例, 年龄35-77岁, 平均年龄59.05岁±9.18岁; 食管鳞癌组织标本86例, 其中男73例, 女13例, 年龄37-77岁, 平均年龄59.34岁±9.13岁, 根据国际抗癌联盟(Union for International Cancer Control, UICC)2009年修订的食管癌TNM分期标准进行分期: Ⅰ期5例, Ⅱ期46例, Ⅲ期35例; 所有标本均经病理学检查确诊, 患者均未经放、化疗及免疫治疗, 标本均为经过患者本人及家属同意后取得.
随机选取37例健康志愿者食管黏膜上皮标本, 其中男23例, 女14例, 年龄28-76岁, 平均年龄59.49岁±10.25岁; 志愿者入选标准: (1)无明显不适症状; (2)胃镜食管黏膜大致正常; (3)食管黏膜组织活检后病理检查结果大致正常; (4)排除有糖尿病、甲亢、近期有重大手术史; (5)未服用激素、精神病药物及其他特殊药物. 标本经患者本人及家属同意后获得. 本研究已通过了青岛市市立医院医学伦理委员会审核. 抗GPX3抗体购自Abcam公司, 货号[23B1](ab27325); 生物素标记的羊抗鼠/兔IgG购自迈新生物技术有限公司; DAB显色系统: 液体DAB酶底物显色试剂盒, 购自福州迈新生物技术有限公司, 产品编号Cat No: DAB-0031/1031, 批号: 1009309902.
1.2.1 免疫组织化学: 将石蜡标本切片(4 μm), 烤片1 h后依次经脱蜡、水化处理, 应用EDTA抗原修复液高压修复5 min, 3%H2O2封闭15 min, 滴加正常非免疫动物血清, 室温10 min, 除去血清, 滴加一抗(1:400), 4 ℃冰箱过夜, 滴加生物素标记的羊抗鼠/兔IgG 10 min, DAB显色3 min, 苏木精复染20 s, 脱水、透明、封片、晾干, 于显微镜下观察.
1.2.2 结果判断: 以现有阳性图片为阳性对照, 以实验中PBS代替一抗实验结果为阴性对照, (1)按细胞浆和/或细胞核显示程度评分: 不显色, 0分; 淡黄色颗粒, 1分; 黄色颗粒, 2分; 棕黄色颗粒, 3分; (2)按细胞显色率评分: 随机选取10个高倍视野, 每个视野计数100个细胞, 计算细胞显色率, 细胞显色率为0%-25%则评定为1分, 细胞显色率为26%-50%评定为2分, 细胞显色率为51%-75%评定为3分, 细胞显色率为76%-100%评定为4分; 最后以两种评分结果相乘所得总积分作为判定标准, 计积分≤4分为阴性, 积分>5分为阳性[4].
统计学处理 采用SPSS19.0统计分析软件进行统计学分析, 用所得的数据建立数据库, 应用χ2检验进行统计学分析, P<0.05为差异有统计学意义.
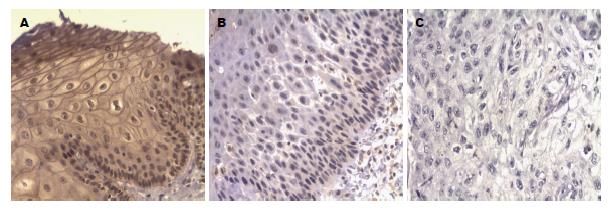
如图1所示, GPX3在正常食管黏膜上皮细胞、食管上皮内瘤变细胞及食管鳞癌细胞中均有不同程度的表达, 表现为细胞的细胞核和/或细胞浆出现黄色或棕黄色颗粒, 其中正常食管黏膜上皮细胞以出现棕黄色和/或黄色颗粒为主, 食管上皮内瘤变细胞及食管鳞癌细胞以出现淡黄色颗粒和/或不显色为主.
如表1所示, 在37例正常食管黏膜上皮、42例食管上皮内瘤变及86例食管鳞癌中GPX3的阳性表达率分别75.7%、38.1%、18.6%; GPX3在正常食管黏膜上皮的阳性表达率显著高于GPX3在食管上皮内瘤变或食管鳞癌的阳性表达率, 且差异有统计学意义(χ2值分别为11.259、36.674, P值分别为0.001、0.000); 食管上皮内瘤变与食管鳞癌的GPX3阳性表达率也存在显著差异(χ2 = 5.717, P = 0.017). GPX3在食管低级别上皮内瘤变及高级别上皮内瘤变的阳性表达率分别为39.3%、35.7%, 两者之间无显著差异(χ2 = 0.050, P = 0.822); GPX3在Ⅰ期、Ⅱ期、Ⅲ期食管鳞癌的阳性表达率分别为20.0%、17.4%、20.0%, 三者间差异无统计学意义(χ2 = 0.096, P = 0.953).
| 组织类型 | n | GPX3的表达(n) | 阳性率(%) | χ2值 | P值 | |
| 阴性 | 阳性 | |||||
| 正常食管黏膜 | 37 | 9 | 28 | 75.7 | ||
| 食管上皮内瘤变 | 42 | 26 | 16 | 38.1 | 11.259 | 0.001 |
| 低级别 | 28 | 17 | 11 | 39.3 | ||
| 高级别 | 14 | 9 | 5 | 35.7 | 0.050 | 0.822 |
| 食管鳞癌 | 86 | 70 | 16 | 18.6 | 36.674 | 0.000 |
| Ⅰ期 | 5 | 4 | 1 | 20.0 | ||
| Ⅱ期 | 46 | 38 | 8 | 17.4 | ||
| Ⅲ期 | 35 | 28 | 7 | 20.0 | 0.096 | 0.953 |
如表2所示, GPX3在无淋巴结转移的食管鳞癌中阳性表达率为30.8%, 显著高于有淋巴结转移的食管鳞癌(8.5%), 且差异具有统计学意义(χ2 = 6.973, P = 0.008); 在高、中、低分化食管鳞癌中GPX3的阳性表达率分别为20.0%、17.8%、18.8%, 无显著差异(χ2 = 0.053, P = 0.974); GPX3的表达与性别、年龄等因素无显著相关性(χ2值分别为1.204、3.119, P值分别为0.272、0.077).
| 临床病理特征 | n | GPX3的表达(n) | 阳性率(%) | χ2值 | P值 | |
| 阴性 | 阳性 | |||||
| 淋巴结转移 | 6.973 | 0.008 | ||||
| 有 | 39 | 27 | 12 | 30.8 | ||
| 无 | 47 | 43 | 4 | 8.5 | ||
| 肿瘤分化程度 | 0.053 | 0.974 | ||||
| 高 | 25 | 20 | 5 | 20.0 | ||
| 中 | 45 | 37 | 8 | 17.8 | ||
| 低 | 16 | 13 | 3 | 18.8 | ||
| 年龄(岁) | 3.119 | 0.077 | ||||
| <60 | 44 | 39 | 5 | 11.4 | ||
| ≥60 | 42 | 31 | 11 | 26.2 | ||
| 性别 | 1.204 | 0.272 | ||||
| 男 | 73 | 58 | 15 | 20.5 | ||
| 女 | 13 | 12 | 1 | 7.7 | ||
GPX3是目前已知的GPX家族8个亚型中唯一的细胞外亚型[5], 由Takahashi等[6]于1987年从血浆中纯化获得, 是人体抗过氧化物酶系统中的重要成员, 能够清除人体正常代谢过程中产生的过氧化氢及脂质过氧化物. 近年来研究显示GPX3的表达与多种疾病的发生发展密切相关, 在卵巢癌[7]、子宫内膜癌[8]、前列腺癌[9]、胃癌[10]、结肠癌[11]等多种恶性肿瘤的相关研究中均发现GPX3存在低表达, 在食管腺癌及Barrett食管的相关研究中也发现GPX3表达下降[2]. 本实验通过免疫组织化学方法检测GPX3在食管上皮内瘤变及食管鳞癌中的表达, 探讨了其在食管鳞癌发生发展过程中的作用及相关机制.
研究结果显示, GPX3在正常食管黏膜上皮组织中的表达水平显著高于食管上皮内瘤变组织中的表达水平(P<0.01), 提示GPX3的表达在食管上皮内瘤变时即开始出现下降; 食管鳞癌的GPX3的表达水平显著低于正常食管黏膜(P<0.01), 与GPX3在食管腺癌中的表达水平相似, 食管鳞癌的GPX3的表达水平也显著低于食管上皮内瘤变(P<0.05), 表明GPX3表达在一定程度上随食管病变进展逐渐下降, 提示GPX3的表达可能与食管病变进展存在相关性.
GPX3与食管肿瘤的发生发展有着密切的关系, 相关研究已经证实氧自由基等活性氧离子可对细胞DNA造成损害[12], GPX3表达下降可能加重氧自由基对细胞DNA的损害, 致使基因断裂、突变, 而基因的上述变化正是导致肿瘤发生发展的重要因素[13], 但GPX3在食管上皮内瘤变及食管鳞癌的发生发展过程中的确切作用尚不十分明确. 既往研究已经证实GPX3的表达与胃癌细胞淋巴结转移存在相关性[14]. 在本研究中, 无淋巴结转移的食管鳞癌病例标本的GPX3阳性表达率显著高于有淋巴结转移的食管鳞癌病例标本(P<0.01), 提示GPX3的高表达在一定程度上可以抑制食管鳞癌细胞迁移. 本研究还显示食管鳞癌肿瘤分化程度与GPX3的表达水平无显著相关(P>0.05).
GPX3在食管上皮内瘤变及食管鳞癌中表达下降的确切机制尚未完全明确, 多项相关研究中已经发现食管癌GPX3基因启动子存在高甲基化, 这可能与GPX3的表达下降密切相关[2,3,15]. 有文献报道5-Aza-Cytidine能够诱导GPX3基因启动子去甲基化[2,15], 使GPX3基因表达上调, STA可增强5-Aza-Cytidine效果[14], 5-Aza-Cytidine等药物可作为食管癌的潜在的化疗药物. 本研究还显示在食管上皮内瘤变中GPX3表达下降, 但食管上皮内瘤变标本中GPX3的低表达是否也与启动子区的高甲基化有关尚未得到证实, 今后还需要做进一步的研究.
总之, GPX3在食管上皮内瘤变及食管鳞癌组织中的表达显著低于正常食管黏膜上皮, 并与食管病变程度及是否有淋巴结转移相关, 表明GPX3的表达下降是食管鳞癌发生发展的一个重要分子事件, 但本研究尚未从基因转录等方面对研究结果加以验证, GPX3在食管鳞癌发生发展中所起作用及其机制尚未明确, 有待于进一步深入研究.
食管鳞癌是我国最常见的恶性肿瘤之一, 严重威胁着人民的健康. 食管鳞癌的发生发展与多种基因密切相关. 相关研究表明谷胱甘肽过氧化物酶(glutathione peroxidase 3, GPX3)在多种恶性肿瘤病变中表达下降, 本研究旨在揭示GPX3在食管鳞癌及其癌前病变(上皮内瘤变)中的表达水平及其临床意义.
卢晓梅, 教授, 研究员, 新疆医科大学第一附属医院临床医学研究院
目前, GPX3在恶性肿瘤中的表达已经成为研究热点, 相关报道表明GPX3在恶性肿瘤中表达下降可能与GPX3基因启动子高甲基化有关, 但GPX3在恶性肿瘤发生发展中所起的作用及GPX3表达下降的具体机制尚不完全明确, 有待于进一步深入研究.
Lee等通过PCR及免疫组织化学等技术研究了GPX3在食管腺癌及Barrett食管中的表达, 发现在Barrett食管相关的食管腺癌中GPX3表达下降, 且表达下降可能与GPX3基因启动子高甲基化相关. 在胃癌、前列腺癌等恶性肿瘤的相关研究均发现GPX3存在低表达, 表明GPX3可能广泛参与了恶性肿瘤的发生发展.
本研究首次应用免疫组织化学技术对食管鳞癌及其癌前病变(上皮内瘤变)中GPX3的表达进行了检测, 探讨了GPX3的表达与食管鳞癌临床病理特征之间的关系.
GPX3在食管鳞癌及其癌前病变(上皮内瘤变)中的异常表达, 证实GPX3可作为食管鳞癌的生物学标志, 为食管鳞癌的诊疗及预后判断提供了新的思路.
编辑: 田滢 电编:闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Lee OJ, Schneider-Stock R, McChesney PA, Kuester D, Roessner A, Vieth M, Moskaluk CA, El-Rifai W. Hypermethylation and loss of expression of glutathione peroxidase-3 in Barrett's tumorigenesis. Neoplasia. 2005;7:854-861. [PubMed] |
| 3. | Peng DF, Razvi M, Chen H, Washington K, Roessner A, Schneider-Stock R, El-Rifai W. DNA hypermethylation regulates the expression of members of the Mu-class glutathione S-transferases and glutathione peroxidases in Barrett's adenocarcinoma. Gut. 2009;58:5-15. [PubMed] [DOI] |
| 4. | Milde-Langosch K, Bamberger AM, Rieck G, Kelp B, Löning T. Overexpression of the p16 cell cycle inhibitor in breast cancer is associated with a more malignant phenotype. Breast Cancer Res Treat. 2001;67:61-70. [PubMed] |
| 5. | Brigelius-Flohé R, Maiorino M. Glutathione peroxidases. Biochim Biophys Acta. 2013;1830:3289-3303. [PubMed] [DOI] |
| 6. | Takahashi K, Avissar N, Whitin J, Cohen H. Purification and characterization of human plasma glutathione peroxidase: a selenoglycoprotein distinct from the known cellular enzyme. Arch Biochem Biophys. 1987;256:677-686. [PubMed] |
| 7. | Agnani D, Camacho-Vanegas O, Camacho C, Lele S, Odunsi K, Cohen S, Dottino P, Martignetti JA. Decreased levels of serum glutathione peroxidase 3 are associated with papillary serous ovarian cancer and disease progression. J Ovarian Res. 2011;4:18. [PubMed] [DOI] |
| 8. | Falck E, Karlsson S, Carlsson J, Helenius G, Karlsson M, Klinga-Levan K. Loss of glutathione peroxidase 3 expression is correlated with epigenetic mechanisms in endometrial adenocarcinoma. Cancer Cell Int. 2010;10:46. [PubMed] [DOI] |
| 9. | Yu YP, Yu G, Tseng G, Cieply K, Nelson J, Defrances M, Zarnegar R, Michalopoulos G, Luo JH. Glutathione peroxidase 3, deleted or methylated in prostate cancer, suppresses prostate cancer growth and metastasis. Cancer Res. 2007;67:8043-8050. [PubMed] |
| 10. | Jee CD, Kim MA, Jung EJ, Kim J, Kim WH. Identification of genes epigenetically silenced by CpG methylation in human gastric carcinoma. Eur J Cancer. 2009;45:1282-1293. [PubMed] [DOI] |
| 11. | Barrett CW, Ning W, Chen X, Smith JJ, Washington MK, Hill KE, Coburn LA, Peek RM, Chaturvedi R, Wilson KT. Tumor suppressor function of the plasma glutathione peroxidase gpx3 in colitis-associated carcinoma. Cancer Res. 2013;73:1245-1255. [PubMed] [DOI] |
| 12. | Peng D, Belkhiri A, Hu T, Chaturvedi R, Asim M, Wilson KT, Zaika A, El-Rifai W. Glutathione peroxidase 7 protects against oxidative DNA damage in oesophageal cells. Gut. 2012;61:1250-1260. [PubMed] [DOI] |
| 13. | Strange RC, Spiteri MA, Ramachandran S, Fryer AA. Glutathione-S-transferase family of enzymes. Mutat Res. 2001;482:21-26. [PubMed] |
| 14. | Peng DF, Hu TL, Schneider BG, Chen Z, Xu ZK, El-Rifai W. Silencing of glutathione peroxidase 3 through DNA hypermethylation is associated with lymph node metastasis in gastric carcinomas. PLoS One. 2012;7:e46214. [PubMed] [DOI] |
| 15. | He Y, Wang Y, Li P, Zhu S, Wang J, Zhang S. Identification of GPX3 epigenetically silenced by CpG methylation in human esophageal squamous cell carcinoma. Dig Dis Sci. 2011;56:681-688. [PubMed] [DOI] |