修回日期: 2013-09-08
接受日期: 2013-09-13
在线出版日期: 2013-10-28
目的: 双氯芬酸灌胃建立非甾体类抗炎药(non-steroidal anti-inflammatory drug, NSAID)相关性大鼠小肠黏膜损伤模型, 研究大鼠小肠黏膜前列腺素E2(prostaglandin E2, PGE2)、环氧合酶-1(cyclooxygenase 1, COX-1)和环氧合酶-2(COX-2)的表达及药物的作用机制.
方法: 32只♂Wistar大鼠随机分为空白组、实验对照组、药物干预组(荆花胃康胶丸组、埃索美拉唑组). 实验对照组和药物干预组给予双氯芬酸, 药物干预组提前1 d分别给予荆花胃康胶丸和埃索美拉唑. 空白组给予生理盐水. 处死大鼠后显微镜下观察大鼠小肠损伤情况, 取小肠组织ELISA法检测小肠组织PGE2含量, Western blot法检测小肠组织COX-1、COX-2蛋白表达.
结果: 与空白对照组相比, 实验对照组大鼠小肠大体评分(4.63±0.52 vs 0.00±0.00)明显增高, 差异有统计学意义(P<0.05); 与实验对照组相比, 荆花胃康组、埃索美拉唑组大鼠小肠大体评分(1.88±0.99, 2.75±1.28)明显降低, 差异有统计学意义(P<0.05). 与空白组相比, 实验对照组大鼠小肠黏膜PGE2(19.32 ng/L±8.22 ng/L vs 36.64 ng/L±3.27 ng/L)明显降低, 差异有统计学意义(P<0.05); 与实验对照组相比, 荆花胃康组、埃索美拉唑组大鼠小肠PGE2(29.51 ng/L±7.61 ng/L; 29.20 ng/L±7.51 ng/L)明显增加, 差异有统计学意义(P<0.05). 与空白组相比, 实验对照组大鼠小肠黏膜COX-1(0.47±0.32 vs 0.78±0.39)明显降低, 差异有统计学意义(P<0.05); 与实验对照组相比, 荆花胃康组、埃索美拉唑组大鼠小肠COX-1(1.29±0.63, 1.53±1.00)明显增加, 差异有统计学意义(P<0.05). 与空白组相比, 实验对照组大鼠小肠黏膜COX-2(1.00±0.72 vs 0.00±0.00)明显增加, 差异有统计学意义(P<0.05); 与实验对照组相比, 荆花胃康组大鼠小肠黏膜COX-2(6.86±9.81)明显增加, 差异有统计学意义(P<0.05); 与实验对照组相比, 埃索美拉唑组大鼠小肠黏膜COX-2(2.59±2.87)增加, 差异无统计学意义(P>0.05).
结论: 双氯芬酸可以引起典型的NSAIDs相关性小肠损伤. NSAIDs相关性小肠损伤与PGE2含量降低有关. 荆花胃康和埃索美拉唑通过提高小肠黏膜PGE2含量, 预防NSAIDs小肠损伤. 荆花胃康引起小肠黏膜PGE2含量的升高, 可能与其增加小肠COX-1和COX-2含量有关. 埃索美拉唑引起小肠黏膜PGE2含量的升高, 可能与其增加小肠COX-1含量有关.
核心提示: 本研究提示双氯芬酸可以引起典型的非甾体类抗炎药(non-steroidal anti-inflammatory drug, NSAID)相关性小肠损伤. NSAIDs相关性小肠损伤与小肠黏膜前列腺素E2(prostaglandin E2, PGE2)含量降低有关. 荆花胃康和埃索美拉唑通过对环氧合酶-1(cyclooxygenase 1, COX-1)和COX-2调控, 提高小肠黏膜PGE2含量, 减轻NSAIDs小肠损伤.
引文著录: 丁瑞峰, 郭元虎, 韩文鹏, 王爱鱼, 田晓娟. NSAIDs相关性大鼠小肠黏膜PGE2、COX的表达及药物保护机制. 世界华人消化杂志 2013; 21(30): 3241-3246
Revised: September 8, 2013
Accepted: September 13, 2013
Published online: October 28, 2013
AIM: To investigate the expression of prostaglandin E2 (PGE2), cyclooxygenase 1 (COX-1) and cyclooxygenase 2 (COX-2) in diclofenac sodium-induced intestinal injury in rats and to analyze their implications for protective effects of drugs.
METHODS: Thirty-two male Wistar rats were randomly and equally divided into four groups: a normal control group (given normal saline), a model control group (given diclofenac sodium), and two treatment groups (given Jinghua Weikang Jiaowan and esomeprazole, respectively). Except for the normal control group, intestinal injury was induced with diclofenac sodium in the other groups. Jinghua Weikang Jiaowan and esomeprazole were administered in the two treatment groups from the day before diclofenac sodium was given. Intestinal injury was observed by microscopy. The content of PGE2 in the small intestine tissues was tested by ELISA. The expression of COX-1 and COX-2 proteins was detected by Western blot.
RESULTS: Compared to the normal control group, the morphological score increased significantly in the model control group (4.63 ± 0.52 vs 0.00 ± 0.00, P < 0.05); however, the morphological score was significantly lower in the two treatment groups than in the model control group (1.88 ± 0.99, 2.75 ± 1.28, both P < 0.05). Compared to the normal control group, the content of PGE2 was significantly lower in the model control group (19.32 ng/L ± 8.22 ng/L vs 36.64 ng/L ± 3.27 ng/L, P < 0.05); however, the content of PGE2 increased significantly in the two treatment group increased significantly compared to the model control group (29.51 ng/L ± 7.61 ng/L, 29.20 ng/L ± 7.51 ng/L, both P < 0.05). The expression level of COX-1 was significantly lower in the model control group than in the normal control group (0.47 ± 0.32 vs 0.78 ± 0.39, P < 0.05); however, the expression of COX-1 increased significantly in the treatment group compared to the model control group (1.29 ± 0.63, 1.53 ± 1.00, both P < 0.05). Compared to the normal control group, the expression of COX-2 increased significantly in the model control group (1.00 ± 0.72 vs 0.00 ± 0.00, P < 0.05); however, the expression of COX-2 increased significantly in the Jinghua Weikang Jiaowen treatment group (6.86 ± 9.81, P < 0.05). Compared to the model control group, the expression of COX-2 increased in the esomeprazole treatment group, but the difference was not significant (2.59 ± 2.87, P > 0.05).
CONCLUSION: Decreased content of PGE2 in the small intestine tissue may be associated with diclofenac sodium-induced small intestinal injury. Jinghua Weikang Jiaowan and esomeprazole exert preventive effects against diclofenac sodium-induced intestinal injury possibly by raising the level of PGE2. The therapeutic effect of Jinghua Weikang Jiaowan may be related to high expression of COX-1 and COX-2, and that of esomeprazole may be related to the high expression of COX-1.
- Citation: Ding RF, Guo YH, Han WP, Wang AY, Tian XJ. Expression of PGE2 and COX in intestinal injury induced with non-steroidal anti-inflammatory drugs in rats: Implications for protective effects of drugs. Shijie Huaren Xiaohua Zazhi 2013; 21(30): 3241-3246
- URL: https://www.wjgnet.com/1009-3079/full/v21/i30/3241.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i30.3241
非甾体类抗炎药(non-steroidal anti-inflammatory drug, NSAID)已有100多年的临床应用史, 是目前最为广泛的处方药物之一. 美国FDA统计, NSAIDs不良反应占所有药物不良反应的1/3, 其中胃肠道损伤最明显. 随着內镜技术的发展, 发现小肠组织比胃组织更易受到NSAIDs的影响[1], 但是目前临床上还没有一种药物可以完全取代他. 本研究通过双氯芬酸连续灌胃建立NSAIDs相关性大鼠小肠损伤模型, 研究大鼠小肠黏膜前列腺素E2(prostaglandin E2, PGE2)与环氧合酶-1(cyclooxygenase 1, COX-1)、COX-2的表达, 以及荆花胃康胶丸、埃索美拉唑是否对NSAIDs肠病有保护作用.
SPF级成年♂Wistar大鼠32只, 体质量180-200 g, 由内蒙古大学实验动物中心提供[实验动物机构许可证号: SCXK(蒙)2007-0001]. 双氯芬酸钠肠溶片(白云山汤阴东泰药业有限责任公司), 国药准字H41024221, 批号110703; 埃索美拉唑镁肠溶片(阿斯利康制药有限公司), 国药准字H20046379, 批号1106083; 荆花胃康胶丸(天津天士力制药股份有限公司), 国药准字Z10970067, 批号110609; PGE2 ELISA试剂盒购自美国RB公司, COX-1、COX-2多克隆抗体购自英国Abcam公司.
1.2.1 分组: 32只♂Wistar成年大鼠, 随机分为4组, 空白组、实验对照组、药物干预组(荆花胃康组、埃索美拉唑组), 每组8只.
1.2.2 模型制备: 参照文献[2]及预实验结果, 依据各药物人体有效治疗剂量及预实验结果计量, 通过人与动物药物剂量换算公式计算得出各药物给药剂量(荆花胃康、埃索美拉唑所用剂量相当于人体有效治疗剂量的6倍), 双氯芬酸15 mg/(kg•d), 荆花胃康30 mg/(kg•d), 埃索美拉唑4.17 mg/(kg•d), 每日分两次给药, 将药物溶于1.0 mL生理盐水中. 空白对照组生理盐水1.0 mL灌胃. 实验对照组和预防组灌胃给予双氯芬酸, 连续给药3 d. 预防组提前1 d给予预防药物, 即连续给预防药4 d. 末次给药后大鼠禁食, 自由取水, 24 h后终止实验.
1.2.3 标本处理: 将大鼠脱颈致死, 仰卧固定于实验台上. 腹部正中切口打开腹腔, 小心游离小肠组织. 取全段小肠, 沿肠系膜对侧切开小肠肠管, 于PBS液中冲洗干净, 距幽门15 cm取小肠组织2段置液氮灌中, 以备Western blot检测COX-1、COX-2和ELISA检测PGE2.
1.2.4 肠黏膜损伤评分: 肠黏膜损伤大体形态评分按下列标准进行[3]: 0分: 无损伤; 1分: 局部充血、水肿但未出现溃疡; 2分: 有溃疡, 但不伴黏膜明显充血水肿等炎性表现; 3分: 有溃疡, 且伴一处黏膜炎症; 4分: 有多处溃疡和炎症, 溃疡<1 cm; 5分: 有多处溃疡和炎症, 且至少一处溃疡>1 cm.
1.2.5 ELISA检测PGE2: 各标本组织块称重50 mg于匀浆管中, 往匀浆管加入450 mL PBS液. 冰水环境中充分碾磨组织. 低温离心匀浆, 取上清液保存待用, 按照试剂盒说明完成实验.
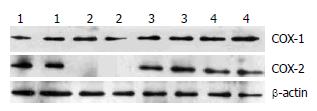
1.2.6 Western blot检测COX-1、COX-2: 组织研磨、离心, 取上清液, BCA定量, 计算上样量, 煮样品. 配制电泳胶, 加样, 浓缩胶恒压90 V, 分离胶恒压160 V. 溴酚蓝到分离胶的下缘时停止电泳. 半干电转移仪, 用PVDF膜, 恒流300 mA, 时间为45 min. 5%TBS-T(-20)脱脂奶粉封闭1 h. 孵育一抗: 杂交袋中孵育, 抗体浓度(COX-1为1:200; COX-2为1:150; β-actin为1:5000), 4 ℃下孵育过夜洗涤: 用TBS-T缓冲液洗膜5 min×3次, 孵育二抗: HRP标记的二抗孵育60 min后洗涤, 浓度(COX-1 1:2000; COX-2 1:3000; β-actin 1:10000). 曝光: 采用ECL化学发光法暗室曝光, 显影, 定影, IPP软件灰度分析.
统计学处理 所有实验数据均采用PAWS18.0统计软件分析处理, 实验结果以mean±SD. 大体评分应用秩和检验, 统计量应用Mann-Whitney U检验. PGE2、COX-1和COX-2结果如方差齐则应用单因素方差分析, 如果不齐则应用秩和检验. 结果均以P<0.05为差异有统计学意义.
空白对照组大鼠饮食、活动、进水和大便正常. 模型组及药物干预组大鼠给药第2天部分出现懒动、食欲下降、毛发枯燥、无光泽、大便不成形、腹壁毛发潮湿. 模型组大鼠造模第3天濒死1只. 解剖发现大鼠腹腔出现大量血性腹水, 伴恶臭. 肠管见充血、粘连、穿孔, 表面覆着大量黄色浓稠苔. 药物干预组无明显异常.
空白组大鼠未见小肠损伤. 实验对照组大鼠小肠可见大量溃疡, 溃疡呈扁椭圆形, 长轴与小肠垂直, 溃疡多沿小肠系膜侧分布, 溃疡周围见黏膜充血水肿, 其中2只大鼠可见局部肠坏死. 小肠大体评分实验对照组明显高于空白组, 差异有显著性意义(P<0.05). 荆花胃康组大鼠小肠可见局部充血、水肿, 偶见小溃疡, 但大多不伴周围黏膜明显充血水肿. 大鼠小肠损伤大体评分荆花胃康组明显低于实验对照组, 差异有统计学意义(P<0.05). 埃索美拉唑组大鼠小肠可见黏膜充血水肿, 小肠损伤大体评分埃索美拉唑组明显低于实验对照组, 差异有统计学意义(P<0.05, 表1).
实验对照组小肠组织PGE2明显低于空白组, 差异有统计学意义(P<0.05). 荆花胃康组、埃索美拉唑组小肠组织PGE2明显高于实验对照组, 差异有统计学意义(均P<0.05)(表1).
Western blot法检测各组大鼠小肠组织COX-1、COX-2含量. 空白对照组小肠组织只有COX-1表达, 无COX-2表达. 实验对照组两者都表达, COX-2较空白对照组明显升高, 差异有统计学意义(P<0.05); COX-1较空白组减低, 差异无统计学意义(P>0.05). 荆花胃康组COX-1、COX-2较实验对照组显著升高, 差异均有统计学意义(均P<0.05); 埃索美拉唑组COX-1较实验对照组显著升高, 差异有统计学意义(P<0.05), COX-2较实验对照组增加, 差异无统计学意义(P>0.05)(表1, 图1).
NSAIDs药物不良反应的严重性早已被人们认识到, 有学者提出NSAIDs不良反应主要在小肠而不是在胃及十二指肠[4]. NSAIDs相关性小肠损伤的主要临床表现包括: NSAIDs肠病、小肠溃疡、狭窄、穿孔和隔膜样改变. NSAIDs引起的小肠损伤的机制还不清楚, 目前主要集中在以下几方面: "三级打击"学说[5]; COX-1和COX-2的双重抑制学说[6]; NO和iNOS损伤学说[7]; 肠肝循环学说[8]. 本研究证实双氯芬酸能够造成严重的小肠损害. 双氯芬酸灌胃3 d后实验大鼠小肠黏膜出现了大量溃疡, 且溃疡长轴与小肠垂直, 集中在肠系膜侧. 这与Pozzoli等[9]报道一致. 双氯芬酸是非特异性环氧合酶抑制剂, 通过抑制COX活性, 干扰花生四烯酸(arachidonic acid, AA)代谢, 从而阻止外周和中枢PGs的合成, 我们的研究显示小肠损伤与小肠黏膜PGE2含量有关, 实验对照组大鼠小肠黏膜损伤大体评分较空白组明显增加, 实验对照组小肠PGE2含量较空白组降低. 前列腺素是一种具有局部保护作用的炎症因子, PGE2通过扩张血管, 进而增加胃肠黏膜的血流量, 还可以抑制炎症细胞的黏附作用, 稳定细胞溶酶体膜、抑制溶酶体释放等细胞保护作用[10]. PGE2生物合成存在两种: 瞬时型和延时型. 瞬时型为受到刺激后即合成, 延时型则是在诱导后数小时才发生. 这种不同与PGE2合成酶和环氧合酶有关. PGE2合成酶分为3种: 胞质PGE2合成酶、膜相关PGE2合成酶1、膜相关PGE2合成酶2. 胞质PGE2合成酶是结构酶广泛表达于各种细胞核组织, 和COX-1一起参与生理性PGE2合成, 维持细胞内稳态. COX-1是构建型环氧合酶, 几乎表达于所有的组织及细胞中. 炎症应激情况下或受到某些激素和生长因子刺激时COX-1可轻度增高[11]. 本实验中实验对照组COX-1较空白组减低, 差异无统计学意义. COX-2是诱导酶, 正常情况下, 各组织细胞中仅表达非常少量或不表达COX-2, 但当病理状态下及炎症处COX-2的表达急剧增加, 尤其是在急性炎症反应中更加明显. 我们的研究提示实验对照组COX-2的表达明显增加, 空白组COX-2无表达. Murakami等[12]发现当膜相关PGE2合成酶1和COX-2共染HEK293细胞株时, 无论是外源性还是内源性AA都会诱导产生大量的PGE2; 而当膜相关PGE2合成酶1和COX-1共染时则不然, 这样说明了COX-2和膜相关PGE2合成酶1, 一起参与炎症反应, 催化延迟型PGE2产生. Takeuchi等[13]发现不管是COX-1特异性抑制剂SC-560, 还是特异性COX-2抑制剂罗非昔布, 都不能单独引起小肠黏膜的损伤. SC-560仅引起肠蠕动减弱、细菌侵入和诱导型一氧化氮合成酶(inducible nitric oxide synthase, iNOS)表达增加, 但小肠黏膜并未受损. 可能与同时引起COX-2表达上调, 产生保护性的PGE2, 从而抵消抑制COX-1引起的PGE2减少. 如果同时应用COX-2抑制剂, 则可以引起小肠损伤.
荆花胃康胶丸是从土荆芥和水团花中提取的挥发油按一定比只组成的复方制剂, 土荆芥具有健胃止痛作用, 水团花有清热利湿、散寒化淤功效, 是一种治疗消化性溃疡及慢性浅表性胃炎的新型中成药. 朱国琴等[14]研究发现荆花胃康胶丸对乙醇所致大鼠急性胃黏膜损伤有预防及修复治疗作用, 其作用机制可能与增加胃黏膜中PGE2和EGF有关. 本实验提示荆花胃康组小肠黏膜损伤大体评分较实验对照组明显减轻, 荆花胃康组小肠黏膜PGE2、COX-1、COX-2含量较实验对照组明显增加, 提示荆花胃康可能通过增加COX-1、COX-2诱导PGE2合成增加而保护小肠黏膜. 埃索美拉唑是奥美拉唑的S-异构体, 与其他质子泵抑制剂(proton pump inhibitor, PPI)一样, 为胃壁细胞质子泵H+-K+-ATP酶的特异性抑制剂, 具有高效持久的抑酸效果, 较好的安全性和较低的不良反应发生率. 有临床证据表明: 对于需要长期接受NSAID药物治疗的老年患者, 埃索美拉唑能够非常有效地预防非甾体类抗炎药引起的肠道损伤和上消化系溃疡, 其疗效优于其他PPI[15]. 本实验提示埃索美拉唑组小肠黏膜损伤大体评分较实验对照组明显减轻, 埃索美拉唑组小肠黏膜PGE2、COX-1含量较实验对照组明显增加, 差异有统计学意义, 埃索美拉唑组小肠黏膜COX-2含量较实验对照组增加, 差异无统计学意义, 提示埃索美拉唑可能通过增加COX-1诱导PGE2合成增加而保护小肠黏膜, COX-2的增加对PGE2合成增加也应起一定的作用. 本课题研究表明, NSAIDs相关性肠病的发病与PGE2含量减少有关. 荆花胃康和埃索美拉唑正是通过增加黏膜PGE2含量起到预防作用, PGE2含量的增加可能与他们上调小肠黏膜COX-1有关. 荆花胃康组黏膜COX-2含量增高可能也起到部分保护作用. 然而结果显示埃索美拉唑组COX-2含量未明显升高, 可能是PPI具有抑制炎症反应有关[16].
非甾体类抗炎药(non-steroidal anti-inflammatory drug, NSAID)是目前最为广泛的处方药物之一, 不良反应占所有药物不良反应的1/3, 其中胃肠道损伤最明显, 小肠组织比胃组织更易受到NSAIDs的影响. 临床上还没有一种药物可以完全取代他, 因此NSAIDs小肠损伤的机制及预防成为研究的热点.
杜群, 副研究员, 广州中医药大学脾胃研究所药理室
NSAID相关性小肠损伤的主要临床表现包括: NSAIDs肠病、小肠溃疡、狭窄、穿孔和隔膜样改变. NSAIDs引起的小肠损伤的机制还不清楚, 目前主要集中在以下几方面: "三级打击"学说; COX-1和COX-2的双重抑制学说; NO和iNOS损伤学说; 肠肝循环学说.
Takeuchi等报道甾体类抗炎药(如消炎痛), 通过抑制COX活性而减少黏膜PGE2的含量, 引起小肠损伤.
本文观察中药荆花胃康胶丸对大鼠NSAID相关小肠损伤的保护, 及荆花胃康对大鼠小肠黏膜前列腺素E2及环氧合酶的影响, 部分解释了荆花胃康对NSAID相关小肠损伤的保护机制. 已有研究显示PPI对NSAID相关小肠损伤有保护作用, 但本文首先研究了埃索美拉唑对NSAID相关大鼠小肠黏膜前列腺素及环氧合酶的影响.
本文研究提示NSAID相关性大鼠小肠损伤与小肠黏膜E2较少相关, 提示荆花胃康胶丸对大鼠NSAID相关性大鼠小肠损伤有保护作用, 为其临床应用于NSAID相关小肠损伤的预防提供了基础实验依据.
"三级打击"学说: 是目前比较推崇的损伤机制. 首先, NSAIDs吸收进入小肠细胞, 引起线粒体氧化磷酸化解偶联. 然后, 氧化磷酸化解偶联引起细胞损伤, 同时细胞间紧密连接结构减少, 细胞通透性增加; 最后由于小肠黏膜通透性增加, 肠道内的胆汁酸、蛋白水解酶、胰酶、食物和细菌等侵袭受损小肠, 导致白细胞趋化聚集, 最终引起小肠非特异性炎症.
NO和iNOS损伤学说: 诱导型一氧化氮合成酶(iNOS)主要存在于巨噬细胞、中性白细胞、内皮细胞、血管平滑肌细胞、心肌和肾髓质细胞中, 且以二聚体形式发挥作用. NSAIDs小肠损伤时iNOS表达升高. NO是免疫系统的双刃剑, 生理剂量NO可以增加肠道腺体分泌, 抑制肠道运动, 抑制细菌的移位. 然而过量的NO则阻断线粒体功能, 产生过量氧自由基, 增加肠道通透性. 进一步诱发肠道有害物质及细菌的侵袭和移位, 造成小肠黏膜损伤;
肠肝循环学说: 大多数NSAIDs吸收至肝脏后与胆汁结合. 约20%-60%的药物随胆汁分泌进入小肠, 即NSAIDs的肝肠循环.
本研究探讨了NSAIDs相关性小肠损伤中小肠黏膜PGE2与COX-1和COX-2的表达, 及荆花胃康和埃索美拉唑对NSAIDs相关性小肠损伤的预防, 有一定的参考价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Smale S, Tibble J, Sigthorsson G, Bjarnason I. Epidemiology and differential diagnosis of NSAID-induced injury to the mucosa of the small intestine. Best Pract Res Clin Gastroenterol. 2001;15:723-738. [PubMed] [DOI] |
| 2. | Yamada T, Deitch E, Specian RD, Perry MA, Sartor RB, Grisham MB. Mechanisms of acute and chronic intestinal inflammation induced by indomethacin. Inflammation. 1993;17:641-662. [PubMed] [DOI] |
| 3. | Zhu F, Qian J, Pan G. [The establishment of TNBS-induced experimental colitis]. Zhongguo Yixue Kexueyuan Xuebao. 1998;20:271-278. [PubMed] |
| 4. | Whittle BJ. Temporal relationship between cyclooxygenase inhibition, as measured by prostacyclin biosynthesis, and the gastrointestinal damage induced by indomethacin in the rat. Gastroenterology. 1981;80:94-98. [PubMed] |
| 5. | Fortun PJ, Hawkey CJ. Nonsteroidal antiinflammatory drugs and the small intestine. Curr Opin Gastroenterol. 2005;21:169-175. [PubMed] [DOI] |
| 6. | Hotz-Behofsits CM, Walley MJ, Simpson R, Bjarnason IT. COX-1, COX-2 and the topical effect in NSAID-induced enteropathy. Inflammopharmacology. 2003;11:363-370. [PubMed] [DOI] |
| 7. | Tuteja N, Chandra M, Tuteja R, Misra MK. Nitric Oxide as a Unique Bioactive Signaling Messenger in Physiology and Pathophysiology. J Biomed Biotechnol. 2004;2004:227-237. [PubMed] [DOI] |
| 9. | Pozzoli C, Menozzi A, Grandi D, Solenghi E, Ossiprandi MC, Zullian C, Bertini S, Cavestro GM, Coruzzi G. Protective effects of proton pump inhibitors against indomethacin-induced lesions in the rat small intestine. Naunyn Schmiedebergs Arch Pharmacol. 2007;374:283-291. [PubMed] [DOI] |
| 10. | Gurleyik G, Ozturk E, Gurleyik E, Aker F, Aktekin A, Ozkara S, Saglam A. Prostaglandins E1 and E2 analogues ameliorate mucosal injury secondary to distal colonic obstruction. J Invest Surg. 2003;16:283-288. [PubMed] [DOI] |
| 11. | Wacker MJ, Best SR, Kosloski LM, Stachura CJ, Smoot RL, Porter CB, Orr JA. Thromboxane A2-induced arrhythmias in the anesthetized rabbit. Am J Physiol Heart Circ Physiol. 2006;290:H1353-H1361. [PubMed] |
| 12. | Murakami M, Naraba H, Tanioka T, Semmyo N, Nakatani Y, Kojima F, Ikeda T, Fueki M, Ueno A, Oh S. Regulation of prostaglandin E2 biosynthesis by inducible membrane-associated prostaglandin E2 synthase that acts in concert with cyclooxygenase-2. J Biol Chem. 2000;275:32783-32792. [PubMed] [DOI] |
| 13. | Takeuchi K, Tanaka A, Kato S, Amagase K, Satoh H. Roles of COX inhibition in pathogenesis of NSAID-induced small intestinal damage. Clin Chim Acta. 2010;411:459-466. [PubMed] [DOI] |
| 15. | Blandizzi C, Tuccori M, Colucci R, Gori G, Fornai M, Antonioli L, Ghisu N, Del Tacca M. Clinical efficacy of esomeprazole in the prevention and healing of gastrointestinal toxicity associated with NSAIDs in elderly patients. Drugs Aging. 2008;25:197-208. [PubMed] [DOI] |
| 16. | Kedika RR, Souza RF, Spechler SJ. Potential anti-inflammatory effects of proton pump inhibitors: a review and discussion of the clinical implications. Dig Dis Sci. 2009;54:2312-2317. [PubMed] [DOI] |