修回日期: 2013-08-10
接受日期: 2013-08-23
在线出版日期: 2013-10-18
目的: 研究肺癌肿瘤抑制物1(tumor suppressor in lung cancer-1, TSLC1)、肺腺癌差异表达因子4.1B(differentially expressed in adenocarcinoma of the lung/4.1B, DAL-1/4.1B)和果蝇肿瘤抑制因子同源分子-3(membrane protein palmitoylated 3, MPP3)在大肠癌中的表达及其相互关系, 并探讨其临床病理意义.
方法: 采用免疫组织化学EnVisionTM法检测76例大肠癌和22例正常肠黏膜组织中TSLC1、DAL-1/4.1B、MPP3的表达, 并结合其临床病理特征分析.
结果: 正常肠黏膜组织中TSLC1、DAL-1/4.1B和MPP3均呈清晰的棕黄色染色定位在上皮细胞质和/或细胞膜. TSLC1、DAL-1/4.1B和MPP3蛋白在大肠癌中的阳性表达率均明显低于其在正常肠黏膜组织中的表达(32.89% vs 81.81%, 27.63% vs 63.64%, 35.53% vs 68.18%; P<0.05). TSLC1、DAL-1/4.1B和MPP3蛋白在大肠癌的表达缺失与肿瘤的分化程度、浸润深度、淋巴结转移和Dukes'分期密切相关(P<0.05), 而与患者的性别、年龄和肿瘤大小无关.
结论: 大肠癌中存在TSLC1、DAL-1/4.1B和MPP3基因的表达缺失, TSLC1与DAL-1/4.1B及MPP3之间的相互作用可能是其发挥肿瘤抑制作用的主要分子机制, 三者可能通过TSLC1级联反应共同参与大肠癌的发生、发展和转移.
核心提示: 抑癌基因TSLC1与DAL-1和MPP3结合构成三聚体, 共同参与调控大肠癌的发生、发展和转移.
引文著录: 高文颂, 熊晶, 王渝. TSLC1、DAL-1/4.1B和MPP3在大肠癌中的表达及其临床意义. 世界华人消化杂志 2013; 21(29): 3173-3178
Revised: August 10, 2013
Accepted: August 23, 2013
Published online: October 18, 2013
AIM: To investigate the clinicopathological significance of expression of tumor suppressor in lung cancer-1 (TSLC1), differentially expressed in adenocarcinoma of the lung/4.1B (DAL-1/4.1B) and membrane protein palmitoylated 3 (MPP3) proteins in colorectal carcinoma.
METHODS: Immunohistochemistry was used to detect the expression of TSLC1, DAL-1/4.1B and MPP3 in 76 colorectal carcinoma tissue samples and 22 normal colorectal mucosal tissue samples. The correlation between expression of TSLC1, DAL-1/4.1B and MPP3 and clinicopathologic features of colorectal carcinoma was analyzed.
RESULTS: Positive staining for TSLC1, DAL-1/4.1B and MPP3 was observed in the cytoplasm and/or membrane of epithelial cells in normal colorectal mucosal tissue. The positive rates of TSLC1, DAL-1/4.1B and MPP3 expression were significantly lower in colorectal carcinoma than in normal control tissue (32.89% vs 81.81%, 27.63% vs 63.64%, 26.32% vs 68.18%; all P < 0.05). The lower expression of TSLC1, DAL-1/4.1B and MPP3 in colorectal carcinoma showed a significant correlation with degree of differentiation, depth of infiltration, lymph node metastasis and Dukes' stage (all P < 0.05), but not with gender, age or tumor size.
CONCLUSION: Low expression of TSLC1, DAL-1/4.1B and MPP3 may be involved the in the development and metastasis of colorectal carcinoma.
- Citation: Gao WS, Xiong J, Wang Y. Clinical significance of expression of TSLC1, DAL-1/4.1B and MPP3 in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(29): 3173-3178
- URL: https://www.wjgnet.com/1009-3079/full/v21/i29/3173.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i29.3173
大肠癌是消化系最常见的恶性肿瘤之一, 其生长、侵袭及转移过程受到多种因素的影响. 其中抑癌基因的突变、缺失和沉默失活是大肠癌发生、发展和转移的重要机制之一. 肺癌肿瘤抑制物1(tumor suppressor in lung cancer-1, TSLC1)是在2001年由Kuramochi等[1]应用功能性互补的方法在人类非小细胞肺癌中发现的一种新的抑癌基因. TSCL1是一种细胞黏附分子, 可参与细胞间黏附、细胞运动、信号转导及免疫调节[2]. 研究发现, 在宫颈癌[3]、喉癌[4]、乳腺癌[5]、食管癌[6]、胰腺癌[7]等多种恶性肿瘤中均存在TSLC1基因的表达缺失或减少, 该基因在肿瘤的发生、发展中起负性作用, 且TSLC1的表达失活与恶性肿瘤的浸润、转移和预后相关. 肺腺癌差异表达因子4.1B(differentially expressed in adenocarcinoma of the lung/4.1B, DAL-1/4.1B)是一类细胞膜骨架蛋白, 定位于人染色体18p11.3[8], 近年的研究已经证实该基因在多种肿瘤中表达缺失, 并且表现出抑制肿瘤转移功能, 被认为是一种潜在的抑癌基因[9]. 果蝇肿瘤抑制因子同源分子-3(membrane protein palmitoylated 3, MPP3)是由585个氨基酸组成一种膜蛋白, 属于膜相关鸟苷酸激酶同系物蛋白(MAGuK)家族成员[10]. 研究发现, TSLC1参与细胞运动和信号传导的功能与DAL-1及MPP3基因密不可分, DAL-1和MPP3与TSLC1在细胞附着位点相互作用, 共同发挥级联抑癌作用[11]. 本研究采用免疫组织化学(EnVisionTM法)检测大肠癌中TSLC1、DAL-1/4.1B和MPP3的表达情况其与临床病理特征之间的关系, 并分析三者之间的相关性, 以探讨三者在大肠癌发生发展和转移中的作用及其临床意义.
收集华中科技大学同济医学院附属同济医院2011-01/2012-12具有完整临床资料大肠癌手术标本73例, 并选取22例癌旁8-10 cm以外的正常段肠管处的正常肠黏膜组织作为对照, 所有病例术前均未进行任何放疗或化疗. 标本经40 g/L甲醛固定、常规石蜡包埋切片和HE染色. 其中男48例, 女28例. 年龄35-72岁, 平均年龄59.6岁. 组织学分级: 高分化腺癌18例, 中分化腺癌33例, 低分化腺癌25例. 浸润深度: 浸润突破肌层者54例, 未突破肌层者22例. Dukes'分期: A期与B期共45例, C期与D期共31例. 有淋巴结转移者31例, 无淋巴结转移者45例. 兔抗人多克隆抗体TSLC1购自Santa Cruz Biotechnology USA; 羊抗人多克隆抗体DAL-1/4.1B购自Abcam公司; 羊抗人多克隆抗体MPP3购自Abcam公司; 免疫组织化学二步法检测试剂盒购自DAKO公司; DAB显色试剂盒购自福州迈新生物技术开发有限公司.
1.2.1 采用免疫组织化学染色EnVision™二步法检测TSLC1、DAL-1/4.1B和MPP3的表达: 实验步骤参照EnVision™说明书进行. 石蜡切片经烤片、脱蜡、梯度乙醇水化后, 用0.01 mol/L(pH 6.0)枸橼酸缓冲液微波抗原修复15 min, 3%双氧水37 ℃孵育10 min. 再分别滴加一抗TSLC1(1:150)、DAL-1/4.1B(1:500)和MPP3(1:500), 37 ℃孵育2 h. 滴加二抗, 37 ℃孵育30 min. DAB显色, 苏木素复染, 脱水, 透明, 中性树胶封片, 镜检. 用已知阳性表达的组织切片做阳性对照, 用PBS缓冲液代替一抗做阴性对照.
1.2.2 结果判断: TSLC1、DAL-1/4.1B和MPP3蛋白阳性表达均定位于细胞质和/或细胞膜, 以细胞质和/或细胞膜出现清晰的棕黄色颗粒判定为阳性细胞. 判断标准: 按照国外文献方法[12], 在高倍镜下(×400倍)对每张切片随机选取10个视野, 每个高倍视野计数200个细胞, 计算阳性细胞数<30%为阴性, 阳性细胞数≥30%为阳性.
统计学处理 采用SPSS18.0统计软件包进行分析, 计数资料采用χ2检验, 相关性检验用Spearman相关分析. P<0.05表示差异有统计学意义.
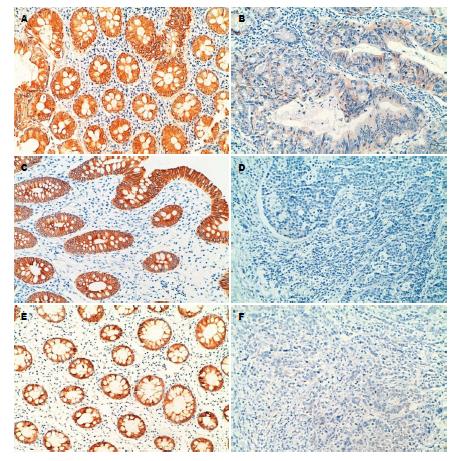
TSLC1、DAL-1/4.1B和MPP3的表达部位相似, 主要定位于细胞质和/或细胞膜, 呈棕黄色颗粒(图1A, C, E). 在76例大肠癌中, TSLC1、DAL-1/4.1B和MPP3均呈不同程度的缺失表达(图1B, D, F), 其阳性表达率分别为32.89%(25/76)、27.63%(21/76)、26.32%(20/76); 而三者在正常肠黏膜组织中的阳性表达率分别为81.81%(18/22)、63.64%(14/22)、68.18%(15/22); 差异有显著性统计学意义(P<0.05, 表1).
| 分组 | n | TSLC1 | DAL-1 | MPP3 | ||||||
| 阳性表达率 | 阴性表达率 | P值 | 阳性表达率 | 阴性表达率 | P值 | 阳性表达率 | 阴性表达率 | P值 | ||
| 正常肠黏膜组织 | 22 | 18(81.8) | 4(18.2) | <0.01 | 14(63.6) | 8(36.4) | <0.05 | 15(68.2) | 7(31.8) | <0.01 |
| 大肠癌组织 | 76 | 25(32.9) | 51(67.1) | 21(27.6) | 55(72.4) | 27(35.5) | 49(64.5) | |||
TSLC1、DAL-1/4.1B和MPP3在大肠癌中的表达与肿瘤的分化程度、浸润深度、淋巴结转移和Dukes'分期密切相关(P<0.05), 而与患者的性别、年龄和肿瘤大小无关(表2). TSLC1、DAL-1/4.1B和MPP3在Dukes'分期C+D期、低分化腺癌、有浆膜浸润及淋巴结转移者中阳性表达率明显低于Duke's分期A+B期、高-中分化腺癌、无浆膜浸润及无淋巴结转移者, 差异有显著性统计学意义.
| 临床病理特征 | n | TSLC1表达 | DAL-1表达 | MPP3表达 | ||||||
| 阳性 | 阴性 | P值 | 阳性 | 阴性 | P值 | 阳性 | 阴性 | P值 | ||
| 年龄(岁) | ||||||||||
| ≤55 | 32 | 10(31.2) | 22(68.8) | >0.05 | 11(34.4) | 21(63.6) | >0.05 | 13(40.1) | 19(59.9) | >0.05 |
| >55 | 44 | 15(34.1) | 29(65.9) | 10(22.7) | 34(77.3) | 14(31.8) | 30(68.2) | |||
| 性别 | ||||||||||
| 男 | 48 | 14(29.2) | 34(70.8) | >0.05 | 14(29.2) | 34(70.8) | >0.05 | 17(35.4) | 31(64.6) | >0.05 |
| 女 | 28 | 11(39.3) | 17(60.7) | 7(25.0) | 21(75.0) | 10(35.7) | 18(64.3) | |||
| 肿瘤大小(cm) | ||||||||||
| ≤5 | 46 | 16(34.8) | 30(65.2) | >0.05 | 13(28.3) | 33(71.7) | >0.05 | 19(41.3) | 27(59.7) | >0.05 |
| >5 | 30 | 9(30.0) | 21(70.0) | 11(36.7) | 19(63.3) | 8(26.7) | 22(73.3) | |||
| 分化程度 | ||||||||||
| 高 | 18 | 10(55.6) | 8(44.4) | <0.05 | 9(50.0) | 9(50.0) | <0.05 | 11(61.1) | 7(38.9) | <0.05 |
| 中 | 33 | 10(30.3) | 23(69.7) | 8(24.2) | 25(75.8) | 10(30.3) | 23(69.7) | |||
| 低 | 25 | 5(20.0) | 20(80.0) | 4(16.0) | 21(84.0) | 6(24.0) | 19(76.0) | |||
| 淋巴结转移 | ||||||||||
| 有 | 31 | 6(19.4) | 25(80.6) | <0.05 | 4(12.9) | 27(87.1) | <0.05 | 6(19.4) | 25(70.6) | <0.05 |
| 无 | 45 | 19(42.2) | 26(57.8) | 17(37.8) | 28(62.2) | 21(46.7) | 24(53.3) | |||
| 浸润深度 | ||||||||||
| 未及浆膜 | 54 | 12(22.2) | 43(77.8) | <0.01 | 11(20.4) | 43(79.6) | <0.05 | 14(25.9) | 40(74.1) | <0.01 |
| 侵及浆膜 | 22 | 13(59.1) | 9(40.9) | 10(45.5) | 12(54.5) | 13(61.9) | 9(38.1) | |||
| Duke's分期 | ||||||||||
| A+B期 | 45 | 21(46.7) | 24(53.3) | <0.01 | 17(37.8) | 28(62.2) | <0.05 | 21(46.7) | 24(53.4) | <0.05 |
| C+D期 | 31 | 4(12.9) | 27(87.1) | 4(12.9) | 27(87.1) | 6(19.4) | 25(80.6) | |||
TSLC1与DAL-1/4.1B、MPP3在大肠癌中的表达具有一定的相关性. 在25例TSLC1阳性表达大肠癌, 12例DAL-1/4.1B呈阳性表达, 18例MPP3呈阳性表达; 而在51例TSLC1表达减少或缺失的病例中, 9例DAL-1/4.1B呈阳性表达, 8例MPP3呈阳性表达; TSLC1与DAL-1/4.1B、MPP3的表达之间存在显著的正相关性(r = 0.319, r = 0.534; P<0.05)(表3).
| TSCL1 | n | DAL-1 | MPP3 | ||||||
| 阳性 | 阴性 | r值 | P值 | 阳性 | 阴性 | r值 | P值 | ||
| 阳性(%) | 25 | 12(48.0) | 13(52.0) | 0.319 | <0.01 | 18(72.0) | 7(28.0) | 0.534 | <0.01 |
| 阴性(%) | 51 | 9(17.6) | 42(82.4) | 9(17.6) | 42(72.6) | ||||
TSLC1是2001年Kuramochi等[1]在人非小细胞肺癌中通过功能性互补方法发现的一种新的抑癌基因, 定位于人染色体11q23.2, 全长约300 kb, 包含12个外显子, 属于细胞黏附分子中免疫球蛋白超家族成员. TSLC1作为一种细胞与细胞之间相互作用的膜蛋白, 可维持上皮细胞之间的紧密连接, 主要参与细胞间黏附、细胞运动、信号转导及免疫调节, 并在肿瘤的发生发展中起负性作用[2]. 研究发现, 在宫颈癌[3]、喉癌[4]、鼻咽癌[13]、乳腺癌[5]、食管癌[6]、胃癌[14]、胰腺癌[7]、前列腺癌[15]等多种恶性肿瘤中均存在TSLC1的表达缺失或减少, 且TSLC1的失活在肿瘤晚期发生更频繁, 启动子甲基化和杂合性缺失是其主要失活机制[2]. 本研究显示, TSLC1在大肠癌中的表达明显低于其在正常肠黏膜组织中的表达. 随着大肠癌分化程度的降低、浸润深度的增加、Dukes'分期的进展以及淋巴结转移的发生, TSLC1的阳性表达率明显降低, 呈缺失表达状态. 因此我们推测作为一种抑癌基因, TSLC1的表达失活不仅在大肠癌的发生发展中发挥了重要作用, 而且与大肠癌的侵袭、转移和预后相关.
DAL-1/4.1B属于4.1蛋白家族, 定位于人染色体18p11.3, 是一种将TSLC1和肌动蛋白细胞骨架相连接的锚连蛋白[8]. DAL-1/4.1B具有维持细胞膜稳定的作用, 与细胞内信号转导和细胞间相互作用密切相关. 该基因已经证实在多种肿瘤中表达缺失, 并且具有抑制肿瘤转移功能, 被认为是一种潜在的抑癌基因[9]. MPP3是由585个氨基酸组成一种膜蛋白, 定位于人染色体17q21, 与CASK、Pals2 及syntenin等均属属于膜相关鸟苷酸激酶同系物蛋白(MAGUK)家族成员, 与果蝇肿瘤抑制基因DLG(discslarge)高度同源[10]. MPP3在细胞中起着分子支架的作用, 可参与保持细胞极性和形态, 并通过其多个作用域参与信号传导[10]. DAL-1和MPP3目前认为与TSLC1结合的蛋白, DAL-1和MPP3与TSLC1在细胞附着位点相互作用, 共同参与维持相邻细胞间黏附, 一旦其中的一种蛋白表达缺失, 就会引起TSLC1级联蛋白的功能丧失, 破坏细胞间黏附而诱发肿瘤转移[5]. 在本研究中, 免疫组织化学结果显示DAL-1和MPP3在大肠癌中的表达与TSLC1具有相似性, DAL-1和MPP3在大肠癌中的表达明显低于其在正常肠黏膜组织中的表达; 且二者的表达与大肠癌的分化程度、浸润深度、淋巴结转移和Dukes'分期密切相关(P<0.05), 而与患者的性别、年龄以及肿瘤大小无关. 上述研究结果提示TSLC1、DAL-1和MPP3的低表达与大肠癌的侵袭和发展密切相关, TSLC1与DAL-1及MPP3间的相互作用可能是其发挥肿瘤抑制能力的主要分子机制.
研究发现, TSLC1与DAL-1及MPP3可能位于同一级联路径, TSLC1参与细胞运动和信号传导的功能与DAL-1及MPP3密不可分. TSLC1的胞内区羧基端含2个重要蛋白结合模序: FERM(protein4.1/ezrin/radixin/moesin)结合模序和PDZ(PSD-95/Dlg/ZO-1)结合模序. TSLC1通过这两个结合模序分别与DAL-1蛋白及MPP3蛋白相互连接形成复合体, 参与细胞骨架的构建和维持正常细胞的黏附功能的稳定; 并通过MPP3参与信号传导, 维持细胞极性, 发挥肿瘤抑制功能[5]. 本研究显示, 大肠癌中TSLC1蛋白与DAL-1及MPP3蛋白的表达呈正相关(P<0.05), 三者可能共同参与维持正常肠道组织结构和肠上皮细胞增殖、黏附功能的稳定, 在大肠癌的发生发展中具有协同作用.
总之, TSLC1、DAL-1和MPP3在大肠癌中表达下调或缺失, 三者的表达失活均与大肠癌的分化程度、浸润深度、淋巴结转移和Dukes'分期密切相关. 大肠癌中TSLC1的表达与DAL-1及MPP3的表达之间具有一定的正相关性. TSLC1蛋白可能与DAL-1和MPP3蛋白结合构成三聚体, 共同参与大肠癌的发生、发展和转移.
TSCL1是一种细胞黏附分子, 可参与细胞间黏附、细胞运动、信号转导及免疫调节, 在多种肿瘤中表达缺失或减少. TSLC1与DAL-1和MPP3在细胞附着位点相互作用, 共同发挥级联抑癌作用.
邹小明, 教授, 黑龙江省哈尔滨市, 哈尔滨医科大学附属第二医院普外二科
TSLC1参与细胞运动和信号传导的功能与DAL-1及MPP3基因密不可分, 三者共同发挥级联抑癌作用. 本研究提示TSLC1蛋白可能与DAL-1和MPP3蛋白结合构成三聚体, 共同参与大肠癌的发生发展和转移.
TSLC1可通过与DAL-1蛋白及MPP3蛋白相互连接形成复合体, 参与细胞骨架的构建和信号传导, 维持细胞极性, 发挥肿瘤抑制功能. TSLC1、DAL-1和MPP3在大肠癌中表达下调或缺失,且大肠癌中TSLC1蛋白与DAL-1及MPP3蛋白的表达相关, 三者可能共同参与维持正常肠道组织结构和肠上皮细胞增殖、黏附功能的稳定, 在大肠癌的发生发展中具有协同作用.
本文检测了抑癌基因TSLC1、DAL-1和MPP3在大肠癌中的表达情况及其与临床病理特征之间的关系, 并分析三者之间的相关性, 探讨三者在大肠癌发生发展和转移中的作用.
本文提示TSLC1与DAL-1及MPP3在调控大肠癌的发生发展和转移中共同发挥肿瘤抑制功能作用.
抑癌基因TSLC1、DAL-1和MPP3在大肠癌中的表达, 有重要临床意义.
编辑: 田滢 电编:鲁亚静
| 1. | Kuramochi M, Fukuhara H, Nobukuni T, Kanbe T, Maruyama T, Ghosh HP, Pletcher M, Isomura M, Onizuka M, Kitamura T. TSLC1 is a tumor-suppressor gene in human non-small-cell lung cancer. Nat Genet. 2001;27:427-430. [PubMed] [DOI] |
| 2. | Masuda M, Kikuchi S, Maruyama T, Sakurai-Yageta M, Williams YN, Ghosh HP, Murakami Y. Tumor suppressor in lung cancer (TSLC)1 suppresses epithelial cell scattering and tubulogenesis. J Biol Chem. 2005;280:42164-42171. [PubMed] [DOI] |
| 3. | Steenbergen RD, Kramer D, Braakhuis BJ, Stern PL, Verheijen RH, Meijer CJ, Snijders PJ. TSLC1 gene silencing in cervical cancer cell lines and cervical neoplasia. J Natl Cancer Inst. 2004;96:294-305. [PubMed] [DOI] |
| 4. | Lu B, Di W, Wang H, Ma H, Li J, Zhang Q. Tumor suppressor TSLC1 is implicated in cell proliferation, invasion and apoptosis in laryngeal squamous cell carcinoma by regulating Akt signaling pathway. Tumour Biol. 2012;33:2007-2017. [PubMed] [DOI] |
| 5. | Heller G, Geradts J, Ziegler B, Newsham I, Filipits M, Markis-Ritzinger EM, Kandioler D, Berger W, Stiglbauer W, Depisch D. Downregulation of TSLC1 and DAL-1 expression occurs frequently in breast cancer. Breast Cancer Res Treat. 2007;103:283-291. [PubMed] [DOI] |
| 6. | Ito T, Shimada Y, Hashimoto Y, Kaganoi J, Kan T, Watanabe G, Murakami Y, Imamura M. Involvement of TSLC1 in progression of esophageal squamous cell carcinoma. Cancer Res. 2003;63:6320-6326. [PubMed] |
| 7. | Mao X, Seidlitz E, Truant R, Hitt M, Ghosh HP. Re-expression of TSLC1 in a non-small-cell lung cancer cell line induces apoptosis and inhibits tumor growth. Oncogene. 2004;23:5632-5642. [PubMed] [DOI] |
| 8. | Takakuwa Y. Protein 4.1, a multifunctional protein of the erythrocyte membrane skeleton: structure and functions in erythrocytes and nonerythroid cells. Int J Hematol. 2000;72:298-309. [PubMed] |
| 9. | Kikuchi S, Yamada D, Fukami T, Masuda M, Sakurai-Yageta M, Williams YN, Maruyama T, Asamura H, Matsuno Y, Onizuka M. Promoter methylation of DAL-1/4.1B predicts poor prognosis in non-small cell lung cancer. Clin Cancer Res. 2005;11:2954-2961. [PubMed] [DOI] |
| 10. | Fukuhara H, Masuda M, Yageta M, Fukami T, Kuramochi M, Maruyama T, Kitamura T, Murakami Y. Association of a lung tumor suppressor TSLC1 with MPP3, a human homologue of Drosophila tumor suppressor Dlg. Oncogene. 2003;22:6160-6165. [PubMed] [DOI] |
| 11. | Yageta M, Kuramochi M, Masuda M, Fukami T, Fukuhara H, Maruyama T, Shibuya M, Murakami Y. Direct association of TSLC1 and DAL-1, two distinct tumor suppressor proteins in lung cancer. Cancer Res. 2002;62:5129-5133. [PubMed] |
| 12. | Goto A, Niki T, Chi-Pin L, Matsubara D, Murakami Y, Funata N, Fukayama M. Loss of TSLC1 expression in lung adenocarcinoma: relationships with histological subtypes, sex and prognostic significance. Cancer Sci. 2005;96:480-486. [PubMed] [DOI] |
| 13. | Lung HL, Cheung AK, Xie D, Cheng Y, Kwong FM, Murakami Y, Guan XY, Sham JS, Chua D, Protopopov AI. TSLC1 is a tumor suppressor gene associated with metastasis in nasopharyngeal carcinoma. Cancer Res. 2006;66:9385-9392. [PubMed] [DOI] |
| 14. | Tamura G. Promoter methylation status of tumor suppressor and tumor-related genes in neoplastic and non-neoplastic gastric epithelia. Histol Histopathol. 2004;19:221-228. [PubMed] |