修回日期: 2013-08-28
接受日期: 2013-09-17
在线出版日期: 2013-10-18
目的: 检测白介素-23(interleukin-23, IL-23)和IL-17在溃疡性结肠炎(ulcerative colitis, UC)患者血浆及肠黏膜组织中的表达, 并探讨二者间关系.
方法: 留取40例UC患者血浆及肠黏膜组织标本, 进行组织学分级, 同时收集12例正常对照者血浆和肠黏膜组织标本. ELISA法检测血浆中IL-23、IL-17水平, 免疫组织化学SP法检测肠黏膜组织中IL-23、IL-17的表达, 并分析两者关系.
结果: 40例UC患者组织学分级1级7例, 2级21例, 3级12例. UC患者血浆及肠黏膜组织中IL-23、IL-17表达均高于正常对照组(分别为: 0.17±0.58 vs 4.38±1.27, P<0.05; 0.42±1.00 vs 4.88±0.91, P<0.05), 且二者的表达随UC组织病理分级增加而增高(分别为: 3.00±0.53 vs 4.12±1.15 vs 5.58±0.51; 3.71±0.76 vs 4.81±0.60 vs 5.67±0.65), IL-23与IL-17呈显著正相关(P<0.01).
结论: IL-23、IL-17在UC的病程中可能发挥重要作用.
核心提示: 本研究针对活动期溃疡性结肠炎(ulcerative colitis, UC)血浆及肠黏膜组织中白细胞介素(interleukin, IL)-23、IL-17的表达、相关性进行研究, 同时分析两者与组织学分级的相关性, 意在说明IL-23、IL-17在一定程度上可以评估UC疾病活动情况及肠黏膜组织的损伤程度, 临床上我们可以IL-23、IL-17为新的切入点, 寻找更有效的治疗方法.
引文著录: 姚宏凤, 沈洪, 郑凯, 朱磊. 溃疡性结肠炎患者血浆及肠黏膜组织中IL-23、IL-17的表达及相互关系. 世界华人消化杂志 2013; 21(29): 3153-3157
Revised: August 28, 2013
Accepted: September 17, 2013
Published online: October 18, 2013
AIM: To determine the levels of interleukin 23 (IL-23) and IL-17 in the plasma and colonic mucosa in patients with ulcerative colitis (UC) and to analyze their correlations.
METHODS: ELISA and immunohistochemistry were used to determine the levels of IL-23 and IL-17 in the plasma and colonic mucosa in 40 UC patients and 12 healthy controls, respectively.
RESULTS: Both plasma and colonic mucosal levels of IL-23 and IL-17 were significantly increased in UC patients compared to healthy controls (all P < 0.05). IL-23 and IL-17 immunoreactivity was significantly associated with pathologic grade of UC. The expression of IL-17 had a positive correlation with that of IL-23.
CONCLUSION: IL-23 and IL-17 may play an important role in the progression of UC.
- Citation: Yao HF, Shen H, Zheng K, Zhu L. Plasma and colonic mucosal levels of IL-23 and IL-17 in patients with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2013; 21(29): 3153-3157
- URL: https://www.wjgnet.com/1009-3079/full/v21/i29/3153.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i29.3153
溃疡性结肠炎(ulcerative colitis, UC)为直肠和结肠慢性非特异性炎症性疾病[1], 病变主要局限于大肠黏膜及黏膜下层, 临床表现为腹泻、黏液脓血便、腹痛等, 病情轻重不等, 多反复发作.
UC发病机制涉及遗传、免疫等多方面. 白细胞介素-23(interleukin-23, IL-23)与IL-17做为IL-23/IL-17轴最主要的炎症因子, 是近年来国内外学者研究的热点. IL-23由抗原提呈细胞(antigen presenting cell, APC)分泌, 文献报道IL-23可能是引起肠道炎症的关键介质[2], 他与辅助性T细胞17(T helper 17 cells, Th17)表面IL-23受体(IL-23R)结合, 促使Th17细胞稳定扩增, 从而表达大量效应致炎细胞因子IL-17, 破坏肠黏膜屏障、损伤肠上皮细胞, 导致肠道炎症[3]. 至今虽有多项研究表明IL-23、IL-17在UC肠黏膜组织及血浆中表达均升高[4-6], 但IL-23、IL-17表达相关性及两者与UC患者肠黏膜组织病理分级关系尚不明确. 因此, 我们检测了IL-23、IL-17在UC血浆及肠黏膜中的表达, 探讨他们在UC发病机制中的作用和相互关系.
选择2012-04/2012-12江苏省中医院及南京市第一人民医院消化科住院及门诊符合条件的40例活动期UC患者, 所有UC患者临床表现、肠镜和病理检查均符合2007年中华医学会消化病学分会炎症性肠病协作组制定的UC诊断标准[7]. 其中男23例, 女17例, 年龄19-63岁(中位年龄42.8岁), 病程0.4-8.4年. 对照组12例, 为性别、年龄与患者相匹配的健康体检者. 组织学分级由2位病理科医生阅片, 按Riley-Manigoodman标准进行[8]. 所有患者及健康对照者标本留取前均签署知情同意书.
1.2.1 标本采集: 分别在患者就诊时行电子结肠镜检查, 留取结肠黏膜活检标本, 10%甲醛固定, 脱水, 常规石蜡包埋待测; 另于肠镜次日取患者晨空腹肘静脉血2 mL, 离心后分离血浆, 置-80 ℃冰箱保存待测.
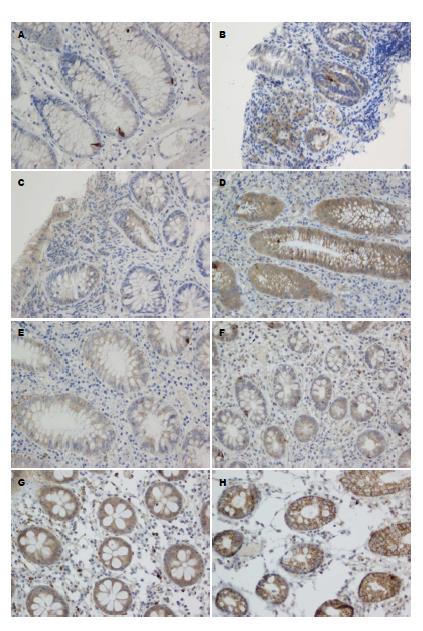
1.2.2 检测: (1)酶联免疫吸附(ELISA)法: 分别使用IL-23、IL-17 ELISA试剂盒检测血浆中IL-23、IL-17水平, 由CliniBio 128型酶标仪测定结果, 采用EXCEL软件绘制标准曲线, 试剂盒均由美国RB公司提供, 操作按说明书进行. 所有标本均同批检测; (2)免疫组织化学染色: 石蜡切片脱蜡水化, H2O2灭活内源性酶, 高压锅高温高压修复抗原, 免疫组织化学染色方法参照SP试剂盒产品说明书操作流程依次进行, 用0.01 mol/L PBS替代一抗作阴性对照, 用已知阳性切片作阳性对照. DAB显色、苏木素复染, 脱水, 透明, 封片显微镜下观察. 所用试剂: 纯化的鼠抗人IL-23(p19)多克隆抗体(稀释比例1:100), 购自Biolegend公司; 兔抗人IL-17多克隆抗体(稀释比例1:100), 购自Santa Cruz公司. 结果判定: 将黏膜病理切片染色强度、染色面积均为阴性记0分; 黏膜病理切片染色强度、染色面积分别为淡黄色及<10%均记1分; 黏膜病理切片染色强度、染色面积分别为黄色及10%-25%均记2分; 黏膜病理切片染色强度、染色面积分别为棕黄色及26%-50%均记3分; 黏膜病理切片染色面积>50%记4分. 计算病理切片染色强度及染色面积赋分和.
统计学处理 采用SPSS19.0统计软件处理数据资料, 结果以mean±SD表示, 运用两独立样本均数t检验(Student's t-test)检验UC组和对照组血浆及组肠黏膜组织IL-23、IL-17表达水平; 单因素方差分析(one way ANOVA)进行组织学分级间的比较; IL-23与IL-17相关性分析采用Pearson相关分析. P<0.05为差异有统计学意义.
临床类型为初发型和慢性复发型; 按Southerland疾病活动指数进行分期[9], 入选患者均为活动期; 组织学分级1级7例, 2级21例, 3级12例.
活动期UC患者血浆中IL-23、IL-17表达水平高于对照组(639.79 ng/L±309.41 ng/L vs 2231.27 ng/L±1623.87 ng/L, P<0.05; 1.46±0.22 vs 4.80±4.33, P<0.05). 且随着病理组织学级别增加, IL-23、IL-17水平增高, 其中组织学分级为1、2级UC患者IL-23、IL-17水平虽高于对照组, 但两组间差异无统计学意义(P>0.05, 表1).
活动期UC肠黏膜组织中IL-23、IL-17表达明显高于对照组(P<0.05). 且随着病理组织学级别增加, IL-23、IL-17表达明显增多, 且组间比较均有显著性差异(P<0.05, 表2, 图1).
UC患者结肠黏膜及血浆中IL-23与IL-17表达水平经双变量相关分析, 结果显示r = 0.725, P<0.01, 认为两者呈正向直线相关.
IL-23/IL-17轴是近年来研究的热点, 研究证实[10-12], 该轴与银屑病、原发性胆汁性肝硬化、闭塞性细支气管炎综合征等多种炎症反应及自身免疫相关性疾病的发病密切相关. 在UC肠黏膜炎症中, IL-23、IL-17在IL-23/IL-17轴中通过以下途径发挥致炎作用. 当肠道内致病菌产物(如脂多糖LPS、磷酸葡萄糖酸盐PGN等)与各自的Toll样受体(Toll-like receptor, TLR)(分别是TLR4和TLR2)结合, 从而诱导APC's(如被激活的树突状细胞、巨噬细胞等)分泌IL-23. IL-23与Th17细胞表面IL-23R结合, 促使Th17细胞稳定、大量扩增, 与此同时, Th17细胞表达大量效应致炎细胞因子IL-17. IL-17促使血管内皮细胞分泌黏附分子(如: ICAM-1等), 使肌纤维细胞、上皮细胞分泌IL-6、IL-8. IL-8作为中性粒细胞浸入肠黏膜组织的趋化因子. 中性粒细胞的浸润导致炎症介质(如基质金属蛋白酶)及诱导型一氧化氮合酶(iducible nitric oxide synthase, iNOS)释放, 这一系列过程最终导致肠道慢性炎症、上皮细胞的损伤, 肠黏膜屏障破坏, 形成UC. 其中IL-23通过STAT3信号通路介导, 在UC的发病机制中起中枢性纽带作用. 有学者推测IL-23是通过先激活固有免疫系统, 然后后者再激活、诱导肠道局部的T细胞免疫应答, 导致UC发病[13]; IL-23可激活UC患者肠黏膜上皮间淋巴细胞(intraepithelial lymphocyte, IEL)、NK细胞, 促使其分泌相应的致炎细胞因子, 调节炎症反应; 还通过抑制Foxp3+调节性T细胞的发展来促进肠炎的发生[14]. 而IL-17是UC肠黏膜组织炎症反应中重要的调节因子, 他通过细胞外信号调节(extracellular regulated protein kinases, ERK)-丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)和NF-κB通路发挥生物学效应, 诱导IL-6、粒细胞/巨噬细胞集落刺激因子、细胞间黏附分子1等炎症相关基因表达, 引起组织细胞浸润和组织破坏, 导致肠道炎症. IL-23作为IL-23/IL-17轴中炎症的始动因子, 而IL-17则为核心致炎因子, 促发炎症的级联放大, 最终介导了肠道炎症的发生和肠黏膜的损伤.
Liu等[6]研究显示UC肠黏膜组织标本IL-23p19主要表达于肠黏膜的CD68+巨噬细胞, IL-23p19阳性细胞的百分比及IL-23p19 mRNA较健康对照组显著增高; 同时, 在UC肠黏膜中, IEL的IL-23R表达明显增高, IL-23可刺激UC IEL分泌更高水平的IFN-γ、TNF、IL-2, 同时分泌IL-17A, 而健康对照者的IEL经IL-23刺激无IL-17A的表达. 而Fujino等[5]对UC患者血浆及肠黏膜组织中的IL-17研究显示, 活动期UC血浆IL-17水平明显高于健康对照组; 同时, IL-17表达于UC肠黏膜中CD3+ T细胞、CD68+单核细胞及巨噬细胞, 活动期UC IL-17表达数量明显高于缓解期UC; 而健康对照组、缺血性肠病、感染性结肠炎患者中均无IL-17的阳性表达. IL-23、IL-17在UC患者中均表达增高, 但两者表达水平变化与UC患者肠黏膜组织学分级是否相关, 以及两者内部关联性, 尚无明确报道阐述证实. 本研究发现, IL-23、IL-17不仅在活动期UC血浆及肠黏膜组织中表达高于健康对照组, 还随着组织学分级增高而表达增强, 虽组织学分级1、2级的UC血浆中两致炎细胞因子较健康对照组表达水平增高, 但无统计学意义, 与相关研究结果[15]证实IL-23、IL-17在中重度UC及克罗恩病(Crohn's disease, CD)患者中显著表达吻合. 且IL-23与IL-17表达密切相关, 无论是在血浆中还是肠黏膜组织中IL-17均伴随IL-23升高而升高.
总之, IL-23/IL-17轴相关的细胞因子IL-23、IL-17在活动期UC患者血浆及肠黏膜组织中均高表达, 且随着UC肠黏膜组织学分级的增加而表达水平增高, 提示IL-23/IL-17轴的主要细胞因子IL-23、IL-17与UC肠道黏膜损伤程度密切相关, 在UC的发生发展中占据重要地位, 其具体的作用机制有待进一步研究.
溃疡性结肠炎(ulcerative colitis, UC)发病由肠黏膜天然免疫异常启动、肠壁黏膜免疫调节异常持续、肠道感染、肠壁黏膜屏障缺损、遗传和环境等因素共同参与, 其中免疫反应异常是UC发生发展的核心环节. 白细胞介素(interleukin)-23、IL-17作为IL-23/IL-17轴主要细胞因子已成为研究热点, 但两者表达水平变化与UC肠黏膜组织学分级是否相关以及两者内部关联性尚不明确.
杜群, 副研究员, 广州中医药大学脾胃研究所药理室; 卢晓梅, 教授, 研究员, 新疆医科大学第一附属医院临床医学研究院
本研究通过检测IL-23、IL-17在活动期UC患者血浆及肠黏膜组织中的表达, 分析两种细胞因子的变化与UC肠黏膜组织学分级间的关系, 同时分析两者内部关联性.
Liu等研究显示UC肠黏膜IL-23p19主要表达于肠黏膜中的CD68+巨噬细胞, 其表达数量明显高于健康对照组; 同时, IL-23可刺激UC IEL分泌IL-17A. Fujino等研究发现, 活动期UC血浆IL-17水平明显高于健康对照组; 同时, IL-17表达于UC肠黏膜中CD3+ T细胞、CD68+单核细胞及巨噬细胞, UC活动期IL-17表达数量明显高于缓解期; 健康对照组、缺血性肠病、感染性结肠炎患者均无IL-17的阳性表达.
已有研究显示IL-23、IL-17在UC患者中均表达增高, 但其表达水平的变化与组织学分级是否相关, 两细胞因子内部是否有关联性, 尚无明确论述. 本研究发现, IL-23、IL-17不仅在血浆及肠黏膜组织中表达显著高于对照组, 且随着组织学分级增高而表达水平升高; 数据经检验分析, 发现IL-17伴随IL-23表达增高而增高, 两者呈显著直线正相关.
本文具有一定的科学性和可读性.
编辑: 田滢 电编:鲁亚静
| 1. | Danese S, Fiocchi C. Ulcerative colitis. N Engl J Med. 2011;365:1713-1725. [PubMed] [DOI] |
| 2. | Hue S, Ahern P, Buonocore S, Kullberg MC, Cua DJ, McKenzie BS, Powrie F, Maloy KJ. Interleukin-23 drives innate and T cell-mediated intestinal inflammation. J Exp Med. 2006;203:2473-2483. [PubMed] |
| 3. | Fitzpatrick LR. Novel Pharmacological Approaches for Inflammatory Bowel Disease: Targeting Key Intracellular Pathways and the IL-23/IL-17 Axis. Int J Inflam. 2012;2012:389404. [PubMed] [DOI] |
| 5. | Fujino S, Andoh A, Bamba S, Ogawa A, Hata K, Araki Y, Bamba T, Fujiyama Y. Increased expression of interleukin 17 in inflammatory bowel disease. Gut. 2003;52:65-70. [PubMed] |
| 6. | Liu Z, Yadav PK, Xu X, Su J, Chen C, Tang M, Lin H, Yu J, Qian J, Yang PC. The increased expression of IL-23 in inflammatory bowel disease promotes intraepithelial and lamina propria lymphocyte inflammatory responses and cytotoxicity. J Leukoc Biol. 2011;89:597-606. [PubMed] [DOI] |
| 8. | Atreya I, Atreya R, Neurath MF. NF-kappaB in inflammatory bowel disease. J Intern Med. 2008;263:591-596. [PubMed] [DOI] |
| 9. | Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study. N Engl J Med. 1987;317:1625-1629. [PubMed] |
| 10. | Vanaudenaerde BM, De Vleeschauwer SI, Vos R, Meyts I, Bullens DM, Reynders V, Wuyts WA, Van Raemdonck DE, Dupont LJ, Verleden GM. The role of the IL23/IL17 axis in bronchiolitis obliterans syndrome after lung transplantation. Am J Transplant. 2008;8:1911-1920. [PubMed] [DOI] |
| 11. | Qian C, Jiang T, Zhang W, Ren C, Wang Q, Qin Q, Chen J, Deng A, Zhong R. Increased IL-23 and IL-17 expression by peripheral blood cells of patients with primary biliary cirrhosis. Cytokine. 2013;64:172-180. [PubMed] [DOI] |
| 12. | Brunner PM, Koszik F, Reininger B, Kalb ML, Bauer W, Stingl G. Infliximab induces downregulation of the IL-12/IL-23 axis in 6-sulfo-LacNac (slan)(+) dendritic cells and macrophages. J Allergy Clin Immunol. 2013; Jul 25. [Epub ahead of print]. [PubMed] [DOI] |
| 13. | Buonocore S, Ahern PP, Uhlig HH, Ivanov II, Littman DR, Maloy KJ, Powrie F. Innate lymphoid cells drive interleukin-23-dependent innate intestinal pathology. Nature. 2010;464:1371-1375. [PubMed] [DOI] |
| 14. | Izcue A, Hue S, Buonocore S, Arancibia-Cárcamo CV, Ahern PP, Iwakura Y, Maloy KJ, Powrie F. Interleukin-23 restrains regulatory T cell activity to drive T cell-dependent colitis. Immunity. 2008;28:559-570. [PubMed] [DOI] |
| 15. | Higa S, Suzuki T, Hayashi A, Tsuge I, Yamamura Y. Isolation of catecholamines in biological fluids by boric acid gel. Anal Biochem. 1977;77:18-24. [PubMed] |