修回日期: 2013-08-07
接受日期: 2013-08-13
在线出版日期: 2013-10-18
125I粒子由于其良好的物理学及放射生物学特性, 并且组织间插植治疗具有损伤小, 精确适形、肿瘤局部控制率高等优点, 在肝癌的非手术治疗中起到了越来越重要的作用. 目前125I粒子植入主要治疗不能手术切除的原发性肝癌、肝癌合并门静脉癌栓、胆管细胞癌、肝转移癌等, 并且对于严格选择的患者鲜有并发症发生. 总的来说, 对于新发或者复发不能手术切除或完全切除的原发性肝癌或肝转移癌, 粒子植入治疗能够显著改善患者的生存率和生活质量.
核心提示: 植入治疗由于持续低剂量率照射作用于各个细胞周期, 阻断细胞周期活动, 同时由于其持续的低剂量照射增加了再氧合故提高了肿瘤组织的放射敏感性.
引文著录: 仝宇梭, 曹秀峰. 125I粒子组织间插植治疗肝癌的进展. 世界华人消化杂志 2013; 21(29): 3072-3077
Revised: August 7, 2013
Accepted: August 13, 2013
Published online: October 18, 2013
125I seeds have good physical and radiobiological characteristics. Interstitial brachytherapy has advantages of minimal invasive, precise stereotactic treatment and high local control rate and plays an important role in the treatment of hepatocellular carcinoma (HCC). Brachytherapy with 125I seeds has been used in unresectable HCC, HCC with portal vein tumor thrombus, intrahepatic cholangiocarcinoma, hepatic metastases, and some other tumors, providing encouraging survival rates. Radiation-related complications are rare in highly selected patients. In a word, 125I brachytherapy is a safe and effective treatment for newly diagnosed or recurrent unresectable intrahepatic malignancies and can provide better survival rates and decent quality of life.
- Citation: Tong YS, Cao XF. Brachytherapy with iodine-125 seeds for hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(29): 3072-3077
- URL: https://www.wjgnet.com/1009-3079/full/v21/i29/3072.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i29.3072
原发性肝癌(hepatocellular carcinoma, HCC)是严重危害人类健康的常见恶性肿瘤, 在全球范围内HCC的发病率在所有恶性肿瘤中居第6位, 在恶性肿瘤致死率中居第3位, 据统计仅2008年新诊断HCC患者人数就接近70万例, 由于其较高的致死率, 使得其发病率和死亡率近乎相等[1,2]. 目前HCC治疗首选手术切除或原位肝移植, 但是由于缺乏早期临床症状, 大部分患者就诊时已发生肝外转移或血管侵犯以及供体缺乏等原因, 能够从手术治疗中获益的患者不足15%[3]. 对于不能手术切除的患者, 目前肝动脉化学栓塞(transhepatic arterial chemoembolization, TACE)治疗成为首选[4], 但由于肿瘤较大, 肿瘤的双重血供等原因, 使得部分肿瘤不能达到完全坏死, 造成肿瘤在局部或邻近组织复发的可能性增加[5]. 近年来由于放射性生物学观念的转变以及三维适形等放疗技术不断进步, 使得外放射治疗HCC取得一定进步, 但因治疗剂量(>60 Gy, 而正常肝脏耐受剂量为30 Gy)可能造成严重放射性肝脏损伤以及周围脏器如小肠、肾脏等放射剂量限制等, 在一定程度上限制其应用及疗效[6-8]. 125I粒子植入治疗肿瘤已有近60年历史, 通过组织间插植治疗的方式用于多种肿瘤的治疗, 如前列腺癌、脑胶质瘤、头颈部肿瘤、胰腺癌等[9-13], 特别在前列腺癌和脑胶质瘤的治疗中, 已取得了较好的临床效果[13]. 125I粒子植入治疗肝癌已有近20年历史, 由于其良好的物理及放射生物学特性, 在肝癌的局部治疗中发挥越来越重要的作用. 长期随访表明患者的生存率和生活质量均得到显著改善. 本文总结国内外近10年来125I粒子植入治疗肝癌的相关文献, 就125I粒子的物理学及放射生物学特性、技术方法、适应症、生存率、存在问题等做一综述.
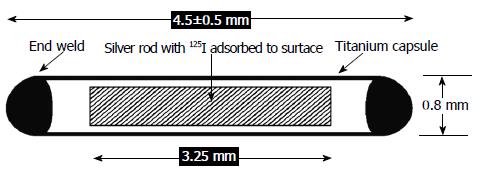
125I粒子呈圆柱形, 外层由钛金属包被, 长4.5 mm, 直径0.8 mm[14](图1), 单个粒子的放射性活度约为0.5-0.8 mci, 半衰期为59.4-60.2 d, 初始剂量率为7 cGy/h, 240 d释放总治疗剂量的94%[15,16], 125I粒子主要通过电子俘获衰变, 共释放3种类型的射线, 分别为27.4 kev X线, 31.4 kev γ线, 35.8 kev b线, 平均射线能量为28.5 kev. 125I粒子为低能放射性核素, 在组织中的半价层为17 mm, 而在铅则为0.025 mm[15], 从而使对医务人员的防护简单易行. 常用于植入治疗肝内肿瘤的放射性粒子192Ir、90Y、103Pd的物理性质比较见[17-19](表1).
| 125I | 192Ir | 90Y | 103Pd | |
| 半衰期(T1/2) | 59.4-60.2 d | 74.5 d | 64.2 h | 17 d |
| 平均能量(kev) | 28 | 360 | 937 | 21 |
| 射线类型 | χ、γ | γ | β | γ |
| 组织半价层(mm) | 17 | 63 | 2.5 | 16 |
| 初始计量率(cGy/h) | 7 | 40 | ? | 18 |
组织间插植治疗是将具有放射性功能的核素所制成的籽源经术中或在CT或B超等的引导下植入肿瘤部位. 通过放射性核素衰变所产生的射线持续不断的照射达到杀伤肿瘤的目的[20]. 组织间插植治疗属于内照射范畴, 125I粒子释放的γ射线在组织间可通过直接和间接两种方式发挥作用, 如γ射线直接作用于有生物活性的大分子, 如核酸和一些酶类等, 通过电离激发引起化学键的断裂, 导致肿瘤细胞代谢和功能障碍, 或通过光电效应、康普顿效应等产生次级电离, 产生大量氧化自由基, 间接造成生物大分子的损伤, 达到杀伤肿瘤细胞的作用[21]. 这种治疗具有高度的适形性, 使得肿瘤靶区具有较高的照射剂量, 而周围正常组织受照剂量较少. 当然组织间插植治疗不等同于常规放疗, 传统的放射治疗的剂量率一般为200 cGy/min, 而组织间插植治疗则要低得多, 一般低于100 cGy/h, 这种低剂量率的持续照射由于损伤修复在受到亚致死剂量照射的周围正常组织明显高于肿瘤治疗区, 减少周围正常组织的放射性损伤, 提高了治疗效果[15]. 使得组织间插植治疗对于不能手术切除的HCC、肝转移癌具有良好的应用前景.
不同的细胞分裂周期对射线的敏感性是不同的, 其中放射敏感最高的时相是在有丝分裂期(M)和DNA合成后期(G2)[22]. 125I粒子植入治疗由于持续低剂量率照射作用于各个细胞周期, 阻断细胞周期活动, 同时由于其持续的低剂量照射增加了再氧合均提高了肿瘤组织的放射敏感性. 克服传统外放疗作用于单个细胞周期、乏氧细胞对射线抗拒等缺点[23]. 在Cron等[24]利用大鼠研究125I粒子持续的低剂量照射对肿瘤微环境的改变(如灌注、氧分压)的研究中, 结果显示: 在粒子植入的3 d后, 距离粒子2-4 mm处血流灌注明显增加, 而PO2(氧分压)增加, 则是在植入后的1-3 d. 因此此时如果同时合并常规放疗, 应该在粒子植入后的1-3 d进行, 因为此时PO2较高, 增加了肿瘤对射线的放射敏感性. 同样如果合并同步化学治疗, 应该在粒子植入后的3-4 d进行, 因为此时血流灌注较高.
所有需要粒子植入的患者均必须有明确的影像学或病理学诊断. 粒子植入具体方法在很多文献中都有详细的报道, 常见单纯粒子植入、手术、放疗或TACE联合粒子植入等[25-27]. 在单纯粒子植入过程中: (1)首先在粒子植入前根据患者的CT或MRI信息确定肿瘤的大小、位置、形状, 边界以及和周围重要组织的关系, 然后将患者的信息输入治疗计划系统(treatment planning system, TPS)模拟布源, 计算出所需匹配周边剂量(matched periperal dose, MPD), 根据单个粒子活度计算所需植入粒子的总数以及每个粒子植入的位置; (2)在粒子植入时通过CT或B超确定体表穿刺点, 局麻后经皮快速穿刺至患者肝脏, 按照CT或超声引导将18 G穿刺针定位于肿瘤部位, 然后按照术前计划后退式植入125I粒子, 每个粒子间距0.5-1.0 cm(单个粒子在1.7 cm内具有杀伤肿瘤细胞的作用), 然后退出穿刺针, 局部压迫止血. 而在我国因为HCC患者多合并肝硬化以及凝血功能障碍, 因此穿刺点应选择在肝组织及大血管较少的部位, 并且当穿刺针到达肝包膜时, 应嘱患者屏气, 减少呼吸运动造成的肝脏损伤出血; 对于严重黄疸的患者应首先改善黄疸后减轻肿瘤水肿再行粒子植入; (3)在植入完成后再次复查CT, 并和之前的定位CT进行比较, 进行质量验证, 以确保粒子植入位置准确, 对可能出现的"冷区"进行及时补种; (4)术后进行常规的止血及预防感染治疗, 并留院观察3-7 d[23].
125I粒子组织间插植主要治疗不能手术切除的HCC、HCC合并门静脉癌栓(portal vein tumor thrombosis, PVTT)、胆管细胞癌、肝转移癌等, 同时也可以联合手术、放疗或TACE等治疗. 所有患者在治疗开始前应检查血常规、肝肾功能、凝血功能等, 对于WBC<3.0×109/L; PLT<70×109/L; 严重地凝血功能障碍、KPS评分<60分; 肝功能child-push分级C级; 预计生存时间<3 mo的患者则不能纳入本治疗. (1)125I粒子植入治疗HCC: 根治性手术切除术或肝移植一直是HCC治疗的首选, 对于严格选择的患者, 患者的5年生存率可达60%-70%[28], 然而大部分患者在确诊时已属中晚期以及合并肝硬化和肝脏储备功能的差异等因素, 能够根治性切除的患者通常不足30%, 并且术后每年约有25%的肿瘤复发, 不能根治性切除的患者平均生存时间不超过1年[29,30], 而125I粒子单纯植入治疗或联合手术或TACE的综合治疗对此类患者提高整体生存率, 预防局部复发中起到了非常重要的作用. 在Lin等[31]1.5 T磁共振引导下125I粒子植入治疗肝癌的报道中, 23例患者中位随访期23.5 mo, 1年、2年生存率分别为95.7%、82.7%, 平均生存时间为18 mo, 近期疗效显著. 在Chen等[32]报道了手术联合125I粒子植入治疗肝癌的研究中, 68例患者分为单纯手术组(34例)和术后联合125I粒子植入治疗组(34例), 中位随访期47.6 mo, 术后肿瘤复发时间联合治疗组显著长于单纯手术组(60 mo vs 36.7 mo), 并且治疗后1、3、5年生存率联合治疗组也显著优于单纯治疗组(94.12%, 73.53%, 55.88% vs 88.24%, 52.94%, 29.41%). 在宋进华等[33] 125I粒子植入联合TACE治疗肝癌的研究中, 观察组(28例, TACE联合125I粒子植入治疗)治疗后4 mo控制率以及1年生存率分别为75%和72%, 较之对照组(32例, 单纯TACE治疗)37.5%和43.3%均有明显提高; (2)HCC合并PVTT: 原发性肝癌较易侵犯门静脉, 约有30%-62.2%HCC患者合并PVTT, 癌栓阻断门静脉血流, 加重肝硬化患者门静脉高压, 并且PVTT是肝内转移以及治疗后复发的主要原因, 是影响患者预后的重要因素之一, 此类患者如未加治疗, 平均生存时间仅为2.4-4 mo[14,34,35]. 传统外科手术、外放疗以及全身化疗等疗效均欠佳, 在Chuan-Xing等[36]TACE联合125I粒子植入治疗HCC合并PVTT的研究中, b组(TACE联合门静脉扩张以及粒子植入)中位生存期显著优于a组(TACE联合门静脉扩张), 8.9 mo vs 5.7 mo, 以及罗剑钧等[37]报道的125I粒子联合支架及TACE治疗PVTT的研究中, 50例患者平均生存370.1 d, 较之Le Treut等[38]报道的对26例原发性肝癌伴门静脉癌栓患者行手术切除, 平均生存时间9 mo, 以及Yamada等[39]报道的对19例原发性肝癌合并门静脉癌栓患者行三维适形放疗联合肝动脉化疗, 总的有效率为57.6%, 1年和2年生存率分别为40.6%和10.2%均有提高; (3)胆管细胞癌: 胆管细胞癌是仅次于HCC的肝内原发性恶性肿瘤, 由于其高度恶性的病理学特性, 使得能够手术治疗患者不足40%, 并且术后50%-80%患者存在复发可能[40,41]. 在曹贵文等[42] 125I粒子植入治疗胆管细胞癌的研究中, 植入术后6 mo、1、3年的生存率分别为90.6%(29/32)、74.3%(26/32)、40%(14/32). Nag等[43]报道中4例胆管细胞癌患者, 2例分别无病生存20及40 mo, 以及吕进等[25]的报道中2例胆管细胞癌患者在随访结束时(40 mo)仍然存活, 表现出125I粒子在胆管细胞癌治疗方面的优势; (4)其他肝内恶性肿瘤: 结直肠癌患者易发肝转移, 15%-25%结直肠癌患者在最初确诊时就已经发生肝脏转移, 而最终约有50%的结直肠癌患者发生肝脏转移, 这类患者手术切除仍是首选, 可使5年生存率达到50%-60%, 然而由于肝内转移瘤常为多发性, 肿瘤临近大血管, 肝外其他疾病等, 使得能够手术切除的患者不足20%, 不能手术的患者5年生存率近乎为0[44,45]. 而125I粒子植入治疗肝内转移癌在大量文献报道中表现出较好的临床价值. 在Nag等[43]报道的125I粒子治疗肝内恶性肿瘤的长期随访中, 60例结直肠癌合并肝转移患者1、3、5年的生存率分别为73%、23%、5%, 中位生存时间20 mo, 在这次长期随访研究中, Nag等[43]发现粒子植入后患者的生存率与肝内转移癌的数目、之前肝脏是否进行手术切除以及粒子植入靶区的大小具有明显的相关性. 植入前肝脏未行手术切除, 肝内转移瘤单发, 粒子植入靶区<20 cm3是提示预后良好的重要标志.
(1)目前大量文献报道了肝内肿瘤粒子植入术后的并发症, 特别是穿刺引起的大出血在一定程度上限制了粒子植入的治疗, 但在CT或B超穿刺前的精确定位下, 这种情况鲜有发生. 其他如放射性肺炎、放射性肠炎、粒子迁移、放射性肝炎、胆汁瘘、胰瘘、肝衰竭等[46-48]发生率均远低于TACE以及外放疗相关并发症发生率; (2)目前125I粒子治疗肝癌方面尚无统一的剂量标准, 相关数据及方法多来自粒子植入治疗前列腺癌的研究以及来自医生的临床经验. 最佳处方剂量以及最佳粒子活度的确定仍需我们进一步的研究; (3)125I虽属于低能放射性核素, 但在治疗过程中仍有可能存在放射性污染问题, 以及对患者及其周围人群的剂量监测和防护一直被忽视, 这些仍需引起我们足够的重视; (4)125I初始剂量率相对较低(7.7 cGy/h), 适合分化程度较好、恶性程度低的肝癌, 而对于生长迅速、分化较差的肝癌则不太适合. 目前肝癌粒子植入治疗多为单一粒子植入, 复合粒子植入治疗仍相对较少. 新型复合粒子的出现或将有助于解决不同分期, 不同分化程度肝癌治疗问题.
125I粒子组织间插植治疗是HCC重要的辅助治疗手段, 其优良的物理及放射生物学特性, 以及组织间插植具有损伤小、高度适形, 局部控制率高等优点使得其在HCC的局部治疗中发挥越来越重要的作用, 提高了患者的生存率和生活质量. 然而组织间插植治疗仅为局部治疗, 而肿瘤为全身性疾病, 如何在综合治疗中发挥作用, 提高患者的远期预后, 仍需要我们进一步的实验和研究.
放射性粒子组织间植入近距离治疗恶性肿瘤, 是指将放射性粒子直接永久植入肿瘤组织内或是插植于手术切除的肿瘤床、残存癌及淋巴转移的途径, 利用其释放低能量光子产生的γ射线持续照射肿瘤细胞并将其杀死的一种新的技术方法. 可以减轻手术创伤、缩短手术时间、减少术后并发症; 粒子植入与手术和化疗配合, 有望提高肿瘤治疗的彻底性, 解决在恶性肿瘤治疗中起关键作用的肿瘤局部复发与再生长问题; 能够有效延长患者生存期和提高患者的生存质量.
肖文华, 主任医师, 中国人民解放军总医院第一附属医院肿瘤科
如何提高肝癌患者远期生存率是当前临床医生面临的比较棘手的问题, 也是今后我们研究的热点. 粒子植入联合手术以及放化疗的综合治疗将在一定程度上使部分肝癌患者受益.
在曹秀峰等125I粒子组织间植入治疗恶性肿瘤的现状和未来的研究中, 详细阐述了125I粒子治疗恶性肿瘤中的应用, 以及目前存在的一些不足.
本文侧重点在于介绍125I粒子在治疗肝内恶性肿瘤中的应用, 从粒子的生理特性, 放射生物学特征以及技术方法到临床疗效等方面叙述以及目前存在相关不足. 使读者能够详细全面了解.
手术切除原发性肝癌以及肝脏转移癌仍然是治疗肝内恶性肿瘤最佳方法. 临床实践证明125I粒子联合手术或化疗治疗中晚期肝内恶性肿瘤能够延长患者的生存时间. 随着这一技术的不断完善, 对治疗恶性肿瘤具有良好的应用前景.
粒子植入治疗在我国只作为第3类医疗技术, 值得去探索. 但我国现在广泛开展此类技术, 而大多数大夫又不知道如何去选择适当患者去开展研究. 因此, 本文具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma. Lancet. 2012;379:1245-1255. [PubMed] [DOI] |
| 2. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 3. | Abou-Alfa GK, Schwartz L, Ricci S, Amadori D, Santoro A, Figer A, De Greve J, Douillard JY, Lathia C, Schwartz B. Phase II study of sorafenib in patients with advanced hepatocellular carcinoma. J Clin Oncol. 2006;24:4293-4300. [PubMed] [DOI] |
| 4. | Liao M, Huang J, Zhang T, Wu H. Transarterial chemoembolization in combination with local therapies for hepatocellular carcinoma: a meta-analysis. PLoS One. 2013;8:e68453. [PubMed] [DOI] |
| 5. | Muhammad A, Dhamija M, Vidyarthi G, Amodeo D, Boyd W, Miladinovic B, Kumar A. Comparative effectiveness of traditional chemoembolization with or without sorafenib for hepatocellular carcinoma. World J Hepatol. 2013;5:364-371. [PubMed] [DOI] |
| 6. | Ibrahim SM, Lewandowski RJ, Sato KT, Gates VL, Kulik L, Mulcahy MF, Ryu RK, Omary RA, Salem R. Radioembolization for the treatment of unresectable hepatocellular carcinoma: a clinical review. World J Gastroenterol. 2008;14:1664-1669. [PubMed] |
| 9. | Heysek RV. Modern brachytherapy for treatment of prostate cancer. Cancer Control. 2007;14:238-243. [PubMed] |
| 10. | Ruge MI, Simon T, Suchorska B, Lehrke R, Hamisch C, Koerber F, Maarouf M, Treuer H, Berthold F, Sturm V. Stereotactic brachytherapy with iodine-125 seeds for the treatment of inoperable low-grade gliomas in children: long-term outcome. J Clin Oncol. 2011;29:4151-4159. [PubMed] [DOI] |
| 11. | Jiang YL, Meng N, Wang JJ, Ran WQ, Yuan HS, Qu A, Yang RJ. Percutaneous computed tomography/ultrasonography-guided permanent iodine-125 implantation as salvage therapy for recurrent squamous cell cancers of head and neck. Cancer Biol Ther. 2010;9:959-966. [PubMed] [DOI] |
| 12. | Wang KX, Jin ZD, Du YQ, Zhan XB, Zou DW, Liu Y, Wang D, Chen J, Xu C, Li ZS. EUS-guided celiac ganglion irradiation with iodine-125 seeds for pain control in pancreatic carcinoma: a prospective pilot study. Gastrointest Endosc. 2012;76:945-952. [PubMed] [DOI] |
| 14. | Luo J, Yan Z, Liu Q, Qu X, Wang J. Endovascular placement of iodine-125 seed strand and stent combined with chemoembolization for treatment of hepatocellular carcinoma with tumor thrombus in main portal vein. J Vasc Interv Radiol. 2011;22:479-489. [PubMed] [DOI] |
| 15. | Schwarz SB, Thon N, Nikolajek K, Niyazi M, Tonn JC, Belka C, Kreth FW. Iodine-125 brachytherapy for brain tumours--a review. Radiat Oncol. 2012;7:30. [PubMed] [DOI] |
| 17. | Morgan B, Kennedy AS, Lewington V, Jones B, Sharma RA. Intra-arterial brachytherapy of hepatic malignancies: watch the flow. Nat Rev Clin Oncol. 2011;8:115-120. [PubMed] [DOI] |
| 18. | Raben A, Mychalczak B, Brennan MF, Minsky B, Anderson L, Casper ES, Harrison LB. Feasibility study of the treatment of primary unresectable carcinoma of the pancreas with 103Pd brachytherapy. Int J Radiat Oncol Biol Phys. 1996;35:351-356. [PubMed] |
| 19. | Kulik LM, Carr BI, Mulcahy MF, Lewandowski RJ, Atassi B, Ryu RK, Sato KT, Benson A, Nemcek AA, Gates VL. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology. 2008;47:71-81. [PubMed] [DOI] |
| 20. | 王 俊杰, 修 典荣, 冉 维强, 白 静, 朱 丽红, 刘 江平. 术中超声引导放射性125I粒子植入治疗胰腺癌. 中华放射医学与防护杂志. 2005;25:431-443. |
| 22. | Wang Y, Ji P, Liu J, Broaddus RR, Xue F, Zhang W. Centrosome-associated regulators of the G(2)/M checkpoint as targets for cancer therapy. Mol Cancer. 2009;8:8. [PubMed] [DOI] |
| 23. | Zhang FJ, Li CX, Jiao DC, Zhang NH, Wu PH, Duan GF, Wu YX. CT guided 125iodine seed implantation for portal vein tumor thrombus in primary hepatocellular carcinoma. Chin Med J (Engl). 2008;121:2410-2414. [PubMed] |
| 24. | Cron GO, Beghein N, Crokart N, Chavée E, Bernard S, Vynckier S, Scalliet P, Gallez B. Changes in the tumor microenvironment during low-dose-rate permanent seed implantation iodine-125 brachytherapy. Int J Radiat Oncol Biol Phys. 2005;63:1245-1251. [PubMed] [DOI] |
| 28. | Llovet JM, Bruix J. Novel advancements in the management of hepatocellular carcinoma in 2008. J Hepatol. 2008;48 Suppl 1:S20-S37. [PubMed] [DOI] |
| 29. | Ye SL, Takayama T, Geschwind J, Marrero JA, Bronowicki JP. Current approaches to the treatment of early hepatocellular carcinoma. Oncologist. 2010;15 Suppl 4:34-41. [PubMed] [DOI] |
| 30. | Mohnike K, Wieners G, Pech M, Seidensticker M, Rühl R, Lopez-Haenninen E, Ricke J. Image-guided interstitial high-dose-rate brachytherapy in hepatocellular carcinoma. Dig Dis. 2009;27:170-174. [PubMed] [DOI] |
| 31. | Lin ZY, Lin J, Lin C, Li YG, Chen SM, Hu JP, Hu R, Chen J. 1.5T conventional MR-guided iodine-125 interstitial implants for hepatocellular carcinoma: feasibility and preliminary clinical experience. Eur J Radiol. 2012;81:1420-1425. [PubMed] [DOI] |
| 32. | Chen K, Xia Y, Wang H, Xiao F, Xiang G, Shen F. Adjuvant iodine-125 brachytherapy for hepatocellular carcinoma after complete hepatectomy: a randomized controlled trial. PLoS One. 2013;8:e57397. [PubMed] [DOI] |
| 33. | 宋 进华, 顾 建平, 楼 文胜, 何 旭, 陈 亮, 陈 国平, 苏 浩波, 汪 涛, 曹 秀峰. 125I粒子植入联合肝动脉栓塞化疗治疗肝癌. 中华放射学杂志. 2008;8:802-806. |
| 34. | Kousidou OC, Mitropoulou TN, Roussidis AE, Kletsas D, Theocharis AD, Karamanos NK. Genistein suppresses the invasive potential of human breast cancer cells through transcriptional regulation of metalloproteinases and their tissue inhibitors. Int J Oncol. 2005;26:1101-1109. [PubMed] |
| 35. | Zhang L, Mu W, Hu CF, Huang XQ. Treatment of portal vein tumor thrombus using ¹²5Iodine seed implantation brachytherapy. World J Gastroenterol. 2010;16:4876-4879. [PubMed] [DOI] |
| 36. | Chuan-Xing L, Xu H, Bao-Shan H, Yong L, Pei-Jian S, Xian-Yi Y, Xiao-Ning L, Li-Gong L. Efficacy of therapy for hepatocellular carcinoma with portal vein tumor thrombus: chemoembolization and stent combined with iodine-125 seed. Cancer Biol Ther. 2011;12:865-871. [PubMed] [DOI] |
| 37. | 罗 剑钧, 颜 志平, 王 建华, 刘 清欣, 瞿 旭东, 张 雯. 腔内植入125I粒子条及支架联合经动脉化疗栓塞治疗原发性肝癌合并门脉主干癌栓的疗效. 中华肿瘤杂志. 2011;7:535-539. |
| 38. | Le Treut YP, Hardwigsen J, Ananian P, Saïsse J, Grégoire E, Richa H, Campan P. Resection of hepatocellular carcinoma with tumor thrombus in the major vasculature. A European case-control series. J Gastrointest Surg. 2006;10:855-862. [PubMed] [DOI] |
| 39. | Yamada K, Izaki K, Sugimoto K, Mayahara H, Morita Y, Yoden E, Matsumoto S, Soejima T, Sugimura K. Prospective trial of combined transcatheter arterial chemoembolization and three-dimensional conformal radiotherapy for portal vein tumor thrombus in patients with unresectable hepatocellular carcinoma. Int J Radiat Oncol Biol Phys. 2003;57:113-119. [PubMed] [DOI] |
| 40. | Fu Y, Yang W, Wu W, Yan K, Xing BC, Chen MH. Radiofrequency ablation for postoperative recurrences of intrahepatic cholangiocarcinoma. Chin J Cancer Res. 2011;23:295-300. [PubMed] [DOI] |
| 41. | Poultsides GA, Zhu AX, Choti MA, Pawlik TM. Intrahepatic cholangiocarcinoma. Surg Clin North Am. 2010;90:817-837. [PubMed] [DOI] |
| 43. | Nag S, DeHaan M, Scruggs G, Mayr N, Martin EW. Long-term follow-up of patients of intrahepatic malignancies treated with iodine-125 brachytherapy. Int J Radiat Oncol Biol Phys. 2006;64:736-744. [PubMed] [DOI] |
| 44. | Tzeng CW, Aloia TA. Colorectal liver metastases. J Gastrointest Surg. 2013;17:195-201; quiz 201-202. [PubMed] [DOI] |
| 46. | Gasent Blesa JM, Dawson LA. Options for radiotherapy in the treatment of liver metastases. Clin Transl Oncol. 2008;10:638-645. [PubMed] |
| 47. | Zhu AX, Wallner KE, Frivold GP, Ferry D, Jutzy KR, Foster GP. Prostate brachytherapy seed migration to the right coronary artery associated with an acute myocardial infarction. Brachytherapy. 2006;5:262-265. [PubMed] [DOI] |
| 48. | Sugawara A, Nakashima J, Shigematsu N, Kunieda E, Kubo A. Prediction of seed migration after transperineal interstitial prostate brachytherapy with I-125 free seeds. Brachytherapy. 2009;8:52-56. [PubMed] [DOI] |