修回日期: 2013-08-30
接受日期: 2013-09-06
在线出版日期: 2013-10-18
目的: 测定肿瘤发生抑制基因13号(suppression of tumorigenicity13, ST13)蛋白和热休克蛋白70 (heat shock protein70, HSP70)在胃息肉癌变过程中的表达水平, 揭示ST13和HSP70在胃息肉及胃癌形成过程中的的相互关系及临床意义.
方法: 采用免疫组织化学SABC法检测ST13和HSP70在106例胃黏膜组织中的表达水平, 按组织病理类型分为: 正常胃黏膜组30例、增生性息肉组30例、腺瘤样息肉组16例、胃癌组30例, 研究二者在胃息肉癌变过程中表达的相互作用及临床意义.
结果: 采用Krusral-wallis H方法检验HSP70在正常胃黏膜组、增生性息肉组、腺瘤样息肉组、胃癌组中的表达秩均值分别为32.35、40.47、63.25、82.48, 有非常显著的差异性(P<0.01), 表达呈逐渐递增趋势. ST13在正常胃黏膜、增生性息肉、腺瘤样息肉、胃癌组织中的表达秩均值分别为68.25、59.77、44.91、37.07, 有非常显著差异性(P<0.01), 表达呈逐渐递减趋势. HSP70和ST13在腺瘤样息肉组和胃癌组中表达呈非常显著负相关(P<0.01).
结论: (1)HSP70蛋白在正常胃黏膜、胃增生性息肉、胃腺瘤样息肉、胃癌组织中的表达水平呈显著增高趋势; (2)ST13蛋白在正常胃黏膜、胃增生性息肉、胃腺瘤样息肉、胃癌组织中的表达水平呈显著降低趋势; (3)在胃腺瘤样息肉及胃癌组织中HSP70蛋白与ST13蛋白可能相互作用, 其相互关系为负相关, HSP70蛋白可能对其分子共伴侣ST13蛋白产生直接或间接下调作用.
核心提示: HSP70蛋白的高表达和ST13蛋白的低表达在胃息肉癌变的过程中具有密切的负相关性, 二者的表达在胃癌的发生、发展过程中发挥着重要作用. 早期检测HSP70蛋白及ST13蛋白在胃癌癌前病变中的表达程度, 将有助于提高胃癌早期发现的几率, 同时, 为胃癌的肿瘤免疫治疗及分子靶向治疗提供研究线索.
引文著录: 陈吉, 牛昊书. ST13和HSP70在胃息肉及胃癌中的表达及相关性. 世界华人消化杂志 2013; 21(29): 3059-3066
Revised: August 30, 2013
Accepted: September 6, 2013
Published online: October 18, 2013
AIM: To detect the expression of suppression of tumorigenicity13 (ST13) and heat shock protein70 (HSP70) in gastric polyps and gastric cancer and to analyze their correlation.
METHODS: Immunohistochemistry was used to detect the expression of ST13 and HSP70 in 30 cases of normal gastric mucosa, 30 cases of gastric polyps, 16 cases of gastric adenomatous polyps, and 30 cases of gastric carcinoma. The correlation between expression of ST13 and HSP70 in gastric polyps and gastric carcinoma was analyzed.
RESULTS: The rank mean for HSP70 expression in normal gastric mucosa, hyperplastic polyps, adenomatous polyps, gastric carcinoma was 32.35, 40.47, 63.25, and 82.48, respectively, showing a gradually decreasing trend (P < 0.01). The rank mean for expression of STl3 in normal gastric mucosa, hyperplastic polyps, adenomatous polyps, and gastric carcinoma group was 68.25, 59.77, 44.91 and 37.07, respectively, showing a gradually increasing trend. HSP70 and ST13 expression was negatively correlated in both adenomatous polyps and gastric cancer.
CONCLUSION: HSP70 protein expression shows an increasing trend and ST13 protein expression shows a decreasing trend in gastric carcinogenesis, suggesting that HSP70 and ST13 are closely related to the formation of gastric cancer. There is a negative correlation between HSP70 protein and ST13 protein expression in gastric adenomatous polyps and gastric carcinoma, suggesting that they may interact with each other.
- Citation: Chen J, Niu HS. Expression of ST13 and HSP70 in gastric polyps and gastric cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(29): 3059-3066
- URL: https://www.wjgnet.com/1009-3079/full/v21/i29/3059.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i29.3059
胃癌为消化系常见肿瘤之一, 全球每年有900万新发胃癌病例, 每年700万人因胃癌而死亡. 其致死率为全球所有肿瘤致死率第2位[1], 居我国消化系统恶性肿瘤发病率和死亡率第1位, 病死率在我国排首位[2], 胃息肉是胃癌的癌前疾病之一, 分为增生性息肉和腺瘤型息肉, 部分有恶变倾向[3], 细胞增殖与凋亡平衡的失调是肿瘤形成、进展的重要原因, 也是目前肿瘤研究最广泛、最深入的领域, 其影响因素众多, 而热休克蛋白70(heat-shock protein70, HSP70)在维持其平衡稳定的过程中占有重要地位, HSP70又称应激蛋白, 具有提高细胞应激耐受性及细胞自身稳定功能, 与细胞的增生、分化、凋亡、瘤变及免疫等过程有关, 其在多种肿瘤细胞中表达增强. 被认为是肿瘤形成发展的先决条件之一. 目前研究已经证实, 胃癌组织中HSP70蛋白呈过度表达, 使用反义RNA特异性抑制胃癌细胞中的HSP70蛋白表达, 可以使胃癌进展缓慢甚至好转, 提示HSP70是胃癌形成、发展的重要影响因素之一, 但其在胃癌癌变过程中的具体机制尚不完全清楚. 肿瘤发生抑制基因13号(suppression of tumorigenicity 13, ST13)基因是一种大肠癌负相关基因, 目前研究表明其主要作为HSP70的分子伴侣在不同的正常组织及肿瘤组织中发挥不同的生物学功能, 现有研究证实其可能与肿瘤细胞转移和细胞生长有关. ST13可能通过HSP70发挥其部分生物学作用, 了解ST13与HSP70在胃癌中的关系及作用机制, 将对HSP70在胃癌中作用的研究提供帮助. 本研究旨在通过测定HSP70蛋白和ST13蛋白在胃息肉及胃癌中的表达水平, 研究ST13蛋白和HSP70蛋白在胃息肉及胃癌形成过程中的相互关系及临床意义. 探索胃息肉癌变过程中的影响因素, 从而为胃癌的早期临床诊断及治疗研究提供帮助.
胃增生性息肉、腺瘤型息肉及正常胃黏膜组: 选取2010-09/2012-07在内蒙古包钢医院消化内科内窥镜中心行胃镜活检的石蜡标本共76例, 分为正常胃黏膜组30例, 其中男性10例, 女性20例, 年龄30-46岁(均以腹胀、中上腹不适为主要症状就诊, 均行14C呼气试验排除幽门螺杆菌感染, 就诊4 wk内均未服用质子泵抑制剂、NSAID类药物、无饮酒史); 增生性息肉组30例, 其中男性9例, 女性21例, 年龄37-56岁; 腺瘤样息肉组16例, 其中男性3例, 女性13例, 年龄41-52岁; 以上各组均由2位胃镜专家及2位病理学专家按内镜形态学及病理组织学证实.
胃癌组: 选取2010-09/2012-07在内蒙古包钢医院普外科手术切除及消化内科内窥镜中心行胃镜活检的胃腺癌石蜡标本共30例, 其中男性14例, 女性16例, 年龄35-66岁, 按临床TNM分期均为II期, 均由2位消化内科专家及2位病理学专家按内镜形态学及病理组织学证实. 兔抗人HSP70多克隆抗体(美国bioss公司); SABC(Strept Avidin-Biotin Complex)免疫组织化学试剂盒(福州迈新生物技术公司); DAB显色试剂盒(福州迈新生物技术公司).
1.2.1 常规HE染色确定标本的组织病理类型: 所有标本用组织石蜡包埋机制成蜡块, 将蜡块以5 µm厚度连续切取3张切片, 其中1张切片经病理专家采用HE染色经病理诊断再次证实, 余2张切片采用SABC免疫组织化学染色.
1.2.2 SABC免疫组织化学染色: 标本石蜡切片, 二甲苯脱蜡, 梯度乙醇水化, 高温高压抗原热修复, 常温下冷却45 min, PBS冲洗, 滴加过氧化酶阻断溶液, 室温下孵育10 min, PBS冲洗, 滴加正常非免疫动物血清(试剂B), 室温下孵育12 min. 除去血清, 滴加第一抗体(ST13、HSP70)4 ℃过夜, PBS冲洗, 滴加生物素标记的第二抗体, 室温下孵育10 min. PBS冲洗, 滴加链霉素抗生物素-过氧化物酶溶液, 室温下孵育10 min. PBS冲洗3次滴加DAB显微镜下观察观察5 min, 苏木素复染、反蓝、梯度酒精脱水、二甲苯透明, 中性树胶封固.
1.2.3 判定标准: HSP70及ST13免疫组织化学阳性产物呈棕黄色颗粒, 定位于细胞浆内. 采用Bresalier半定量公式判断染色结果. 在每张切片中随机选取10个高倍视野, 每个高倍视野根据细胞染色情况分为细胞无着色为0分、淡黄色为1分、棕黄色为2分、棕褐色为3分; 计数每一着色视野数, 根据下列计算公式确定每张切片的平均染色强度: 强度分值(intensity store, IS) = ∑{(0×F0)+(1×Fl)+(2×F2)+(3×F3)}, F为每类型视野的百分比. 例如: 一张切片随机选取10个视野, 无着色2个视野, 占20%, 淡黄色3个视野, 占30%, 棕黄色占3个视野, 占30%, 棕褐色占2个视野, 占20%. 此切片染色强度IS = (0×20%)+(1×30%)+(2×30%)+(3×20%) = 1.5. 每张切片按染色强度分为4级, 0分: 阴性(-); 0-1分: 弱阳性(+); 1-2分: 中强阳性(++); 2-3分: 强阳性(+++).
统计学处理 数据分析采用SPSS19.0软件系统, 对实验数据进行Krusral-wallis H非参数检验, P<0.05为差异有统计学意义. 对正常胃黏膜、增生性息肉、腺瘤样息肉、胃癌组间进行bonferroni法多重比较(组间采用Mann-Whitney U检验), 以校验P<0.008(P<0.05)为差异有统计学意义. ST13和HSP70表达的相关性采用Kendall's taur-b等级相关分析法. 以P<0.05为差异有统计学意义.
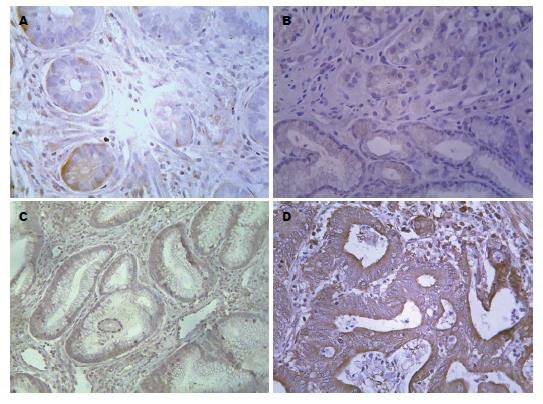
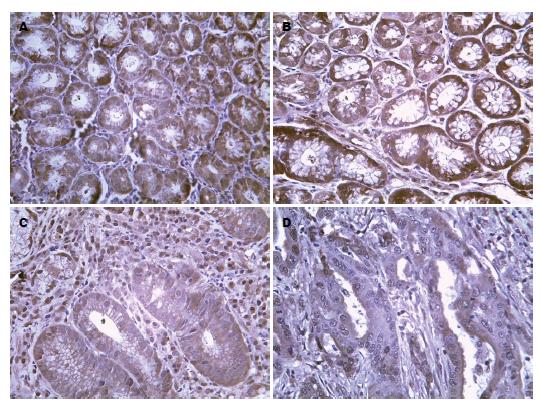
HSP70表达定位于正常胃黏膜、增生性息肉、腺瘤样息肉、胃癌组织的细胞胞浆中, 免疫阳性产物为棕黄色. HSP70于各组中的表达情况如表1-3所示, 染色采用Krusral-wallis H方法检验HSP70在正常胃黏膜、增生性息肉、腺瘤样息肉、胃癌组织中的表达秩均值分别为32.35、40.47、63.25、82.48, 有非常显著的差异性(P<0.01, 表4, 图1), 表达呈逐渐递增趋势. 对正常胃黏膜、增生性息肉、腺瘤样息肉、胃癌组间进行Bonferroni法多重比较, 校验后当P = 0.008时P = 0.05, 以校验P<0.008, P<0.05为差异有统计学意义. 增生性息肉组与正常胃黏膜组表达无显著差异性(U = 361.5, P>0.05), 腺瘤样息肉组与正常胃黏膜组表达有显著差异性(U = 96, P<0.01), 胃癌组与正常胃黏膜组表达有显著差异性(U = 48, P<0.01), 腺瘤样息肉组与增生性息肉组表达有显著差异性(U = 128, P<0.05), 胃癌组与腺瘤样息肉组表达无显著差异性(U = 140, P>0.05), 胃癌组与增生性息肉组表达有显著差异性(U = 82, P<0.01).
| HSP70 | 合计 | r值 | P值 | |||||
| - | + | ++ | +++ | |||||
| ST13 | - | 0 | 0 | 1 | 1 | 2 | ||
| + | 6 | 2 | 2 | 0 | 10 | |||
| ++ | 2 | 5 | 1 | 0 | 8 | |||
| +++ | 4 | 5 | 1 | 0 | 10 | |||
| 合计 | 12 | 12 | 5 | 1 | 30 | -0.105 | 0.577 | |
| HSP70 | 合计 | r值 | P值 | |||||
| - | + | ++ | +++ | |||||
| ST13 | - | 0 | 0 | 1 | 1 | 2 | ||
| + | 0 | 1 | 3 | 3 | 7 | |||
| ++ | 2 | 2 | 1 | 1 | 6 | |||
| +++ | 1 | 0 | 0 | 0 | 1 | |||
| 合计 | 3 | 3 | 5 | 5 | 16 | -0.532 | 0.002 | |
| HSP70 | 合计 | r值 | P值 | |||||
| - | + | ++ | +++ | |||||
| ST13 | - | 0 | 0 | 1 | 7 | 8 | ||
| + | 1 | 0 | 2 | 9 | 12 | |||
| ++ | 0 | 2 | 3 | 4 | 9 | |||
| +++ | 0 | 0 | 1 | 0 | 1 | |||
| 合计 | 1 | 2 | 7 | 20 | 30 | -0.364 | 0.009 | |
ST13表达定位于正常胃黏膜、增生性息肉、腺瘤样息肉、胃癌组织的细胞胞浆中, 免疫阳性产物为棕黄色. ST13于各组中的表达情况如表1-3所示, 采用Krusral-wallis H方法检验ST13在正常胃黏膜、增生性息肉、腺瘤样息肉、胃癌组织中的表达秩均值分别为68.25、59.77、44.91、37.07, 有非常显著差异性(P<0.01, 表5, 图2), 表达呈逐渐递减趋势. 对正常胃黏膜、增生性息肉、腺瘤样息肉、胃癌组间进行bonferroni法多重比较, 校验后当P = 0.008时P = 0.05, 以校验P<0.008, P<0.05为差异有统计学意义. 增生性息肉组与正常胃黏膜组表达无显著差异性(U = 381, P>0.05), 腺瘤样息肉组与正常胃黏膜组表达有显著差异性(U = 128, P<0.05), 胃癌组与正常胃黏膜组表达有显著差异性(U = 188.5, P<0.01), 腺瘤样息肉组与增生性息肉组表达无显著差异性(U = 172, P>0.05), 胃癌组与腺瘤样息肉组表达无显著差异性(U = 197.5, P>0.05), 胃癌组与增生性息肉组表达有显著差异性(U = 261, P<0.05).
热休克蛋白HSP70是热休克蛋白家族中的极重要成员, 其作为分子伴侣在蛋白质折叠、组装、运输、降解及控制的调节蛋白的活性的过程中发挥重要作用[4], 与肿瘤的发生、发展、肿瘤免疫以及机体对肿瘤治疗药物耐药性的发生、发展和肿瘤预后都有关[5]. HSP70蛋白的主要生物学功能是在应激状态下保护细胞生命活动所必需的蛋白质以维持细胞的生存, 并参与细胞的增殖调控[6], 参与肿瘤增殖、分化和抗肿瘤免疫[7].
HSP70通过"分子伴侣"功能在肿瘤细胞的形成与发展中起着凋亡抑制作用: (1)他作为分子伴侣优先表达于人类肿瘤细胞和培养的肿瘤细胞系中, 大量研究表明, HSP70可通过与其客户端的蛋白质相互作用, 在细胞信号转导、细胞周期调控、细胞分化和程序性细胞死亡的过程中发挥重要功能, 以保护肿瘤细胞避免大范围的细胞凋亡和坏死[8]; (2)作为分子伴侣, HSP70通过与原癌基因和抑癌基因及其蛋白产物的相互作用调节肿瘤细胞的增殖, 其过度表达HSP70的恶性肿瘤呈持续增殖状态, 而选择性去除HSP70蛋白的恶性肿瘤组织的增殖则明显变得缓慢[7,9,10]; (3)有研究表明, HSP70的过度表达会干扰磷脂酶A2的信号转运系统, 降低其在细胞毒性中的作用, 减少肿瘤坏死因子(tumor necrosis factor, TNF)介导的对特定肿瘤细胞的细胞杀伤, 从而协助肿瘤细胞免受免疫杀伤作用; (4)HSP70作为"分子伴侣", 具有在抗原呈递中将抗原分解成特异性肽段从而直接控制细胞呈递抗原的能力, 并提供结合蛋白, 协同参与抗原加工、转运、免疫球蛋白装配及T细胞免疫[11], HSP70在人体多种不同肿瘤组织和细胞中的表达均明显增高, 其过度表达程度是在抗肿瘤治疗效果不佳的癌症(如乳腺癌, 子宫内膜癌, 宫颈癌, 和膀胱癌)中尤其明显[12,13], HSP70在机体的自身免疫、抗感染免疫, 特别是肿瘤免疫中起重要作用; (5)研究还发现HSP70反义RNA可以特异性抑制HSP70的表达. 选择性的下调HSP70可以导致肿瘤细胞表现为增生抑制, 甚至是诱导凋亡[14]. 提示HSP70可能作为一种重要的基因控制着肿瘤细胞的增生及凋亡. 多项研究表明, 胃癌组织中的HSP70蛋白呈过度表达[15-18], 提示HSP70蛋白过度表达与胃癌的形成发展有密切关系. 本研究发现HSP70蛋白在正常胃黏膜、增生性息肉、腺瘤样息肉、胃癌组织中的表达呈显著逐渐递增趋势(P<0.01), 其中正常胃黏膜与增生性息肉组的表达无显著差异性(P>0.05), 腺瘤样息肉、胃癌组与正常胃黏膜、增生性息肉组有显著差异, 腺瘤样息肉是增殖较活跃的异形细胞, 其细胞内蛋白质的合成明显增强, 需要大量的HSP70作为分子伴侣参与合成蛋白质生物活性功能, 早期检测HSP70蛋白的表达水平将对胃癌的早期诊断及发现具有极其重要的参考价值. 本实验发现HSP70在腺瘤样息肉中的表达明显增加, 虽多重比较腺瘤样息肉组织与胃癌组织的中的表达无显著性差异(较验前P>0.008, 校验后P>0.05), 但单独比较HSP70在二者中的表达水平仍有较显著的差异(较验前P<0.05), 提示HSP70蛋白的增多与胃癌的形成和发展有重要的关系, 与目前国内外相关研究结果相符.
ST13分子有数个不同的功能区[19]: N-端功能区可使其分子同源聚合(homo-oligomerization); TPR(tetratricopeptide repeats)功能区可使其与HSP70的ATPase区结合; GGMP重复序列被认为与HSP70的多肽结合区相互作用有关; C端的p60/Stil区被认为可调节GGMP功能区与HSP70多肽结合区的相互作用[20]. ST13蛋白具有与多种细胞凋亡子相互作用的分子特性, 有可能与其他细胞凋亡子如凋亡蛋白酶激活因子(apoptotic protease activating factor-1, APAF-1)、凋亡诱导因子(apoptotisis inducing factor, AIF)、B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)基因等相互作用, 其中APAF-1、AIF与HSP70的ATP结合区序列有局部同源性, 由于ST13可与HSP70分子上的ATP结合区直接作用[20], ST13有可能与APAF-1和AIF的ATP结合区直接作用从而抑制凋亡小体的形成或抑制AIF所参与的凋亡通路[21]. Bcl-2家族为细胞凋亡的重要调控因子, 该家族成员 B淋巴细胞瘤-2基因相关抗凋亡蛋白(Bcl-2 associated athanogene l, BAG-1)可与Bcl-2相互作用抑制细胞凋亡, 也可以其保守的C端结构域与HSP70结合, 稳定HSP70的ATP构象, 使HSP70与其作用底物蛋白解离, 起负调控HSP70的作用[20-23]. ST13可与BAG-1竞争性结合HSP70的ATPase结合位点, 抑制ADP的解离, 防止底物蛋白的过早释放或解离, 从而稳定HSP70的分子伴侣活性而发挥正调控分子伴侣作用[24]. 国内李岗等[25]发现, ST13蛋白在人体不同组织的恶性肿瘤中有不同程度的表达, 据此推测, ST13蛋白在不同组织来源的恶性肿瘤的发生发展中扮演不同的作用. 国内郑树等研究显示, ST13在大肠癌及胃癌组织中呈低表达趋势, 本研究结果发现ST13蛋白在正常胃黏膜、增生性息肉、腺瘤样息肉、胃癌组织中的表达呈显著逐渐递减趋势(P<0.01), 与目前研究结果相符, 表明ST13蛋白可能通过与HSP70相互作用参与了胃细胞内的重要事件, ST13通常被描述为抑癌基因, 但为什么在胃癌、大肠癌中出现表达下调, 而在其他肿瘤中表达上调, 考虑可能与基因突变或功能改变有关, 但目前尚无相关研究证据证明.其具体分子生物学功能尚待进一步研究.
本研究结果表明HSP70和ST13在腺瘤样息肉组和胃癌组中表达呈非常显著的负相关性(P<0.01), 而在胃增生性息肉组中的相关性无显著差异性(P>0.05), 因胃增生性息肉主要为炎性刺激所致, 而腺瘤样息肉及胃癌主要为基因变异所致, 提示HSP70与ST13在潜在恶性及恶性肿瘤形成的过程中存在相互影响的关系. 部分研究结果表明, HSP70的过度表达是人体各组织恶性肿瘤形成的前提条件[26], HSP70是胃癌形成过程中的重要影响因子之一, 而长期被作为HSP70的分子伴侣所研究的ST13, 目前研究仅发现ST13正调控HSP70的分子伴侣作用[27-29], 与本研究结果相反, 但为什么会出现起正调控功能的作为HSP70分子伴侣的ST13下调, 而HSP70本身被过度表达的机制尚不清楚. 最近相关免疫组织化学研究表明, ST13下调可能仅存于胃癌、大肠癌等特殊类型癌症中, 而在其他类型的癌症如乳腺癌、肺癌、肝癌、子宫内膜癌中进行同样的研究, 未能遵循这个模式. 因目前对ST13基因功能的研究尚较少, 其基因功能尚未完全阐明[30], 结合ST13具有多个功能区, 可与多种细胞因子相互作用的潜在分子特性[31], 故据此推测, 在胃癌变的发生发展过程中, ST13可能存在其他的调节机制或参与抑制其他的细胞凋亡途径, 而非单纯通过HSP70起调控作用, 其具体分子生物学机制尚须进一步研究.
总之, HSP70蛋白的高表达和ST13蛋白的低表达在胃息肉癌变的过程中具有密切的负相关性, 二者的表达在胃癌的发生、发展过程中发挥着重要作用. 早期检测HSP70蛋白及ST13蛋白在胃癌癌前病变中的表达程度, 将有助于提高胃癌早期发现的几率, 同时, 肿瘤免疫治疗及分子靶向治疗是目前胃癌研究领域的重点方向, 随着研究的深入开展, 其对预防胃癌的复发、转移、降低对抗肿瘤药物的耐药性的优势亦逐渐显现出来[32], 是最有前景的肿瘤治疗方法. 通过今后更加深入的研究, HSP70及ST13有可能会成为胃癌免疫治疗及分子靶向治疗的潜在靶分子.
胃癌为消化系常见肿瘤之一, 胃息肉是WHO确定的胃癌的癌前疾病之一, 探究胃息肉癌变的分子生物学机制是目前胃癌的研究热点之一, 热休克蛋白70(heat shock protein70, HSP70)又称应激蛋白, 具有提高细胞应激耐受性及细胞自身稳定功能, 与细胞的增生、分化、凋亡、瘤变及免疫等过程有关, 被认为是肿瘤形成发展的先决条件之一. ST13基因(suppression of tumorigenicity 13)是一种大肠癌负相关基因, 目前研究表明其主要作为HSP70的分子伴侣发挥生物学功能, 现有研究证实其可能与肿瘤细胞转移和细胞生长有关.
沈克平, 主任医师, 上海中医药大学附属龙华医院
胃癌组织中HSP70蛋白呈过度表达, 使用反义RNA特异性抑制胃癌细胞中的HSP70蛋白表达, 可以使胃癌进展缓慢甚至好转, 但其具体机制不明, ST13作为HSP70的分子伴侣, 可能通过HSP70发挥其部分生物学作用, 了解ST13与HSP70在胃癌中的关系及作用机制, 将对HSP70在胃癌中作用的研究提供帮助.
张建军等发现HSP70 mRNA在胃癌组织中的表达程度明显高于正常胃黏膜组织, 未分化型癌的HSP70 mRNA表达程度明显高于分化型癌, 在TNM分期Ⅲ、Ⅳ期中, HSP70 mRNA的表达程度明显高于其他分期, 提示HSP70可用于判断胃癌分化程度及临床分期的辅助指标, Zhao等在研究中利用HSP70反义寡核苷酸转染到胃癌SGC-7901细胞系内发现, HSP70反义寡核苷酸定向在人HSP70的mRNA中, 使得人胃癌SGC-7901的细胞增殖和存活受到抑制. 提示HSP70的反义RNA基因治疗可以作为胃癌的有效治疗方法之一.
近年大量研究发现, 在胃癌的发生、发展中, HSP70成高表达, 并与胃癌的组织类型及临床分期有关. 而作为HSP70分子伴侣的ST13在胃癌中表达的相关研究较少, 本研究发现, HSP70与ST13在胃癌变过程中的表达呈负相关关系, 在胃癌变的发生发展过程中, ST13可能存在其他的调节机制或参与抑制其他的细胞凋亡途径, 而非单纯通过HSP70起调控作用.
完善HSP70在胃癌发生、发展中的分子作用机制, 了解HSP70及其分子伴侣ST13在胃癌变的相互关系, 探寻HSP70及ST13对胃癌细胞的免疫、凋亡的影响, 可以对HSP70的反义RNA基因治疗胃癌提供线索, 具有一定临床前景.
本文观察了ST13和HSP70在胃息肉及胃癌中的表达, 对研究胃癌癌变过程中的基因表达异常具有重要意义, 可以为胃癌诊治提供新的线索.
编辑: 郭鹏 电编:鲁亚静
| 1. | Hotta K, Oyama T, Akamatsu T, Tomori A, Hasebe O, Nakamura N, Kojima E, Suga T, Miyabayashi H, Ohta H. A comparison of outcomes of endoscopic submucosal dissection (ESD) For early gastric neoplasms between high-volume and low-volume centers: multi-center retrospective questionnaire study conducted by the Nagano ESD Study Group. Intern Med. 2010;49:253-259. [PubMed] |
| 2. | Wang G, Yu D, Tan W, Zhao D, Wu C, Lin D. Genetic polymorphism in chemokine CCL22 and susceptibility to Helicobacter pylori infection-related gastric carcinoma. Cancer. 2009;115:2430-2437. [PubMed] [DOI] |
| 3. | Goddard AF, Badreldin R, Pritchard DM, Walker MM, Warren B. The management of gastric polyps. Gut. 2010;59:1270-1276. [PubMed] [DOI] |
| 4. | Hartl FU. Molecular chaperones in cellular protein folding. Nature. 1996;381:571-579. [PubMed] [DOI] |
| 5. | Conroy SE, Latchman DS. Do heat shock proteins have a role in breast cancer? Br J Cancer. 1996;74:717-721. [PubMed] [DOI] |
| 6. | Chen YC, Lin-Shiau SY, Lin JK. Involvement of heat-shock protein 70 and P53 proteins in attenuation of UVC-induced apoptosis by thermal stress in hepatocellular carcinoma cells. Photochem Photobiol. 1999;70:78-86. [PubMed] [DOI] |
| 7. | Jäättelä M. Escaping cell death: survival proteins in cancer. Exp Cell Res. 1999;248:30-43. [PubMed] [DOI] |
| 8. | Nylandsted J, Brand K, Jäättelä M. Heat shock protein 70 is required for the survival of cancer cells. Ann N Y Acad Sci. 2000;926:122-125. [PubMed] |
| 9. | Jäättelä M, Wissing D, Kokholm K, Kallunki T, Egeblad M. Hsp70 exerts its anti-apoptotic function downstream of caspase-3-like proteases. EMBO J. 1998;17:6124-6134. [PubMed] [DOI] |
| 10. | Aghdassi A, Phillips P, Dudeja V, Dhaulakhandi D, Sharif R, Dawra R, Lerch MM, Saluja A. Heat shock protein 70 increases tumorigenicity and inhibits apoptosis in pancreatic adenocarcinoma. Cancer Res. 2007;67:616-625. [PubMed] [DOI] |
| 11. | Haug M, Dannecker L, Schepp CP, Kwok WW, Wernet D, Buckner JH, Kalbacher H, Dannecker GE, Holzer U. The heat shock protein Hsp70 enhances antigen-specific proliferation of human CD4+ memory T cells. Eur J Immunol. 2005;35:3163-3172. [PubMed] [DOI] |
| 12. | Ciocca DR, Calderwood SK. Heat shock proteins in cancer: diagnostic, prognostic, predictive, and treatment implications. Cell Stress Chaperones. 2005;10:86-103. [PubMed] [DOI] |
| 13. | Ciocca DR, Clark GM, Tandon AK, Fuqua SA, Welch WJ, McGuire WL. Heat shock protein hsp70 in patients with axillary lymph node-negative breast cancer: prognostic implications. J Natl Cancer Inst. 1993;85:570-574. [PubMed] [DOI] |
| 14. | Zhao ZG, Shen WL. Heat shock protein 70 antisense oligonucleotide inhibits cell growth and induces apoptosis in human gastric cancer cell line SGC-7901. World J Gastroenterol. 2005;11:73-78. [PubMed] |
| 15. | 刘 重元, 欧阳 美黎, 谢 海龙. HSP70蛋白在胃癌中的表达. 南华大学学报(医学版). 2007;3:336-337, 340. |
| 17. | 薄 爱华, 戴 洁, 王 金科, 张 志生, 左 东升, 张 江兰, 白 丽娜, 陈 秀玲, 杨 燕君. 热休克蛋白70 mRNA在老年人胃癌中表达的意义. 中国老年学杂志. 2005;6:655-656. |
| 19. | Velten M, Villoutreix BO, Ladjimi MM. Quaternary structure of the HSC70 cochaperone HIP. Biochemistry. 2000;39:307-315. [PubMed] [DOI] |
| 20. | 董 庆华. 大肠癌相关基因ST13功能研究. 杭州: 浙江大学 2004; . |
| 21. | Ravagnan L, Gurbuxani S, Susin SA, Maisse C, Daugas E, Zamzami N, Mak T, Jäättelä M, Penninger JM, Garrido C. Heat-shock protein 70 antagonizes apoptosis-inducing factor. Nat Cell Biol. 2001;3:839-843. [PubMed] |
| 22. | Wang HG, Takayama S, Rapp UR, Reed JC. Bcl-2 interacting protein, BAG-1, binds to and activates the kinase Raf-1. Proc Natl Acad Sci U S A. 1996;93:7063-7068. [PubMed] |
| 23. | Takayama S, Sato T, Krajewski S, Kochel K, Irie S, Millan JA, Reed JC. Cloning and functional analysis of BAG-1: a novel Bcl-2-binding protein with anti-cell death activity. Cell. 1995;80:279-284. [PubMed] |
| 24. | 薛 晶文. ST13/HIP和HSP70在子宫内膜癌组织中的表达及临床意义. 沈阳: 中国医科大学 2008; . |
| 26. | Saibil H. Molecular chaperones: containers and surfaces for folding, stabilising or unfolding proteins. Curr Opin Struct Biol. 2000;10:251-258. [PubMed] [DOI] |
| 27. | Ballinger CA, Connell P, Wu Y, Hu Z, Thompson LJ, Yin LY, Patterson C. Identification of CHIP, a novel tetratricopeptide repeat-containing protein that interacts with heat shock proteins and negatively regulates chaperone functions. Mol Cell Biol. 1999;19:4535-4545. [PubMed] |
| 28. | Takayama S, Bimston DN, Matsuzawa S, Freeman BC, Aime-Sempe C, Xie Z, Morimoto RI, Reed JC. BAG-1 modulates the chaperone activity of Hsp70/Hsc70. EMBO J. 1997;16:4887-4896. [PubMed] [DOI] |
| 29. | Nollen EA, Brunsting JF, Song J, Kampinga HH, Morimoto RI. Bag1 functions in vivo as a negative regulator of Hsp70 chaperone activity. Mol Cell Biol. 2000;20:1083-1088. [PubMed] [DOI] |
| 30. | Shu ZHENG, Jimin SHAO, Qi DONG, Jiaping PENG, Suzhan ZHANG. Characterization of ST13 protein expression in human colorectal cancer tissues. Chinese-German J Clin Oncol. 2005;4:2-7. [DOI] |
| 31. | Castells A, Gusella JF, Ramesh V, Rustgi AK. A region of deletion on chromosome 22q13 is common to human breast and colorectal cancers. Cancer Res. 2000;60:2836-2839. [PubMed] |
| 32. | Longo L, Platini F, Scardino A, Alabiso O, Vasapollo G, Tessitore L. Autophagy inhibition enhances anthocyanin-induced apoptosis in hepatocellular carcinoma. Mol Cancer Ther. 2008;7:2476-2485. [PubMed] [DOI] |