修回日期: 2013-08-09
接受日期: 2013-09-09
在线出版日期: 2013-10-18
目的: 观察shMRE11沉默MRE11基因对肝癌耐药细胞Bel7402/5-FU DNA损伤修复功能的影响.
方法: 采用阳离子脂质体法将shMRE11干扰质粒转染BEL7402/5-FU细胞, Real-time PCR及Western blot检测沉默效率; Western blot检测细胞γ-H2AX蛋白表达; EdU法检测细胞DNA合成; MTT法检测细胞增殖情况.
结果: Real-time PCR及Western blot检测结果显示MRE11 mRNA及蛋白水平的沉默效率分别为78.0%、56.1%; Western blot检测γ-H2AX表达结果显示shMRE11实验组(1.04±0.056)较对照组(0.847±0.025)增加(P<0.05, t = 10.78); EdU检测结果显示shMRE11实验组DNA合成率(38.819±2.607)较对照组(49.814±1.227)降低(P<0.05, t = -8.87); MTT细胞增殖检测结果显示转染72 h后shMRE11实验组(0.58±0.08)与对照组(0.87±0.09)相比细胞增殖速度减慢(P<0.05, t = -50.2).
结论: shMRE11干扰质粒能够有效抑制BEL7402/5-FU细胞中MRE11表达, 使细胞DNA损伤修复能力减弱、抑制细胞增殖.
核心提示: 转染靶向MRE11的shRNA干扰质粒能增加化疗药物对耐药细胞造成的损伤, 使DNA损伤修复功能减弱, 增加药物对细胞的损伤程度; 对细胞的生物学行为产生影响, 使细胞增殖速度减慢, MRE11的沉默能够降低BEL7402/5-FU细胞的耐药性.
引文著录: 范芳, 耿磊, 李大玉, 李长福. shRNA沉默MRE11表达对肝癌耐药细胞BEL7402/5-FU DNA损伤修复的影响. 世界华人消化杂志 2013; 21(29): 3053-3058
Revised: August 9, 2013
Accepted: September 9, 2013
Published online: October 18, 2013
AIM: To investigate the effect of shRNA-mediated MRE11 gene silencing on cell proliferation and apoptosis in multidrug-resistant hepatocellular carcinoma cell line BEL7402/5-FU.
METHODS: A shRNA targeting the MRE11 gene was transiently transfected into BEL7402/5-FU cells using cathodolyte liposomes. Silencing efficiency was assessed using Real-time PCR and Western blot. The protein expression of γ-H2AX was detected by Western blot. Cellular DNA synthesis was detected by EdU. Cell proliferation was assessed by MTT assay.
RESULTS: Real-time PCR and Western blot results showed that the efficiency of RNA interference for MRE11 was 78.0% at the mRNA level and 56.1% at the protein level. Western blot analysis demonstrated that γ-H2AX expression was significantly higher in the shMRE11 group than in the control group (1.04 ± 0.056 vs 0.847 ± 0.025, P < 0.05, t = 10.78). DNA synthesis was significantly decreased in the shMRE11 group compared with the control group (38.819 ± 2.607 vs 49.814 ± 1.227, P < 0.05, t = -8.87). The proliferation rate was significantly lower in the shMRE11 group than in the control group (0.58 ± 0.08 vs 0.87 ± 0.09, P < 0.05, t = -50.2).
CONCLUSION: ShRNA-mediated MRE11 gene silencing effectively inhibit DNA repair and proliferation of BEL7402/5-FU cells.
- Citation: Fan F, Geng L, Li DY, Li CF. ShRNA-mediated MRE11 gene silencing inhibits DNA repair in multidrug-resistant hepatocellular carcinoma cell line BEL7402/5-FU. Shijie Huaren Xiaohua Zazhi 2013; 21(29): 3053-3058
- URL: https://www.wjgnet.com/1009-3079/full/v21/i29/3053.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i29.3053
原发性肝癌是临床常见的恶性肿瘤之一, 其发病机制和病因尚不明确. DNA双链断裂(double-stranded breaks, DSBs)是细胞最严重的一种损伤, 可导致细胞失去分裂增殖能力而死亡, 是抗癌药物致肿瘤细胞死亡主要机制. Meiotic recombination 11(MRE11)是参与DNA损伤修复的MRN复合物的重要组分, 在DSBs修复中发挥重要作用[1], 不仅是DNA损伤的感受器, 更是修复DNA的启动因子, 还能修饰受损的DNA分子[2,3]. 本文将shMRE11转染肝癌耐药细胞株BEL7402/5-氟尿嘧啶(5-fluorouracil, 5-FU), 通过检测MRE11沉默对细胞DNA损伤修复的影响, 初步探索MRE11与肝癌发生的关系.
BEL7402/5-FU细胞株购自南京凯基生物科技发展有限公司, piGENE-PUR-hu6-MRE11shRNAi质粒由北京大学医学部贾弘禔教授馈赠; LipofectamineTM 2000购自Invitrogen公司; MRE11、γ-H2AX抗体购自ABGENT公司; EdU检测试剂盒购自广州市锐博生物科技有限公司; MTT购自Solarbio公司; 其余试剂均为国产分析纯试剂.
1.2.1 BEL7402/5-FU细胞的培养: 将BEL7402/5-FU细胞于含10%胎牛血清、20 μg/mL 5-FU的DMEM培养液, 37 ℃、5%CO2饱和湿度条件下培养. 细胞贴壁生长, 每天换液1次, 2-3 d传代一次, 取对数生长期细胞用于实验.
1.2.2 实验分组与质粒转染: 实验分为4组: 空白对照组、脂质体组、空质粒组、shMRE11实验组. 将BEL7402/5-FU细胞接种于24孔培养板, 每孔接种细胞2×104个左右, 当细胞融合度达到80%左右时吸去各孔中的培养液, 将质粒-脂质体复合物加至相应培养孔中, 每孔100 μL, 6 h后换液.
1.2.3 Real-time PCR检测MRE11 mRNA水平的表达: 细胞总RNA的提取按RNAiso Plus试剂盒说明书进行, Real-time PCR引物: MRE11上游5'-GTGGACAAGGAGGAGAAAGATG-3'; 下游3'-TACTTCAGGCACTCCGATACTG-5', 扩增片段长度为188 bp. β-actin上游5'-TGGCACCCAGCACAATGAA-3'; 下游3'-CTAAGTCATAGTCCGCCTAGAAGCA-5', 扩增片段长度为232 bp.
各组样品MRE11 mRNA表达量经Real-time PCR仪器检测, PCR产物作熔解曲线分析, 根据Ct值通过公式2-∆∆Ct进行相对定量分析计算可得MRE11 mRNA相对表达量.
1.2.4 Western blot检测MRE11、γ-H2AX蛋白表达: 用预冷PBS将各组细胞漂洗2次, 加入1 mL蛋白裂解液充分裂解, 4 ℃, 12000 r/min离心5 min, 提取细胞总蛋白. 按BCA蛋白含量检测试剂盒步骤制作标准曲线, 计算样品蛋白浓度. 取30 μg蛋白样品与上样缓冲液混匀, 以SDS-PAGE电泳(MRE11测定用12%分离胶、5%积层胶, MRP1测定用8%分离胶、4%积层胶), 80 V约4 h. 电泳完后取下凝胶, 电转至PVDF膜, 用5%的脱脂奶粉室温摇床封闭1 h. 加入MRE11(稀释比例1:200)、γ-H2AX(稀释比例1:2000)一抗, 37 ℃孵育2 h, TBST洗膜3次. 二抗37 ℃孵育1 h, TBST洗膜3次, ECL发光显色. 用Quantity One定量分析软件分析灰度比.
1.2.5 MTT法检测细胞增殖情况: 取BEL7402/5-FU细胞制成细胞悬液, 接种于96孔培养板中, 共分4组, 各组设3个复孔, 每孔加量为200 μL, 同时种3块96孔板. 各组分别于培养24、48、72 h后取出一块培养板, 各孔加入180 μL无血清培养液、20 μL MTT(0.5%), 继续培养4 h后弃上清, 每孔加150 μL二甲基亚砜(DMSO), 摇床低速震荡10 min, 全自动酶标仪(490 nm)测定各孔吸光度值. 以培养时间为横坐标, 吸光度值为纵坐标, 绘制细胞生长曲线.
1.2.6 EdU法检测细胞DNA合成情况: 转染48h后将细胞按照广州锐博EdU检测试剂盒说明书进行操作, 荧光倒置显微镜下观察细胞并拍照, 蓝色荧光由绿光激发, 红色荧光由紫光激发. 每组取5个视野, 计数相同视野下EdU标记细胞及总细胞数, 计算DNA合成率.
统计学处理 以上实验均重复3次, 采用SPSS18.0软件包进行统计学分析, 实验数据以mean±SD表示. 对样本进行正态和方差齐性检验, 满足条件者, 多组间的均数比较采用单因素方差分析, 均数的两两比较采用LSD法, 两组间比较采用t检验. P<0.05表示差异有统计学意义, P<0.01为差异有显著统计学意义.
实验结果使用2-∆∆Ct法进行分析, 结果显示(表1): 空白对照组、脂质体组、质粒对照组MRE11 mRNA表达无明显差异(P>0.05), shMRE11实验组MRE11 mRNA的表达较对照组明显下调(P<0.01). 通过计算得到MRE11 mRNA水平的沉默效率为78.0%.
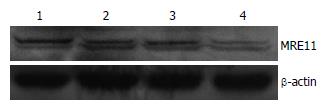
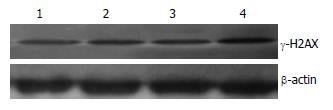
转染48 h后收集各组细胞, 提取总蛋白, Western blot检测转染后各组细胞MRE11、γ-H2AX蛋白表达变化. 结果显示: 空白对照组、脂质体组、质粒对照组表达无明显差异(P>0.05), shMRE11实验组MRE11蛋白表达下降, 与对照组比较差异具有统计学意义(P<0.01), 计算得到MRE11蛋白水平的沉默效率为56.1%(表2, 图1); 与对照组相比shMRE11实验组γ-H2AX蛋白表达增加(P<0.05). 提示MRE11的沉默能够增加化疗药物对肝癌耐药细胞BEL7402/5-FU DNA造成的损伤(表3, 图2).
| 分组 | MRE11/β-actin |
| 空白对照组 | 0.804±0.065 |
| 脂质体组 | 0.771±0.030 |
| 质粒对照组 | 0.721±0.010 |
| 实验组 | 0.353±0.041b |
MTT检测结果显示(表4): 空白对照组、脂质体组、质粒对照组细胞生长曲线差异不明显(P>0.05), 而shMRE11实验组细胞增殖能力降低, 与对照组相比, 差异具有统计学意义(P<0.05). 可见MRE11的沉默可抑制肝癌耐药细胞BEL7402/5-FU的增值.
各组细胞转染48 h后按EdU试剂盒说明书操作步骤进行检测, 荧光显微镜下观察, 计算每组DNA合成细胞即EdU标记细胞占总细胞的百分比(%). 由实验结果(表5)可知, shMRE11实验组DNA合成率明显低于对照组(P<0.05). 空白对照组、脂质体组、质粒对照组DNA合成率无明显差异(P>0.05), 提示MRE11的沉默能够抑制BEL7402/5-FU细胞的DNA合成.
肝癌是严重地威胁人类健康的临床常见肿瘤, 治疗效果差. 各种原因引起的DNA损伤是发生肝癌的重要分子基础, DNA损伤后可引起细胞的一系列反应, 包括损伤信号的传导、损伤修复、诱导细胞死亡等. 这些诱因也能作用于损伤修复系统中的某个环节, 使DNA损伤不能修复或不能正确修复, 细胞发生恶性转化[4,5]. 临床上很多化疗药物是以DNA为靶点, 造成DSBs, DSBs发生后, 细胞周期发生相应改变, 信号传导途径检查点首先感知并放大损伤信号, 启动一系列的生物学效应[6-8]. MRE11是细胞应对DSBs过程中的一种重要的多功能蛋白质, 参与最初蛋白复合物形成, 其N端具有4个保守区, 为磷酸酯酶结构域, C端有2个DNA结合区, 并具有核酸酶活性[9]. MRE11、RAD50和NBS1组成MRN复合物, 在快速识别DSBs后可通过调控细胞周期, 为DNA修复争取时间[10], 在DNA损伤的感知和修复以及信号的传导过程中起关键作用[11-18]. 因此可通过干扰DSBs修复功能, 使肿瘤细胞不能及时修复DSBs, 从而增加肿瘤细胞的放化疗敏感性[19-21]. MRE11还可受一种新的细胞周期调节因子的调控, 从而参与肿瘤的发生发展[22]. 肝癌组织中也存在MRE11表达异常的现象[23]. 目前关于MRE11的研究较少, 他与肝癌的产生发展、肝癌细胞DNA损伤修复、耐药等是否有关是我们感兴趣的内容.
如前所述MRE11是DNA损伤修复相关因子, 因此推测它的沉默对细胞的生物学行为有可能会有一定的影响. 肿瘤的形成是基因调控的细胞增殖、分化异常和/或细胞凋亡过程受到抑制等方面作用所致. 我们通过MTT法检测了各组细胞增殖情况, 实验结果显示: shMRE11对BEL7402/5-FU细胞增殖具有抑制作用, 使细胞增殖速度减慢, 与Yuan等[24]的研究结果相似.
肿瘤的发生与演进是肿瘤细胞过度增殖造成的, 而肿瘤细胞的过度增殖必然涉及到DNA复制增加和DNA损伤修复功能增强. 对于正常细胞, 完整DNA损伤修复功能能保证细胞基因组染色体的完整性和稳定性, 然而对于肿瘤细胞, 临床常用的放化疗很多都是以DNA为靶点, 研究DNA的损伤修复对肿瘤的治疗有非常重要的意义. 如何诱导肿瘤细胞DNA损伤, 防止DNA损伤的修复, 从而诱导肿瘤细胞的坏死与凋亡, 是肿瘤治疗的一个重要途径.
γ-H2AX是一类进化上保守的组蛋白H2A的变体[25], 在DSBs发生后可被磷酸化而富集到DNA断裂处, 招募BRCA1、RAD51等DNA损失修复蛋白对损伤处进行修复[26-28], 是重要的DNA损伤感应分子, 是检测DSBs的金标准[29,30]. 为研究shMRE11对DNA损伤造成的影响, 本研究用Western blot方法检测γ-H2AX表达来判断各组细胞的损伤程度. 实验结果发现干扰BEL7402/5-FU细胞中MRE11的表达后, γ-H2AX的表达增加, 提示MRE11的抑制能够一定程度上增加化疗药物对耐药细胞造成的损伤.
DNA损伤修复必然与DNA的合成有关, 为了直观地了解各组细胞DNA合成情况的差异, 我们用EdU法进行了检测. EdU是一种胸腺嘧啶核苷类似物, 其乙炔基团在天然化合物中很少见, 在细胞增殖时能够插入正在复制的DNA分子中, 基于EdU与染料的共轭反应可以高效快速地检测细胞增殖, 可以有效地检测DNA合成. 结果显示MRE11干扰后DNA的合成减少, 提示MRE11的沉默能够抑制DNA的合成, 使BEL7402/5-FU细胞DNA损伤后的修复途径受阻.
总之, 本课题研究结果表明, 转染靶向MRE11的shRNA干扰质粒能在一定程度上增加化疗药物对耐药细胞造成的损伤, 使DNA损伤修复功能减弱, 增加了药物对细胞的损伤程度; 并对细胞的生物学行为产生了一定的影响, 使细胞增殖速度减慢, 可见MRE11的沉默在一定程度上能够降低BEL7402/5-FU细胞的耐药性. 本课题组的其他研究结果显示, 转染靶向MRE11的shRNA干扰质粒后, BEL7402/5-FU细胞中的多药耐药相关蛋白1(MRP1)的表达下调, 并能促进细胞的凋亡(另文发表). 因此推测MRE11沉默降低细胞耐药性的机制除了与抑制DNA损伤修复途径有关, 还可能与下调MRP1表达、促进细胞凋亡存在一定的联系, 具体机制还需作进一步的实验研究.
原发性肝癌是我国最常见也是公认危害最大的恶性肿瘤之一, 其发病率及死亡率非常高. 肝癌的高复发率、低切除率决定了化疗在综合治疗中的重要地位, 但易产生多药耐药. 肿瘤的耐药性已成为肿瘤有效治疗的一大难题, 不仅大大降低了化疗效果, 而且有可能会导致肿瘤的转移, 使肿瘤进一步恶化.
秦建民, 主任医师, 上海中医药大学附属普陀医院普外科
肿瘤产生多药耐药的机制复杂, 是患者机体本身和肿瘤细胞恶性程度及肿瘤生长微环境等在不同的生理及病理状态下多种因素共同存在、共同作用的结果. DNA一直是肿瘤治疗的重要靶点, DNA损伤的自我修复机制增强可导致肿瘤细胞产生耐药性. 如何诱导肿瘤细胞DNA损伤, 阻止DNA损伤的修复, 进而使肿瘤细胞凋亡与坏死, 是肿瘤治疗研究中的重点.
有实验证明MRN复合物在DNA双链断裂的早期就能感知这种损伤, 发挥一系列的效应, 但是对MRN复合物的组分之一Mre11在DNA修复过程中作用的研究报道则不是很明确, 两者的关系有待进一步研究.
肝癌化疗耐药是临床治疗的难点, 抑制DNA损伤修复基因的表达有望逆转化疗耐药, 本课题采用RNA干扰抑制Mre11基因的表达, 进一步揭示肝癌细胞DNA损伤修复与化疗耐药的关系, 为肝癌患者临床治疗提供实验依据.
本文具有一定的理论研究价值.
编辑: 田滢 电编:鲁亚静
| 1. | Yamaguchi-Iwai Y, Sonoda E, Sasaki MS, Morrison C, Haraguchi T, Hiraoka Y, Yamashita YM, Yagi T, Takata M, Price C. Mre11 is essential for the maintenance of chromosomal DNA in vertebrate cells. EMBO J. 1999;18:6619-6629. [PubMed] [DOI] |
| 2. | Liao S, Guay C, Toczylowski T, Yan H. Analysis of MRE11's function in the 5'--& gt; 3' processing of DNA double-strand breaks. Nucleic Acids Res. 2012;40:4496-4506. [PubMed] [DOI] |
| 3. | Foster SS, Balestrini A, Petrini JH. Functional interplay of the Mre11 nuclease and Ku in the response to replication-associated DNA damage. Mol Cell Biol. 2011;31:4379-4389. [PubMed] [DOI] |
| 6. | Zhou BB, Elledge SJ. The DNA damage response: putting checkpoints in perspective. Nature. 2000;408:433-439. [PubMed] |
| 7. | Cummings WJ, Zolan ME. Functions of DNA repair genes during meiosis. Curr Top Dev Biol. 1998;37:117-140. [PubMed] [DOI] |
| 8. | Rothkamm K, Krüger I, Thompson LH, Löbrich M. Pathways of DNA double-strand break repair during the mammalian cell cycle. Mol Cell Biol. 2003;23:5706-5715. [PubMed] [DOI] |
| 9. | Costanzo V, Robertson K, Bibikova M, Kim E, Grieco D, Gottesman M, Carroll D, Gautier J. Mre11 protein complex prevents double-strand break accumulation during chromosomal DNA replication. Mol Cell. 2001;8:137-147. [PubMed] |
| 10. | Williams RS, Williams JS, Tainer JA. Mre11-Rad50-Nbs1 is a keystone complex connecting DNA repair machinery, double-strand break signaling, and the chromatin template. Biochem Cell Biol. 2007;85:509-520. [PubMed] |
| 11. | Petrini JH. The Mre11 complex and ATM: collaborating to navigate S phase. Curr Opin Cell Biol. 2000;12:293-296. [PubMed] |
| 13. | Maehara Y, Saeki H, Morita M. Molecular mechanisms of esophageal squamous cell carcinogenesis: clues to improve treatment outcomes. Ann Thorac Cardiovasc Surg. 2010;16:387-388. [PubMed] |
| 14. | Deng Y, Guo X, Ferguson DO, Chang S. Multiple roles for MRE11 at uncapped telomeres. Nature. 2009;460:914-918. [PubMed] |
| 16. | van den Bosch M, Bree RT, Lowndes NF. The MRN complex: coordinating and mediating the response to broken chromosomes. EMBO Rep. 2003;4:844-849. [PubMed] [DOI] |
| 17. | Abraham RT, Tibbetts RS. Cell biology. Guiding ATM to broken DNA. Science. 2005;308:510-511. [PubMed] [DOI] |
| 18. | Lavin MF. ATM and the Mre11 complex combine to recognize and signal DNA double-strand breaks. Oncogene. 2007;26:7749-7758. [PubMed] [DOI] |
| 22. | Guan R, Hou DF, Rao X, Guan YJ, Ouyang YM, Yu YH, Jim HU, Chen ZC. ZNF403, a Novel Cell Cycle Regulator. Progress in Biochemistry and Biophysics. 2013;40:147-158. |
| 24. | Yuan SS, Hou MF, Hsieh YC, Huang CY, Lee YC, Chen YJ, Lo S. Role of MRE11 in cell proliferation, tumor invasion, and DNA repair in breast cancer. J Natl Cancer Inst. 2012;104:1485-1502. [PubMed] [DOI] |
| 25. | Redon C, Pilch D, Rogakou E, Sedelnikova O, Newrock K, Bonner W. Histone H2A variants H2AX and H2AZ. Curr Opin Genet Dev. 2002;12:162-169. [PubMed] [DOI] |
| 26. | Kinner A, Wu W, Staudt C, Iliakis G. Gamma-H2AX in recognition and signaling of DNA double-strand breaks in the context of chromatin. Nucleic Acids Res. 2008;36:5678-5694. [PubMed] [DOI] |
| 27. | Paull TT, Rogakou EP, Yamazaki V, Kirchgessner CU, Gellert M, Bonner WM. A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage. Curr Biol. 2000;10:886-895. [PubMed] [DOI] |
| 29. | 邹 鹏, 杨 晓丽, 陈 先. 博来霉素对肝癌细胞DNA损伤以及H2AX相互作用蛋白的影响. 复旦学报(自然科学版). 2011;l:172-177. |
| 30. | Downey M, Durocher D. gammaH2AX as a checkpoint maintenance signal. Cell Cycle. 2006;5:1376-1381. [PubMed] |