修回日期: 2013-08-09
接受日期: 2013-09-17
在线出版日期: 2013-10-08
目的: 检测Hippo-YAP信号通路中主要效应蛋白Yes相关蛋白(Yes-associated protein, YAP)在正常胰腺组织和胰腺癌组织中的表达, 探讨其表达强度与临床病理因素之间的关系及意义.
方法: 应用免疫组织化学EnVision法测定Hippo信号通路中YAP蛋白在45例胰腺癌及15例正常胰腺组织中的表达, 应用RT-PCR方法检测YAP mRNA在45例胰腺癌及15例正常胰腺组织中的表达.
结果: 胰腺癌组织中YAP蛋白主要表达于胰腺导管上皮细胞, 45例胰腺癌组织中YAP的阳性表达率为93.33%(42/45), 15例正常胰腺组织中YAP阳性表达率为26.67%(4/15), 两组间的表达差异具有统计学意义(χ2 = 27.95, P<0.01). 在胰腺癌组织中YAP的表达与肿瘤分化程度密切相关(P = 0.048), 与年龄、性别、吸烟、饮酒、肥胖、糖耐量异常、糖尿病、慢性胰腺炎及临床分期等无关(P值分别是0.577、0.565、0.541、0.224、1.000、0.542、0.555、0.571、0.926). 胰腺癌患者血清CA19-9水平与胰腺癌组织中YAP阳性程度呈正相关. YAP mRNA在胰腺癌组织中的表达较正常胰腺组织明显升高(0.3682±0.0783 vs 0.0394±0.0091, P<0.01).
结论: Hippo-YAP通路可能在胰腺癌的发生、发展中发挥重要作用. 并有可能成为胰腺癌治疗中新的靶点.
核心提示: Hippo-Yes相关蛋白(Yes-associated protein, YAP)信号通路已被证实与胃癌、食管癌、结肠癌等多种肿瘤的发生和转移有关, 本实验通过探讨YAP在正常胰腺组织和胰腺癌组织中的表达, 探讨其在胰腺癌发生中的作用.
引文著录: 李晓宇, 田字彬, 单信芝, 张翠萍, 刘晓英, 徐永红, 李新华, 武军, 赵文君, 李丹. Hippo通路中Yes相关蛋白在胰腺癌中的表达及意义. 世界华人消化杂志 2013; 21(28): 3013-3018
Revised: August 9, 2013
Accepted: September 17, 2013
Published online: October 8, 2013
AIM: To detect the expression of Yes-associated protein (YAP), a component of the Hippo signaling pathway, in human pancreatic cancer, and to explore the correlation between the expression of YAP and clinicopathologic features of pancreatic cancer.
METHODS: Immunohistochemistry was used to investigate the protein expression of YAP in 45 pancreatic cancer specimens and 15 normal pancreatic tissue specimens. The mRNA expression of YAP was detected by RT-PCR.
RESULTS: YAP was mainly expressed in pancreatic ductal epithelial cells. The positive rate of YAP expression was significantly higher in pancreatic cancer than in normal pancreatic tissue (93.33% vs 26.67%, P < 0.05). The mRNA expression of YAP in pancreatic cancer was significantly higher than that in normal pancreatic tissue (0.3682 ± 0.0783 vs 0.0394 ± 0.0091, P < 0.05). The expression of YAP was associated with degree of differentiation of pancreatic cancer but had no correlation with age, lymph node metastasis, clinical stage, smoking, drinking, or diabetes mellitus.
CONCLUSION: The expression of YAP may play an important role in the development of pancreatic cancer, and YAP may be a new target for therapy of pancreatic cancer.
- Citation: Li XY, Tian ZB, Shan XZ, Zhang CP, Liu XY, Xu YH, Li XH, Wu J, Zhao WJ, Li D. Significance of expression of Yes-associated protein in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(28): 3013-3018
- URL: https://www.wjgnet.com/1009-3079/full/v21/i28/3013.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i28.3013
胰腺癌是恶性程度最高的肿瘤之一, 位列消化系统肿瘤死亡原因的第2位, 发病率和死亡率在世界范围内呈逐年上升趋势[1]. Hippo-YAP通路为新近发现的一种调节器官发育的关键信号通路[2]. 他最先在果蝇体内被发现, 调控这条通路可以观察到果蝇眼睛和翅膀大小的变化. Yes相关蛋白(Yes-associated protein, YAP)是哺乳动物Hippo-YAP信号通路的主要效应因子. YAP的过度表达会造成组织器官的增大, 相反, YAP的失活会造成组织器官萎缩. Hippo-YAP信号通路已被证实与胃癌、食管癌、结肠癌等多种肿瘤的发生和转移有关, 但在胰腺癌中鲜有报道. 本实验通过探讨YAP在正常胰腺组织和胰腺癌组织中的表达, 探讨其在胰腺癌发生中的作用.
收集青岛大学医学院附属医院肝胆外科2011-2012年胰腺癌手术切除标本45例. 胰腺癌患者术前均未行放化疗治疗, 术后经病理组织学检查确诊, 均为原发性胰腺导管腺癌. 其中男性20例, 女性25例. 年龄46-79岁, 平均年龄62.00岁±12.51岁. 胰头29例, 胰体尾16例. 低分化腺癌26例, 中分化腺癌14例, 高分化腺癌5例. TNM分期: Ⅰ期28例、Ⅱ期15例、Ⅲ期2例. 因其他原因切除的正常胰腺组织15例, 其中男性5例, 女性10例, 年龄27-59岁, 平均年龄40.00岁±13.01岁. 需行免疫组织化学检查的标本经4%多聚甲醛固定, 石蜡包埋, 4 μm切片及苏木素-伊红(HE)染色. 同时取新鲜手术标本保存在液氮罐中供PCR检测用. 收集胰腺癌患者临床资料, 包括: 性别、年龄、吸烟、饮酒、体质量指数(body mass index, BMI)、是否有糖耐量异常、是否合并糖尿病或慢性胰腺炎、血清CA19-9水平等. 本研究方案获青岛大学医学院附属医院伦理委员会批准. 兔抗人YAP单克隆抗体购自美国Epitomics公司, 抗体稀释液及二氨基联苯胺(DAB)显色试剂盒均购自北京中杉金桥生物技术有限公司.
1.2.1 免疫组织化学染色检测: 应用免疫组织化学染色法(EnVision法)检测. 石蜡标本以4 μm切片, 常规脱蜡、水化, 3%H2O2微波孵育2 min, 阻断内源性过氧化物酶. 以柠檬酸盐缓冲液(pH 6.0)作为抗原修复液微波热修复3次×5 min. 分别滴加1-2滴兔抗人YAP抗体(EP1674Y, 1:100稀释), 以PBS代替一抗作为阴性对照. 4 ℃湿盒内孵育过夜. PBS冲洗后, 滴加1-2滴EnVisionTM(Genetech公司, GK500705)孵育45 min. DAB显色15 min. 苏木素复染3 min. 以YAP表达阳性的肝癌组织切片作为阳性对照.
1.2.2 结果判定: YAP定位于细胞质或细胞核中, 阳性染色为胞质或胞核染成棕黄色. 染色强度(A)分为0分(无染色)、1分(弱染色)、2分(中度染色)、3分(强染色). 3个随机选取的视野中, 根据200个细胞中阳性细胞所占的比例数(B)分为0(<5%)、1(5%-25%)、2(26%-50%)、3(51%-75%)、4(>75%). A与B结果相乘, 结果分为0(-)、低表达1-4(+)、中度表达5-8(++)、高度表达9-12(+++).
1.2.3 荧光定量聚合酶链反应(Real-time PCR): TRIzol法提取胰腺癌组织和正常胰腺组织总RNA, 逆转录反应依照TaKaRa公司逆转录试剂盒说明书进行操作. 将逆转录产物进行PCR反应, 体系如下: cDNA 2 μL, 2×SYBR Premix Ex TaqⅡ10 μL, 上下游引物各2 μL, ddH2O 4.8 μL. YAP上游引物: 5'-TGAACAAACGTCCAGCAAGATAC-3', 下游引物5'-CAGCCCCCAAAATGAACAGTAG-3', 扩增长度134 bp; GAPDH上游引物: 5'-TGACTTCAACAGCGACACCCA-3', 下游引物: 5'-CACCCTGTTGCTGTAGCCAAA-3', 扩增长度121 bp. 反应条件为: 95 ℃预变性30 s, 95 ℃ 5 s, 60 ℃ 30 s, 扩增40个循环. 2-△△Ct法计算YAP基因和内参基因的相对含量.
统计学处理 采用SPSS19.0统计软件进行数据统计分析, 实验数据以mean±SD形式表示, 免疫组织化学数据各组之间的比较采用卡方检验(χ2), 应用非参数统计中Spearman等级相关分析胰腺癌患者血清CA19-9水平与胰腺癌组织中YAP免疫组织化学阳性程度的相关性, 应用非配对t检验检测胰腺癌组织和正常胰腺组织中YAP mRNA表达差异. P<0.05为差异有统计学意义.
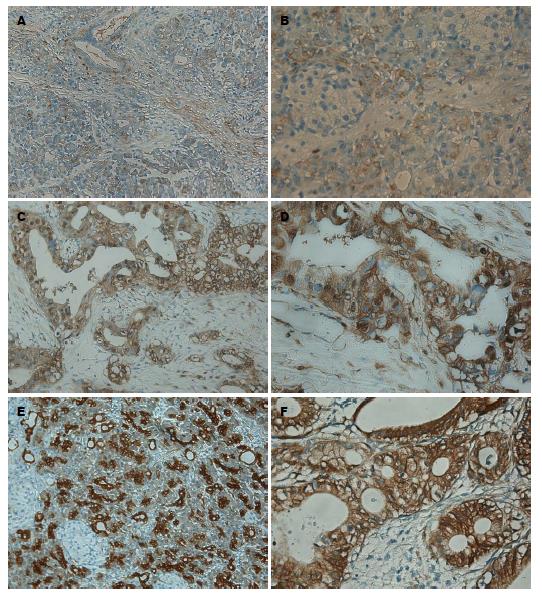
在正常胰腺组织中, YAP主要在胰腺导管上皮细胞的细胞质中呈低至中度表达, 在部分细胞核中有表达, 在胰腺腺泡和泡心细胞中无表达. 在胰腺癌组织中, YAP在导管上皮细胞中呈高度表达, 且主要是细胞质和细胞核表达(图1). 胰腺癌组织中YAP阳性表达率为93.33%, 正常胰腺组织中阳性表达率为26.67%, 差异具有显著统计学意义(χ2 = 27.95, P<0.01, 表1).
| 胰腺组织 | n | 不表达(0分) | 低表达(1-4分) | 中表达(5-8分) | 高表达(9-12分) | 阳性率(%) | χ2 | P值 |
| 胰腺癌组织 | 45 | 3 | 5 | 15 | 22 | 93.33% | 27.950 | 0.000 |
| 正常胰腺组织 | 15 | 11 | 3 | 1 | 0 | 26.67% | ||
| 合计 | 60 | 14 | 8 | 16 | 22 |
RT-PCR结果显示, YAP mRNA在胰腺癌组中的相对表达量是正常胰腺组织的9.35倍, 表达差异具有高度统计学意义(0.3682±0.0783 vs 0.0394±0.0091, P<0.01).
YAP在胰腺癌组织中的阳性表达差异与肿瘤的分化程度(χ2 = 5.294, P = 0.048)有明显的统计学意义, 而与年龄、性别、吸烟、饮酒、肥胖、糖耐量异常、糖尿病、慢性胰腺炎、临床分期等无关(P>0.05, 表2).
| 不表达(0分) | 低表达(1-4分) | 中表达(5-8分) | 高表达(9-12分) | χ2 | P值 | |
| 性别 | 0.643 | 0.577 | ||||
| 男 | 2 | 3 | 5 | 10 | ||
| 女 | 1 | 2 | 10 | 12 | ||
| 年龄(岁) | 0.787 | 0.565 | ||||
| >60 | 1 | 4 | 8 | 13 | ||
| <60 | 2 | 1 | 7 | 9 | ||
| 吸烟 | 1.452 | 0.541 | ||||
| 有 | 3 | 4 | 9 | 15 | ||
| 无 | 0 | 1 | 6 | 7 | ||
| 饮酒 | 1.896 | 0.224 | ||||
| 有 | 1 | 3 | 11 | 16 | ||
| 无 | 2 | 2 | 4 | 6 | ||
| 肥胖BMI(kg/m2) | 0.000 | 1.000 | ||||
| >27 | 2 | 4 | 9 | 15 | ||
| <27 | 1 | 1 | 6 | 7 | ||
| 糖耐量异常 | 1.773 | 0.542 | ||||
| 有 | 3 | 3 | 9 | 14 | ||
| 无 | 0 | 2 | 6 | 8 | ||
| 糖尿病 | 0.952 | 0.555 | ||||
| 有 | 1 | 2 | 8 | 16 | ||
| 无 | 2 | 3 | 7 | 6 | ||
| 慢性胰腺炎 | 0.643 | 0.577 | ||||
| 有 | 2 | 2 | 6 | 10 | ||
| 无 | 1 | 3 | 9 | 12 | ||
| 分化程度 | 5.294 | 0.048 | ||||
| 低分化 | 0 | 1 | 11 | 16 | ||
| 中、高分化 | 3 | 4 | 4 | 6 | ||
| T分期 | 2.143 | 0.543 | ||||
| T1 | 2 | 1 | 3 | 9 | ||
| T2 | 1 | 2 | 6 | 6 | ||
| T3 | 0 | 2 | 5 | 6 | ||
| T4 | 0 | 0 | 1 | 1 | ||
| N分期 | 0.592 | 1.000 | ||||
| N0 | 3 | 3 | 13 | 19 | ||
| N1 | 0 | 2 | 2 | 3 | ||
| 临床分期 | 0.153 | 0.926 | ||||
| Ⅰ | 2 | 3 | 11 | 12 | ||
| Ⅱ | 1 | 2 | 4 | 8 | ||
| Ⅲ | 0 | 0 | 0 | 2 |
在胰腺癌患者血清CA19-9水平与胰腺癌组织中YAP免疫组织化学的阳性程度呈正相关(r = 0.652, P<0.01), 即胰腺癌组织中YAP阳性程度越高对应CA19-9水平也越高.
Hippo-YAP通路为新近发现的一种调节器官大小发育的关键信号通路, 是一种细胞分裂和死亡的控制开关. 他最先在果蝇体内发现, 调控这条通路可以观察到果蝇的眼睛和翅膀大小的变化[2]. 在哺乳动物中同样是细胞增殖的负向调控通路, 核心分子组成为: Mst1/2、WW45、Lats、Mob1及YAP[3]. YAP是哺乳动物Hippo-YAP信号通路的主要效应因子. 其转录辅助活性取决于YAP在细胞内的位置: 磷酸化的YAP于胞浆中积聚, 通过磷酸化的ser127与14-3-3蛋白相结合而无法进入细胞核, 而非磷酸化的YAP可以进入细胞核, 与带有PDZ结合基序的转录增强因子TAZ形成复合体, 与TEA功能域转录因子(TEA domain transcription factor, TEAD)结合, 诱导下游转录因子细胞周期蛋白E(cyclinE)以及凋亡调控因子cIAP1等表达增加, 促进细胞增殖, 抑制细胞凋亡[4]. 除此之外, Hippo-YAP信号通路还与细胞间接触抑制[5]、上皮细胞间质转化(epithelial-mesenchymal transition, EMT)[4]等密切相关, 参与多种肿瘤的发生、发展以及转移过程.
YAP通过与抑癌基因p73相互作用上调Bax的表达, 加速Aβ(25-35)介导的细胞凋亡[6]. YAP通过上调BIRC2/clAPl, 促进细胞增殖和抑制细胞凋亡, 同时他们还发现在肝癌中YAP可以诱导c-myc、SOX4、H19及AFP等与正常肝细胞增殖相关基因以及IAP(凋亡抑制因子)家族中BIRC5/Survivin等凋亡抑制基因的表达[7]. YAP的高表达和肝癌细胞的低分化、高血清AFP表达及再发肝癌的血管渗透呈强烈正相关[8]. 在肝细胞中过表达YAP可使肝脏过度生长并最终导致肝癌的发生[9,10]. YAP在肾透明细胞癌中也表达增加, 与肿瘤分化程度有关, 提示YAP在肾透明细胞癌发生发展过程中起重要作用[11].
我们课题组之前的研究证实, YAP在正常胃黏膜组织、肠上皮化生、不典型增生和胃癌组织中的表达依次升高, 且在胃癌组织中YAP的表达与胃癌分化程度及淋巴结转移密切相关, 提示其在胃癌的发生、发展、转移过程中发挥重要作用[12]. 在食管炎、Barrett食管、食管不典型增生、食管癌组织中也证实了YAP阳性表达率依次升高. 有研究发现Hippo-YAP通路在胰腺胚胎发育过程中起到重要作用, YAP可以维持胰腺腺泡细胞后天分化[13]. 但在胰腺癌组织中相关研究较少. 我们的研究发现, YAP蛋白在胰腺癌组织较正常胰腺组织中表达明显升高. 在正常胰腺组织中, YAP主要在胰腺导管上皮细胞的细胞质中呈低至中度表达, 在胰腺腺泡细胞和泡心细胞中无表达. 而在胰腺癌组织中, YAP在导管上皮细胞中呈高度表达, 主要是细胞质和细胞核表达, 与肿瘤分化程度密切相关: 肿瘤分化程度越低, YAP免疫组织化学的表达率越高, 这提示YAP在胰腺癌的发生、发展过程中发挥重要作用.
胰腺癌的发生是遗传和环境因素共同作用的结果, 流行病学、分子生物学和遗传学研究认为多个生物因素和社会因素可能导致胰腺癌发生的危险性增加. 吸烟是胰腺癌公认的危险因素[14], 大量的流行病学研究不断为此提供新证据. 肥胖者和糖尿病患者发生胰腺癌的风险也显著升高. 糖尿病可能是病因, 也可能是胰腺癌的临床表现. 有学者提出要重视非典型糖尿病(无糖尿病家族史、无肥胖和有胰岛素依赖)患者发生胰腺癌的危险性[15]. 新发糖尿病可能为胰腺癌的早期诊断提供线索[16]. 我们收集了45例胰腺癌患者的临床资料, 包括: 性别、年龄、吸烟、饮酒、肥胖BMI、是否有糖耐量异常、是否合并糖尿病或慢性胰腺炎等. 我们发现这些高危因素如吸烟、肥胖、合并糖尿病等与YAP在胰腺癌中的表达无明显关系, 这可能与我们收集的资料数较少有关.
CA19-9为唾液酸化的乳-N-岩藻戊糖Ⅱ, 是一种类粘蛋白的糖蛋白成分, 是目前公认的对胰腺癌有诊断价值的肿瘤标志物. CA19-9升高对于良恶性肿瘤鉴别、诊断、手术疗效评估有重要意义[17]. 有研究显示, CA19-9水平与胰腺癌的TNM分期呈正相关, 与生存期呈负相关, 为反映预后和复发的重要指标[17,18]. 高频超声治疗后能明显下调胰腺癌血清CA19-9水平[19]. 我们的研究发现胰腺癌患者血清CA19-9水平与胰腺癌组织中YAP阳性程度正相关, 提示YAP对于胰腺癌的进展和预后有提示意义.
总之, 本研究表明YAP在胰腺癌组织中表达较正常胰腺组织增加, 并与胰腺癌分化程度有关, 并且胰腺癌组织中YAP阳性程度与患者血清CA19-9水平呈正相关. 这些结果提示Hippo-YAP通路可能在胰腺癌的发生、发展中发挥重要作用, 并有可能成为胰腺癌治疗中新的靶点.
胰腺癌的致病因素包括长期大量吸烟、饮酒、饮咖啡者, 糖尿病患者, 慢性胰腺炎患者发病率较高. 也可能与内分泌有关, 以及炎性介质的参与, 癌基因的激活与抑癌基因的失活, 信号通路的异常等. Hippo通路是近年来新发现的信号通路, 近年来研究表明其在肿瘤的发生发展中也起到重要的作用.
陈光, 教授, 吉林大学第一医院消化器官外科; 吴泰璜, 教授, 山东省立医院肝胆外科
研究发现, Hippo信号通路作为近年来新的信号通路, 其与细胞的增殖与凋亡密切相关, 目前Hippo信号通路与肿瘤的相关研究正逐渐成为热点, 而Hippo信号通路与胰腺癌的关系也逐渐引起人们的重视.
目前关于Hippo通路与胃癌、肝癌等均有研究, 而与胰腺癌关系的研究较少, 本实验通过探讨YAP在正常胰腺组织和胰腺癌组织中的表达, 探讨其在胰腺癌发生中的作用.
本实验通过免疫组织化学、RT-PCR等方法研究胰腺癌与Hippo通路的核心组件YAP的关系, 从分子方面研究了胰腺癌的发生发展机制, 为胰腺癌的靶向治疗提供了一定的理论依据.
本研究内容比较重要, 有新颖性.
编辑: 郭鹏 电编:鲁亚静
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 2. | Badouel C, Garg A, McNeill H. Herding Hippos: regulating growth in flies and man. Curr Opin Cell Biol. 2009;21:837-843. [PubMed] [DOI] |
| 3. | Zeng Q, Hong W. The emerging role of the hippo pathway in cell contact inhibition, organ size control, and cancer development in mammals. Cancer Cell. 2008;13:188-192. [PubMed] [DOI] |
| 4. | Li Z, Zhao B, Wang P, Chen F, Dong Z, Yang H, Guan KL, Xu Y. Structural insights into the YAP and TEAD complex. Genes Dev. 2010;24:235-240. [PubMed] [DOI] |
| 5. | Zhao B, Wei X, Li W, Udan RS, Yang Q, Kim J, Xie J, Ikenoue T, Yu J, Li L. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes Dev. 2007;21:2747-2761. [PubMed] [DOI] |
| 6. | Zhang H, Wu S, Xing D. YAP accelerates Aβ(25-35)-induced apoptosis through upregulation of Bax expression by interaction with p73. Apoptosis. 2011;16:808-821. [PubMed] [DOI] |
| 7. | Zender L, Spector MS, Xue W, Flemming P, Cordon-Cardo C, Silke J, Fan ST, Luk JM, Wigler M, Hannon GJ. Identification and validation of oncogenes in liver cancer using an integrative oncogenomic approach. Cell. 2006;125:1253-1267. [PubMed] [DOI] |
| 8. | Xu MZ, Yao TJ, Lee NP, Ng IO, Chan YT, Zender L, Lowe SW, Poon RT, Luk JM. Yes-associated protein is an independent prognostic marker in hepatocellular carcinoma. Cancer. 2009;115:4576-4585. [PubMed] [DOI] |
| 9. | Dong J, Feldmann G, Huang J, Wu S, Zhang N, Comerford SA, Gayyed MF, Anders RA, Maitra A, Pan D. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 2007;130:1120-1133. [PubMed] |
| 10. | Zhou D, Conrad C, Xia F, Park JS, Payer B, Yin Y, Lauwers GY, Thasler W, Lee JT, Avruch J. Mst1 and Mst2 maintain hepatocyte quiescence and suppress hepatocellular carcinoma development through inactivation of the Yap1 oncogene. Cancer Cell. 2009;16:425-438. [PubMed] [DOI] |
| 12. | 魏 文超, 张 翠萍, 张 琪, 王 小玮, 张 红珠, 赵 坤, 田 字彬. Hippo信号通路在胃黏膜癌变过程中的作用. 世界华人消化杂志. 2012;20:3027-3032. [DOI] |
| 13. | Gao T, Zhou D, Yang C, Singh T, Penzo-Méndez A, Maddipati R, Tzatsos A, Bardeesy N, Avruch J, Stanger BZ. Hippo signaling regulates differentiation and maintenance in the exocrine pancreas. Gastroenterology. 2013;144:1543-1553, 1553. e1. [PubMed] [DOI] |
| 14. | Momi N, Kaur S, Ponnusamy MP, Kumar S, Wittel UA, Batra SK. Interplay between smoking-induced genotoxicity and altered signaling in pancreatic carcinogenesis. Carcinogenesis. 2012;33:1617-1628. [PubMed] |
| 15. | Bonelli L, Aste H, Bovo P, Cavallini G, Felder M, Gusmaroli R, Morandini E, Ravelli P, Briglia R, Lombardo L. Exocrine pancreatic cancer, cigarette smoking, and diabetes mellitus: a case-control study in northern Italy. Pancreas. 2003;27:143-149. [PubMed] [DOI] |
| 16. | Pannala R, Basu A, Petersen GM, Chari ST. New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer. Lancet Oncol. 2009;10:88-95. [PubMed] [DOI] |
| 19. | 王 缨, 史 兵伟, 葛 信国. 高能聚焦超声治疗前、后胰腺癌患者血清CEA、CA19-9的变化. 中华物理医学与康复杂志. 2006;28:775-777. |