修回日期: 2013-07-30
接受日期: 2013-09-09
在线出版日期: 2013-10-08
目的: 研究观察胃癌及癌旁组织中Ras蛋白激酶类似物-1(Ras protein activator like 1, RASAL1)和细胞外信号调节激酶(extracellular regulated protein kinases, ERK)的表达情况, 并分析其与胃癌临床病理特征的关系.
方法: 采用免疫组织化学方法检测60例胃癌组织及其对应癌旁组织中RASAL1、ERK以及磷酸化ERK(p-ERK)的表达水平, 并结合胃癌临床病理资料进行分析.
结果: RASAL1在胃癌组织中呈弱表达或者无表达, 而在癌旁组织中呈强阳性表达, 两组间表达差异有统计学意义(秩均数分别为35.84和85.16, P<0.001). ERK在胃癌和癌旁组织中表达无明显差异(秩均数分别为60.68和60.33, P>0.05). p-ERK在胃癌组织中的水平明显高于癌旁组织中的水平, 两组间表达差异有统计学意义(秩均数分别为84.93和36.07, P<0.001), 且RASAL1的表达下降、p-ERK的过度表达与肿瘤大小、分期、浸润深度、分化程度及淋巴结转移明显相关(均P<0.05).
结论: RASAL1低表达和p-ERK过度表达可能与胃癌的发生、发展有关, 而RASAL1可能通过调控ERK的活化, 使之成为p-ERK, 促进胃癌发生及进展.
核心提示: 本文研究发现胃癌组织中Ras蛋白激活物类似物-1(Ras protein activator like 1, RASAL1)呈低表达, 而p-ERK呈高表达,并与临床病理特点相关, 提示RASAL1可能通过参与调节Ras/Raf/MEK/ERK信号传导通路的活性而抑制胃癌的发生发展. 本研究结果将有助于加深理解胃癌发生发展的分子机制, 为胃癌的分子诊断、靶向治疗提供新思路.
引文著录: 赵艳春, 陈洪, 孙林, 邱梅, 陈旭东. RAS蛋白激酶类似物-1和细胞外信号调节激酶在胃癌中的表达及其临床意义. 世界华人消化杂志 2013; 21(28): 2929-2936
Revised: July 30, 2013
Accepted: September 9, 2013
Published online: October 8, 2013
AIM: To investigate the expression of Ras protein activator like 1 (RASAL1) and extracellular regulated protein kinase (ERK) in gastric cancer and to analyze their association with clinicopathological features of gastric cancer.
METHODS: The expression of RASAL1, ERK and phosphorylated ERK (p-ERK) was detected by immunohistochemistry in 60 gastric cancer tissue specimens and matched tumor-adjacent tissue specimens. The association of RASAL1 and ERK expression with clinicopathologic characteristics of gastric cancer was then analyzed.
RESULTS: RASAL1 expression was weak or undetectable in gastric cancer but strong in tumor-adjacent tissue (mean rank score: 35.84 vs 85.16, P < 0.01). No significant difference was observed in ERK expression between gastric cancer and tumor-adjacent tissue (mean rank score: 60.68 vs 60.33, P > 0.05). The expression level of p-ERK in gastric cancer was significantly higher than that in tumor-adjacent tissue (mean rank score: 84.93 vs 36.07, P < 0.0001). Besides, decreased expression of RASAL1 and over-activation of ERK were significantly correlated with tumor size, stage, depth of invasion, grade and lymph node metastasis (all P < 0.05).
CONCLUSION: Low expression of RASAL1 and high expression of p-ERK may be involved in the development and progression of gastric cancer. RASAL1 promotes gastric cancer occurrence and development possibly by regulating the activation of ERK.
- Citation: Zhao YC, Chen H, Sun L, Qiu M, Chen XD. Clinical significance of expression of Ras protein activator like 1 and extracellular regulated protein kinase in gastric cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(28): 2929-2936
- URL: https://www.wjgnet.com/1009-3079/full/v21/i28/2929.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i28.2929
胃癌是最常见的消化系恶性肿瘤之一, 据统计在我国胃癌死亡率居于各种癌症死亡率的首位[1]. 胃癌的发生发展涉及到多基因的改变和多阶段的过程, 但具体发病机制目前尚未完全明确. 近年来, Ras/Raf/MEK/细胞外信号激酶(extracellular regulated protein kinases, ERK)信号通路失调与多种肿瘤的发生发展的关系引起较多关注[2]. ERK是Ras/Raf/MEK/ERK信号传导通路中的关键激酶, 研究表明ERK参与了细胞外信号传递至细胞核的过程, 与细胞的增殖、分化有关, 并参与肿瘤的发生发展[2]. Ras蛋白激活物类似物-1(Ras protein activator like 1, RASAL1)是近年新发现的一个基因, 其编码蛋白可激活Ras GTP酶, 使与Ras P21蛋白结合的GTP转变为GDP, 进而导致Ras P21蛋白失活, 起到调节丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路活性的作用, 从而参与细胞的增殖、分化及凋亡[3,4]. 已有较多研究报道发现RASAL1以及ERK的表达失调参与肿瘤发生发展[2,4,5]. 本研究以胃癌组织及其相应癌旁组织为研究对象, 采用免疫组织化学的方法检测RASAL1、ERK以及p-ERK的表达水平, 并分析其与胃癌发生及进展的关系.
胃癌组织及癌旁组织取自2012-04/2012-12在我院及盐城市第一人民医院确诊为原发性胃癌并行胃癌根治术患者的手术标本( n = 60). 收集所有病例的病理资料和临床资料, 包括年龄、性别、肿瘤大小、分化程度、浸润深度、淋巴结转移及TNM分期等情况. 其中男性44例, 女性16例; 最小年龄49岁, 最大79岁, 平均年龄65.78岁; 有淋巴结转移的患者48例, 无淋巴结转移的患者12例; TNM分期1、2期患者26例, 3、4期患者34例. 所有病例术前未进行任何放疗、化疗及生物靶向治疗. 癌旁标本取自距离胃癌组织边缘5 cm以上的组织, 标本获得后即以40 g/L甲醛固定24 h, 然后取材并以梯度酒精脱水, 再以10%硬脂酸石蜡(65 ℃)透明浸蜡处理8 h, 石蜡包埋; 组织块4 μm厚度组织切片, 载玻片多聚-L-赖氨酸预处理, 捞片后置入烤箱58 ℃-60 ℃ 60 min使切片紧密粘附. ERK、p-ERK及RASAL1一抗购自英国Abcam公司, 为羊抗人多克隆抗体, 使用浓度为1:200. 二抗为兔抗羊单克隆IgG-HRP, 购自南京巴傲得生物科技有限公司.
利用免疫组织化学法(二步法)检测RASAL1、ERK及p-ERK在胃癌组织和癌旁组织的表达水平. 病理组织蜡块经4 μm连续切片、二甲苯脱蜡、将切片浸入0.01 mol/L柠檬酸盐抗原修复缓冲液(pH 6.0)内, 微波炉加热至沸腾后断电, 循环2-3次达到抗原修复目的, 分别做抗RASAL1、ERK及p-ERK免疫组织化学染色. 染色方法按免疫组织化学染色试剂盒(Vector Labs, USA)说明书步骤进行. 在光镜下观察, 以细胞浆或(和)细胞核内出现棕黄色颗粒为阳性. 将细胞染色强度和阳性细胞百分数分为4级, 阳性细胞数<5%记为0分、5%-29%记为1分、30%-75%为2分、>75%为3分. 根据黄色的深浅将无显色评为0分、淡黄色评为1分、桔黄色评为2分、棕黄色评为3分. 将每张切片的染色程度与染色细胞百分率得分相乘作为最后得分. 0-1分为阴性(-), 2-3分为弱阳性(+), 4-6分为中等阳性(++), >6分为强阳性(+++). 所有染色切片由两位高级职称病理医师独立重复阅片.
统计学处理 采用SPSS13.0软件进行统计分析. 计数资料采用频数描述原始数据. 该资料为单向有序R*C资料, 采用非参数秩和检验比较组间差异. P<0.05为差异有统计学意义.
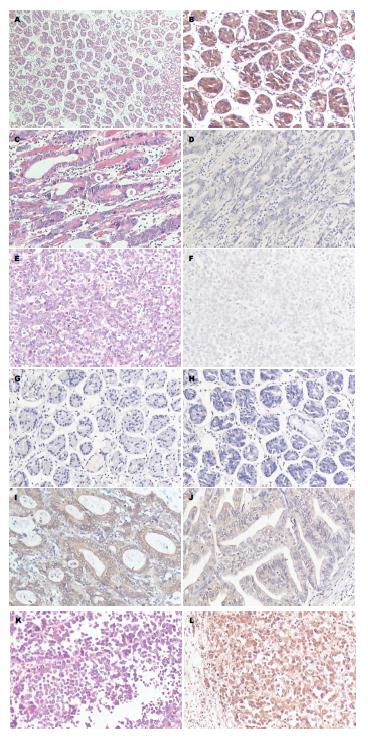
胃癌组织和癌旁组织经HE染色后, 作抗RASAL1、抗ERK以及p-ERK免疫组织化学染色, 统计其表达情况. 结果显示, RASAL1在胃癌组织中呈弱表达或者无表达, 而在癌旁组织中呈强阳性表达; 胃癌组中RASAL1阳性率明显低于癌旁组织中的阳性率, 差异具有统计学意义(P<0.001). 而p-ERK在胃癌组织中的表达水平明显高于癌旁组织中的水平(P<0.001). ERK在胃癌组织与癌旁组织中的表达水平无明显差异(P>0.05)(表1, 图1).
| 表达水平 | 秩均数 | Z值, P值 | |||||
| - | + | ++ | +++ | ||||
| Ras蛋白激活物类似物-1 | 癌组织 | 25 | 28 | 7 | 0 | 35.84 | -8.060, <0.001 |
| 癌旁组织 | 1 | 8 | 30 | 21 | 85.16 | ||
| 细胞外信号激酶 | 癌组织 | 1 | 10 | 29 | 20 | 60.68 | -0.060, 0.952 |
| 癌旁组织 | 2 | 8 | 31 | 19 | 60.33 | ||
| 磷酸化细胞外信号激酶 | 癌组织 | 2 | 8 | 24 | 26 | 84.93 | -7.966, <0.001 |
| 癌旁组织 | 34 | 17 | 9 | 0 | 36.07 | ||
统计结果表明, RASAL1、ERK、p-ERK的表达与年龄、性别均无明显相关(P>0.05). 胃癌组织中RASAL1的表达和肿瘤大小(P<0.01)、分化程度(P<0.05)、浸润深度(P<0.001)、淋巴结转移(P<0.05)、分期(P<0.001)明显相关, 在肿瘤体积大、分化程度低、浸润程度深、有淋巴结转移及TNM分期晚的病例中, RASAL1呈低表达. p-ERK的表达也和肿瘤大小(P<0.05)、分化程度(P<0.01)、浸润深度(P<0.001)、淋巴结转移(P<0.05)、TNM分期(P<0.001)明显相关, 在肿瘤体积大、分化程度低、浸润深、有淋巴结转移及TNM分期晚的病例中, p-ERK呈高表达. 而胃癌组织中ERK的表达与肿瘤大小、浸润深度、淋巴结转移、TNM分期等无明显相关(P>0.05)(表2-4).
| 表达水平 | 秩均数 | Z值, P值 | |||
| - | + | ++ | |||
| 性别 | -0.368, 0.713 | ||||
| 男 | 19 | 20 | 5 | 30.05 | |
| 女 | 6 | 8 | 2 | 31.75 | |
| 年龄(岁) | -0.635, 0.525 | ||||
| ≥60 | 19 | 20 | 7 | 31.22 | |
| <60 | 6 | 8 | 0 | 28.14 | |
| 肿瘤大小(cm) | -3.517, <0.001 | ||||
| <4 | 6 | 18 | 6 | 37.70 | |
| ≥4 | 19 | 10 | 1 | 23.30 | |
| 浸润深度 | -4.115, <0.001 | ||||
| 黏膜层和黏膜下层 | 4 | 15 | 7 | 40.13 | |
| 肌层和浆膜层 | 21 | 13 | 0 | 23.13 | |
| 分化程度 | -2.460, 0.014 | ||||
| 低分化及印戒细胞癌 | 12 | 5 | 1 | 22.81 | |
| 中高分化 | 13 | 23 | 6 | 33.80 | |
| 淋巴结转移 | -2.900, 0.004 | ||||
| 无 | 2 | 5 | 5 | 42.38 | |
| 有 | 23 | 23 | 2 | 27.53 | |
| TNM分期 | -4.115, <0.001 | ||||
| 1、2期 | 4 | 15 | 7 | 40.13 | |
| 3、4期 | 21 | 13 | 0 | 23.13 | |
| 表达水平 | 秩均数 | Z值, P值 | ||||
| - | + | ++ | +++ | |||
| 性别 | -0.344, 0.731 | |||||
| 男 | 1 | 8 | 19 | 16 | 30.07 | |
| 女 | 0 | 2 | 10 | 4 | 31.69 | |
| 年龄(岁) | -0.057, 0.955 | |||||
| ≥60 | 1 | 8 | 22 | 15 | 30.57 | |
| <60 | 0 | 2 | 7 | 5 | 30.29 | |
| 肿瘤大小(cm) | -3.106, 0.002 | |||||
| <4 | 0 | 4 | 18 | 8 | 24.03 | |
| ≥4 | 1 | 6 | 11 | 12 | 36.97 | |
| 浸润深度 | -3.684, <0.001 | |||||
| 黏膜层和黏膜下层 | 0 | 5 | 14 | 7 | 21.73 | |
| 肌层和浆膜层 | 1 | 5 | 15 | 13 | 37.21 | |
| 分化程度 | -2.883, 0.004 | |||||
| 低分化及印戒细胞癌 | 1 | 3 | 8 | 6 | 39.67 | |
| 中高分化 | 0 | 7 | 21 | 14 | 26.57 | |
| 淋巴结转移 | -2.442, 0.015 | |||||
| 无 | 0 | 4 | 5 | 3 | 20.33 | |
| 有 | 1 | 6 | 24 | 17 | 33.04 | |
| TNM分期 | -3.684, <0.001 | |||||
| 1、2期 | 0 | 5 | 14 | 7 | 21.73 | |
| 3、4期 | 1 | 5 | 15 | 13 | 37.21 | |
| 表达水平 | 秩均数 | Z值, P值 | ||||
| - | + | ++ | +++ | |||
| 性别 | -0.239, 0.813 | |||||
| 男 | 1 | 6 | 19 | 18 | 30.80 | |
| 女 | 1 | 2 | 5 | 8 | 29.69 | |
| 年龄(岁) | -0.390, 0.697 | |||||
| ≥60 | 2 | 7 | 16 | 21 | 30.05 | |
| <60 | 0 | 1 | 8 | 5 | 31.96 | |
| 肿瘤大小(cm) | -0.273, 0.785 | |||||
| <4 | 2 | 7 | 13 | 8 | 29.93 | |
| ≥4 | 0 | 1 | 11 | 18 | 31.07 | |
| 浸润深度 | -0.698, 0.485 | |||||
| 黏膜层和黏膜下层 | 2 | 8 | 10 | 6 | 28.85 | |
| 肌层和浆膜层 | 0 | 0 | 14 | 20 | 31.76 | |
| 分化程度 | -0.307, 0.759 | |||||
| 低分化及印戒细胞癌 | 0 | 1 | 4 | 13 | 29.53 | |
| 中高分化 | 2 | 7 | 20 | 13 | 30.92 | |
| 淋巴结转移 | -1.176, 0.240 | |||||
| 无 | 1 | 5 | 3 | 3 | 25.63 | |
| 有 | 1 | 3 | 21 | 23 | 31.72 | |
| TNM分期 | -0.698, 0.485 | |||||
| 1、2期 | 2 | 8 | 10 | 6 | 28.85 | |
| 3、4期 | 0 | 0 | 14 | 20 | 31.76 | |
本研究通过免疫组织化学方法检测了60例胃癌及其相应癌旁组织中RASAL1、ERK以及p-ERK蛋白水平, 发现RASAL1、p-ERK蛋白在胃癌及癌组织中表达有明显的差异, 且两者蛋白表达水平和胃癌的进展相关, ERK在胃癌及癌旁组织中表达无明显差异.
肿瘤的发生发展是一个涉及到多基因的改变和多阶段的过程. 原癌基因及抑癌基因不可逆的积累突变并失调是肿瘤发生的一个重要的分子机制[6]. 其中ras基因是研究十分广泛的原癌基因, 编码Ras蛋白[7], 而ras基因突变、过量表达和多种肿瘤的发生发展密切相关[8-13]. 当Ras蛋白持续活化时, 其能持续激活下游的Raf/MEK/ERK信号传导通路, 造成细胞生长失控、无限制增殖, 进而引起肿瘤的发生[14-17]. 有研究表明Ras蛋白的活性可受Ras蛋白活性调节因子, 如Ras-GTP酶活化蛋白(GTPase activating protein, GAP)调控. Ras GAPs具有GTP酶活性, 能够通过水解作用使Ras蛋白失活. 在ras基因没有突变的情况下, Ras GAPs的功能缺失同样可以使Ras蛋白的过度活化, 进而促进肿瘤的形成和发展[4,18-19]. RASAL1作为Ras GAPs可以通过水解Ras GTP使Ras蛋白失活而发挥肿瘤生长抑制作用[3,20]. 已有研究表明, RASAL1在结直肠癌、肝癌等多种肿瘤中表达下调, 被认为是候选抑癌基因[21,22]. 本课题组既往研究及相关文献也表明RASAL1基因在胃癌细胞株及胃癌组织中表达降低、RASAL1基因可能参与了胃癌的发生发展[22,23-25]. 在本研究中, 我们发现RASAL1蛋白在肿瘤体积大、分化程度低、浸润程度深、有淋巴结转移及TNM分期晚的胃癌病例中RASAL1呈现为低表达, 表明胃癌组织的RASAL1表达和临床病理特征有着明显的相关性.
ERK是MAPK家族中的重要成员, 通过Ras/Raf/MEK/ERK通路磷酸化激活. 活化的ERK(即p-ERK)转移至细胞核内, 可激活下游多种转录因子, 诱导细胞分裂增殖[26]. 大量的研究表明ERK过度活化在细胞恶性转化及演进中起重要作用[27-29]. 本研究发现ERK在胃癌组织中的表达与其在癌旁组织中的表达无明显差异, p-ERK和胃癌可能更为相关. 进一步研究也发现, p-ERK的表达和胃癌的临床病例特征有明显的相关性, 在肿瘤体积大、分化程度低、浸润程度深、有淋巴结转移及TNM分期晚的病例中p-ERK呈现高表达. 我们推测, 可能由于RASAL1的表达降低导致RAS蛋白活性异常上调, 持续激活Ras/Raf/MEK/ERK信号传导通路, 从而使ERK持续活化为p-ERK, 进而调控细胞异常增殖, 血管生成等, 但具体的调控机制尚有待进一步的研究.
本实验提示胃癌组织中RASAL1低表达和p-ERK过度表达可能与胃癌发生、发展有关. 进一步深入研究RASAL1与ERK信号通路的调控机制可能为胃癌的早期诊断、预后判断以及分子靶向治疗提供实验依据.
胃癌的发生发展涉及到多个基因的改变和多阶段的过程, 但具体发病机制目前尚未完全明确. 目前已明确RAS基因家族活性异常增高是人类恶性肿瘤形成的关键因素之一, 围绕RAS基因及其信号传导通路的研究一直是分子肿瘤学的研究热点. Ras蛋白激活物类似物-1(Ras protein activator like 1, RASAL1)是近年新发现的基因,研究发现功能失活与部分肿瘤的发生发展有关, 被认为是候选的抑癌基因.
刘颖斌, 主任医师, 上海交通大学医学院附属新华医院
RASAL1基因编码的蛋白属于RAS GAP1家族, 可负性调控RAS蛋白的活性, 继而参与调控Ras/Raf/MEK/ERK信号通路. 目前已有研究发现RASAL1在胃癌组织中表达异常, 但其与胃癌组织中Ras/Raf/MEK/ERK信号通路失调的关系尚无确切证据.
杨晓薇等发现胃癌组织中RASAL1基因的表达在mRNA水平和蛋白水平均下调, 表达水平与胃癌的恶性程度有一定关系. 夏挺松等检测胃癌组织中RASAL1的表达可反映肿瘤大小、分化程度、浸润深度及有无淋巴结转移, 提示RASAL1基因的低表达与胃癌的发生及进展有密切关系.
本文同时检测胃癌组织和癌旁组织标本中RASAL1及其下游信号分子ERK和p-ERK的表达情况, 结果发现RASAL1和p-ERK在胃癌组织和癌旁组织中的表达有显著差异. 作者从细胞外信号调节通路的角度分析这两种差异的内在联系, 及其在胃癌的发生发展中的意义.
本文发现胃癌组织中RASAL1呈低表达, 而p-ERK呈高表达, 并与胃癌的临床病理特点密切相关, 该研究结果为胃癌的分子靶向治疗提供了潜在新靶点.
本文结论可信, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Chen W, Zheng R, Zhang S, Zhao P, Li G, Wu L, He J. Report of incidence and mortality in China cancer registries, 2009. Chin J Cancer Res. 2013;25:10-21. [PubMed] [DOI] |
| 2. | Santarpia L, Lippman SM, El-Naggar AK. Targeting the MAPK-RAS-RAF signaling pathway in cancer therapy. Expert Opin Ther Targets. 2012;16:103-119. [PubMed] [DOI] |
| 3. | Seto M, Ohta M, Ikenoue T, Sugimoto T, Asaoka Y, Tada M, Mohri D, Kudo Y, Ijichi H, Tateishi K. Reduced expression of RAS protein activator like-1 in gastric cancer. Int J Cancer. 2011;128:1293-1302. [PubMed] [DOI] |
| 4. | Jin H, Wang X, Ying J, Wong AH, Cui Y, Srivastava G, Shen ZY, Li EM, Zhang Q, Jin J. Epigenetic silencing of a Ca(2+)-regulated Ras GTPase-activating protein RASAL defines a new mechanism of Ras activation in human cancers. Proc Natl Acad Sci U S A. 2007;104:12353-12358. [PubMed] [DOI] |
| 5. | Ohta M, Seto M, Ijichi H, Miyabayashi K, Kudo Y, Mohri D, Asaoka Y, Tada M, Tanaka Y, Ikenoue T. Decreased expression of the RAS-GTPase activating protein RASAL1 is associated with colorectal tumor progression. Gastroenterology. 2009;136:206-216. [PubMed] [DOI] |
| 6. | Vogelstein B, Kinzler KW. The multistep nature of cancer. Trends Genet. 1993;9:138-141. [PubMed] [DOI] |
| 7. | Bos JL. ras oncogenes in human cancer: a review. Cancer Res. 1989;49:4682-4689. [PubMed] |
| 8. | Malumbres M, Barbacid M. RAS oncogenes: the first 30 years. Nat Rev Cancer. 2003;3:459-465. [PubMed] [DOI] |
| 9. | Downward J. Targeting RAS signalling pathways in cancer therapy. Nat Rev Cancer. 2003;3:11-22. [PubMed] [DOI] |
| 10. | Nakae K, Mitomi H, Saito T, Takahashi M, Morimoto T, Hidaka Y, Sakamoto N, Yao T, Watanabe S. MUC5AC/β-catenin expression and KRAS gene alteration in laterally spreading colorectal tumors. World J Gastroenterol. 2012;18:5551-5559. [PubMed] [DOI] |
| 11. | Tan C, Du X. KRAS mutation testing in metastatic colorectal cancer. World J Gastroenterol. 2012;18:5171-5180. [PubMed] [DOI] |
| 12. | Brose MS, Volpe P, Feldman M, Kumar M, Rishi I, Gerrero R, Einhorn E, Herlyn M, Minna J, Nicholson A. BRAF and RAS mutations in human lung cancer and melanoma. Cancer Res. 2002;62:6997-7000. [PubMed] |
| 13. | von Lintig FC, Dreilinger AD, Varki NM, Wallace AM, Casteel DE, Boss GR. Ras activation in human breast cancer. Breast Cancer Res Treat. 2000;62:51-62. [PubMed] [DOI] |
| 14. | McCubrey JA, Steelman LS, Chappell WH, Abrams SL, Wong EW, Chang F, Lehmann B, Terrian DM, Milella M, Tafuri A. Roles of the Raf/MEK/ERK pathway in cell growth, malignant transformation and drug resistance. Biochim Biophys Acta. 2007;1773:1263-1284. [PubMed] [DOI] |
| 15. | Roberts PJ, Der CJ. Targeting the Raf-MEK-ERK mitogen-activated protein kinase cascade for the treatment of cancer. Oncogene. 2007;26:3291-3310. [PubMed] [DOI] |
| 16. | Steelman LS, Franklin RA, Abrams SL, Chappell W, Kempf CR, Bäsecke J, Stivala F, Donia M, Fagone P, Nicoletti F. Roles of the Ras/Raf/MEK/ERK pathway in leukemia therapy. Leukemia. 2011;25:1080-1094. [PubMed] [DOI] |
| 17. | Hilger RA, Scheulen ME, Strumberg D. The Ras-Raf-MEK-ERK pathway in the treatment of cancer. Onkologie. 2002;25:511-518. [PubMed] [DOI] |
| 18. | Yarwood S, Bouyoucef-Cherchalli D, Cullen PJ, Kupzig S. The GAP1 family of GTPase-activating proteins: spatial and temporal regulators of small GTPase signalling. Biochem Soc Trans. 2006;34:846-850. [PubMed] [DOI] |
| 19. | Kupzig S, Deaconescu D, Bouyoucef D, Walker SA, Liu Q, Polte CL, Daumke O, Ishizaki T, Lockyer PJ, Wittinghofer A. GAP1 family members constitute bifunctional Ras and Rap GTPase-activating proteins. J Biol Chem. 2006;281:9891-9900. [PubMed] [DOI] |
| 20. | Sot B, Behrmann E, Raunser S, Wittinghofer A. Ras GTPase activating (RasGAP) activity of the dual specificity GAP protein Rasal requires colocalization and C2 domain binding to lipid membranes. Proc Natl Acad Sci U S A. 2013;110:111-116. [PubMed] [DOI] |
| 22. | Qiao F, Su X, Qiu X, Qian D, Peng X, Chen H, Zhao Z, Fan H. Enforced expression of RASAL1 suppresses cell proliferation and the transformation ability of gastric cancer cells. Oncol Rep. 2012;28:1475-1481. [PubMed] [DOI] |
| 25. | Chen H, Yang XW, Zhang H, Yang Q, Wang Z, Liu Y, Lu FL, Zhou BY, Qiu-Xi CH, Lu SL. In vivo and in vitro expression of the RASAL1 gene in human gastric adenocarcinoma and its clinicopathological significance. Oncol Lett. 2012;3:535-540. [PubMed] [DOI] |
| 26. | Pearson G, Robinson F, Beers Gibson T, Xu BE, Karandikar M, Berman K, Cobb MH. Mitogen-activated protein (MAP) kinase pathways: regulation and physiological functions. Endocr Rev. 2001;22:153-183. [PubMed] [DOI] |
| 27. | Feng DY, Zheng H, Tan Y, Cheng RX. Effect of phosphorylation of MAPK and Stat3 and expression of c-fos and c-jun proteins on hepatocarcinogenesis and their clinical significance. World J Gastroenterol. 2001;7:33-36. [PubMed] |
| 28. | Liu Y, Yang Y, Ye YC, Shi QF, Chai K, Tashiro S, Onodera S, Ikejima T. Activation of ERK-p53 and ERK-mediated phosphorylation of Bcl-2 are involved in autophagic cell death induced by the c-Met inhibitor SU11274 in human lung cancer A549 cells. J Pharmacol Sci. 2012;118:423-432. [PubMed] [DOI] |
| 29. | Ravenhall C, Guida E, Harris T, Koutsoubos V, Stewart A. The importance of ERK activity in the regulation of cyclin D1 levels and DNA synthesis in human cultured airway smooth muscle. Br J Pharmacol. 2000;131:17-28. [PubMed] [DOI] |