修回日期: 2013-08-25
接受日期: 2013-09-06
在线出版日期: 2013-10-08
目的: 探讨泛素特异性肽酶22(ubiquitin specific peptidase 22, USP22), 转移相关基因1(metastasis associated gene 1, MTA1)及细胞增殖核抗原(nuclear associated antigen, Ki-67)在人食管鳞癌组织中的表达、与肿瘤生物学行为的关系以及他们三者之间的相关性.
方法: 采用免疫组织化学的方法检测USP22、MTA1及Ki-67在人食管鳞癌组织、癌旁组织及正常组织的表达, 探讨上述三者在不同组织中表达的特点及他们相互之间的相关性.
结果: (1)USP22的阳性表达率: 食管鳞癌组织68.18%, 癌旁组织36.36%, 正常组织15.91%, 两两组间比较, 均P<0.05, 差异均具有统计学意义; USP22蛋白的阳性表达率与肿瘤浸润深度及组织学分级有显著的关系, 而与淋巴结转移、年龄、性别无关; (2)MTA1的阳性表达率: 食管鳞癌组织61.36%, 癌旁组织31.82%, 正常组织6.82%, 两两组间比较, 均P<0.05, 差异均具有统计学意义; MTA1蛋白的阳性表达率与淋巴结转移、肿瘤浸润深度及组织学分级有显著的关系, 而与年龄、性别无关; (3)Ki-67的阳性表达率: 食管鳞癌组织70.45%, 癌旁组织43.18%, 正常组织11.36%, 两两组间比较, 均P<0.05, 差异均具有统计学意义; Ki-67蛋白的阳性表达率与淋巴结转移、肿瘤浸润深度及组织学分级有显著的关系, 而与年龄、性别无关; (4)USP22蛋白的表达与MTA1蛋白的表达呈正相关; USP22蛋白的表达与Ki-67蛋白的表达呈正相关; MTA1蛋白的表达与Ki-67蛋白的表达无相关性.
结论: USP22、MTA1及Ki-67参与食管癌的发生发展、浸润转移, 三者联合检测将有助于食管癌的诊断, 可更准确地判断食管癌的生物学行为, 并有望成为食管癌基因治疗的新靶点.
核心提示: 泛素特异性肽酶22(ubiquitin specific peptidase 22, USP22)、转移相关基因1(metastasis associated gene 1, MTA1)及Ki-67共同参与食管癌的发生发展、浸润转移, USP22与MTA1及Ki-67在肿瘤的形成中有一定程度的协同作用, 三者可作为食管癌潜在的分子标记物, 联合检测可以更准确地判断食管癌的生物学行为, 对食管癌患者的早期诊断及分子靶向治疗具有推动作用.
引文著录: 郑文凤, 李颖霞, 陈奎生, 温洪涛. USP22、MTA1及Ki-67蛋白在食管鳞癌中的表达及相关性. 世界华人消化杂志 2013; 21(28): 2915-2921
Revised: August 25, 2013
Accepted: September 6, 2013
Published online: October 8, 2013
AIM: To investigate the expression of ubiquitin specific peptidase 22 (USP22), metastasis associated gene 1 (MTA1) and nuclear associated antigen (Ki-67) in esophageal squamous cell carcinoma (ESCC) and to analyze their relationship with clinicopathologic features of ESCC.
METHODS: Immunohistochemistry was used to detect the expression of USP22, MTA1 and Ki-67 proteins in ESCC, matched tumor-adjacent tissue and normal esophageal tissue. The correlation between the expression of these proteins and clinicopathologic features of ESCC was analyzed.
RESULTS: The positive rate of USP22 expression in ESCC was significantly higher than that in tumor-adjacent tissue and normal esophageal tissue (68.18% vs 36.36%, 15.91%, both P < 0.05). Expression of USP22 was significantly associated with tumor invasion depth and histological grade, but not with age, sex or lymph node metastasis. The positive rate of MTA1 expression was also significantly higher in ESCC than in tumor-adjacent tissue and normal esophageal tissue (61.36% vs 31.82%, 6.82%, both P < 0.05). MTA1 expression was significantly associated with lymph node metastasis, tumor invasion depth and histological grade, but not with age or sex. The positive rate of Ki-67 expression was also significantly higher in ESCC than in tumor-adjacent tissue and normal esophageal tissue (70.45% vs 43.18%, 11.36%, both P < 0.05). Expression of Ki-67 was significantly associated with lymph node metastasis, tumor invasion depth and histological grade, but not with age or sex. USP22 protein expression was positively correlated with the expression of MTA1 and Ki-67 proteins; however, the expression of MTA1 protein was not significantly correlated with that of Ki-67 protein.
CONCLUSION: USP22, MTA1 and Ki-67 may participate in the occurrence and metastasis of esophageal carcinoma. Combined detection of the expression of these proteins will be helpful to the diagnosis of esophageal carcinoma and accurate determination of the biological behavior of this malignancy. USP22, MTA1 and Ki-67 may become new targets for gene therapy of esophageal carcinoma.
- Citation: Zheng WF, Li YX, Chen KS, Wen HT. Expression of USP22, MTA1 and Ki-67 in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(28): 2915-2921
- URL: https://www.wjgnet.com/1009-3079/full/v21/i28/2915.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i28.2915
食管癌是我国最常见的恶性肿瘤之一, 在某些地区位于发病率和死亡率的首位[1,2]. 多种基因共同参与食管癌的发生发展、浸润转移. 泛素特异性肽酶22(ubiquitin specific peptidase 22, USP22), 定位于人17号染色体上, 由14个外显子组成, 编码525个氨基酸(分子量约60 kDa), 包括半胱氨酸、天冬氨酸、组氨酸、冬氨酸/天冬酰胺, 以及泛素特异性加工酶(ubiquitin-specific processing proteases, UBP)家族去泛素酶的高度保守区域等. USP22具有一个氨基末端的锌指基序, 是介导USP22分子与底物靶蛋白相互作用的结构基础[3]. 去泛素酶在调节蛋白酶体活性、转录调控及肿瘤形成等方面具有重要作用[4]. USP22表达于早期胚胎和成人多种组织, 适度表达于心脏和骨骼肌, 但弱表达于肺和肝脏[5]. 研究发现, USP22参与胚胎发育、调节细胞周期及端粒动态平衡等, 从而参与肿瘤的发生、发展[5-7]. 转移相关基因1(metastasis associated gene 1, MTA1)是Pencil等[8]利用相差杂交技术从鼠乳腺癌细胞13762NF中分离出的, 因与肿瘤转移能力呈正相关, 被命名为MTAl. 应用荧光原位杂交技术发现人MTA1基因位于14号染色体[9], MTA1是通过其蛋白参与信号转导, 直接或间接地作用于某些促进肿瘤浸润、转移的基因, 上调其转录[10]. 细胞增殖核抗原(nuclear associated antigen, Ki-67)是一种核抗原, 1983年由Scholzen等[11]研究Hodgkin淋巴瘤L428细胞系时发现, Ki-67基因位于10号染色体上. Ki-67可以较好地反映细胞的增殖活性, Ki-67蛋白的表达与恶性肿瘤的发展、转移及预后有关[12]. 肿瘤的发生发展、浸润、转移是多步骤, 多阶段的, 涉及多种基因及其产物的表达. 目前, 在食管癌中联合检测USP22、MTA1及Ki-67蛋白的表达尚未见报道, 本研究采用免疫组织化学方法检测USP22、MTA1及Ki-67在食管癌中的表达情况及相互之间的关系, 可能为食管癌患者的早期诊断、分子靶向治疗等带来新的前景.
收集2011-01/2011-12于我院手术切除44例患者的食管癌, 癌旁(距离癌床组织边缘3 cm以内)及正常组织(自手术切缘或癌组织边缘3 cm以外), 上述患者手术之前均未进行放化疗, 靶向治疗及中药等相关治疗, 术后均被病理所证实. 其中男27例, 女17例, 年龄45-82岁, 年龄分层: ≤60岁的22例, >60岁的22例; 组织学分级: 高及高中分化(Ⅰ/Ⅰ-Ⅱ级)15例, 中分化(Ⅱ级)15例, 低及中低分化(Ⅲ/Ⅱ-Ⅲ)14例; 局部淋巴结转移: 无转移19例, 有转移25例; 浸润深度: 浸润全层(突破肌层至外膜)23例, 未浸润全层(未突破肌层)21例. 兔抗人USP22多克隆抗体购于英国Abcam公司, 兔抗人MTA1多克隆抗体购于武汉博士德生物工程有限公司, 兔抗人Ki-67多克隆抗体购于北京中杉金桥生物技术有限公司, SP免疫组织化学染色系列试剂均购于北京中杉金桥生物技术有限公司.
采用SP免疫组织化学染色法进行试验, 所有试验操作步骤均按各自说明书严格进行, 用已知的阳性乳腺癌切片作为阳性对照, 用PBS缓冲液代替一抗作为阴性对照.
USP22及MTA1的结果判定: 阳性细胞总数量≤25%为1分, 26-50%为2分, 51-75%为3分, >75%为4分. 染色强度, 无色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 根据上述两项指标评分乘积进行分级: 0分为阴性(-), 1-2分为弱阳性(+), 3-4分为阳性(++), 大于4分为强阳性(+++). 统计学处理时将分级≥1分归为阳性, 记为"+".
Ki-67的结果判定: 采用相对定量法: 对每张切片随机选取5个高倍镜视野, 每个视野计数200个细胞, 计算阳性细胞占镜下细胞的百分比. 阳性细胞比率<10%为(-), 10%-25%为(+), 26%-50%为(++), >50%为(+++). 统计学处理时将阳性细胞数≥10%归为阳性, 记为"+".
统计学处理 应用SPSSl7.0统计软件进行分析, 各组之间率的比较采用χ2检验, 相关分析采用Spearman检验, 检验水准α = 0.05. P<0.05为差异具有统计学意义.
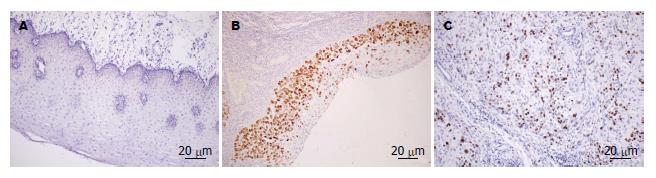
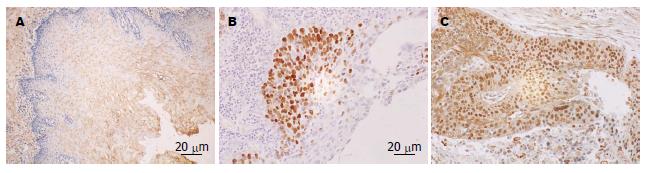
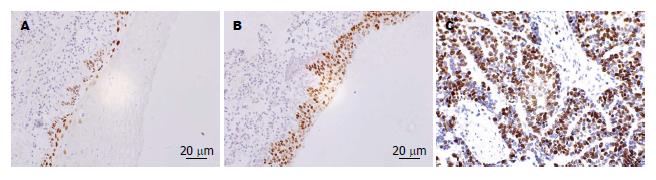
USP22蛋白主要表达于细胞核, 呈棕黄色颗粒; MTA1蛋白阳性染色定位于细胞质和细胞核, 以细胞核为主, 呈棕黄色颗粒; Ki-67蛋白主要在细胞核表达, 部分细胞胞浆也呈阳性反应, 呈棕黄色颗粒(图1-3, 表1).
| 分组 | USP22蛋白 | MTA1蛋白 | Ki-67蛋白 | |||||||||
| - | + | (%) | P值 | - | + | (%) | P值 | - | + | (%) | P值 | |
| 正常组织 | 37 | 7 | 15.91 | <0.05 | 41 | 3 | 6.82 | <0.05 | 39 | 5 | 11.36 | <0.05 |
| 癌旁组织 | 28 | 16 | 36.36 | 30 | 14 | 31.82 | 25 | 19 | 43.18 | |||
| 食管鳞癌 | 14 | 30 | 68.18 | 17 | 27 | 61.36 | 13 | 31 | 70.45 | |||
由表2可知, USP22的表达与肿瘤浸润深度、组织学分级有关, 而与淋巴结转移、年龄及性别无关; MTA1及Ki-67蛋白的表达与淋巴结转移、肿瘤浸润深度、组织学分级有关, 而与年龄、性别无关.
| 分组 | n | USP22蛋白 | MTA1蛋白 | Ki-67蛋白 | |||||||||
| - | + | (%) | P值 | - | + | (%) | P值 | - | + | (%) | P值 | ||
| 年龄 | 0.517 | 0.353 | 0.741 | ||||||||||
| ≤60 | 22 | 8 | 14 | 63.64 | 10 | 12 | 54.55 | 7 | 15 | 68.18 | |||
| >60 | 22 | 6 | 16 | 72.73 | 7 | 15 | 68.18 | 6 | 16 | 72.73 | |||
| 性别 | 0.786 | 0.718 | 0.488 | ||||||||||
| 男 | 27 | 9 | 18 | 66.67 | 11 | 16 | 59.26 | 9 | 18 | 66.67 | |||
| 女 | 17 | 5 | 12 | 70.59 | 6 | 11 | 64.71 | 4 | 13 | 76.47 | |||
| 淋巴结转移 | 0.181 | 0.004 | 0.024 | ||||||||||
| 无 | 19 | 4 | 15 | 78.95 | 12 | 7 | 36.84 | 9 | 10 | 52.63 | |||
| 有 | 25 | 10 | 15 | 60.00 | 5 | 20 | 80.00 | 4 | 21 | 84.00 | |||
| 肿瘤浸润深度 | 0.005 | 0.016 | 0.012 | ||||||||||
| 浸润全层 | 23 | 3 | 20 | 86.96 | 5 | 18 | 78.26 | 3 | 20 | 86.96 | |||
| 未浸润全层 | 21 | 11 | 10 | 47.62 | 12 | 9 | 42.86 | 10 | 11 | 52.38 | |||
| 组织学分级 | 0.019 | 0.013 | 0.043 | ||||||||||
| I/I-II级 | 15 | 13 | 2 | 13.33 | 10 | 5 | 33.33 | 8 | 7 | 46.67 | |||
| II级 | 15 | 9 | 6 | 40.00 | 5 | 10 | 66.67 | 3 | 12 | 80.00 | |||
| III/II-III级 | 14 | 5 | 9 | 64.29a | 2 | 12 | 85.71a | 2 | 12 | 85.71a | |||
食管癌的发生发展是一个由多种因素参与调控的过程, 有多种基因参与肿瘤细胞的增殖、分化及凋亡. 自2008年以来, 国际权威杂志不断发表有关USP22的研究文章, 报道USP22与人转录复合物SAGA(human Spt-Ada-Gcn5-acetyltransferase)的亚单位结合, 促使SAGA乙酰化染色体上的组蛋白(H2A、H2B), 激活基因的转录, 促进细胞由G1/S、G2/M期过渡, 促使肿瘤发生、发展及转移[13]. USP22促进多种肿瘤细胞增殖[14-16]. Lv等[17]通过沉默USP22基因, 下调了USP22的表达, 使细胞停留在G1期, 抑制了膀胱癌细胞的增殖. 降低USP22基因的表达水平, 可抑制胃癌AGS细胞增殖, 阻滞细胞周期[18]. USP22异常高表达使肿瘤细胞增殖调控受到影响, 从而导致肿瘤异常增殖[19]. 本实验结果提示, USP22在正常组织、癌旁组织及食管癌组织中阳性表达率逐渐增加, 差异有显著的统计学意义, 并且与食管癌浸润深度、肿瘤分化程度有关, 与淋巴结转移无关. 本实验检测结果Ⅲ/Ⅱ-Ⅲ级组USP22的表达率高于Ⅰ/Ⅰ-Ⅱ级组, 差异有统计学意义(χ2 = 7.985, P = 0.005), 而Ⅰ/Ⅰ-Ⅱ级组与Ⅱ级组、Ⅱ级组与Ⅲ/Ⅱ-Ⅲ级组间USP22蛋白阳性表达率差异无统计学意义, 可能是由于每组样本量不足的原因, 还需要我们更进一步的探究. 本实验研究提示USP22蛋白的高表达是食管癌发生的机制之一.
核糖体是染色质的结构单位, MTA1被认为是核小体重构及组蛋白脱乙酰基酶复合物的一个亚单位[20]. 乙酰化可以减少基因组DNA与组蛋白的结合, 使染色质结构松散, 有利于DNA的转录. Hofer等[21]研究发现MTA1可以改变细胞内角蛋白丝系统的装配及细胞骨架蛋白的定位, 细胞获得具有转移性和侵袭性的表面粘附分子, 通过相关信号转导, 调控一系列与肿瘤浸润、转移有关蛋白的表达, 使细胞之间粘附力下降, 增加细胞的侵袭及转移能力. 而具体分子机制目前尚未清楚, 还有待于医学界的同胞们进一步探究. 有研究报道, MTA1 mRNA相对量及MTA1蛋白的表达在胃癌组织中显著高于正常胃粘膜组织, 而伴有淋巴结转移的胃癌中MTA1 mRNA的相对量表达明显高于不伴有淋巴结转移的胃癌组织[22]. 在多种恶性肿瘤组织中MTA1过表达与肿瘤的浸润转移密切相关[23,24]. 在胃肠癌和食管癌中, MTA1的过表达与癌浸润的深度、淋巴转移等恶性表型显著相关[25]. 我们实验结果表明MTA1蛋白在食管癌组织中呈高表达, 显著高于癌旁组织及正常组织, 差异有统计学意义, MTA1蛋白的表达与性别、年龄无关, 与淋巴结转移、肿瘤浸润深度及组织学分级呈显著相关性. 由此可知, MTA1基因的异常高表达, 促使肿瘤细胞的浸润及转移.
目前大多数学者认为, 细胞持续增长时, 容易形成肿瘤. Ki-67蛋白是一种与细胞增殖特异性相关的核抗原, G1期开始表达, G2/M期表达最强, M期后递减, G0期不表达[26-28]. 多数研究表明, Ki-67表达能可靠而迅速地反映恶性肿瘤增殖率[29,30]. 本实验研究结果表明, Ki-67在食管癌中高表达, 与癌旁组织及正常组织间的差异有统计学意义, 以胞核染色为主, 阳性细胞主要为基底细胞, 这种现象提示Ki-67与细胞增殖有关. Ki-67蛋白的表达与淋巴结转移、肿瘤浸润深度及组织学分级有关, 而与性别和年龄无关, 与Czyzewska等[31]研究一致. 因此, Ki-67反映细胞的增殖状态, 与细胞增殖的维持相关. Ki-67表达的高低对评价肿瘤细胞的增殖状态、研究肿瘤的生物学行为具有重要意义.
本研究发现USP22与MTA1、Ki-67蛋白的表达均呈正相关, 而MTA1与Ki-67蛋白的表达无相关性. 可能提示在食管癌中MTA1表达的上调激活了USP22基因, 使USP22蛋白高表达. 有关研究报道, USP22在乳腺癌中高表达, 其表达与肿瘤细胞增殖的标志Ki-67表达呈正相关[32]. USP22和Ki-67两者可能相互作用, 共同促进细胞增殖. 在本实验结果中, MTA1与Ki-67蛋白的表达无相关性(P = 0.988), 需进一步实验探讨两者之间有无相互作用. 在食管癌的发生发展中, USP22、MTA1及Ki-67可作为食管癌潜在的分子标记物, 对食管癌患者的早期诊断及分子靶向治疗具有推动作用, 联合检测可以更准确地判断食管癌的生物学行为, 指导临床工作.
食管癌是人类最常见的恶性肿瘤之一, 近年来随着对食管癌发病机制的不断深入研究, 泛素特异性肽酶(USP22)成为研究的热点, 对食管癌的诊断及探索新的有效治疗方式有一定的意义.
张力为, 副教授, 新疆医科大学第一附属医院胸外科
食管癌的发病机制、诊断及靶向治疗越来越受到医学界的关注, 而新的肿瘤标志基因USP22在食管癌中的研究较少, USP22在食管癌发病中的具体机制、与MTA1、Ki-67如何相互作用促进肿瘤形成及浸润转移是目前需要研究的问题.
Ki-67、MTA1蛋白的高表达与肿瘤的分化程度、浸润转移有关, USP22蛋白的高表达与肿瘤的分化程度、浸润深度有关, 与淋巴结转移无关. 在食管癌中USP22、MTA1及Ki-67蛋白表达的相关性未见报道.
本文首次探讨了USP22、MTA1及Ki-67在食管癌中表达的相关关系, 提示在食管癌中MTA1表达的上调激活了USP22基因, 使USP22蛋白高表达; USP22和Ki-67相互作用, 共同促进细胞增殖, 加速肿瘤形成.
本研究发现, USP22与食管癌浸润深度、肿瘤分化程度有关, MTA1及Ki-67与食管癌浸润深度、肿瘤分化程度、淋巴结转移有关; USP22与MTA1、Ki-67表达呈正相关; 联合使用免疫组织化学进行检测, 可考虑作为食管癌早期诊断及评价肿瘤生物学行为的重要指标.
本文探讨USP22、MTA1及Ki-67蛋白在人食管鳞癌组织中的表达、与肿瘤生物学行为的关系及他们三者之间的相关性, 立题较新颖.
编辑: 郭鹏 电编:鲁亚静
| 1. | Yu R, Melmed S. Pituitary tumor transforming gene: an update. Front Horm Res. 2004;32:175-185. [PubMed] |
| 2. | Chen L, Puri R, Lefkowitz EJ, Kakar SS. Identification of the human pituitary tumor transforming gene (hPTTG) family: molecular structure, expression, and chromosomal localization. Gene. 2000;248:41-50. [PubMed] |
| 3. | Zhao Y, Lang G, Ito S, Bonnet J, Metzger E, Sawatsubashi S, Suzuki E, Le Guezennec X, Stunnenberg HG, Krasnov A. A TFTC/STAGA module mediates histone H2A and H2B deubiquitination, coactivates nuclear receptors, and counteracts heterochromatin silencing. Mol Cell. 2008;29:92-101. [PubMed] [DOI] |
| 4. | Shabek N, Ciechanover A. Degradation of ubiquitin: the fate of the cellular reaper. Cell Cycle. 2010;9:523-530. [PubMed] |
| 5. | Lee HJ, Kim MS, Shin JM, Park TJ, Chung HM, Baek KH. The expression patterns of deubiquitinating enzymes, USP22 and Usp22. Gene Expr Patterns. 2006;6:277-284. [PubMed] |
| 6. | Zhang XY, Varthi M, Sykes SM, Phillips C, Warzecha C, Zhu W, Wyce A, Thorne AW, Berger SL, McMahon SB. The putative cancer stem cell marker USP22 is a subunit of the human SAGA complex required for activated transcription and cell-cycle progression. Mol Cell. 2008;29:102-111. [PubMed] [DOI] |
| 7. | Atanassov BS, Evrard YA, Multani AS, Zhang Z, Tora L, Devys D, Chang S, Dent SY. Gcn5 and SAGA regulate shelterin protein turnover and telomere maintenance. Mol Cell. 2009;35:352-364. [PubMed] [DOI] |
| 8. | Pencil SD, Toh Y, Nicolson GL. Candidate metastasis-associated genes of the rat 13762NF mammary adenocarcinoma. Breast Cancer Res Treat. 1993;25:165-174. [PubMed] [DOI] |
| 9. | Cui Q, Takiguchi S, Matsusue K, Toh Y, Yoshida MA. Assignment of the human metastasis-associated gene 1 (MTA1) to human chromosome band 14q32.3 by fluorescence in situ hybridization. Cytogenet Cell Genet. 2001;93:139-140. [PubMed] [DOI] |
| 11. | Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown. J Cell Physiol. 2000;182:311-322. [PubMed] |
| 12. | 蔡 敏, 孔 香云, 王 研, 刘 志艳, 周 志强, 马 榕, 张 庆慧. 乳腺分叶状肿瘤EGFR、Ki-67的表达和意义. 中国现代普通外科进展. 2007;10:247-250. |
| 13. | Zhang XY, Pfeiffer HK, Thorne AW, McMahon SB. USP22, an hSAGA subunit and potential cancer stem cell marker, reverses the polycomb-catalyzed ubiquitylation of histone H2A. Cell Cycle. 2008;7:1522-1524. [PubMed] |
| 14. | Liu YL, Yang YM, Xu H, Dong XS. Aberrant expression of USP22 is associated with liver metastasis and poor prognosis of colorectal cancer. J Surg Oncol. 2011;103:283-289. [PubMed] [DOI] |
| 15. | 熊 建军, 干 丽君, 林 玲, 龚 帧, 吴 周环, 李 卫东. 泛素特异性水解酶ZZ基因RNA干扰真核表达载体的构建及鉴定. 四川大学学报(医学版). 2011;42:166-169. |
| 16. | Luo Y, Zeng FQ, Gu ZH, Wang L, Wang ZY, Jiang GS, Xiao XY. Quantitative analysis of the putative cancer stem cell marker USP22 mRNA in the transitional cell carcinoma of the bladder and the relationship between USP22 and the grading of tumor. J Clin Urol. 2009;24:140-144. [DOI] |
| 17. | Lv L, Xiao XY, Gu ZH, Zeng FQ, Huang LQ, Jiang GS. Silencing USP22 by asymmetric structure of interfering RNA inhibits proliferation and induces cell cycle arrest in bladder cancer cells. Mol Cell Biochem. 2011;346:11-21. [PubMed] [DOI] |
| 20. | Xue Y, Wong J, Moreno GT, Young MK, Côté J, Wang W. NURD, a novel complex with both ATP-dependent chromatin-remodeling and histone deacetylase activities. Mol Cell. 1998;2:851-861. [PubMed] |
| 21. | Hofer MD, Menke A, Genze F, Gierschik P, Giehl K. Expression of MTA1 promotes motility and invasiveness of PANC-1 pancreatic carcinoma cells. Br J Cancer. 2004;90:455-462. [PubMed] |
| 23. | Sasaki H, Moriyama S, Nakashima Y, Kobayashi Y, Yukiue H, Kaji M, Fukai I, Kiriyama M, Yamakawa Y, Fujii Y. Expression of the MTA1 mRNA in advanced lung cancer. Lung Cancer. 2002;35:149-154. [PubMed] |
| 24. | Hofer MD, Kuefer R, Varambally S, Li H, Ma J, Shapiro GI, Gschwend JE, Hautmann RE, Sanda MG, Giehl K. The role of metastasis-associated protein 1 in prostate cancer progression. Cancer Res. 2004;64:825-829. [PubMed] |
| 25. | Toh Y, Ohga T, Endo K, Adachi E, Kusumoto H, Haraguchi M, Okamura T, Nicolson GL. Expression of the metastasis-associated MTA1 protein and its relationship to deacetylation of the histone H4 in esophageal squamous cell carcinomas. Int J Cancer. 2004;110:362-367. [PubMed] |
| 26. | Nicolini A, Carpi A, Tarro G. Biomolecular markers of breast cancer. Front Biosci. 2006;11:1818-1843. [PubMed] |
| 27. | 樊 素珍, 苑 中甫. 宫颈癌组织中Annexin A2和Ki-67蛋白的表达. 郑州大学学报(医学版). 2010;45:81-84. |
| 28. | 南 燕, 李 红雨, 许 雅娟. 宫颈癌组织中TSPAN-1与Ki-67蛋白的表达. 郑州大学学报(医学版). 2010;45:469-471. |
| 29. | Mullerat J, Deroide F, Winslet MC, Perrett CW. Proliferation and p53 expression in anal cancer precursor lesions. Anticancer Res. 2003;23:2995-2999. [PubMed] |
| 30. | Liu M, Lawson G, Delos M, Jamart J, Ide C, Coche E, Weynand B, Desuter G, Hamoir M, Remacle M. Predictive value of the fraction of cancer cells immunolabeled for proliferating cell nuclear antigen or Ki67 in biopsies of head and neck carcinomas to identify lymph node metastasis: comparison with clinical and radiologic examinations. Head Neck. 2003;25:280-288. [PubMed] |
| 31. | Czyzewska J, Guzińska-Ustymowicz K, Lebelt A, Zalewski B, Kemona A. Evaluation of proliferating markers Ki-67, PCNA in gastric cancers. Rocz Akad Med Bialymst. 2004;49 Suppl 1:64-66. [PubMed] |
| 32. | Zhang Y, Yao L, Zhang X, Ji H, Wang L, Sun S, Pang D. Elevated expression of USP22 in correlation with poor prognosis in patients with invasive breast cancer. J Cancer Res Clin Oncol. 2011;137:1245-1253. [PubMed] [DOI] |