修回日期: 2013-09-02
接受日期: 2013-09-09
在线出版日期: 2013-10-08
目的: 探讨骨髓间充质干细胞(mesenchymal stem cells, MSCs)是否具有修复溃疡性结肠炎(ulcerative colitis, UC)大鼠结肠血管内皮的潜能及其对UC大鼠的治疗作用.
方法: 从骨髓中提纯单核细胞, 体外扩增、鉴定为MSCs. 将30只♀大鼠随机分为正常组、模型组、MSCs组, 每组10只. 模型组和MSCs组用三硝基苯磺酸/乙醇复合法局部灌肠法建立大鼠UC模型; 24 h后, 正常组和模型组经尾静脉输入1 mL生理盐水; MSCs组经尾静脉输入1 mL MSCs悬液. 2 wk后留取结肠组织标本. 进行病理学观察; 结肠组织连续切片, 采用荧光原位杂交法结合免疫荧光染色, 观察移植组大鼠结肠组织Y染色体和CD34双阳性细胞的分布情况; 免疫组织化学法检测结肠组织CD34蛋白的表达; RT-PCR技术检测CD34 mRNA的表达; ELISA检测结肠组织中白介素-6(interleukin-6, IL-6)、IL-10含量.
结果: 连续切片可见MSCs组结肠组织可见Y染色体和CD34双阳性细胞. 与正常组比较, 模型组结肠组织中CD34的表达增高(1.629±0.067 vs 1.000±0.113, P<0.05), IL-6的表达增高(238.304 pg/mL±0.019 pg/mL vs 81.439 pg/mL±0.120 pg/mL, P<0.01), IL-10的表达降低(87.531 pg/mL± 0.101 pg/mL vs 289.413 pg/mL±0.039 pg/mL, P<0.01); 与模型组比较, MSCs组结肠组织CD34的表达增高(2.502±0.189 vs 1.629±0.067, P<0.05); IL-6的表达降低(160.95 pg/mL±0.116 pg/mL vs 238.304 pg/mL±0.109 pg/mL, P<0.01), IL-10的表达增高(158.185 pg/mL±0.033 pg/mL vs 87.531 pg/mL±0.115 pg/mL, P<0.01).
结论: MSCs可向结肠血管内皮细胞分化从而促进血管生成, 同时能抑制肠道炎症, 有效地促进UC大鼠结肠黏膜的修复.
© 2013年版权归百世登出版集团有限公
核心提示: 骨髓间充质干细胞(mesenchymal stem cells)对溃疡性结肠炎(ulcerative colitis)有良好的治疗作用, 能够分化为结肠组织黏膜血管内皮细胞, 促进血管内皮修复.
引文著录: 张夏梦, 寿折星, 石月萍, 范恒, 唐庆, 左冬梅, 刘星星. 骨髓间充质干细胞对溃疡性结肠炎大鼠结肠组织血管内皮的修复作用. 世界华人消化杂志 2013; 21(28): 2908-2914
Revised: September 2, 2013
Accepted: September 9, 2013
Published online: October 8, 2013
AIM: To investigate whether bone marrow mesenchymal stem cells (MSCs) can repair colonic vascular endothelium in rats with ulcerative colitis (UC).
METHODS: Monocytes were purified from bone marrow, amplified and identified as MSCs in vitro. Thirty female Wistar rats were randomly and equally divided into three groups: a normal control, a model group and a MSC group. Colitis was induced with trinitro-benzene-sulfonic acid in rats of the model and MSC groups. Rats of the MSC group were injected with 1 mL of MSC suspension via the tail vein, while the rats of the normal control group and model group were injected with equal volume of normal saline. After two weeks, colon tissue samples were analyzed for histopathology, and serial sections of the colon tissue were made for determining the distribution of Y chromosome and CD34 double positive cells. The protein expression of CD34 was detected by immunohistochemisty. The mRNA expression of CD34 was determined by RT-PCR. The contents of interleukin-6 (IL-6) and interleukin-10 (IL-10) in colon tissue were determined by ELISA.
RESULTS: Y chromosome and CD34 double positive cells could be seen in colon tissue of rats injected with MSCs. Compared to the normal control group, the expression of CD34 and IL-6 was increased (1.629 ± 0.067 vs 1.000 ± 0.113, P < 0.05; 238.304 pg/mL ± 0.019 pg/mL vs 81.439 pg/mL ± 0.120 pg/mL, P < 0.01) and the expression of IL-10 was decreased (87.531 pg/mL ± 0.101 pg/mL vs 289.413 pg/mL ± 0.039 pg/mL, P < 0.01) in the model group. Compared to the model group, the expression of CD34 and IL-10 was increased (2.502 ± 0.189 vs 1.629 ± 0.067, P < 0.05; 158.185 pg/mL ± 0.033 pg/mL vs 87.531 pg/mL ± 0.115 pg/mL, P < 0.01) and the expression of IL-6 was decreased (160.95 pg/mL ± 0.116 pg/mL vs 238.304 pg/mL ± 0.109 pg/mL, P < 0.01) in the MSC group.
CONCLUSION: MSCs may exert a therapeutic effect on colitis by differentiating into vascular cell endothelial cells and inhibiting inflammation.
- Citation: Zhang XM, Shou ZX, Shi YP, Fan H, Tang Q, Zuo DM, Liu XX. Bone marrow mesenchymal stem cells repair colonic vascular endothelium in rats with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2013; 21(28): 2908-2914
- URL: https://www.wjgnet.com/1009-3079/full/v21/i28/2908.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i28.2908
溃疡性结肠炎(ulcerative colitis, UC)属于炎症性肠病(inflammatory bowel disease, IBD), 是一类病因尚未完全明确的肠道非特异性炎症性疾病. UC伴随结肠黏膜损伤和肠道炎症, 修复受损肠黏膜、抑制肠道炎症是治疗的关键. 近年来的研究表明, 血管生成在UC结肠黏膜组织修复的过程中具有十分重要的意义[1,2]. 骨髓间充质干细胞(mesenchymal stem cells, MSCs)是一种具有多分化潜能的细胞, 在特定条件下能诱导分化形成各种非造血组织[3-5], 另外还具有很强的免疫调节作用[6-8], 是用于组织工程和细胞治疗的理想细胞. 本实验通过建立大鼠UC模型, 观察MSCs是否能分化为血管内皮细胞从而促进UC大鼠结肠受损部位血管生成, 另外观察其改善肠道炎症的情况, 为MSCs移植治疗UC提供理论和实验依据.
SPF级SD大鼠, 由华中科技大学同济医学院实验动物中心提供[实验动物质量合格证SCKY(鄂)2008-0005, No: 4200696100; 实验动物设施使用证明SYXK(鄂)2010-0057, No: 00116132]. 3-4周龄雄性大鼠5只, 体质量160 g±20 g, 用于制备移植细胞; 6-8周龄♀大鼠30只, 体质量250 g±20 g, 用于制作UC 模型. 2,4,6-三硝基苯磺酸(Sigma, P2297); 大鼠SRY DNA原位荧光杂交染色系统(天津市灏洋生物, RAT2009BIO); 兔抗大鼠CD34单克隆抗体(bioss, bs-0217R); 生物素标记蓖麻凝集素(RCAI, Vector公司); 浓缩型DAB显色剂(bioss, C-0010); TRIzol(Invitrogen公司); 兔抗羊IgG-AP(武汉博士德, BA1011), SABC-Cy3试剂盒(武汉博士德, SA2001); DAPI(Sigma公司, D9564); 逆转录试剂盒(Fermentas); SYBR Green定量PCR试剂盒(Roche公司); 大鼠白介素6(interleukin-6, IL-6) 酶联免疫吸附测定试剂盒、大鼠白介素10(interleukin-10, IL-10)酶联免疫吸附测定试剂盒(伊莱瑞特, E-EL-R0015/E-EL-R0016); 实时荧光定量PCR仪(ABI7900HT); 荧光显微镜带自动照相和数字成像装置(OLYMPUS, BX58).
1.2.1 MSCs的分离、传代与鉴定: ♂大鼠颈椎脱臼法处死, 750 mL/L乙醇浸泡消毒, 无菌取双侧股骨和胫骨, 剔除骨表面的软组织, 于磷酸盐缓冲液(PBS)中剪断两端骨骺, 用PBS(20G针头)反复冲洗骨髓腔, 直到骨髓腔清亮, 去除红细胞, 收集骨髓细胞于15 mL离心管中, 轻拨动试管弹开细胞, 用完全培养基重悬, 转移至25 cm2培养瓶中, 轻轻摇匀, 置于CO2细胞培养箱中培养. 48 h后换新鲜培养基以去除未贴壁的细胞, 以后每隔3 d换一次液, 当贴壁细胞达到80%融合后, 0.25%的胰蛋白酶消化, 以1:3的比例传代培养. 取第3代细胞留用. 取第3代MSC以0.25%胰蛋白酶消化, 室温离心5 min, 弃上清, 以PBS制成单细胞悬液, 每管100 µL, 分别加入荧光标记的CD29、CD90、CD45、CD11b, 4 ℃避光孵育30 min, 加入PBS清洗, 离心后弃上清, 除去未结合的荧光抗体, 加1 mL PBS悬浮上机检测.
1.2.2 UC模型制备及分组: 用三硝基苯磺酸(TNBS)/乙醇复合法[9]局部灌肠法建立溃疡性结肠炎大鼠模型. 在禁食不禁饮24 h条件下, 用10%的水合氯醛每3 mL/kg腹腔注射麻醉, 麻醉后将内径约2 mm的导尿管从肛门缓慢插入约8 cm, 向导尿管内注入500 mL/L的乙醇0.25 mL, 继而注入0.6 mL TNBS, 提起大鼠尾部倒立约30 s, 待清醒后自由进食和饮水. 将30只SD♀大鼠随机分为: 正常组、模型组、MSCs组, 每组10只. 模型组和MSCs组建立大鼠UC模型. 24 h后, 正常组和模型组经尾静脉注入生理盐水1 mL; MSCs组经尾静脉注入1×106个MSCs悬液1 mL. 建立模型后, 观察大鼠日常活动、进食以及腹泻和黏液脓血便情况. 2 wk后, 留取每只大鼠远端结肠组织长约8 cm, 比较各组大鼠结肠组织病理学变化. 取病变明显的结肠组织一部分迅速置于液氮中保存; 另一部分置于10倍标本体积以上的40 g/L甲醛溶液中, 24 h内石蜡包埋并HE染色切片.
1.2.3 荧光原位杂交结合免疫荧光染色: (1)Y染色体DNA荧光原位杂交: 结肠组织连续切片, 常规脱蜡, 置于枸橼酸缓冲液浸泡10 min; 置打孔液中室温10 min, 磷酸盐缓冲液(PBS)冲洗2次, 加500 g/L去离子甲酰胺60 ℃ 1 h, 2×SSC洗1次, 加2 mol/L盐酸室温30 min, PBS冲洗2次, 置90 ℃水浴中加热15 min后迅速置4 ℃冰育液中; 滴加复合消化工作液, 室温10 min; 滴加预杂交工作液覆盖组织37 ℃湿盒孵育6 h, 盖上盖玻片; 滴加杂交工作液覆盖组织37 ℃湿盒孵育10 h; 杂交后洗涤; DAPI复染细胞核, 甲醇DAPI溶液37 ℃孵育组织切片15 min, 甩片, 甘油封片; (2)免疫荧光染色检测CD34表达: 结肠组织连续切片、拷片、脱蜡复水; 抗原修复后, 3% H2O2室温避光下孵育20 min, PBS漂洗3次; 滴加正常山羊血清封闭液, 室温封闭30 min; 滴加兔抗大鼠CD34单克隆抗体, 置于湿盒中, 4 ℃过夜; 滴加生物素化兔抗羊抗体, 37 ℃湿盒孵育30 min; 加SABC-CY3室温30 min(避光); PBS洗3次, 甘油封片; 滴加DAPI避光孵育5 min, 进行核复染; 用含抗荧光淬灭剂的封片液封片, 在荧光显微镜下观察采集图像; (3)各组结肠组织切片按以上步骤处理后, 在荧光显微镜下, FAM激发波长λ = 510 nm, 观察采集位于细胞核内的黄绿色荧光图像. DAPI激发波长λ = 360 nm, 观察采集细胞核内的蓝色荧光图像. CY3激发波长λ = 550 nm, 观察采集位于细胞浆的红色荧光. 应用Image2pro3DS 5.1图像处理软件进行图片扫描、取图、图像叠加.
1.2.4 免疫组织化学SP法检测CD34的表达: 常规脱蜡, 抗原修复后用PBS振荡浸洗3遍, 室温正常山羊血清封闭1 h, 加一抗, 4 ℃湿盒中孵育过夜, 加生物素化二抗, 湿盒中37 ℃孵育30 min, 加SABC复合物, 湿盒中37 ℃孵育30 min, DAB显色, 苏木素复染, 脱水, 透明, 中性树胶封片. 用PBS代替一抗, 同等条件下做阴性对照. 结果判断: CD34阳性表达为细胞质呈棕黄色. 阳性表达细胞计数标准: 每张切片随机选取5个高倍视野(×200), 分别计数200个细胞, 计算阳性细胞百分比.
1.2.5 RT-PCR技术检测CD34的表达: 按照TRIzol试剂盒说明书提取结肠组织细胞总RNA, 逆转录成cDNA. 取2 μL转录产物作模板, 引物序列如下: β-actin f: 5'-CACGATGGAGGGGCCGGACTCATC-3', β-actin r: 5'-TAAAGACCTCTATGCCAACACAGT-3', 扩增长度240 bp; CD34 f: 5'-ACTTCTGTTGCCTCGGAGAA-3', CD34 r: 5'-ACGGTTGGGTAAGTCTGTGG-3', 扩增长度248 bp. 反应条件为: 94 ℃ 4 min; 94 ℃ 30 s, 54 ℃ 30 s, 72 ℃ 25 s; 30个循环, 72 ℃ 4 min, 4 ℃ 4 min. 采用2-△△Ct方法分析各组相对基因表达差异.
1.2.6 ELISA检测结肠组织IL-6、IL-10的表达: 将组织样品称质量, 按组织质量: PBS体积 = 1:9的比例用预冷的PBS将组织样品匀浆, 4 ℃ 10000 r/min离心10 min, 小心吸取上清检测. ELISA实验步骤参照说明书进行, 采用酶标仪测A值.
统计学处理 采用SPSS17.0软件进行统计学数据分析, 计量资料数据以mean±SD表示, 采用单因素方差分析, 两两比较用LSD法, P<0.05为差异有统计学意义.
原代细胞接种24 h后可见散在分布的贴壁细胞, 为短梭形、椭圆形、长梭形; 15 d左右, 细胞的体积亦较刚贴壁时增大, 呈旋涡状排列. 经消化、传代后, 第3代MSCs在24 h内即可完全贴壁、伸展, 呈纺锤状、折光性好(图1). 流式细胞术分析表明第3代MSCs、CD29和CD90均高表达, CD45和CD11b均低表达, 可判定最终培养的细胞为MSCs.
造模后24 h, 正常组大鼠一般状况无明显改变. 其余两组大鼠均出现不同程度的竖毛、喜扎堆、活动迟缓, 并出现稀便和黏液脓血便, 说明大鼠UC造模成功[10]. MSCs组经治疗后大鼠饮食、体质量逐渐增加, 大便次数减少、便血或大便隐血逐渐消失.
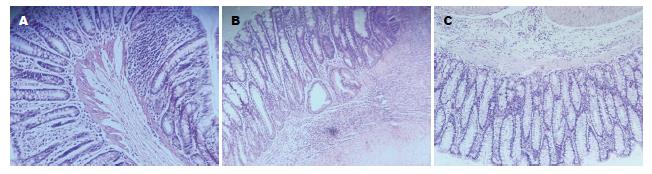
病变结肠组织切片后常规HE染色, 镜下观察可见: 正常组: 结肠组织黏膜结构完整、连续, 腺体排列整齐, 黏膜内血管基质和纤维间质正常; 模型组: 结肠组织黏膜结构异常, 黏膜腺体破坏, 排列不规则, 杯状细胞减少, 黏膜和黏膜下层明显充血水肿, 可见黏膜局灶糜烂和溃疡, 有的溃疡深及黏膜肌层, 在黏膜层及黏膜下层可见大量炎性细胞浸润; MSCs组: 结肠组织黏膜结构尚完整, 黏膜层和黏膜下固有层充血、水肿较轻, 溃疡较浅表, 腺体增生活跃, 杯状细胞增多, 炎性细胞浸润减少(图2).
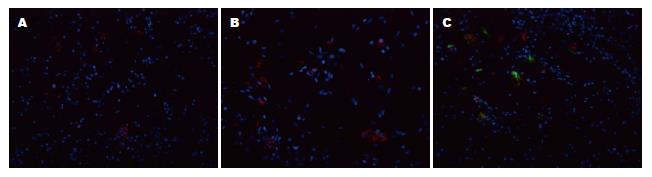
正常组和模型组结肠组织免疫荧光切片可见位于细胞浆的红色荧光, 即CD34阳性, 主要分布在黏膜固有层和黏膜下层的血管内皮细胞中, 未发现细胞核内有黄绿色荧光, 即Y染色体SRY FISH阴性. MSCs移植组结肠组织切片可蓝色荧光的细胞核内有绿色荧光亮点, 即Y染色体SRY FISH阳性表达. 连续切片显示部分Y染色体阳性细胞, 荧光显微镜下可见位于细胞浆的红色荧光, 即Y染色体和CD34双阳性细胞表达. 观察到Y染色体阳性细胞在结肠组织固有层和黏膜下层的血管内皮细胞中均有分布(图3).
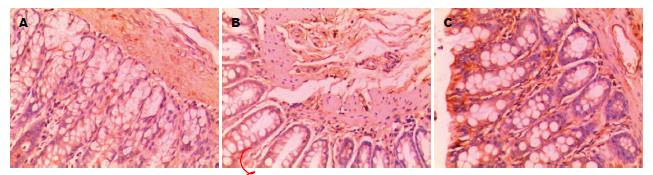
正常组少见CD34阳性表达; 模型组和MSCs组可见CD34阳性表达, 主要见于结肠组织黏膜及黏膜下层的血管内皮细胞中(图4); 模型组和MSCs组CD34表达较正常组增高(P<0.05), MSCs组CD34的表达较模型组增高(P<0.05, 表1).
较正常组, 模型组及MSCs组CD34表达增高(P<0.05); 较模型组, MSCs组CD34表达增高(P<0.05, 表1). 说明结肠损伤后, CD34表达增高, 并提示MSCs能促进CD34的表达.
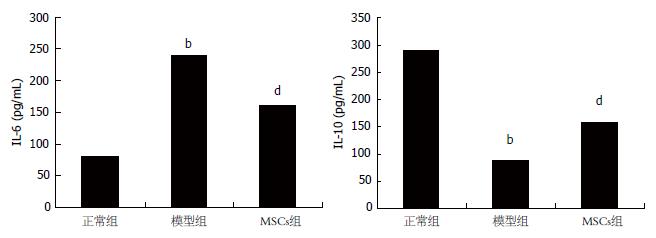
模型组及MSCs组IL-6的水平较正常组显著增高(P<0.01), MSCs组IL-6的水平较模型组显著降低(P<0.01), 提示MSCs能降低UC大鼠结肠组织中IL-6的水平. 模型组及MSCs组IL-10的水平较正常组显著减低(P<0.01), MSCs组中IL-10的水平比模型组显著增高(P<0.01, 图5), 说明MSCs能提高UC大鼠结肠组织中IL-10的水平.
最近研究表明, UC愈合不良与受损结肠微血管功能障碍和内皮屏障缺陷导致组织持续低灌注和缺血密切相关[11]. 损伤的结肠组织需要肉芽组织来修复, 包括沉积的结缔组织基质、成纤维细胞和血管生成, 从而重建结肠黏膜微血管, 提供氧气和营养[12]. 血管生成是UC治疗中的重要部分, 重建血管是溃疡或伤口愈合的关键, 是肉芽组织关键组成部分, 新生的毛细血管和大血管提供氧气和营养, 使纤维母细胞增生, 形成临时疏松肉芽组织[1,13]. 肉芽组织是取代不能再生的细胞如平滑肌细胞(肠道壁最大组成部分)的唯一选择.
MSCs是一群存在于骨髓中的非造血成体干细胞, 具有多向分化的潜能[14,15], 并可向特定的靶器官迁徙、定植, 能分化平滑肌细胞、成骨细胞、软骨细胞、脂肪细胞和内皮细胞[16,17]. MSCs具有内皮细胞的部分表型, MSCs可表达vWF、SH2因子和内皮细胞黏附分子-1, 以上因子均能在内皮细胞上表达且分别与内皮细胞的损伤、游走和活化有关[18,19]. 另外, 在机体组织发生损伤时, MSCs会迁移到损伤部位参与组织的修复[20-22]. 有研究表明, MSC移植到心肌梗死模型中, 可以分化为血管内皮, 使心肌中的毛细血管密度显著增加[23,24]. 说明MSCs具有分化成内皮细胞从而修复损伤结肠的潜能, 关于MSCs移植分化为结肠血管内皮的报道尚比较罕见. CD34是一种高度糖基化跨膜蛋白, 主要存在于幼稚的造血干细胞和造血祖细胞质膜以及内皮细胞的祖细胞表面, 可作为内皮细胞的标志物, 在内皮细胞胞浆中表达. 在MSCs组结肠组织连续切片上发现, 部分Y染色体阳性的细胞中同时可见CD34阳性表达, 说明雄性供体MSCs移植后能定值到受损结肠部位, 并分化成为结肠血管内皮细胞, 促进血管内皮的修复, 从而促进结肠血液动力学的恢复, 使受损的黏膜组织微循环得以重建, 组织血氧供应增加, 进而促进肉芽组织生成, 促进结肠黏膜修复.
根据在炎症反应中的作用可将细胞因子分为促炎因子肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)、IL-6等和抗炎因子IL-10、IL-4等, 这两类细胞因子的失衡与UC的发病密切相关. IL-6在UC的发病过程其重要作用, 其增高是UC发病的主要特征之一[25,26], 其血浆中的浓度与溃疡性结肠炎病变范围和病变严重程度成正相关[27]; IL-10是维持正常肠道黏膜免疫调节与稳定肠道黏膜内环境的重要因子, 在结肠炎的发展和愈合中起重要作用[28,29]. MSCs有很强的免疫调节能力, 可以抑制T细胞增殖、影响树突细胞的成熟及功能、抑制B细胞增殖和分化, 对其他的免疫细胞如NK细胞、巨噬细胞也有免疫调制的作用[30,31]. MSCs移植后结肠组织IL-6表达降低, IL-10表达增高, 说明MSCs能通过调节促炎细胞因子和抑炎细胞因子失衡从而对UC大鼠起治疗作用. 另外, MSCs组炎症水平的降低可能与MSCs治疗后血流动力学恢复从而使促进炎症吸收有关.
总之, 本研究表明MSCs对UC有良好的治疗作用, 能够分化为结肠组织黏膜血管内皮细胞, 促进血管内皮修复, 另外能调节促炎因子IL-6和抑炎因子IL-10的表达, 为MSCs应用于UC的治疗提供了理论依据.
溃疡性结肠炎(ulcerative colitis, UC)被世界卫生组织列为难治性疾病, 寻求新的治疗方法成为当务之急. 骨髓间充质干细胞(mesenchymal stem cells, MSCs)具有很强的分化和免疫调节作用, 有望成为治疗UC新方法.
缪应雷, 主任医师, 昆明医科大学第一附属医院消化内科
目前已有大量实验证明MSCs能在体内外分化为各种非造血组织, 其免疫调节作用也得到广泛认同, 但是其具体的分化机制及免疫调节机制尚不明确, 尚需进一步研究.
有研究表明MSCs移植对UC的修复有明显的促进作用, 可能与其分化、旁分泌、免疫调节能力有关.
关于MSCs治疗UC的研究尚比较少见, 本文通过Y-FISH结合免疫荧光的方法研究MSCs是否能分化为UC结肠血管内皮细胞.
MSCs来源广泛、取材容易, 易于体外培养扩增, 且体内植入排斥反应较弱, 是一种用于细胞治疗的理想细胞. 本文为MSCs用于治疗UC提供了一定的理论依据.
本文设计合理, 方法得当, 结果可信, 结论具有基础研究和临床研究价值.
编辑: 郭鹏 电编:鲁亚静
| 1. | Szabo S, Deng X, Tolstanova G, Khomenko T, Paunovic B, Chen L, Jadus M, Sandor Z. Angiogenic and anti-angiogenic therapy for gastrointestinal ulcers: new challenges for rational therapeutic predictions and drug design. Curr Pharm Des. 2011;17:1633-1642. [PubMed] [DOI] |
| 2. | Tolstanova G, Khomenko T, Deng X, Szabo S, Sandor Z. New molecular mechanisms of the unexpectedly complex role of VEGF in ulcerative colitis. Biochem Biophys Res Commun. 2010;399:613-616. [PubMed] [DOI] |
| 3. | Liu J, Liu C, Sun B, Shi C, Qiao C, Ke X, Liu S, Liu X, Sun H. Differentiation of Rabbit Bone Mesenchymal Stem Cells into Endothelial Cells In Vitro and Promotion of Defective Bone Regeneration In Vivo. Cell Biochem Biophys. 2013; Aug 14. [Epub ahead of print]. [PubMed] |
| 4. | Maxson S, Lopez EA, Yoo D, Danilkovitch-Miagkova A, Leroux MA. Concise review: role of mesenchymal stem cells in wound repair. Stem Cells Transl Med. 2012;1:142-149. [PubMed] [DOI] |
| 5. | Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284:143-147. [PubMed] [DOI] |
| 6. | MacFarlane RJ, Graham SM, Davies PS, Korres N, Tsouchnica H, Heliotis M, Mantalaris A, Tsiridis E. Anti-inflammatory role and immunomodulation of mesenchymal stem cells in systemic joint diseases: potential for treatment. E. xpert Opin Ther Targets. 2013;17:243-254. [PubMed] [DOI] |
| 7. | Kuo YR, Chen CC, Goto S, Lin PY, Wei FC, Chen CL. Mesenchymal stem cells as immunomodulators in a vascularized composite allotransplantation. Clin Dev Immunol. 2012;2012:854846. [PubMed] [DOI] |
| 8. | Auletta JJ, Bartholomew AM, Maziarz RT, Deans RJ, Miller RH, Lazarus HM, Cohen JA. The potential of mesenchymal stromal cells as a novel cellular therapy for multiple sclerosis. Immunotherapy. 2012;4:529-547. [PubMed] [DOI] |
| 9. | Fan H, Shen L, Tang Q, Xiong P, Shou Z, Liao Y, Liang L, Chen X. Effect of Wumeiwan on cytokines TNF-alpha, IL-6, IL-8, IL-10 and expression of NF-kappaBp65 in rats with ulcerative colitis. J Huazhong Univ Sci Technolog Med Sci. 2009;29:650-654. [PubMed] [DOI] |
| 10. | Brenna Ø, Furnes MW, Drozdov I, van Beelen Granlund A, Flatberg A, Sandvik AK, Zwiggelaar RT, Mårvik R, Nordrum IS, Kidd M. Relevance of TNBS-colitis in rats: a methodological study with endoscopic, histologic and Transcriptomic [corrected] characterization and correlation to IBD. PLoS One. 2013;8:e54543. [PubMed] [DOI] |
| 11. | Deng X, Szabo S, Chen L, Paunovic B, Khomenko T, Tolstanova G, Tarnawski AS, Jones MK, Sandor Z. New cell therapy using bone marrow-derived stem cells/endothelial progenitor cells to accelerate neovascularization in healing of experimental ulcerative colitis. Curr Pharm Des. 2011;17:1643-1651. [PubMed] |
| 12. | Van der Sluis M, De Koning BA, De Bruijn AC, Velcich A, Meijerink JP, Van Goudoever JB, Büller HA, Dekker J, Van Seuningen I, Renes IB. Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology. 2006;131:117-129. [PubMed] [DOI] |
| 13. | Danese S, Papa A, Scaldaferri F, Graziani C, Bonizzi M, Armuzzi A, Fedeli G, Gasbarrini G, Gasbarrini A. A novel pathogenic role for microvasculature in inflammatory bowel disease. Eur Rev Med Pharmacol Sci. 2006;10:3-5. [PubMed] |
| 14. | Dawn B, Bolli R. Adult bone marrow-derived cells: regenerative potential, plasticity, and tissue commitment. Basic Res Cardiol. 2005;100:494-503. [PubMed] [DOI] |
| 15. | Grove JE, Bruscia E, Krause DS. Plasticity of bone marrow-derived stem cells. Stem Cells. 2004;22:487-500. [PubMed] [DOI] |
| 16. | Caplan AI. Why are MSCs therapeutic? New data: new insight. J Pathol. 2009;217:318-324. [PubMed] [DOI] |
| 17. | Maul TM, Chew DW, Nieponice A, Vorp DA. Mechanical stimuli differentially control stem cell behavior: morphology, proliferation, and differentiation. Biomech Model Mechanobiol. 2011;10:939-953. [PubMed] [DOI] |
| 18. | Hristov M, Erl W, Weber PC. Endothelial progenitor cells: mobilization, differentiation, and homing. Arterioscler Thromb Vasc Biol. 2003;23:1185-1189. [PubMed] [DOI] |
| 19. | Noseda M, McLean G, Niessen K, Chang L, Pollet I, Montpetit R, Shahidi R, Dorovini-Zis K, Li L, Beckstead B. Notch activation results in phenotypic and functional changes consistent with endothelial-to-mesenchymal transformation. Circ Res. 2004;94:910-917. [PubMed] [DOI] |
| 20. | Wu Y, Wang J, Scott PG, Tredget EE. Bone marrow-derived stem cells in wound healing: a review. Wound Repair Regen. 2007;15 Suppl 1:S18-S26. [PubMed] [DOI] |
| 21. | Ren G, Chen X, Dong F, Li W, Ren X, Zhang Y, Shi Y. Concise review: mesenchymal stem cells and translational medicine: emerging issues. Stem Cells Transl Med. 2012;1:51-58. [PubMed] [DOI] |
| 22. | Mahmood A, Lu D, Lu M, Chopp M. Treatment of traumatic brain injury in adult rats with intravenous administration of human bone marrow stromal cells. Neurosurgery. 2003;53:697-702; discussion 702-703. [PubMed] |
| 23. | Nagaya N, Fujii T, Iwase T, Ohgushi H, Itoh T, Uematsu M, Yamagishi M, Mori H, Kangawa K, Kitamura S. Intravenous administration of mesenchymal stem cells improves cardiac function in rats with acute myocardial infarction through angiogenesis and myogenesis. Am J Physiol Heart Circ Physiol. 2004;287:H2670-H2676. [PubMed] |
| 24. | Nagaya N, Kangawa K, Itoh T, Iwase T, Murakami S, Miyahara Y, Fujii T, Uematsu M, Ohgushi H, Yamagishi M. Transplantation of mesenchymal stem cells improves cardiac function in a rat model of dilated cardiomyopathy. Circulation. 2005;112:1128-1135. [PubMed] [DOI] |
| 25. | Galvez-Llompart M, Del Carmen Recio Iglesias M, Gálvez J, García-Domenech R. Novel potential agents for ulcerative colitis by molecular topology: suppression of IL-6 production in Caco-2 and RAW 264.7 cell lines. Mol Divers. 2013;17:573-593. [PubMed] [DOI] |
| 26. | Hegazy SK, El-Bedewy MM. Effect of probiotics on pro-inflammatory cytokines and NF-kappaB activation in ulcerative colitis. World J Gastroenterol. 2010;16:4145-4151. [PubMed] [DOI] |
| 27. | Atreya R, Neurath MF. Involvement of IL-6 in the pathogenesis of inflammatory bowel disease and colon cancer. Clin Rev Allergy Immunol. 2005;28:187-196. [PubMed] |
| 28. | Bamba S, Lee CY, Brittan M, Preston SL, Direkze NC, Poulsom R, Alison MR, Wright NA, Otto WR. Bone marrow transplantation ameliorates pathology in interleukin-10 knockout colitic mice. J Pathol. 2006;209:265-273. [PubMed] [DOI] |
| 29. | Fischbeck A, Leucht K, Frey-Wagner I, Bentz S, Pesch T, Kellermeier S, Krebs M, Fried M, Rogler G, Hausmann M. Sphingomyelin induces cathepsin D-mediated apoptosis in intestinal epithelial cells and increases inflammation in DSS colitis. Gut. 2011;60:55-65. [PubMed] [DOI] |
| 30. | Yi T, Song SU. Immunomodulatory properties of mesenchymal stem cells and their therapeutic applications. Arch Pharm Res. 2012;35:213-221. [PubMed] [DOI] |
| 31. | Urbán VS, Kiss J, Kovács J, Gócza E, Vas V, Monostori E, Uher F. Mesenchymal stem cells cooperate with bone marrow cells in therapy of diabetes. Stem Cells. 2008;26:244-253. [PubMed] [DOI] |