修回日期: 2013-07-20
接受日期: 2013-07-31
在线出版日期: 2013-09-28
目的: 探讨microRNA-214(miR-214)在结直肠癌(colorectal cancer, CRC)中的表达, 分析其与临床病理特征间的关系, 并观察对SW1116细胞增殖的影响.
方法: 通过Real-time PCR技术检测miR-214在结肠癌细胞株及44例结直肠癌组织、相应切缘无瘤黏膜组织中的表达水平, 分析miR-214的表达与结直肠癌患者临床病理特征的关系. 采用脂质体介导的转染方法将miR-214模拟物转染SW1116; MTS及克隆形成试验检测对细胞增殖的影响.
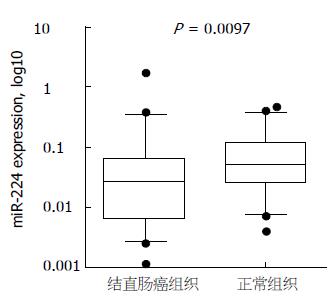
结果: miR-214在77.3%(34/44)的结直肠癌组织中低表达; miR-214在结直肠癌组织和相应切缘无瘤黏膜中的表达水平分别为0.0264(0.0063, 0.0591)和0.0505(0.0250, 0.1122), 结直肠癌组织中表达水平显著低于切缘无瘤黏膜, 差异有统计学意义(Z = -2.591, P = 0.0097). miR-214在黏液癌中的表达水平显著低于非黏液癌(P = 0.0138). 结肠癌细胞株中miR-214的表达普遍下调. SW1116细胞转染miR-214模拟物后, miR-214表达明显增加; miR-214模拟物转染组和阴性对照组相比, 细胞生长减慢, 细胞集落减少, 细胞增殖活力明显受抑制(P<0.01).
结论: miR-214在结直肠癌中低表达, 黏液癌中下调更明显. 上调miR-214表达可抑制结肠癌细胞增殖活性. miR-214可能在结直肠癌的发生发展中发挥抑癌作用.
核心提示: MiR-214在结直肠癌中低表达, 黏液癌中下调更明显. 上调miR-214表达可抑制结肠癌细胞增殖活性. miR-214可能在结直肠癌的发生发展中发挥抑癌作用.
引文著录: 张丽静, 吴晨鹏, 张志勇, 刘博, 樊智彬, 裴永彬, 赵增仁. MicroRNA-214在结直肠癌中的表达及其对细胞增殖的影响. 世界华人消化杂志 2013; 21(27): 2875-2880
Revised: July 20, 2013
Accepted: July 31, 2013
Published online: September 28, 2013
AIM: To assess the clinical significance of expression of microRNA-214 (miR-214) in colorectal cancer (CRC), and to investigate the effect of miR-214 overexpression on SW1116 cell proliferation.
METHODS: Total RNA was extracted from 44 surgical specimens of CRC and matched normal mucosa, as well as from seven colon cancer cell lines. MiR-214 expression was detected by real-time PCR, and its clinical significance was analyzed. MTS assay and colony formation assay were used to assess the effect of miR-214 overexpression on CRC cell proliferation.
RESULTS: MiR-214 expression was down-regulated in 77.3 % (34/44) of tumor tissue specimens. The relative expression level of miR-214 was significantly lower in tumor tissues than in matched normal mucosal tissues (0.0264 vs 0.0505, P = 0.0097). Lower miR-214 level was strongly associated with mucinous cancer (P = 0.0138). The expression of miR-214 in colon cancer cell lines was lower than that in controls. Overexpression of miR-214 inhibited the growth and colony formation of tumor cells (both P < 0.01).
CONCLUSION: MiR-214 expression is down-regulated in CRC, particularly in mucinous cancer. MiR-214 might act as a tumor suppressor through inhibiting cell proliferation.
- Citation: Zhang LJ, Wu CP, Zhang ZY, Liu B, Fan ZB, Pei YB, Zhao ZR. Expression of miR-214 in colorectal cancer and effect of miR-214 overexpression on colorectal cancer cell proliferation. Shijie Huaren Xiaohua Zazhi 2013; 21(27): 2875-2880
- URL: https://www.wjgnet.com/1009-3079/full/v21/i27/2875.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i27.2875
结直肠癌是最常见的恶性肿瘤之一, 其发病率和死亡率均居于恶性肿瘤前列[1]. microRNA(miRNA)为一种单链非编码RNA, 作为调控因子参与了细胞的生长、增殖、分化、凋亡等多种生命过程[2-4]. miRNA失调与肿瘤发生发展关系密切. 研究表明miRNA-214(miR-214)可通过多种机制影响肿瘤的发生发展[5-11]. 目前, miR-214在结直肠癌中的研究鲜有报道. 本研究通过检测miR-214在结直肠癌组织和细胞中的表达, 分析其在结直肠癌发生发展中的作用, 为结直肠癌的发病机制提供新的理论依据.
收集2009-05/2012-05河北医科大学第一医院44例结直肠癌组织标本, 每例标本分别取自结直肠原发肿瘤组织及上(下)切缘正常黏膜且术后病理证实无癌组织侵犯. 离体后迅速置于液氮, 存于-80 ℃备用. 患者年龄31-83岁, 平均64.52岁±13.97岁; 男性25例, 女性19例; 结肠21例, 直肠23例; 未侵及浆膜9例, 侵及浆(外)膜及以外35例; 高分化2例, 中分化35例, 低分化7例; 非黏液癌34例, 黏液癌9例, 资料缺失1例; 无淋巴结转移28例, 有淋巴结转移16例; Dukes分期A期5例, B期22例, C期13例, D期4例. 所有患者术前未接受任何放化疗, 术后经病理证实符合WHO结直肠癌诊断标准. 实验所选用7种结肠癌细胞株(Caco-2、DLD1、HT29、LOVO、SW620、SW480、SW1116)由香港中文大学于君教授转赠. TRIzol试剂购自美国Invirotrogen公司; Real-time PCR试剂盒All-in-One™ miRNA qRT-PCR Detection Kit, U6、miR-214引物, 均购自美国复能基因有限公司; McCoys 5A培养液、DMEM培养液、Leibovitz's L-15培养液、胎牛血清、青链霉素, 均购自美国Gibco公司.
1.2.1 细胞培养: HT-29细胞选用McCoys 5A培养液, SW480、SW620、SW1116细胞选用Leibovitz's L-15培养液, DLD1、LOVO、Caco-2选用DMEM培养液, 培养液均加入10%FBS和1%PEST. 培养条件为37 ℃、5%CO2, 根据生长情况每2-3 d换液1次, 当细胞数达长满培养瓶底部时, 收集细胞.
1.2.2 总RNA的提取: 将约100 mg组织放入研钵研磨, 放入加有1 mL TRIzol的EP管(如在细胞中提取, 将细胞培养瓶中培养液吸净, 加入1 mL TRIzol, 反复吹打然后移入EP管中), 静置5 min, 加氯仿0.2 mL, 混匀静置5 min, 12000 g离心15 min, 吸取上层无色液相, 加入0.5 mL异丙醇, 静置15 min, 12000 g离心15 min, 可见RNA沉淀, 弃上清, 加750 mL/L乙醇1 mL混匀, 7500 g离心5 min, 弃上清, DEPC水溶解. 琼脂糖凝胶电泳检测RNA完整性、分光光度计检测RNA浓度及纯度.
1.2.3 Real-time PCR检测miR-214的表达: 取总RNA 2 μg进行逆转录反应, 反应条件: 37 ℃、60 min, 85 ℃、5 min. 取逆转录产物cDNA 2 μL进行实时定量PCR反应, 反应条件: 95 ℃预变性10 min, 然后按95 ℃、10 s, 60 ℃、30 s, 72 ℃、10 s, 进行40个循环. 以上各步骤中, 反应体系以及试剂用量均严格按照说明书进行. 反应结束, 检测各模板的Ct值. 通过Ct值进行相对定量. miR-214的相对表达量用2-∆∆Ct法计算, 其中∆Ct = CT(miR-214)-CT(U6), 以2-∆∆Ct表示样品中目的基因初始cDNA相对表达量.
1.2.4 miR-214模拟物的转染: 将结肠癌细胞 SW1116细胞接种后24 h, 待贴壁细胞达到40%-50%时进行转染, 参照脂质体转染试剂说明书分别转染miR-214模拟物和阴性对照(NC).
1.2.5 细胞增殖活性的检测: (1)MTS比色法来测定细胞活力: 转染miR-214模拟物组和NC组结肠癌SW1116细胞株, 于转染后24 h , 消化细胞, 按照1000个/孔接种于96孔细胞培养板中, 每孔100 μL培养液, 分别于培养12、24、36、48、60 h按20 μL/孔加入MTS检测试剂, 在培养箱中继续孵育2 h, 490 nm测定吸光度(A)值, 绘制增殖曲线; (2)克隆形成实验: 将各转染组细胞以1×103/mL的浓度接种于6孔板中, 设立3个复孔. 每孔加入2 mL培养液常规培养, 每3 d换液1次. 镜下见细胞克隆中细胞数>50个细胞时, 终止培养. 去除培养液后, PBS清洗1遍, 用结晶紫固定染色1-2 h, 去除结晶紫染料, 用清水洗去多余的染料, 晾干后肉眼进行计数.
统计学处理 应用SPSS13.0软件对数据进行统计分析, 非正态数据以中位数(四分位数间距), 两组间配对样本采用Wilcoxon检验, 独立样本采用Mann-Whitney检验, 正态数据以mean±SD表示, 采用配对t检验, 以P<0.05为差异具有统计学意义.
我们采用Real-time PCR技术检测miR-214的表达, 以U6为内参, 2-∆∆Ct法分析结直肠癌组织相对无瘤正常黏膜组织的相对表达量. miR-214在77.3%( 34/44)的结直肠癌组织中低表达; miR-214在结直肠癌组织和相应切缘无瘤黏膜中的表达水平分别为0.0264(0.0063, 0.0591)和0.0505(0.0250, 0.1122), 结直肠癌组织中表达水平显著低于切缘无瘤黏膜, 差异有统计学意义(Z = -2.591, P = 0.0097)(图1).
miR-214的表达水平与结直肠癌患者的组织学分型密切相关, 即非黏液癌中的表达水平显著高于黏液癌(U = 70, P = 0.0138), 而与性别、年龄、部位、浸润深度、分化程度、淋巴结转移和临床分期无关(均P>0.05)(表1).
| 临床病理特征 | n | miR-214 | P值 |
| 性别 | 0.722 | ||
| 男 | 25 | 0.413(0.144, 1.463) | |
| 女 | 19 | 0.296(0.157, 0.614) | |
| 年龄(岁) | 0.371 | ||
| ≤60 | 14 | 0.418(0.254, 1.016) | |
| >60 | 30 | 0.249(0.137, 1.373) | |
| 肿瘤位置 | 0.121 | ||
| 结肠 | 21 | 0.443(0.177, 2.612) | |
| 直肠 | 23 | 0.226(0.138, 0.992) | |
| 浸润深度 | 0.332 | ||
| 肌层 | 9 | 0.216(0.128, 0.748) | |
| 浆膜层 | 35 | 0.350(0.170, 1.176) | |
| 分化程度 | 0.893 | ||
| 中、高分化 | 37 | 0.296(0.174, 1.155) | |
| 低分化 | 7 | 0.443(0.063, 6.168) | |
| 组织学类型 | 0.0138 | ||
| 非黏液癌 | 34 | 0.418(0.204, 1.373) | |
| 黏液腺癌 | 9 | 0.134(0.047, 0.409) | |
| 淋巴结转移 | 0.502 | ||
| 有 | 28 | 0.571(0.223, 1.119) | |
| 无 | 16 | 0.524(0.193, 1.092) |
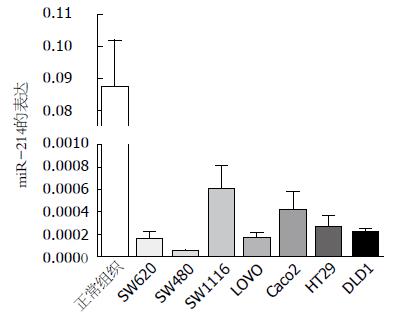
miR-214在结肠癌细胞Caco-2、DLD1、HT29、LOVO、SW620、SW480和SW1116中的表达均明显低于结直肠切缘无瘤黏膜组织(P<0.01)(图2).
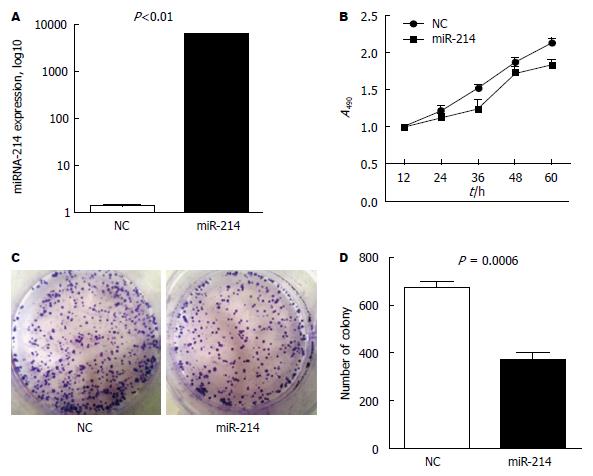
我们选取生长状态及细胞形态较好的SW1116细胞作为研究对象, 将SW1116细胞分别转染miR-214模拟物和阴性对照, 检测miR-214的表达, 结果证实, 转染miR-214模拟物组miR-214的表达水平约是NC对照组的5000倍(图3A). 随后MTS检测结果显示, 转染miR-214模拟物后细胞生长速度较NC对照组明显减慢, 差异有统计学意义(P<0.01)(图3B). 细胞克隆形成实验检测结果发现, 与阴性对照组比较, 经miR-214模拟物处理后SW1116细胞形成的集落数明显减少(图3C, D).
microRNA是一种高度保守的单链非编码RNA, 主要在转录后水平调控基因的表达. miRNA几乎在所有细胞的生物学进程中发挥重要的调控作用, 如细胞增殖、分化、代谢、凋亡和应激等. 人类蛋白质编码基因约1/3受miRNA的调控[12].
最近发现miR-214在肿瘤中作用尤为活跃, 在多种恶性肿瘤中均有异常表达, 但在不同肿瘤中miR-214的表达情况却不尽相同, 具有一定的肿瘤特异性. Huang等[5]研究表明miR-214在食管鳞癌中低表达并与食管鳞癌的病理分级、临床分期和淋巴结转移相关. Shih等[6]发现在肝细胞肝癌中miR-214表达下调与患者的复发和预后差密切相关. 另有学者认为在乳腺癌患者血清中miR-214也存在低表达, 并且与淋巴结转移情况相关[7]. Yang等[8]研究发现miR-214在宫颈癌组织中表达水平明显低于正常组织. 另外一些研究发现, miR-214在某些肿瘤中呈现高表达, 通过促进癌细胞的增殖、增强化疗耐药性发挥癌作用. Zhang等[9]认为miR-214在胰腺癌中高表达, 能促进胰腺癌细胞的生存并够降低癌细胞对GEM的敏感性. Yang等[10]发现miR-214可以促进卵巢癌细胞的存活, 并降低化疗药物顺铂敏感性. 此外, miR-214可以对黑色素瘤细胞的转移和侵袭也具有促进作用[11]. 在本研究中, 我们发现, miR-214在多种结肠癌细胞以及肿瘤组织中的表达水平均显著低于结直肠切缘无瘤黏膜, 随后分析其与临床病理特征的关系发现, 黏液腺癌中miR-214的表达明显降低. 结直肠黏液癌的发生机制、形态学表现及预后等均与非黏液癌显著不同. Song等[13]收集2079例结直肠癌的临床病理及预后进行了回顾性研究, 结果显示同非黏液癌相比, 黏液癌分期更晚, 易发生转移, 预后往往较差. 提示结直肠黏液癌与非黏液癌不仅组织形态不同, 其生物学行为也不同, 二者可能具有不同的肿瘤发生机制. King-Yin Lam等[14]对36例结直肠黏液癌和228例非黏液癌的研究结果相同. 在本研究中, 结直肠黏液癌中miR-214表达水平明显低于非黏液癌, 提示miR-214下调可能与黏液癌的发生密切相关.
miR-214在结直肠癌中表达下调, 可能参与了结直肠癌的发展过程, 然而其调控机制尚不明确. 为了深入了解miR-214在结肠癌发病过程中的具体作用及其对结肠癌细胞生物学行为的影响, 本研究使用化学合成的miR-214模拟物转染结肠癌SW1116细胞, 上调结肠癌细胞中miR-214的表达, 采用平板克隆形成试验, 观察细胞生长情况, 发现miR-214高表达可以减少细胞集落形成, 抑制细胞增殖. 目前, 有多项研究表明miR-214影响了肿瘤细胞的增殖、凋亡、侵袭、转移等生物过程. Huang等[5]研究认为miR-214表达上调可以显著抑制食管鳞状细胞癌细胞Eca109的转移和侵袭能力. 同时有学者研究发现miR-214可以抑制宫颈癌[5]及乳腺癌细胞的侵袭[7].
细胞增殖过程有诸多蛋白参与, 推测miR-214可能直接或间接锚定其中某些蛋白mRNA 3'UTR区, 使蛋白合成抑制或减少, 使细胞周期与细胞增殖活性失调而发生恶性转化. 有研究发现, miR-214可以通过调节P53, 抑制DNA复制而发挥抑制骨髓瘤细胞生长的作用[15]. 肝细胞癌的研究发现, miR-214通过抑制β-catenin途径而发挥抑制细胞生长、侵袭的作用[16,17]. 关于miR-214在结直肠癌中的具体作用机制, 调控的靶基因及参与调节的信号通路仍待进一步研究.
总之, miR-214在结直肠癌中表达下调, miR-214可能通过抑制细胞增殖发挥抑癌作用, 但具体信号通路有待进一步研究.
miRNAs对细胞的增殖、分化和凋亡有重要的调节作用, 他们在正常组织和肿瘤组织中的表达显著不同. 研究发现, miRNA在恶性肿瘤发生发展过程中起了癌基因或抑癌基因的作用.
许剑民, 教授, 上海市复旦大学附属中山医院普外科
研究发现miR-214在多种恶性肿瘤中均有异常表达, 并且可通过多种机制影响肿瘤的发生发展. 目前, miR-214在结直肠癌中的研究鲜有报道. 本研究通过检测miR-214在结直肠癌组织和细胞中的表达, 分析其在结直肠癌发生发展中的作用, 为结直肠癌的发病机制提供新的理论依据.
Huang研究认为miR-214表达上调可以显著抑制食管鳞状细胞癌细胞的转移和侵袭能力. 同时有学者研究发现miR-214可以抑制宫颈癌及乳腺癌细胞的侵袭.
本研究分析了miR-214在结直肠癌及切缘无瘤黏膜组织中的表达, 并分析了和临床病理特征间的关系. 同时通过上调结肠癌细胞中miR-214的表达, 探讨其对肿瘤细胞增殖的影响.
MiR-214在结直肠癌发生发展过程中的作用研究尚处于初级阶段, 对其深入研究有助于了解并探索结直肠癌发生发展机制, 本实验为miR-214用于结直肠癌的靶向治疗提供了初步的理论依据.
本文分析结直肠癌组织中miR-214的表达, 并探讨其与临床病理特征间的关系, 具有一定的临床意义.
编辑: 田滢 电编:鲁亚静
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 2. | 郁 婷婷, 李 硕, 傅 敏根, 曹 日昇, 朱 宏, 施 瑞华. miR-130b在食管鳞癌中的表达及对食管鳞癌细胞增殖和迁移的影响. 世界华人消化杂志. 2013;21:1685-1692. [DOI] |
| 4. | 冷 弘, 臧 文巧, 王 涛, 王 媛媛, 马 晶, 赵 国强. miR-451对食管癌EC9706细胞增殖、凋亡及侵袭能力的影响. 世界华人消化杂志. 2012;20:1323-1327. [DOI] |
| 5. | Huang SD, Yuan Y, Zhuang CW, Li BL, Gong DJ, Wang SG, Zeng ZY, Cheng HZ. MicroRNA-98 and microRNA-214 post-transcriptionally regulate enhancer of zeste homolog 2 and inhibit migration and invasion in human esophageal squamous cell carcinoma. Mol Cancer. 2012;11:51. [PubMed] [DOI] |
| 6. | Shih TC, Tien YJ, Wen CJ, Yeh TS, Yu MC, Huang CH, Lee YS, Yen TC, Hsieh SY. MicroRNA-214 downregulation contributes to tumor angiogenesis by inducing secretion of the hepatoma-derived growth factor in human hepatoma. J Hepatol. 2012;57:584-591. [PubMed] [DOI] |
| 7. | Schwarzenbach H, Milde-Langosch K, Steinbach B, Müller V, Pantel K. Diagnostic potential of PTEN-targeting miR-214 in the blood of breast cancer patients. Breast Cancer Res Treat. 2012;134:933-941. [PubMed] [DOI] |
| 8. | Yang Z, Chen S, Luan X, Li Y, Liu M, Li X, Liu T, Tang H. MicroRNA-214 is aberrantly expressed in cervical cancers and inhibits the growth of HeLa cells. IUBMB Life. 2009;61:1075-1082. [PubMed] [DOI] |
| 9. | Zhang XJ, Ye H, Zeng CW, He B, Zhang H, Chen YQ. Dysregulation of miR-15a and miR-214 in human pancreatic cancer. J Hematol Oncol. 2010;3:46. [PubMed] [DOI] |
| 10. | Yang H, Kong W, He L, Zhao JJ, O'Donnell JD, Wang J, Wenham RM, Coppola D, Kruk PA, Nicosia SV. MicroRNA expression profiling in human ovarian cancer: miR-214 induces cell survival and cisplatin resistance by targeting PTEN. Cancer Res. 2008;68:425-433. [PubMed] [DOI] |
| 11. | Penna E, Orso F, Cimino D, Tenaglia E, Lembo A, Quaglino E, Poliseno L, Haimovic A, Osella-Abate S, De Pittà C. microRNA-214 contributes to melanoma tumour progression through suppression of TFAP2C. EMBO J. 2011;30:1990-2007. [PubMed] [DOI] |
| 12. | Lim LP, Lau NC, Garrett-Engele P, Grimson A, Schelter JM, Castle J, Bartel DP, Linsley PS, Johnson JM. Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs. Nature. 2005;433:769-773. [PubMed] |
| 13. | Song W, Wu SJ, He YL, Cai SR, Zhang CH, Zhang XH, Zhan WH. Clinicopathologic features and survival of patients with colorectal mucinous, signet-ring cell or non-mucinous adenocarcinoma: experience at an institution in southern China. Chin Med J (Engl). 2009;122:1486-1491. [PubMed] |
| 14. | King-Yin Lam A, Ong K, Ho YH. Colorectal mucinous adenocarcinoma: the clinicopathologic features and significance of p16 and p53 expression. Dis Colon Rectum. 2006;49:1275-1283. [PubMed] |
| 15. | Misiewicz-Krzeminska I, Sarasquete ME, Quwaider D, Krzeminski P, Ticona FV, Paíno T, Delgado M, Aires A, Ocio EM, García-Sanz R. Restoration of microRNA-214 expression reduces growth of myeloma cells through positive regulation of P53 and inhibition of DNA replication. Haematologica. 2013;98:640-648. [PubMed] [DOI] |
| 16. | Wang X, Chen J, Li F, Lin Y, Zhang X, Lv Z, Jiang J. MiR-214 inhibits cell growth in hepatocellular carcinoma through suppression of β-catenin. Biochem Biophys Res Commun. 2012;428:525-531. [PubMed] [DOI] |