修回日期: 2013-08-12
接受日期: 2013-09-17
在线出版日期: 2013-09-28
目的: 检测双调蛋白(amphiregulin, AREG)在结直肠癌组织中的表达水平及其启动子区甲基化水平, 分析AREG基因与结直肠癌发生发展的关系, 以探讨其在结直肠癌诊断治疗中的意义.
方法: 采用实时荧光定量聚合酶链反应(qRT-PCR)技术检测基因在145例结直肠癌组织及145例癌旁正常组织中的表达; 甲基化特异性聚合酶链反应(methylation-specific polymerase chain reaction, MSP)技术检测AREG基因启动子区甲基化水平.
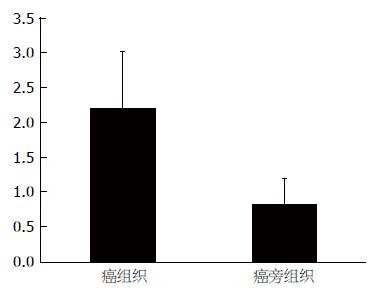
结果: AREG基因在癌组织与正常组织中的相对表达量分别为(2.214±0.802)和(0.834±0.356), 癌组织与正常组织的表达水平差异显著, AREG的高表达与患者年龄及肿瘤的分化程度密切相关(P<0.05). 甲基化特异性PCR结果显示癌组织基因启动子区甲基化发生率(11.7%), 明显低于正常组织甲基化发生率(67.6%).
结论: AREG基因的高表达与结直肠癌患者的年龄及肿瘤细胞分化程度密切相关, 其高表达可能与启动子区去甲基化有关.
核心提示:AREG基因可作为结直肠癌的一个候选检测靶点, 检测AREG基因的表达可作为判断结直肠癌恶性分化程度高低的有价值的指标之一, 进一步明确其作用机制能为结直肠癌治疗提供新的方向.
引文著录: 吴涛, 赵滢, 李丹, 何红梅, 李娜, 张阳, 赵丹. 结直肠癌AREG基因的表达与甲基化水平. 世界华人消化杂志 2013; 21(27): 2870-2874
Revised: August 12, 2013
Accepted: September 17, 2013
Published online: September 28, 2013
AIM: To investigate the expression and promoter methylation of amphiregulin (AREG) in colorectal neoplasms.
METHODS: The expression of AREG mRNA was detected by real-time quantitative reverse transcription-polymerase chain reaction (qRT-PCR) in 145 cases of colorectal neoplasms and matched normal colorectal tissues. The promoter methylation status of AREG in the above specimens was detected using methylation-specific polymerase chain reaction (MSP).
RESULTS: Overexpression of AREG was found in colorectal neoplasms compared with normal colorectal tissues. The rate of AREG gene promoter methylation was significantly lower in colorectal neoplasms than in normal colorectal tissues (11.5% vs 67.7%, P < 0.05).
CONCLUSION: Higher expression of AREG has a significant correlation with patient age and tumor differentiation degree. Promoter demethylation may play an important role in AREG overexpression in colorectal neoplasms.
- Citation: Wu T, Zhao Y, Li D, He HM, Li N, Zhang Y, Zhao DY. Expression and promoter methylation of AREG in colorectal neoplasms. Shijie Huaren Xiaohua Zazhi 2013; 21(27): 2870-2874
- URL: https://www.wjgnet.com/1009-3079/full/v21/i27/2870.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i27.2870
结直肠癌是常见的恶性肿瘤, 近年来由于环境、水源污染以及人们饮食结构的改变等原因, 其发病率逐渐上升[1], 已成为我国发病率增长最快的恶性肿瘤[2]. 结直肠癌治疗预后不佳, 严重影响患者生活质量. 从分子遗传水平探究结直肠癌发病机制, 确定分子治疗靶标已成为现在基础研究工作重点.
双调蛋白(amphiregulin, AREG)基因定位于4号染色体长臂, 所编码双调蛋白是表皮生长因子(epidermal growth factor, EGF)家族的成员[3], 是一种自分泌生长因子, 同时也是星型胶质细胞、雪旺细胞以及成纤维细胞的促分裂素. AREG蛋白参与肿瘤细胞复制、侵袭以及凋亡抑制等过程, 本文探讨AREG基因在结直肠癌中的表达, 并进一步揭示其与肿瘤发生发展的关系.
收集我院胃肠外科2006-01/2012-09外科手术切除的原发性结直肠癌手术标本145例, 其中男性83例, 女性62例, 年龄42-85岁(62岁±10.23岁), 所有病例术前均未行放疗或化疗, 术后经病理确诊, 详细病理资料如表1. 同时收集距肿瘤边缘>5 cm的145例癌旁正常组织作为对照. RNA提取TRIzol试剂为Invitrogen公司产品, RNA提取试剂盒及DNA提取试剂盒均购自天根生化科技公司, 逆转录试剂盒及SYBR premix购自大连TaKaRa公司, 引物序列由上海生物工程有限公司合成; EZ DNA甲基化修饰试剂盒(Zymo Research 美国), 亚硫酸氢盐修饰的通用人类甲基化DNA标准(Bisulfite Converted Universal Methylated Human DNA Standard)(Zymo Research, 美国)用作阳性对照, 以经亚硫酸氢盐修饰的人外周血淋巴细胞DNA作为甲基化阴性对照. qPCR仪(ABI公司 7500 Fast Real-Time PCR系统), 普通PCR仪(ABI公司 2720热循环仪)凝胶成像分析系统(GelDoc-It TS Imaging System UVP公司).
| 病理参数 | n | 病理参数 | n |
| 性别 | 分化程度 | ||
| 男 | 83 | 高分化 | 25 |
| 女 | 62 | 中高分化 | 58 |
| 年龄(岁) | 低中分化 | 62 | |
| <60 | 57 | 转移情况 | |
| ≥60 | 88 | 淋巴结转移 | 52 |
| 肿瘤直径(cm) | 无淋巴结转移 | 93 | |
| <5 | 81 | 远处转移 | 39 |
| ≥5 | 64 | 无远处转移 | 106 |
1.2.1 组织RNA及DNA提取: 依照试剂盒操作步骤进行RNA及DNA的提取, 提取过程中防止样品的污染和降解, RNA提取全程在冰上操作, 提取样品于-80 ℃保存, DNA样品于-20 ℃保存, 通过紫外分光光度仪测定所提取核酸浓度和纯度.
1.2.2 逆转录及定量PCR: 本实验采用比较Ct值的相对定量法, 以GAPDH为管家基因, 应用2-∆∆Ct进行分析. 定量PCR反应体系(25 μL): SYBR premix(2×)12.5 μL, 目的基因上、下游引物各0.5 μL, cDNA模板2.0 μL, ddH2O 9.5 μL, 反应条件: 95 ℃预变性5 min, 95 ℃ 15 s, 59 ℃ 30 s, 72 ℃ 30 s, 40个循环.
1.2.3 甲基化特异性聚合酶链反应(methylation-specific polymerase chain reaction, MSP): EZ甲基化修饰试剂盒对500 ng组织DNA行亚硫酸氢盐修饰, 修饰后的DNA样本洗脱后立即使用或-80 ℃保存待用. MSP参照Herman等[4]方法, 每个MSP反应需20 ng修饰的DNA样本作为模板, 引物序列如表2, 反应体系(20 μL): 10 μL Hot Start PCR Master Mix, 20 ng DNA模板, 上下游引物各10 pmol. 反应条件: 95 ℃变性1 min, 62 ℃退火1 min, 72 ℃延伸1 min. 每例样品设3个对照: 甲基化阳性、阴性对照以及水作为空白对照. 取8 μL扩增产物于2%含溴化乙锭琼脂糖凝胶上电泳, 紫外光下凝胶拍照, 分析.
| 引物名称 | 上游引物 | 下游引物 | Tm(℃) |
| AREG(RT) | TGGATTGGACCTCAATGACA | AGCCAGGTATTTGTGGTTCG | 59.5 |
| GAPDH | GAGTCAACGGATTTGGTCGT | TTGATTTTGGAGGGATCTCG | 60 |
| AREG(MSP) | |||
| AREG-M | CGGCGTATATTTTCGGTTTTTATTC | GTCTCGATCTCTAAAACAACTCGAT | 62 |
| AREG-U | GAGAGTGGTGTATATTTTTGGTTTTTATTT | ATCTCAATCTCTAAAACAACTCAAT | 62 |
统计学处理 应用SPSS16.0统计软件, 计数资料用百分比表示, 计量资料以mean±SD表示, 组间比较采用χ2检验, P<0.05为差异有统计学意义.
AREG基因与管家基因扩增产物特异, 无引物二聚体或其他非特异性产物, 根据2-∆∆Ct方法进行计算得出, AREG在结直肠癌组织和正常组织中的相对表达量分别为2.214±0.802和0.834±0.356, 差异具有统计学意义(P<0.05, 图1).
结直肠癌145例患者AREG表达水平与肿瘤病理参数分析结果显示, 基因的高表达与患者年龄及肿瘤分化水平密切相关, 具有统计学意义(P<0.05)(表3).
| 病理参数 | n | AREG表达量 | P值 |
| 年龄(岁) | 0.034 | ||
| <60 | 57 | 1.873±0.973 | |
| ≥60 | 88 | 2.842±1.212 | |
| 分化程度 | 0.021 | ||
| 高分化 | 25 | 3.023±1.423 | |
| 中高分化 | 58 | 2.634±1.103 | |
| 低中分化 | 62 | 1.843±1.434 |
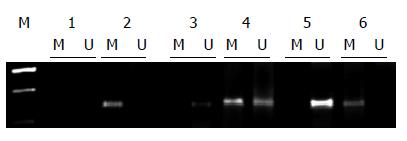
癌旁正常组织共有98例出现甲基化, 占67.6%, 结直肠癌患者组甲基化17例, 占11.7%. 正常组与患者组差异具统计学意义(表4, 图2).
| 甲基化 | 非甲基化 | P值 | |||
| n(%) | 表达量 | n(%) | 表达量 | ||
| 癌组织 | 17(11.7) | 1.232±0.984 | 128(88.3) | 2.475±1.257 | 0.031 |
| 癌旁正常组织 | 98(67.6) | 1.326±1.034 | 47(32.4) | 2.501±1.385 | 0.027 |
依据启动子区甲基化情况将癌组织及癌旁正常组织再次进行分组, 分为甲基化组和非甲基化组, 研究其表达情况(表4), 癌组织及癌旁正常组织分析结果均显示, 甲基化水平与基因表达具有相关性(P<0.05).
随着分子遗传学理论的发展及分子生物学检测手段的进步, 人们对恶性肿瘤的发生发展有了更深层次的认识. 染色体畸形, 癌基因突变或扩增激活, 抑癌基因失活等一系列改变在肿瘤形成发展过程中起到了非常重要的作用[5,6]. 外界环境因素以及体内大量微效基因的共同作用组成了结直肠癌的形成机制.
AREG基因定位于人类4号染色体长臂, 编码双调蛋白是表皮生长因子EGF家族成员之一. 研究发现, AREG基因在肿瘤组织中高表达, 而在正常组织中低表达甚至不表达[7,8]. AREG被认为是一种双官能的生长调节糖蛋白, 可以激活成纤维细胞的增殖, 同时又能抑制神经母细胞瘤和其他腺瘤细胞系的生长[9]. 在不同的生物学条件下, AREG既可以激活肺癌的增殖又可以抑制肺癌细胞的增殖[10]. 目前未见AREG基因表达及表观遗传学改变与结直肠癌相关性方面的报道, 本研究从表达及甲基化水平初步阐释AREG基因与结直肠癌的关系.
表观遗传学不涉及遗传物质一级结构即核苷酸序列的改变, 常见的表观遗传学改变如甲基化通过对基因启动子区CpG岛的修饰, 从而达到调节基因表达的目的, 大量研究表明, 甲基化在肿瘤发生发展过程中发挥重要作用[11]. 研究发现, 相关基因的甲基化在结直肠癌发生发展中起到重要作用[12,13].
本研究对比了结直肠癌患者组和癌旁正常组织的AREG基因表达情况, 结果显示患者组的AREG基因表达水平明显高于癌旁正常组织, 差异具统计学意义, 本研究结果与研究者在其他肿瘤中所得出结果相一致[14-16]. 更高的年龄和肿瘤细胞分化程度的患者, 其表达水平相应也更高, 说明AREG基因在结直肠癌中与肿瘤的增殖、分化有着密切的关系, 其作用机制可能包括产生细胞增殖信号, 激活细胞无限增殖潜力, 增加肿瘤细胞组织侵袭力和转移能力以及血管生成, 抑制细胞凋亡等方面.
甲基化水平研究结果提示, 启动子区的去甲基化可能是AREG基因高表达的一个重要原因, 可能存在上游调节因子影响基因的甲基化水平, 去甲基化原因可作为后续研究来阐明AREG基因作用机制.
总之, AREG基因可作为结直肠癌的一个候选检测靶点, 检测AREG基因的表达可作为判断结直肠癌恶性分化程度高低的有价值的指标之一, 进一步明确其作用机制能为结直肠癌治疗提供新的方向.
结直肠癌是常见的恶性肿瘤, 近年来由于环境、水源污染以及人们饮食结构的改变等原因, 其发病率逐渐上升, 已成为我国发病率增长最快的恶性肿瘤. 结直肠癌治疗预后不佳, 严重影响患者生活质量. 从分子遗传水平探究结直肠癌发病机制, 确定分子治疗靶标已成为现在基础研究工作重点.
陆云飞, 教授, 广西医科大学第一附属医院
本文对比了结直肠癌患者组和癌旁正常组织的AREG基因表达情况, 结果显示患者组的AREG基因表达水平明显高于癌旁正常组织.
本文研究设计合理, 实验方法规范, 结果可信, 对了解AREG基因与结直肠癌的关系具有一定参考意义.
编辑: 田滢 电编:鲁亚静
| 1. | Yeoh KG, Ho KY, Chiu HM, Zhu F, Ching JY, Wu DC, Matsuda T, Byeon JS, Lee SK, Goh KL. The Asia-Pacific Colorectal Screening score: a validated tool that stratifies risk for colorectal advanced neoplasia in asymptomatic Asian subjects. Gut. 2011;60:1236-1241. [PubMed] [DOI] |
| 2. | Yang L, Parkin DM, Li L, Chen Y. Time trends in cancer mortality in China: 1987-1999. Int J Cancer. 2003;106:771-783. [PubMed] |
| 3. | Ohchi T, Akagi Y, Kinugasa T, Kakuma T, Kawahara A, Sasatomi T, Gotanda Y, Yamaguchi K, Tanaka N, Ishibashi Y. Amphiregulin is a prognostic factor in colorectal cancer. Anticancer Res. 2012;32:2315-2321. [PubMed] |
| 4. | Herman JG, Graff JR, Myöhänen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci U S A. 1996;93:9821-9826. [PubMed] |
| 5. | Downing JR. Cancer genomes--continuing progress. N Engl J Med. 2009;361:1111-1112. [PubMed] [DOI] |
| 6. | Pollard PJ, Ratcliffe PJ. Cancer. Puzzling patterns of predisposition. Science. 2009;324:192-194. [PubMed] [DOI] |
| 7. | Castillo J, Erroba E, Perugorría MJ, Santamaría M, Lee DC, Prieto J, Avila MA, Berasain C. Amphiregulin contributes to the transformed phenotype of human hepatocellular carcinoma cells. Cancer Res. 2006;66:6129-6138. [PubMed] |
| 8. | Plowman GD, Green JM, McDonald VL, Neubauer MG, Disteche CM, Todaro GJ, Shoyab M. The amphiregulin gene encodes a novel epidermal growth factor-related protein with tumor-inhibitory activity. Mol Cell Biol. 1990;10:1969-1981. [PubMed] |
| 9. | Shoyab M, McDonald VL, Bradley JG, Todaro GJ. Amphiregulin: a bifunctional growth-modulating glycoprotein produced by the phorbol 12-myristate 13-acetate-treated human breast adenocarcinoma cell line MCF-7. Proc Natl Acad Sci U S A. 1988;85:6528-6532. [PubMed] |
| 10. | Mallakin A, Sugiyama T, Kai F, Taneja P, Kendig RD, Frazier DP, Maglic D, Matise LA, Willingham MC, Inoue K. The Arf-inducing transcription factor Dmp1 encodes a transcriptional activator of amphiregulin, thrombospondin-1, JunB and Egr1. Int J Cancer. 2010;126:1403-1416. [PubMed] [DOI] |
| 11. | Suvà ML, Riggi N, Bernstein BE. Epigenetic reprogramming in cancer. Science. 2013;339:1567-1570. [PubMed] [DOI] |
| 12. | Prabhu JS, Korlimarla A, Banerjee A, Wani S, K P, Sahoo R. Gene-specific methylation: potential markers for colorectal cancer. Int J Biol Markers. 2009;24:57-62. [PubMed] |
| 13. | Liu Y, Tham CK, Ong SY, Ho KS, Lim JF, Chew MH, Lim CK, Zhao Y, Tang CL, Eu KW. Serum methylation levels of TAC1. SEPT9 and EYA4 as diagnostic markers for early colorectal cancers: a pilot study. Biomarkers. 2013;18:399-405. [PubMed] [DOI] |
| 14. | Busser B, Sancey L, Josserand V, Niang C, Favrot MC, Coll JL, Hurbin A. Amphiregulin promotes BAX inhibition and resistance to gefitinib in non-small-cell lung cancers. Mol Ther. 2010;18:528-535. [PubMed] [DOI] |
| 15. | Ahn EY, Kim JS, Kim GJ, Park YN. RASSF1A-mediated regulation of AREG via the Hippo pathway in hepatocellular carcinoma. Mol Cancer Res. 2013;11:748-758. [PubMed] [DOI] |
| 16. | Tinhofer I, Klinghammer K, Weichert W, Knödler M, Stenzinger A, Gauler T, Budach V, Keilholz U. Expression of amphiregulin and EGFRvIII affect outcome of patients with squamous cell carcinoma of the head and neck receiving cetuximab-docetaxel treatment. Clin Cancer Res. 2011;17:5197-5204. [PubMed] [DOI] |