修回日期: 2013-07-21
接受日期: 2013-07-31
在线出版日期: 2013-09-28
目的: 检测RhoGTP酶解离抑制蛋白2(RhoGTPase dissociation inhibitor 2, RHOGDI2)在胃癌患者中的表达状况, 并评价其与胃癌临床病理特征的相关性, 评估RhoGDI2在胃癌侵袭转移中的临床意义.
方法: 采用免疫组织化学技术检测103例胃癌标本中RhoGDI2的表达.
结果: RhoGDI2阳性表达细胞为肿瘤细胞, 主要位于胞浆或胞核. RhoGDI2在胃癌组织表达率为72.82%(75/103), 在非癌胃组织(病理结果示"黏膜呈轻度慢性炎症改变"或"正常胃黏膜表现")中无表达(0/21), 差异有统计学意义(χ2 = 38.70, P<0.05); 低分化型胃癌组显著高于高-中分化型胃癌组(χ2 = 6.37, P<0.05); 随浸润深度(分别浸润至黏膜层、黏膜下层、肌层、浆膜层)增加, RhoGDI2的表达率增加(χ2 = 21.64, P<0.05); 淋巴结转移组显著高于无转移组(χ2 = 54.50, P<0.05); 远处转移组显著高于无转移组(χ2 = 19.81, P<0.05); 临床分期Ⅲ+Ⅳ期组明显高于Ⅰ+Ⅱ期组(χ2 = 24.90, P<0.05). RhoGDI2表达与性别、年龄(<60岁或≥60岁)、肿瘤部位(贲门胃底、胃体、胃角、胃窦)、原发灶大小(直径<5 cm或≥5 cm)无相关性(P>0.05).
结论: 在胃癌组织RhoGDI2的表达与胃癌侵袭转移病理特征密切相关. RhoGDI2可能参与调节胃癌的侵袭转移的过程.
核心提示: RhoGTP酶解离抑制蛋白2(RhoGTPase dissociation inhibitor 2, RhoGDI2)蛋白在大多数胃癌组织中的表达水平均较在胃正常黏膜组织中升高, 且与临床病理特征(胃癌分化程度、浸润深度、淋巴结转移、远处转移和TNM分期)密切相关. 提示RhoGDI2可能有促进胃癌侵袭和转移的作用.
引文著录: 石干, 田德安, 何星星, 廖家智. RhoGDI2在胃癌中的原位表达及与临床病理特征的相关性. 世界华人消化杂志 2013; 21(27): 2832-2837
Revised: July 21, 2013
Accepted: July 31, 2013
Published online: September 28, 2013
AIM: To detect the expression of RhoGTPase dissociation inhibitor 2 (RhoGDI2) in gastric cancer, and to assess its correlation with clinicopathological characteristic of gastric cancer.
METHODS: Immunohistochemistry was used to detect the expression of RhoGDI2 in 103 gastric cancer specimens.
RESULTS: RhoGDI2 was expressed mainly in the cytoplasm or the nucleus. The positive rate of RhoGDI2 protein expression was significantly higher in gastric cancer than in normal gastric tissue (72.82% vs 0.00%, χ2 = 38.70, P < 0.05). The expression of RhoGDI2 protein was significantly correlated with tumor differentiation, invasion, lymph node metastasis, distant metastasis and stage (χ2 = 6.37, 21.64, 54.50, 19.81, 24.90, all P < 0.05), but not with gender, age, tumor location or size.
CONCLUSION: The expression of RhoGDI2 is closely related to the invasion and metastasis of gastric cancer.
- Citation: Shi G, Tian DA, He XX, Liao JZ. Clinicopathological significance of expression of RhoGDI2 in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(27): 2832-2837
- URL: https://www.wjgnet.com/1009-3079/full/v21/i27/2832.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i27.2832
胃癌是消化系最多见的恶性肿瘤, 肿瘤转移则是致使胃癌患者死亡的主要原因, 研究导致胃癌发生侵袭和转移的相关基因具有重要意义. RhoGTP酶解离抑制蛋白2(RhoGTPase dissociation inhibitor 2, RhoGDI2)属于RhoGDI家族成员, 能使Rho家族GTP酶的活性下调, 是近年来发现的一种肿瘤转移抑制基因. 众多研究表明, 在不同类型的肿瘤以及同类肿瘤的不同研究层面, RhoGDI2表达水平的变化趋势不尽相同, 也发挥着不同的功能: 促进或抑制肿瘤的侵袭和转移[1]. 目前国内外文献甚少有RhoGDI2蛋白在胃癌组织中的表达及其与临床病理特征相关性的研究报道. 本研究用免疫组织化学方法检测103例胃癌组织中的RhoGDI2蛋白表达情况, 并分析其与临床病理特征的关系, 为胃癌的诊断及预后评估提供参考依据.
共有103例胃癌病例入组, 均来源于2011-06/2012-06武汉同济医院的住院患者, 经消化内镜中心胃镜活检获取. 统计其性别、年龄、肿瘤位置、原发灶直径和组织学分级等资料, 记录其住院病历诊疗资料、后续胃癌手术术中所见、临床分期(肿瘤浸润深度、有无淋巴结转移及远处转移)并进行统计分析. 胃镜检查活检前所有患者均未行放化疗. 本研究经同济医学院伦理委员会批准, 履行告知义务并获病人知情同意. 具体入组病例临床资料分类如表1. 胃癌TNM分期采用AJCC标准(2010). 一抗兔抗人多克隆抗体RhoGDI2(#ab15198)、EliviSionTM plus试剂盒(#40405a)、DAB显色试剂盒(#ARl022)均购自武汉谷歌生物技术开发有限公司.
| 临床病例特征 | n | RhoGDI2表达 | 阳性率(%) | χ2值 | P值 | |
| - | + | |||||
| 性别 | ||||||
| 男 | 67 | 16 | 51 | 76.11 | 1.06 | >0.05 |
| 女 | 36 | 12 | 24 | 66.66 | ||
| 年龄(岁) | ||||||
| <60 | 52 | 12 | 40 | 76.92 | 0.9 | >0.05 |
| ≥60 | 51 | 16 | 35 | 68.62 | ||
| 肿瘤位置 | ||||||
| 贲门胃底 | 20 | 5 | 15 | 75 | 1.18 | >0.05 |
| 胃体 | 19 | 7 | 12 | 63.16 | ||
| 胃角 | 34 | 9 | 25 | 73.53 | ||
| 胃窦 | 30 | 7 | 23 | 76.67 | ||
| 原发灶直径(cm) | ||||||
| <5 | 47 | 15 | 32 | 68.1 | 0.98 | >0.05 |
| ≥5 | 56 | 13 | 43 | 76.79 | ||
| 组织学分级 | ||||||
| 高-中分化 | 23 | 11 | 12 | 52.17 | 6.37 | <0.05 |
| 低分化 | 80 | 17 | 63 | 78.75 | ||
| 原发灶分期 | ||||||
| T1-2 | 23 | 15 | 8 | 34.78 | 21.64 | <0.05 |
| T3-4 | 80 | 13 | 67 | 83.75 | ||
| 淋巴结转移 | ||||||
| N0 | 27 | 22 | 5 | 18.52 | 54.50 | <0.05 |
| N1+N2+N3 | 76 | 6 | 70 | 92.11 | ||
| 远处转移 | ||||||
| M0 | 32 | 18 | 14 | 43.75 | 19.81 | <0.05 |
| M1 | 71 | 10 | 61 | 85.91 | ||
| 临床分期 | ||||||
| I+II | 47 | 24 | 23 | 48.94 | 24.90 | <0.05 |
| III+IV | 56 | 4 | 52 | 92.86 | ||
1.2.1 免疫组织化学染色检测(EliviSionTM plus): 切片脱蜡, 乙醇脱水, 水洗; 3%H2O2去离子水避光孵育15 min, PBS洗涤3次×5 min; 热修复抗原; 擦干边缘水分, 滴加0.3%Triton-100, 37 ℃温盒孵育后PBS洗3次×5 min; 滴加BSA封闭液, 室温下孵育20 min, 滴加一抗(1:200), 4 ℃过夜; PBS洗3次×5 min; 滴加聚合物增强剂(试剂A), 室温孵育20 min, PBS洗3次×5 min; 滴加酶标羊抗鼠聚合物(试剂B), 室温孵育, PBS洗3次×5 min; 新鲜配制DAB显色, 蒸馏水洗涤; 苏木素复染, 0.1%盐酸分化, PBS返蓝, 自来水冲洗; 梯度乙醇脱水干燥, 二甲苯透明, 中性树胶封片. 以已知的阳性切片作阳性对照, 以PBS代替一抗作阴性对照. RhoGDI2阳性细胞为棕色或黄色, 阳性颗粒均定位于细胞胞浆或细胞胞核.
1.2.2 免疫组织化学染色结果评定: 所有切片采用盲法由两位病理科医生独立阅片, 每个样本均选择2张切片, 采用十字分区取5个不同视野(×200倍), 至少计数1000个细胞. 参照Remmele和Stegner提出的免疫反应积分(IRS)评分法[2], 观察染色强度, 计数免疫组织化学标记定位准确的阳性细胞占视野内细胞数的比例并计分, 将二者计分乘积作为最后结果.
统计学处理 应用SPSS18.0软件进行χ2检验, P<0.05为差异有统计学意义.
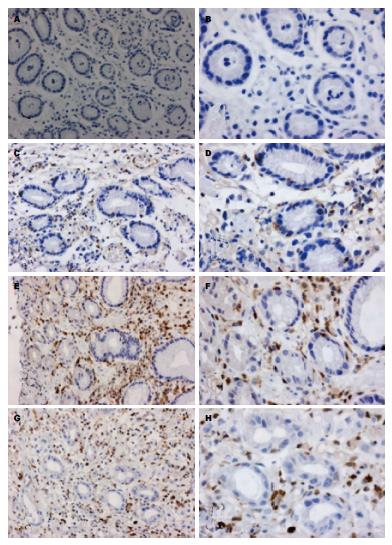
RhoGDI2阳性表达细胞为肿瘤细胞, 主要位于胞浆或胞核. RhoGDI2在胃癌组织表达率为72.82%(75/103), 在非癌胃组织(病理结果示"黏膜呈轻度慢性炎症改变"或"正常胃黏膜表现")中无表达(0/21), 差异有统计学意义(χ2 = 38.70, P<0.05); 低分化型胃癌组显著高于高-中分化型胃癌组(χ2 = 6.37, P<0.05); 随浸润深度(分别浸润至黏膜层、黏膜下层、肌层、浆膜层)增加, RhoGDI2的表达率增加(χ2 = 21.64, P<0.05); 淋巴结转移组显著高于无转移组(χ2 = 54.50, P<0.05); 远处转移组显著高于无转移组(χ2 = 19.81, P<0.05); 临床分期Ⅲ+Ⅳ期组明显高于Ⅰ+Ⅱ期组(χ2 = 24.90, P<0.05). RhoGDI2表达与性别、年龄(<60岁或≥60岁)、肿瘤部位(贲门胃底、胃体、胃角、胃窦)、原发灶大小(直径<5 cm或≥5 cm)无相关性(P>0.05)(表1, 图1).
胃癌在我国高发, 其死亡人数在我国居恶性肿瘤的首位. 肿瘤侵袭转移是胃癌患者致死的主要原因. 胃癌侵袭转移过程中涉及许多特殊基因, 包括促进转移的转移基因和控制转移的转移抑制基因. 有关胃癌侵袭转移的分子机制尚未完全阐明, 寻找及研究胃癌侵袭转移相关基因及其产物在胃癌侵袭转移过程中的表达变化与分子机制, 可以加深我们对于胃癌侵袭转移调控机制的理解和认识, 同时也为胃癌侵袭转移的早期诊断和靶向干预提供理论基础.
2009-04由美国弗吉尼亚大学的泌尿学与分子生理学教授Steven Christopher Smith与Dan Theodorescu博士领导研究小组系统对肿瘤转移抑制基因进行综述, 发表在Nat Rev Cancer(影响因子29.538)杂志上[3], 揭示RhoGDI2是众多肿瘤转移抑制基因之一. 并认为弄清楚肿瘤转移抑制蛋白的生物学功能可以为我们开发出更有效的疗法来为肿瘤治疗提供更多、更好的思路. RhoGDI2是肿瘤转移抑制基因其中的一种, 然而与传统意义上的肿瘤转移抑制基因不同, 近两年已有研究揭示: 在不同类型的肿瘤以及同类肿瘤的不同研究层面, RhoGDI2表达水平不尽相同, 也发挥着不同的功能: 促进或抑制肿瘤的侵袭和转移[1]. 曾有报道RhoGDI2在膀胱癌[4,5]、肺癌[6]以及霍奇金淋巴瘤中[7]RhoGDI2表达下调, 也有研究提示RhoGDI2在卵巢癌[8,9]、白血病[10]和胃癌[11,12]等组织中表达上调.
国内外关于RhoGDI2在胃癌中的研究报道甚少. 2009年Cho等[11]通过对26例小样本量的胃癌组织检测后发现, RhoGDI2在进展期胃癌组织中高表达, 在正常胃黏膜组织中低表达或不表达. 在实验中, 他们揭示RhoGDI2能够正向调节胃癌的生长, 通过蛋白检测分析, 其胃癌组织中的蛋白表达水平比正常胃黏膜组织中更高. 免疫组织化学结果也显示RhoGDI2的表达水平在胃癌进展期增高, 且与淋巴转移明显相关. 在胃癌组织中的定位也与其他组织不同: RhoGDI2在其他组织中多在细胞浆中表达, 偶尔在细胞核内表达[5], 而其研究表明RhoGDI2除了在细胞浆中表达外, 也在细胞核内频繁表达. 实验同时表明, RhoGDI2的高表达显著促进了体内胃癌的生长、侵袭及肺部转移. 其研究的局限性在于样本量较小. 本研究观察到RhoGDI2在胃癌细胞中的细胞核或细胞浆均有表达, 样本量达103例.
恶性肿瘤的侵袭、转移是肿瘤细胞和宿主细胞相互作用的连续过程, 涉及到多因素、多环节. 在胃癌方面, 至今鲜有关于RhoGDI2大样本量表达状况检测及与临床病理参数相关性的分析报道. 本实验通过免疫组织化学方法, 对RhoGDI2在103例胃癌组织中蛋白水平的表达进行检测, 结果表明, RhoGDI2蛋白在大多数胃癌组织中的表达水平均较在胃正常黏膜组织中升高, 且与胃癌分化程度、浸润深度、淋巴结转移、远处转移和TNM分期密切相关: 组织分化程度越低、胃壁浸润越深、有淋巴结转移、远处转移及临床分期越晚的患者, RhoGDI2蛋白表达大多数都明显升高. 综合以上实验结果, 提示RhoGDI2可能有促进胃癌侵袭和转移的作用. 最初RhoGDIs被认为具有对Rho GTP酶的负向调节作用, 当被外源性转入细胞内, RhoGDIs导致了Rho依赖性细胞活动的中断[13]. 然而, 最近的研究表明其也存在对Rho GTP酶的正向调节作用, RhoGDIs协助Rho GTP酶转运到细胞膜上, 此举对于GTP酶与其下游效应蛋白联络至关重要. 有可能RhoGDI2作为RhoGTP酶信号肽的正向调节器在胃癌细胞中发挥功能. 也有可能RhoGDI2影响了其他的信号通路, Groysman等[14]发现RhoGDI2与Vav1(Rho GTP酶鸟嘌呤核苷酸交换因子)有关联, RhoGDI2不是抵消, 而是增强了Vav1的效应-在T细胞感受器活化T细胞过程中诱导NFAT生成, 说明在T细胞感受器信号通路中, RhoGDI2有可能作为信号转换器发挥协同功能. 最近, Schunke等[15]也揭示RhoGDI2在乳腺癌细胞中协同Vav1对NFAT产生活化效应.
寻找肿瘤治疗靶点是目前肿瘤研究的热点. 在RhoGDI2抑制肿瘤转移机理的研究上, Theodorescu等[5]将RhoGDI2转染到高转移性膀胱癌细胞T24T, 并比较转染前后T24T细胞内随之发生显著表达量降低的基因来靶定一些与RhoGDI2的表达状况相对、具有促进肿瘤转移功能并能被药物抑制的分子. 选出T24T细胞转染RhoGDI2蛋白后, 转录体下调, 但在人膀胱癌细胞中转录体上调的基因进行继续研究. 按此思路, Titus等在膀胱癌转移细胞中重新表达RhoGDI2基因, 然后对比两组数据-被RhoGDI2基因抑制的细胞转录组数据和具转移能力的侵袭性膀胱癌转移细胞转录组数据, 结果发现了内皮素1[16]和神经介素U[17]这两个RhoGDI2基因的下游靶蛋白. 内皮素1和神经介素U都在促进肿瘤细胞的肺部转移过程中发挥功效. 虽然目前内皮素1和神经介素U受RhoGDI2调控的机制还处于未知阶段(内皮素1的作用可以被内皮素受体抑制剂阿曲生坦所抑制; 目前尚无神经介素U的抑制剂), 但因其能使肿瘤细胞降低转移能力, 故仍具有十分重要的临床应用价值.
总之, 胃癌组织RhoGDI2的表达与肿瘤侵袭转移有关. 本研究由于病例观察时间受限, 我们尚未发现RhoGDI2与胃癌预后的关系, 未进一步显示其内在关联, 需进行进一步基础及临床随访观察研究. 借助基因芯片分析转染RhoGDI2前后胃癌细胞的差异表达基因, 从而发现RhoGDI2在调节胃癌细胞侵袭转移过程中所牵涉的上下游基因, 并研究探讨其调控作用的分子机制. 对RhoGDI2蛋白下游靶蛋白的深入研究, 有望成为临床上针对恶性肿瘤治疗的新方法, 同时对其结构和功能的探索也将为未来治疗肿瘤药物的开发提供新的策略.
RhoGTP酶解离抑制蛋白2(RhoGTPase dissociation inhibitor 2, RhoGDI2)是近年来发现的一种肿瘤转移抑制基因. 在不同类型的肿瘤以及同类肿瘤的不同研究层面, RhoGDI2表达水平的变化趋势不尽相同, 也发挥着不同的功能: 促进或抑制肿瘤的侵袭和转移. 目前国内外文献甚少有其在胃癌组织中的表达及其与临床病理特征相关性的研究报道.
杜雅菊, 教授, 哈尔滨医科大学附属第二医院消化内科
借助基因芯片分析转染RhoGDI2前后胃癌细胞的差异表达基因, 从而可发现RhoGDI2在调节胃癌细胞侵袭转移过程中所牵涉的上下游基因, 并研究探讨其调控作用分子机制.
2009年Hee等发现, RhoGDI2在进展期胃癌组织中高表达, 在正常胃黏膜组织中低表达或不表达. 他们揭示RhoGDI2能够正向调节胃癌的生长, 通过蛋白检测分析, 其胃癌组织中的蛋白表达水平比正常胃黏膜组织中更高. 其研究的局限性在于样本量较小.
本实验对RhoGDI2在103例胃癌组织中蛋白水平的表达进行检测, 结果表明, RhoGDI2蛋白在大多数胃癌组织中的表达水平均较在胃正常黏膜组织中升高, 且与胃癌分化程度、浸润深度、淋巴结转移、远处转移和TNM分期密切相关, 与前人研究相比, 样本量更大.
对RhoGDI2蛋白下游靶蛋白的深入研究, 有望成为临床上针对恶性肿瘤治疗的新方法, 同时对其结构和功能的探索也将为未来治疗肿瘤药物的开发提供新的策略.
本文检测了胃癌组织中肿瘤转移抑制RhoGDI2蛋白的表达情况, 发现该基因与肿瘤侵袭转移有关, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Griner EM, Theodorescu D. The faces and friends of RhoGDI2. Cancer Metastasis Rev. 2012;31:519-528. [PubMed] [DOI] |
| 2. | Friedrichs K, Gluba S, Eidtmann H, Jonat W. Overexpression of p53 and prognosis in breast cancer. Cancer. 1993;72:3641-3647. [PubMed] |
| 3. | Smith SC, Theodorescu D. Learning therapeutic lessons from metastasis suppressor proteins. Nat Rev Cancer. 2009;9:253-264. [PubMed] [DOI] |
| 4. | Gildea JJ, Seraj MJ, Oxford G, Harding MA, Hampton GM, Moskaluk CA, Frierson HF, Conaway MR, Theodorescu D. RhoGDI2 is an invasion and metastasis suppressor gene in human cancer. Cancer Res. 2002;62:6418-6423. [PubMed] |
| 5. | Theodorescu D, Sapinoso LM, Conaway MR, Oxford G, Hampton GM, Frierson HF. Reduced expression of metastasis suppressor RhoGDI2 is associated with decreased survival for patients with bladder cancer. Clin Cancer Res. 2004;10:3800-3806. [PubMed] |
| 6. | Niu H, Li H, Xu C, He P. Expression profile of RhoGDI2 in lung cancers and role of RhoGDI2 in lung cancer metastasis. Oncol Rep. 2010;24:465-471. [PubMed] |
| 7. | Ma L, Xu G, Sotnikova A, Szczepanowski M, Giefing M, Krause K, Krams M, Siebert R, Jin J, Klapper W. Loss of expression of LyGDI (ARHGDIB), a rho GDP-dissociation inhibitor, in Hodgkin lymphoma. Br J Haematol. 2007;139:217-223. [PubMed] |
| 8. | Tapper J, Kettunen E, El-Rifai W, Seppälä M, Andersson LC, Knuutila S. Changes in gene expression during progression of ovarian carcinoma. Cancer Genet Cytogenet. 2001;128:1-6. [PubMed] |
| 9. | Stevens EV, Banet N, Onesto C, Plachco A, Alan JK, Nikolaishvili-Feinberg N, Midkiff BR, Kuan PF, Liu J, Miller CR. RhoGDI2 antagonizes ovarian carcinoma growth, invasion and metastasis. Small GTPases. 2011;2:202-210. [PubMed] |
| 10. | Cui JW, Li WH, Wang J, Li AL, Li HY, Wang HX, He K, Li W, Kang LH, Yu M. Proteomics-based identification of human acute leukemia antigens that induce humoral immune response. Mol Cell Proteomics. 2005;4:1718-1724. [PubMed] |
| 11. | Cho HJ, Baek KE, Park SM, Kim IK, Choi YL, Cho HJ, Nam IK, Hwang EM, Park JY, Han JY. RhoGDI2 expression is associated with tumor growth and malignant progression of gastric cancer. Clin Cancer Res. 2009;15:2612-2619. [PubMed] [DOI] |
| 12. | Cho HJ, Baek KE, Kim IK, Park SM, Choi YL, Nam IK, Park SH, Im MJ, Yoo JM, Ryu KJ. Proteomics-based strategy to delineate the molecular mechanisms of RhoGDI2-induced metastasis and drug resistance in gastric cancer. J Proteome Res. 2012;11:2355-2364. [PubMed] [DOI] |
| 13. | Takaishi K, Kikuchi A, Kuroda S, Kotani K, Sasaki T, Takai Y. Involvement of rho p21 and its inhibitory GDP/GTP exchange protein (rho GDI) in cell motility. Mol Cell Biol. 1993;13:72-79. [PubMed] |
| 14. | Groysman M, Hornstein I, Alcover A, Katzav S. Vav1 and Ly-GDI two regulators of Rho GTPases, function cooperatively as signal transducers in T cell antigen receptor-induced pathways. J Biol Chem. 2002;277:50121-50130. [PubMed] |
| 15. | Schunke D, Span P, Ronneburg H, Dittmer A, Vetter M, Holzhausen HJ, Kantelhardt E, Krenkel S, Müller V, Sweep FC. Cyclooxygenase-2 is a target gene of rho GDP dissociation inhibitor beta in breast cancer cells. Cancer Res. 2007;67:10694-10702. [PubMed] |
| 16. | Titus B, Frierson HF, Conaway M, Ching K, Guise T, Chirgwin J, Hampton G, Theodorescu D. Endothelin axis is a target of the lung metastasis suppressor gene RhoGDI2. Cancer Res. 2005;65:7320-7327. [PubMed] |