修回日期: 2013-07-29
接受日期: 2013-08-13
在线出版日期: 2013-09-28
随着内镜技术的发展, 消化系黏膜下病变(submucosal lesions, SMLs)在临床上越来越多的被发现. 超声内镜(endoscopic ultrasonography, EUS)既往被认为是消化系SMLs诊断的一项可靠的技术. 但随着EUS在临床的广泛应用和内镜下大黏膜剥离(endoscopic submucosal dissection, ESD)技术深入开展, 现对EUS诊断SMLs提出了新的问题: EUS判断SMLs的准确性如何, 能否鉴别各种SMLs的性质, 对病变侵袭层次的定位及对ESD等手术的术前判断价值如何等. 本文重点就这些问题总结了近10年来国内外文献相关研究报道, 从EUS对消化系SMLs性质的判断、诊断的准确性、良恶性的鉴别、 EUS引导下细针穿刺技术(EUS-guided fine needle aspiration, EUS-FNA)、EUS的随访价值等方面对EUS在消化系SMLs中的应用作一综述.
核心提示: 本文从超声内镜(endoscopic ultrasonography, EUS)对消化系黏膜下病变(submucosal lesions, SMLs)性质的判断、诊断的准确性、良恶性的鉴别、 EUS引导下细针穿刺技术(EUS-guided fine needle aspiration, EUS-FNA)、EUS的随访价值等方面, 系统综述了国内外近10年来关于EUS在消化系SMLs中的应用价值, 认为EUS技术是目前对于消化系SMLs诊断最重要的工具, 下一步需要更多的前瞻性、多中心、大样本的研究, 来帮助制定临床对于消化系SMLs诊疗的规范.
引文著录: 邢珺, 张开光. 超声内镜在消化系黏膜下病变中的应用. 世界华人消化杂志 2013; 21(27): 2808-2814
Revised: July 29, 2013
Accepted: August 13, 2013
Published online: September 28, 2013
Advances in endoscopic imaging technology have led to the detection of more cases of gastrointestinal submucosal lesions (SMLs). Endoscopic ultrasonography (EUS) was previously known as the best imaging procedure to characterize SMLs. However, the progress of endoscopic submucosal dissection (ESD) has raised some new questions concerning the role of EUS in the diagnosis of SMLs. What is the diagnostic accuracy of EUS for SMLs? How is the nature of SMLs determined? How is the layer of origin identified? What is the preoperative value of EUS for ESD? In this review, we will discuss the endosonographic features of SMLs, the diagnostic accuracy of EUS, the ability of EUS to distinguish benign and malignant SMLs, the value of EUS-guided fine-needle aspiration (FNA), and the value of EUS in clinical surveillance.
- Citation: Xing J, Zhang KG. Endoscopic ultrasonography for gastrointestinal submucosal lesions. Shijie Huaren Xiaohua Zazhi 2013; 21(27): 2808-2814
- URL: https://www.wjgnet.com/1009-3079/full/v21/i27/2808.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i27.2808
超声内镜(endoscopic ultrasonography, EUS)是经内镜导入高频微型超声探头, 通过体腔在内镜直视下对消化系管壁或邻近脏器进行超声扫描的方法. 在80年代初应用于临床, 目前已经逐渐成为观察消化系管壁及其周围结构的一项重要工具, 被称为消化系内镜学中最为精确的影像技术. EUS是目前对于消化系黏膜下病变(submucosal lesions, SMLs)诊断准确性最高的影像学方法[1-4].
消化系SMLs或称为黏膜下肿瘤(submucosal tumors, SMTs)是对生长于消化系黏膜层以下的, 非肿瘤性或肿瘤性(包括良性和恶性)病变的统称. 目前对SMLs在整个消化系的发病率尚缺乏准确的流行病学资料, 有报道称SMLs的发病率为0.36%[5-7]. 大部分SMLs患者没有临床症状, 一般是在内镜或放射线检查中无意间被发现, 少数病例存在一些非特异性的症状, 包括出血、梗阻、腹痛、吞咽困难等[8-10].
正常消化系的EUS图像特点: EUS扫描时, 正常消化系管壁从里至外可显示为"高-低-高-低-高"五层回声结构, 分别对应于黏膜层表面与腔内液体界面的反射(高回声带)、黏膜肌层(低回声带)、黏膜下层(高回声带)、固有肌层(低回声带)、浆膜(或外膜)层(高回声带).
EUS可以通过病变大小、起源层次、回声结构、边缘等对SMLs的性质作出大致的判断[11,12].
内镜检查首先需要将真正SMLs与外压性改变(包括: 脾、肝左叶、胆囊、胰腺假性囊肿或肿瘤、肿大淋巴结、扩大的左心房、主动脉瘤和脾动脉等)相鉴别. EUS优于普通内镜、经腹超声、CT、消化系钡餐等其他检查, 对器官外压性改变的诊断有接近100%的准确性[1,5].
脂肪瘤可发生在消化系各个部位, 最常见于结肠. 内镜下表现为单个黄色、质软、边缘光滑的病变, EUS下表现为均质、高回声、边缘光滑清晰的圆形或卵圆形病变, 起源于第3层, EUS表现具有特异性, 内镜下的随访提示其生长速度缓慢.
平滑肌瘤多数位于食道, 结直肠, 在胃及小肠比较少见. EUS下表现为均质, 低回声, 边缘光滑清晰的病变, 起源于第2或4层. 一般单纯通过EUS下表现难以与胃肠道间质瘤(gastrointestinal stromal cell tumors, GISTs)相鉴别, 免疫组织化学标记提示平滑肌瘤表达肌动蛋白和肌间线蛋白, 不表达CD117或CD34以及S-100蛋白[13,14].
异位胰腺又称迷路胰腺或副胰, 是存在于正常胰腺位置以外的孤立胰腺组织, 与正常胰腺之间无解剖学联系. 约90%的异位胰腺位于上消化道, 主要是胃(通常位于胃窦)、十二指肠、空肠. 内镜下异位胰腺呈实性, 略不规则的结节样改变, 多数在黏膜表面有脐样凹陷的腺管开口. EUS下异位胰腺大部分起源于第3层, 表现为低回声, 或者混合回声的不均质病变, 有的还包括无回声的腺管结构, 边缘不规则.
颗粒细胞瘤是起源于神经组织的肿瘤, 多数为良性病变, 约30%的消化系颗粒细胞瘤发生在中段到远段食道, 内镜下表现为灰白色或黄色小结节样病变(其中95%的病变小于1 cm), EUS下表现为不均质、低回声、边界光滑的病变, 起源于第2、3层. 免疫组织化学标记表达S100蛋白和神经元特异性烯醇化酶(提示其神经组织来源).
胃静脉曲张通常发生在胃底, 表现为正常黏膜覆盖下的浅蓝色波状或管状结构, 外压时会发生移动, 当怀疑为曲张静脉时禁忌活检. EUS下表现为圆形或卵圆形弯曲或管状无回声结构, 起源于第3层, 多普勒超声下检测到血流信号具有诊断意义.
消化系囊肿通常是炎症反应的结果, 也有的来源于胚胎发育. 内镜下囊肿表现为可压缩的结节, 多数凸向腔内, EUS下表现为圆形或卵圆形, 边界清楚的无回声病变, 起源于第3层. 炎性囊肿壁为1层高回声结构, 复生囊肿壁一般为3到5层结构.
施旺细胞瘤是发生在软组织的一种良性神经鞘瘤, 在消化系较少见, 与GISTs在消化系的发生率之比是1:50-100[15], 大部分发生在胃, 多数无症状, 免疫组织化学标记表达S-100而不表达c-kit, EUS表现为均质、低回声、圆形或卵圆形病变, 边界清楚, 起源于第3、4层.
淋巴瘤累及消化系并不是真正意义上的SMLs, EUS表现为低回声、均质病变, 起源于第2、3层, 有时也累及各个层次.
类癌是一种较为罕见的, 生长缓慢的来源于嗜铬细胞的神经内分泌肿瘤, 可以发生在整个消化系, 具有恶性潜能, 类癌是小肠最常见的肿瘤, 小肠类癌占全部类癌的25%[16]. 其恶性程度部分取决于其大小(<2 cm的类癌一般很少为恶性). 大多数在EUS下表现为低回声、边界清楚、均质的病变, 可起源于第1、2或3层.
GISTs是最常见的消化系间叶源性肿瘤, 来源于可以分化为Cajal间质细胞(肠道起搏细胞)的前体细胞, GISTs大部分发生在胃(60%-70%)、小肠(20%-30%)、结直肠(5%), 食道的发生率<5%, 发生在小肠的GISTs更具有侵袭性[1,15]. GISTs在光镜下的表现为梭形或上皮样细胞, 常常容易与平滑肌瘤相混淆. 约95%的GISTs在免疫组织化学染色表达c-kit(又称为CD117), 约70%的GISTs表达CD34[17]. EUS下表现为均质、低回声、边界清晰的病变, 与第4层相延续. 目前认为所有的GISTs都有恶性潜能, 所以提倡按照恶性风险度的高低分为: 极低风险、低风险、 中等风险、高风险4类[18,19].
其他一些较为少见的SMLs, 如: 黏膜下转移瘤、血管瘤和淋巴管瘤等也都有其EUS下特点, 本文就不再叙述.
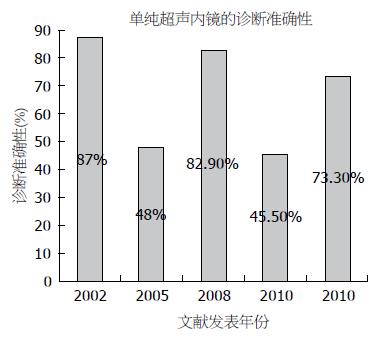
国内外有很多关于EUS的诊断准确性的研究. 在一个76例间叶源性肿瘤的回顾性研究中, EUS对病变的定位准确性是98.7%, 对间叶源性肿瘤诊断准确性为82.9%,对良恶性病变的鉴别准确性是80.3%[20]. 一个22例<2 cm的SMLs的回顾性研究中EUS的诊断准确性是45.5%, 其中对于肿瘤性病变和非肿瘤性病变的诊断准确性分别是30.8%和66.7%[21]. 另一个23例SMLs的前瞻性研究中, EUS的病理诊断符合率为48%[22]. 大部分错误的EUS诊断发生在起源于第3、4层的低回声病变[21-23]. 目前相关研究多以回顾性研究为主, EUS的诊断准确性在不同的研究中差异较大(图1), 这可能与不同研究的设计方法不同以及操作者本身的差异有关. EUS目前认为对于脂肪瘤, 复生囊肿, 异位胰腺, 外压性改变等有较高的诊断准确性. 大部分病变, 特别是起源于第3、4层的低回声病变, 单纯凭借EUS的诊断准确性是有限的, 需要结合活检, EUS-FNA, 手术等方式通过组织学和细胞学才能得到特异性的诊断[24-26].
EUS对SMLs良恶性的鉴别有很重要的临床意义. 有文献总结了病理证实的829例SMLs, 恶性病变所占的比例平均为12%. 恶性SMLs在食道和十二指肠比例分别为1%和5%, 在胃为16%[5].
目前有许多关于消化系SMLs的超声表现与病变良恶性的相关性研究(表1), 总体来说, 病变大小(>3或者4 cm, 根据不同的研究而异)以及边缘不规则, 是推测恶性病变最重要的两个因素[5,27,28]. 其他被提到与恶性病变相关的因素有: 回声焦点, 囊性变, 不均质回声结构, 恶性淋巴结, 侵袭性生长方式, 黏膜表面溃疡以及非圆形或卵圆形结构等[29,30]. 相关研究之间结论的一致性较少, 原因可能是病变大小的评估标准, 统计学方法的不同, 此外检查者本身也是非常重要的影响因素. 有报道EUS下同一特征的出现, 在不同的检查者的判断之间存在很大的差异. 但现有的研究多以小样本回顾性研究为主, 需要进一步大样本, 多中心的前瞻性研究.
| 作者、年份研究类型[引用文献] | 预测恶性的特征 | 诊断恶性的标准 | 敏感性 | 特异性 |
| Chak等[47], 1997年, 回顾性研究 | 不规则边缘, 囊性变>4 mm, 回声焦点>3 mm | 出现2个或以上 | 80%-90%(8-9/10) | 无数据 |
| Palazzo等[27], 2000年, 回顾性研究 | 不规则边缘, 囊性变, 恶性生长淋巴结 | 出现1个或以上 | 91%(20/22) | 88%(30/34) |
| Brand等[28], 2002年, 回顾性研究 | 病变>3 cm, 不规则边缘, 不均质回声结构 | 同时出现2个 | 80%(16/20) | 77%(51/66) |
| Rösch等[48], 2002年, 前瞻性研究 | 病变>3 cm, 不规则边缘, 不均质回声结构, 出现>10 mm的淋巴结 | 出现2个或以上 | 64%(7/11) | 80%(24/30) |
| Nickl等[49], 2002年, 回顾性研究 | 病变>3 cm, 不规则边缘, 黏膜表面溃疡, 非圆形或非卵圆形结构, 异常区域淋巴结 | 出现1个或以上 | 100%(11/11) | 无数据 |
| Ando等[50], 2003年, 前瞻性研究 | 病变>5 cm, 不规则边缘, 囊性变 | 病变大于5 cm加其他任一条或两条 | 83%(5/6) | 76%(13/17) |
| Will等[2], 2011年, 前瞻性研究 | 病变>3 cm, 不规则边缘, 不均质回声结构, 肿大的淋巴结 | 多元分析 | 71% | 81% |
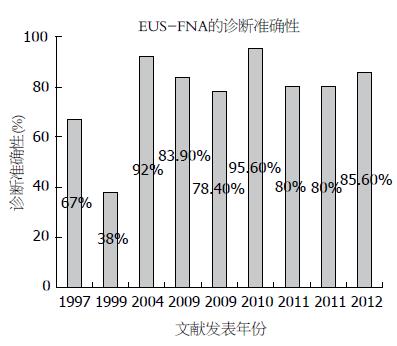
EUS-FNA在90年代早期应用于临床, 是一项安全而有效的活检技术, 被广泛应用于消化系SMLs的诊断, 国内外也有很多相关报道. Ji等[20]报道在112例起源于上消化道第4层的SMLs中, EUS-FNA确诊为61.6%, 疑似诊断22.3%[31]. Karaca等[21]报道在141例连续的消化系SMLs中, EUS-FNA确诊病例占43.3%, 疑似确诊病例占39%[32]. 在50例上消化系SMLs的前瞻性的研究中, EUS-FNA对间叶源性肿瘤的诊断敏感性、特异性、阳性预测值、阴性预测值和诊断准确性分别为 82.9%、73.3%、87.9%、64.7%和80%[33]. 图2总结了部分文献关于EUS-FNA对消化系SMLs的诊断准确性, 可以看出, 近年来随着EUS-FNA技术的进步, EUS-FNA对于SMLs的诊断准确性是相对较高的. 研究认为EUS-FNA对SMLs的诊断率与病变的部位, 大小, 性质以及一些技术因素(包括穿刺针的型号, 活检技术材料)等有关, 此外操作者的技术, 现场即时的细胞病理学检查等对于EUS-FNA诊断率有重要影响. 对于起源于第3、4层的低回声SMLs, 当病变直径超过2 cm时, 实施EUS-FNA明确组织学和细胞学类型是有意义的, 可以帮助指导临床下一步诊疗[34-38].
大部分良性SMLs如: 脂肪瘤、异位胰腺、复生囊肿、神经鞘瘤等不再需要进一步的临床干预, 而一些有症状的或者明确为恶性的病变需要手术或内镜下治疗. 约有50%消化系SMLs患者没有相关临床症状, 病变<3-4 cm, 也没有EUS下的恶性表现; 此外也有一些患者不适合切除或者不愿意接受手术[5,39]. 美国胃肠病学会推荐对于>3 cm的病变进行切除, 对于<3 cm的, 低回声, 起源于第3、4层, 无症状的病变(大部分可能是GISTs)进行周期性的内镜或EUS随访或者也可以选择切除[40,41]. 欧洲肿瘤学会最新的指南认为, 病理证实的>2 cm的GISTs需要手术切除, <2 cm者可以选择随访[42,43].
EUS在SMLs中的随访研究也有很多的报道, 有回顾性的研究报道, 大部分<3 cm的SMLs在中位数为23 mo(平均为30 mo)的时间里不发生变化, 同时在回声结构或病变大小方面发生变化的病变提示为GISTs可能[44]. 另一个49例起源于第4层的无症状低回声, <3 cm的SMLs随访研究报道, 在为期31 mo±20.8 mo的随访时间内, 89.8%(44/49)的病例在病变的大小及回声结构方面无变化. 在病变大小发生改变的病例中有3例经病理证实为极低或者低风险度的GISTs[45].
需要补充说明的是患者在随访中的依从性较差, 只有50%的患者有良好的依从性. 分析认为费用以及患者对反复多次内镜检查的不耐受可能是随访丢失的主要原因[46].
对于内镜, EUS的随访缺乏有足够证据支持的标准, 关于SMLs的自然演变过程的数据也非常少. 理智的选择是初期选择短期的随访(3 mo或者半年), 如果在随访过程中没有任何病变增大的证据, 就可放宽随访期限. 相关研究表明大部分在随访中有病变大小或回声结构改变的病变为具有不同恶性风险程度的GISTs, 鉴于所有的GISTs都有恶性潜能, 所以超声内镜下的随访是必要的.
EUS技术是目前对于消化系SMLs诊断最重要的工具, 可以很好的鉴别SMLs和外压性改变, 对于部分具有特征性表现的SMLs具有很高的诊断准确性. 单纯的EUS目前对于SMLs, 尤其是起源于第3、4层的低回声病变的诊断准确性有限, 联合EUS-FNA技术可以提高诊断的准确性, 同时EUS在SMLs的随访中具有重要意义. 但目前对EUS的诊断价值方面的研究多以回顾性为主, 样本量较小, 下一步需要更多的前瞻性、多中心、大样本的研究, 来帮助制定临床对于消化系SMLs诊疗的规范.
超声内镜(endoscopic ultrasonography, EUS)技术在80年代初应用于临床, 目前已经逐渐发展成为观察消化系管壁及其周围结构的一项重要工具, 被称为消化系内镜学中最为精确的影像技术. 随着EUS技术的发展, 消化系黏膜下病变(submucosal lesions, SMLs)在临床上越来越多的被发现, EUS目前被认为是对于消化系SMLs诊断准确性最高的影像学方法.
毛高平, 教授, 解放军空军总医院
随着EUS技术在临床上的广泛应用,越来越多的消化系SMLs得以被发现, 对于消化系SMLs的诊疗成为临床面临的新课题, 目前对于SMLs国内外尚无统一的诊疗规范可循, 本文在此基础上, 综述了国内外近10年的相关研究报道, 旨在为EUS对消化系SMLs的临床诊疗提供一定的参考价值.
国内目前对于EUS在消化系SMLs中的应用有不少相关报道, 但多数为回顾性病例报道, 系统的综述性文献尚较少, 本文对国内外近10年的相关研究进行了综述, 对临床诊疗有一定的参考价值, 为下一步的相关研究提供了一定的方向.
本文从EUS对消化系SMLs性质的判断, 诊断的准确性, 良恶性的鉴别, EUS-FNA, EUS的随访价值等方面对EUS在消化系SMLs中的应用作一综述. 肯定了EUS对于消化系SMLs诊断的重要价值, 同时介绍了单纯的EUS对于SMLs, 尤其是起源于第3、4层的低回声病变的诊断的局限性. 明确了在将来需要更多的前瞻性、多中心、大样本的研究.
本文内容尚属翔实可靠, 重点突出, 对于超声内镜目前的临床应用现状评价客观,是较好的一篇综述, 对临床有一定参考价值.
编辑: 田滢 电编:鲁亚静
| 1. | Sakamoto H, Kitano M, Kudo M. Diagnosis of subepithelial tumors in the upper gastrointestinal tract by endoscopic ultrasonography. World J Radiol. 2010;2:289-297. [PubMed] [DOI] |
| 2. | Will U, Fueldner F, Mueller AK, Meyer F. A prospective study on endoscopic ultrasonography criteria to guide management in upper GI submucosal tumors. Pol Przegl Chir. 2011;83:63-69. [PubMed] [DOI] |
| 3. | Alkhatib AA, Faigel DO. Endoscopic ultrasonography-guided diagnosis of subepithelial tumors. Gastrointest Endosc Clin N Am. 2012;22:187-205, vii. [PubMed] [DOI] |
| 4. | Hata S, Arai M, Suzuki T, Maruoka D, Matsumura T, Nakagawa T, Katsuno T, Imazeki F, Yokosuka O. Clinical significance of endoscopic ultrasound for gastric submucosal tumors. Clin Res Hepatol Gastroenterol. 2013;37:207-212. [PubMed] [DOI] |
| 5. | Polkowski M, Butruk E. Submucosal lesions. Gastrointest Endosc Clin N Am. 2005;15:33-54, viii. [PubMed] [DOI] |
| 6. | Papanikolaou IS, Triantafyllou K, Kourikou A, Rösch T. Endoscopic ultrasonography for gastric submucosal lesions. World J Gastrointest Endosc. 2011;3:86-94. [PubMed] [DOI] |
| 7. | Landi B, Palazzo L. The role of endosonography in submucosal tumours. Best Pract Res Clin Gastroenterol. 2009;23:679-701. [PubMed] [DOI] |
| 8. | Kim MY, Jung HY, Choi KD, Song HJ, Lee JH, Kim do H, Choi KS, Lee GH, Kim JH. Natural history of asymptomatic small gastric subepithelial tumors. J Clin Gastroenterol. 2011;45:330-336. [PubMed] [DOI] |
| 9. | Chung IK, Hawes RH. Advantages and limitations of endoscopic ultrasonography in the evaluation and management of patients with gastrointestinal submucosal tumors: a review. Rev Gastroenterol Disord. 2007;7:179-192. [PubMed] |
| 10. | Jenssen C, Dietrich CF. Endoscopic ultrasound of gastrointestinal subepithelial lesions. Ultraschall Med. 2008;29:236-256; quiz 257-264. [PubMed] [DOI] |
| 11. | Ponsaing LG, Kiss K, Loft A, Jensen LI, Hansen MB. Diagnostic procedures for submucosal tumors in the gastrointestinal tract. World J Gastroenterol. 2007;13:3301-3310. [PubMed] |
| 12. | Oh JY, Nam KJ, Choi JC, Cho JH, Yoon SK, Choi SS, Kwon HJ, Yoon JH, Kim SJ. Benign submucosal lesions of the stomach and duodenum: imaging characteristics with endoscopic and pathologic correlation. Eur J Radiol. 2008;67:112-124. [PubMed] |
| 13. | Humphris JL, Jones DB. Subepithelial mass lesions in the upper gastrointestinal tract. J Gastroenterol Hepatol. 2008;23:556-566. [DOI] |
| 15. | Sepe PS, Brugge WR. A guide for the diagnosis and management of gastrointestinal stromal cell tumors. Nat Rev Gastroenterol Hepatol. 2009;6:363-371. [PubMed] |
| 16. | Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer. 2003;97:934-959. [PubMed] [DOI] |
| 17. | Dietrich CF, Jenssen C, Hocke M, Cui XW, Woenckhaus M, Ignee A. Imaging of gastrointestinal stromal tumours with modern ultrasound techniques - a pictorial essay. Z Gastroenterol. 2012;50:457-467. [PubMed] [DOI] |
| 18. | Voiosu T, Voiosu A, Rimbaş M, Voiosu R. Endoscopy: possibilities and limitations in the management of GIST of the upper GI tract. Rom J Intern Med. 2012;50:7-11. [PubMed] |
| 19. | Faigel DO, Abulhawa S. Gastrointestinal stromal tumors: the role of the gastroenterologist in diagnosis and risk stratification. J Clin Gastroenterol. 2012;46:629-636. [PubMed] [DOI] |
| 20. | Ji F, Wang ZW, Wang LJ, Ning JW, Xu GQ. Clinicopathological characteristics of gastrointestinal mesenchymal tumors and diagnostic value of endoscopic ultrasonography. J Gastroenterol Hepatol. 2008;23:e318-e324. [PubMed] [DOI] |
| 21. | Karaca C, Turner BG, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial lesions. Gastrointest Endosc. 2010;71:722-727. [PubMed] [DOI] |
| 22. | Hwang JH, Saunders MD, Rulyak SJ, Shaw S, Nietsch H, Kimmey MB. A prospective study comparing endoscopy and EUS in the evaluation of GI subepithelial masses. Gastrointest Endosc. 2005;62:202-208. [PubMed] [DOI] |
| 23. | Chien CH, Chien RN, Yen CL, Fang KM, Liu CJ, Lin CL, Chang JJ, Chen LW, Lee TS, Chen SW. The role of endoscopic ultrasonography examination for evaluation and surveillance of gastric subepithelial masses. Chang Gung Med J. 2010;33:73-81. [PubMed] |
| 24. | Lee HL, Kwon OW, Lee KN, Jun DW, Eun CS, Lee OY, Jeon YC, Han DS, Yoon BC, Choi HS. Endoscopic histologic diagnosis of gastric GI submucosal tumors via the endoscopic submucosal dissection technique. Gastrointest Endosc. 2011;74:693-695. [PubMed] [DOI] |
| 25. | Humphris JL, Jones DB. Subepithelial mass lesions in the upper gastrointestinal tract. J Gastroenterol Hepatol. 2008;23:556-566. [PubMed] [DOI] |
| 26. | 丁 向萍, 张 锦华, 庄 剑波, 缪 连生, 张 富花, 袁 菊霞, 陈 丽. 超声内镜下诊治上消化道良性隆起型病变118例. 世界华人消化杂志. 2009;17:2208-2211. [DOI] |
| 27. | Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours. Gut. 2000;46:88-92. [PubMed] [DOI] |
| 28. | Brand B, Oesterhelweg L, Binmoeller KF, Sriram PV, Bohnacker S, Seewald S, De Weerth A, Soehendra N. Impact of endoscopic ultrasound for evaluation of submucosal lesions in gastrointestinal tract. Dig Liver Dis. 2002;34:290-297. [PubMed] [DOI] |
| 29. | Huang ZG, Zhang XS, Huang SL, Yuan XG. Endoscopy dissection of small stromal tumors emerged from the muscularis propria in the upper gastrointestinal tract: Preliminary study. World J Gastrointest Endosc. 2012;4:565-570. [PubMed] [DOI] |
| 30. | Polkowski M. Endoscopic diagnosis and treatment of upper gastrointestinal tumors. Endoscopy. 2010;42:916-920. [PubMed] |
| 31. | Hoda KM, Rodriguez SA, Faigel DO. EUS-guided sampling of suspected GI stromal tumors. Gastrointest Endosc. 2009;69:1218-1223. [PubMed] [DOI] |
| 32. | Mekky MA, Yamao K, Sawaki A, Mizuno N, Hara K, Nafeh MA, Osman AM, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc. 2010;71:913-919. [PubMed] [DOI] |
| 33. | Turhan N, Aydog G, Ozin Y, Cicek B, Kurt M, Oguz D. Endoscopic ultrasonography-guided fine-needle aspiration for diagnosing upper gastrointestinal submucosal lesions: a prospective study of 50 cases. Diagn Cytopathol. 2011;39:808-817. [PubMed] [DOI] |
| 34. | Williams DB, Sahai AV, Aabakken L, Penman ID, van Velse A, Webb J, Wilson M, Hoffman BJ, Hawes RH. Endoscopic ultrasound guided fine needle aspiration biopsy: a large single centre experience. Gut. 1999;44:720-726. [PubMed] [DOI] |
| 35. | Wiersema MJ, Vilmann P, Giovannini M, Chang KJ, Wiersema LM. Endosonography-guided fine-needle aspiration biopsy: diagnostic accuracy and complication assessment. Gastroenterology. 1997;112:1087-1095. [PubMed] [DOI] |
| 36. | Vander Noot MR, Eloubeidi MA, Chen VK, Eltoum I, Jhala D, Jhala N, Syed S, Chhieng DC. Diagnosis of gastrointestinal tract lesions by endoscopic ultrasound-guided fine-needle aspiration biopsy. Cancer. 2004;102:157-163. [PubMed] [DOI] |
| 37. | Sepe PS, Moparty B, Pitman MB, Saltzman JR, Brugge WR. EUS-guided FNA for the diagnosis of GI stromal cell tumors: sensitivity and cytologic yield. Gastrointest Endosc. 2009;70:254-261. [PubMed] [DOI] |
| 38. | Rong L, Kida M, Yamauchi H, Okuwaki K, Miyazawa S, Iwai T, Kikuchi H, Watanabe M, Imaizumi H, Koizumi W. Factors affecting the diagnostic accuracy of endoscopic ultrasonography-guided fine-needle aspiration (EUS-FNA) for upper gastrointestinal submucosal or extraluminal solid mass lesions. Dig Endosc. 2012;24:358-363. [PubMed] [DOI] |
| 39. | Lok KH, Lai L, Yiu HL, Szeto ML, Leung SK. Endosonographic surveillance of small gastrointestinal tumors originating from muscularis propria. J Gastrointestin Liver Dis. 2009;18:177-180. [PubMed] |
| 40. | American Gastroenterological Association Institute. American Gastroenterological Association Institute medical position statement on the management of gastric subepithelial masses. Gastroenterology. 2006;130:2215-2216. [PubMed] [DOI] |
| 41. | Hwang JH, Rulyak SD, Kimmey MB. American Gastroenterological Association Institute technical review on the management of gastric subepithelial masses. Gastroenterology. 2006;130:2217-2228. [PubMed] [DOI] |
| 42. | ESMO/European Sarcoma Network Working Group. Gastrointestinal stromal tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2012;23 Suppl 7:vii49-vii55. [PubMed] [DOI] |
| 43. | Sato T, Peiper M, Fritscher-Ravens A, Gocht A, Soehendra N, Knoefel WT. Strategy of treatment of submucosal gastric tumors. Eur J Med Res. 2005;10:292-295. [PubMed] |
| 44. | Gill KR, Camellini L, Conigliaro R, Sassatelli R, Azzolini F, Messerotti A, Woodward TA, Wallace MB, Jamil LH, Raimondo M. The natural history of upper gastrointestinal subepithelial tumors: a multicenter endoscopic ultrasound survey. J Clin Gastroenterol. 2009;43:723-726. [PubMed] [DOI] |
| 45. | Bruno M, Carucci P, Repici A, Pellicano R, Mezzabotta L, Goss M, Magnolia MR, Saracco GM, Rizzetto M, De Angelis C. The natural history of gastrointestinal subepithelial tumors arising from muscularis propria: an endoscopic ultrasound survey. J Clin Gastroenterol. 2009;43:821-825. [PubMed] [DOI] |
| 46. | Kim GH. Endoscopic resection of subepithelial tumors. Clin Endosc. 2012;45:240-244. [PubMed] [DOI] |
| 47. | Chak A, Canto MI, Rösch T, Dittler HJ, Hawes RH, Tio TL, Lightdale CJ, Boyce HW, Scheiman J, Carpenter SL. Endosonographic differentiation of benign and malignant stromal cell tumors. Gastrointest Endosc. 1997;45:468-473. [PubMed] [DOI] |
| 48. | Rösch T, Kapfer B, Will U, Baronius W, Strobel M, Lorenz R, Ulm K. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol. 2002;37:856-862. [PubMed] |
| 49. | Nickl N. Hypoechoic intramural tumor study: final report [Abstract]. Gastrointest Endosc. 2002;55:AB98. |
| 50. | Ando N, Goto H, Niwa Y, Hirooka Y, Ohmiya N, Nagasaka T, Hayakawa T. The diagnosis of GI stromal tumors with EUS-guided fine needle aspiration with immunohistochemical analysis. Gastrointest Endosc. 2002;55:37-43. [PubMed] [DOI] |