修回日期: 2013-08-12
接受日期: 2013-08-23
在线出版日期: 2013-09-28
目的: 应用RNA干扰技术抑制人肝细胞癌细胞系HepG2细胞DcR3表达, 并研究DcR3基因沉默后对HepG2细胞凋亡和迁移能力的影响.
方法: 设计并合成特异性DcR3-siRNA 4条和阴性对照siRNA 1条, 转染HepG2细胞, 通过半定量反转录-PCR(RT-PCR)及免疫细胞化学方法检测其对DcR3表达的抑制作用并筛选出干扰效果最强的siRNA, 应用流式细胞仪、DNA ladder方法检测细胞的凋亡情况, 应用划痕实验检测细胞体外迁移能力的变化.
结果: 各特异性DcR3-siRNA均能抑制DcR3 mRNA表达(P<0.05), 其中以DcR3-siRNA4的抑制作用最明显, 抑制作用达62.9%; 将DcR3-siRNA4转染HepG2细胞能明显抑制HepG2细胞DcR3蛋白的表达(P<0.01). 流式细胞仪检测结果显示, 特异性DcR3-siRNA转染组细胞的凋亡率(22.97%±2.10%)明显高于空白对照组(1.17%±0.32%)、脂质体转染组(1.44%±0.43%)和非特异性siRNA转染组(1.22%±0.40%)(均P<0.001); DNA ladder实验发现特异性DcR3-siRNA转染组出现DNA ladder, 而空白对照组、脂质体转染组和非特异性siRNA转染组均未出现DNA ladder. 划痕实验结果显示, 转染后24、48和72 h, 特异性DcR3-siRNA转染组细胞的相对迁移率均低于空白对照组、脂质体转染组和非特异性siRNA转染组.
结论: DcR3在肝癌细胞的凋亡及迁移中发挥重要作用, 抑制DcR3的表达能诱导肝癌细胞凋亡并降低肝癌细胞的迁移能力.
核心提示: 诱捕受体3(decoy receptor 3, DcR3)在肝癌细胞中过表达, 并在肝癌细胞的凋亡及迁移中发挥重要作用, 抑制DcR3的表达能诱导肝癌细胞凋亡并降低肝癌细胞的迁移能力.
引文著录: 苏传丽, 罗殿中, 陈罡, 覃新干. 小干扰RNA靶向抑制DcR3基因对肝癌细胞凋亡和迁移的影响. 世界华人消化杂志 2013; 21(27): 2772-2779
Revised: August 12, 2013
Accepted: August 23, 2013
Published online: September 28, 2013
AIM: To investigate the effect of siRNA-mediated inhibition of DcR3 gene expression on apoptosis and migratory ability of HepG2 cells.
METHODS: Four DcR3-specific siRNAs and one random siRNA were designed, synthesized, and transfected into HepG2 cells using LipofectamineTM 2000. Semi-quantitative RT-PCR was used to screen the siRNA that had the best interfering effect. Immunocytochemistry was used to assess the expression of DcR3 protein. Cell apoptosis was assessed by flow cytometry, and cell migratory ability was determined by wound healing assay.
RESULTS: All four DcR3-specific siRNAs could decrease the expression of DcR3 mRNA, and siRNA4 had the best interfering effect, which could silence the mRNA expression by 62.9% and inhibit the expression of DcR3 protein. The apoptosis rate was significantly higher in the specific interference group than in the three control groups (22.97% ± 2.10% vs 1.17% ± 0.32%, 1.44% ± 0.43%, 1.22% ± 0.40%, all P < 0.001). The relative migratory ability of HepG2 cells in the specific interference group at 24, 48 and 72 h after transfection was significantly lower than that in control groups (all P < 0.001).
CONCLUSION: DcR3 plays an important role in the apoptosis and migration of HepG2 cells. Inhibition of expression of DcR3 can induce apoptosis and repress migration of HepG2 cells.
- Citation: Su CL, Luo DZ, Chen G, Qin XG. SiRNA-mediated inhibition of DcR3 gene expression induces apoptosis and reduces migration of hepatocellular carcinoma HepG2 cells. Shijie Huaren Xiaohua Zazhi 2013; 21(27): 2772-2779
- URL: https://www.wjgnet.com/1009-3079/full/v21/i27/2772.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i27.2772
诱捕受体3(decoy receptor 3, DcR3)是肿瘤坏死因子受体超家族成员之一, 在多种恶性肿瘤中呈现过表达, 能抑制肿瘤细胞的凋亡并与肿瘤的浸润、转移有关, 若能抑制恶性肿瘤中DcR3的表达, 则可能阻抑肿瘤的发生发展, 并为肿瘤的治疗提供新策略. RNA干扰(RNA interference, RNAi)是近年新发展的一种特异抑制基因表达的技术, 主要用于基因功能和基因治疗研究方面. 本研究应用RNAi技术, 将合成的针对DcR3的siRNA转染人肝细胞癌细胞系HepG2细胞, 观察DcR3表达受抑制后肝细胞癌细胞凋亡和迁移能力的变化情况.
根据DcR3 mRNA的序列(Genbank, DcR3: NM_003823)由上海吉玛制药技术有限公司设计并合成4段DcR3特异性siRNA片段和一段与任何基因皆无同源性的非特异性siRNA即阴性对照siRNA, 各siRNA序列具体为: DcR3特异性siRNA序列: siRNA1: sense: 5'-GGCUGUACGCGGAGUGGCATT-3', anti-sense: 5'-UGCCACUCCGCGUACAGCCGG-3'; siRNA2: sense: 5'-GCUCCAGCAAGGACCAUGATT-3', anti-sense: 5'-UCAUGGUCCUUGCUGGAGCAG-3'; siRNA3: sense: 5'-GCCAGAACACGCAGUGCCATT-3', anti-sense: 5'-UGGCACUGCGUGUUCUGGCTG-3'; siRNA4: sense: 5'-CGCAGUUCUGGAACUACCUTT-3', antisense: 5'-AGGUAGUUCCAGAACUGCGTG-3'; 非特异性siRNA序列: sense: 5'-UUCUCCGAACGUGUCACGUTT-3', antisense: 5'-ACGUGACACGUUCGGAGAATT-3'. 人肝细胞癌细胞系HepG2购自中国科学院上海细胞生物学研究所, DMEM培养基购自美国GIBCO公司, FBS购自天津灏洋生物制品科技有限责任公司, 脂质体LipofectamineTM 2000购自美国Invitrogen公司, Simply P总RNA提取试剂盒购自BioFlux公司, 逆转录试剂盒购自Fermentas公司, Taq DNA聚合酶购自日本TaKaRa公司, 抗DcR3兔多克隆抗体购自美国Santa Cruz公司, 二抗和DAB显色液购自北京中杉金桥生物技术有限公司, AnnexinV-异硫氰酸荧光素 (fluorescein isothiocyanate, FITC)细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司, 血液/细胞/组织基因组DNA提取试剂盒购自天根生化科技(北京)有限公司, PCR引物由上海生工生物工程技术服务有限公司合成.
1.2.1 细胞培养: HepG2细胞培养于含10%胎牛血清的DMEM培养液, 并置于37 ℃、50 mL/L CO2、饱和湿度培养箱培养. 实验采用对数生长期细胞.
1.2.2 细胞转染: 根据LipofectamineTM 2000说明书实验步骤进行转染, 细胞分为实验组和对照组, 实验组分siRNA1、siRNA2、siRNA3、siRNA4 4组, 对照组分空白对照组、脂质体组和非特异性siRNA转染组, 各组siRNA转染的终浓度为100 nmol/L. 用荧光显微镜和流式细胞仪检测转染效率.
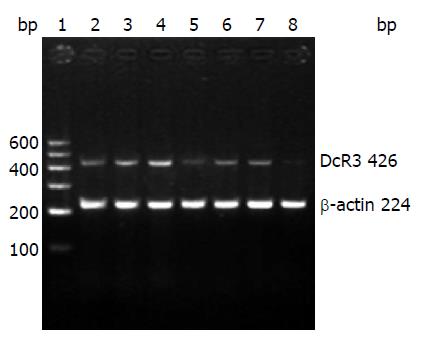
1.2.3 RT-PCR检测DcR3 mRNA表达情况: 转染后24 h收集各组细胞, 用Simply P总RNA提取试剂盒提取细胞总RNA、定量, 各组取等量RNA逆转录后进行PCR. DcR3 PCR上游引物为: 5'-TCCACCGCGCCACTACAC-3', 下游引物为: 5'-ACGGCACGCTCACACTCC-3', 扩增片段长度426 bp; 内参照为β-actin, 上游引物为: 5'-TTCCAGCCTTCCTTCCTGG-3', 下游引物为: 5'-TTGCGCTCAGGAGGAGCAAT-3', 扩增片段长度224 bp. PCR反应条件: 95 ℃ 5 min, 95 ℃ 45 s、58 ℃ 45 s、72 ℃ 1 min共32个循环, 72 ℃ 10 min. PCR产物经2%琼脂糖凝胶电泳后用凝胶成像分析系统分析.
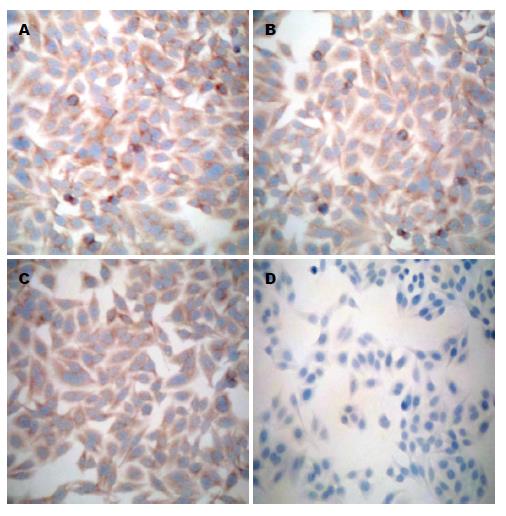
1.2.4 细胞免疫化学实验检测DcR3蛋白的表达: 制备细胞爬片, 按照分组对细胞进行相应处理, 转染48 h后, 进行免疫细胞化学染色, 反应条件为: 1:300稀释的一抗室温孵育2 h, 二抗室温孵育30 min, DAB染液显色10 min. 再由两名病理科医师采用双盲法阅片和评分, 计数细胞1000个以上, 靶细胞阳性率<5%为0分, 5%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分; 显色程度按切片中细胞显色有无及染色深浅记分, 细胞无染色为0分, 浅棕黄色为1分, 棕黄色为2分, 棕褐色为3分; 将两分相乘, 结果分为4个等级, 0分为(-), 1-4分为(+), 5-8分为(++), ≥9分为(+++).
1.2.5 流式细胞仪检测细胞凋亡情况: 细胞分为空白对照组、脂质体转染组、非特异性siRNA转染组及干扰效果最佳的特异性DcR3-siRNA转染组. 转染后72 h, 收集各组细胞, 按试剂盒说明书, 加入500 µL的Binding Buffer悬浮细胞, 然后加入2 µL Annexin V-FITC混匀, 再加入5 µL碘化丙啶(propidium iodide, PI)混匀, 室温避光反应5-15 min, 在1 h内, 应用流式细胞仪进行检测, 计算凋亡细胞的百分比.
1.2.6 DNA ladder检测细胞凋亡情况: 转染后72 h, 收集各组细胞, 按说明书提取各组细胞的基因组DNA, 提取的基因组DNA经琼脂糖凝胶电泳, 然后用凝胶成像分析系统观察是否出现反映细胞凋亡的DNA ladder.
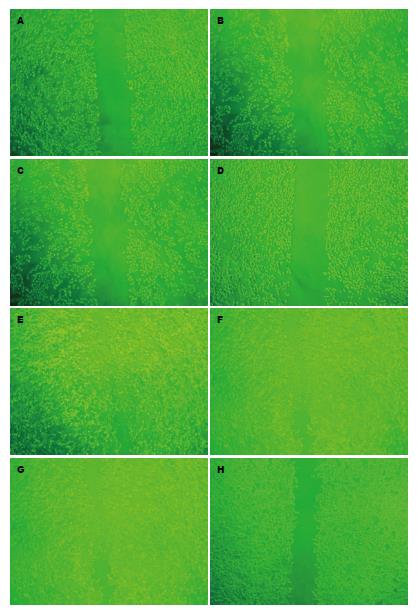
1.2.7 划痕实验检测肝癌细胞的运动迁移能力: 转染前用10 µL Tip头在每孔中央划痕, 用PBS冲洗3遍, 洗掉脱落细胞, 镜下记录划痕区相对距离作为划痕区的原始距离, 并拍照. 在转染后24、48、72 h分别测量划痕创面的宽度, 以原始距离减去各个时间点划痕创面的宽度计算出细胞迁移的相对距离, 每组设三个孔, 每孔等距离取三个点作为测量点, 测量后取均数, 按下面公式计算细胞的相对迁移率: 细胞相对迁移率 = 细胞迁移的相对距离/划痕区的原始距离×100%.
统计学处理 应用SPSS16.0统计软件进行分析, 实验数据以mean±SD表示, 计量资料多组之间比较采用ANOVA进行, 等级资料多组之间比较采用随机区组设计的秩和检验(Friedman检验), 计数资料比较采用四格表确切概率法, P<0.05为差异有统计学意义.
荧光显微镜计数和流式细胞仪检测结果显示转染效率约为85%, 保证了后续实验顺利进行.
半定量RT-PCR结果显示, 各DcR3特异性siRNA均有抑制DcR3 mRNA表达的作用(P<0.05), 其中以siRNA4的作用更明显, 干扰作用达62.9%, siRNA1、siRNA2、siRNA3的干扰作用分别为60.7%、32.1%、23.0%, 而脂质体转染组和非特异性siRNA转染组对DcR3 mRNA的表达无影响(P>0.05)(表1, 图1). 因此, 我们选择干扰效果最佳的siRNA4进行后续实验.
将DcR3-siRNA4转染入HepG2细胞, 免疫细胞化学结果显示, 空白对照组、脂质体转染组和非特异性siRNA转染组细胞DcR3蛋白呈阳性表达(++-+++), 特异性DcR3-siRNA4转染组细胞DcR3蛋白表达明显弱于前3组, 呈阴性或弱阳性表达(--+), 特异性DcR3-siRNA4明显降低DcR3蛋白的表达(P<0.01), 而脂质体转染组和非特异性siRNA转染组对DcR3蛋白的表达无影响(P>0.05)(表2, 图2).
流式细胞仪检测细胞凋亡结果显示, 特异性DcR3-siRNA4转染组细胞与空白对照组、脂质体转染组和非特异性siRNA转染组细胞相比, 凋亡率明显增高, 差异有统计学意义(P<0.001), 而空白对照组、脂质体转染组和非特异性siRNA转染组细胞凋亡率每两组间比较, 差异无统计学意义(P>0.05)(表3).
DNA ladder实验结果显示特异性DcR3-siRNA4转染组出现DNA ladder, 而其余几组均未见DNA ladder出现(P<0.01)(图3).
转染后各个时间点细胞相对迁移率如表4所示, 特异性DcR3-siRNA4转染组细胞相对迁移率在24、48和72 h均低于空白对照组、脂质体转染组和非特异性siRNA转染组, 差异有统计学意义(P<0.01), 而空白对照组、脂质体转染组和非特异性siRNA转染组每两组间比较, 差异无统计学意义(P>0.05). 结果表明, 特异性DcR3-siRNA4转染组细胞的迁移能力低于空白对照组、脂质体转染组和非特异性siRNA转染组(图4).
肿瘤的转移和复发是导致肿瘤治疗困难和患者预后不良的重要原因. 肝癌是我国常见的恶性肿瘤之一, 其发病率逐年升高, 且其转移和复发率很高, 对健康危害极大. 近年来发现的TNFR超家族成员DcR3是FasL、LIGHT和TL1A的诱捕受体, 通过影响FasL、LIGHT和TL1A的促凋亡作用和免疫调节作用而抑制机体的抗肿瘤免疫, 与肿瘤的发生、发展相关[1-6]. 刘忠臣等[7]研究肝癌发展中FasL及其受体Fas/DcR3表达情况发现, 实验小鼠在接种肝细胞癌H22细胞后的第4天, 接种部位可以检测到有DcR3表达, 第6天开始表达上调, 其表达水平随时间的延长而增加, 在FasL高表达的部位DcR3的表达量也较高, 而Fas的表达则随时间的延长而减少直至丢失, 表明肿瘤细胞通过大量表达DcR3来竞争结合FasL, 从而逃避机体的免疫监视. Yang等[8,9]研究发现, DcR3与TL1A相互作用, 促进人脐静脉内皮细胞的增殖和迁移, 上调基质金属蛋白酶-2的表达和活性, 在体外DcR3诱导人脐静脉内皮细胞形成索状血管样结构, 在体内则诱导其形成血管, 促进肿瘤的生长和转移. 陈张铭等[10,11]研究指出DcR3在肝癌组织中表达明显增高, 肝癌组微血管密度(microvessel density, MVD)值明显高于癌旁组和正常对照组, DcR3表达水平与癌组织MVD值呈正相关. Wu等[12]对胃癌研究发现血清DcR3的水平与肿瘤的TNM分期和分化程度相关, TNM分期≤T2/N1/M0的患者血清DcR3的水平低于>T2/N1/M0的患者, 肿瘤分化不良患者比高分化者血清DcR3水平高. Takahama等[13]在也是在对胃癌研究中发现, DcR3 mRNA过表达患者的生存期短于DcR3不表达的患者. Shen等[14,15]和陈罡等[16,17]以前的研究结果发现HCC组织存在DcR3 mRNA和蛋白的过表达, 而癌旁组织无阳性表达, DCR3的高表达可影响凋亡并与肿瘤大小、TNM分期、浸润或转移有关. 杨梅松竹等[18]研究结果显示HCC组和肝硬化组血清DcR3水平均明显高于正常对照组, HCC血清DcR3水平与伴有肝硬化、包膜浸润和复发转移有关, DcR3蛋白在HCC癌组织中的表达与血清水平呈正相关. 若能抑制DcR3的表达, 则可使肿瘤细胞失去DcR3的保护作用, 诱导肿瘤细胞凋亡, 降低肿瘤的转移和复发率, 改善患者的预后.
RNAi技术是新发展的一种特异抑制基因表达的技术, 主要是利用外源导入的dsRNA启动细胞内的RNAi机制, 诱导同源序列的基因表达受抑制, 是一种序列特异的转录后基因沉默, 主要应用于基因功能和基因治疗学方面的研究[19-23]. Elbashir等研究发现外源导入的<30个碱基的siRNA可对哺乳动物细胞造成特异性基因的抑制, 但不会激活细胞干扰素系统造成非特异性基因降解和细胞死亡, 而且体外合成的siRNA具有抑制作用强、稳定性高、细胞摄取相对容易等优点[24], 这一研究成果对在哺乳动物细胞进行RNAi试验起到了极大的指导作用.
目前大部分研究中所报道的siRNA都是利用21个碱基对的短双链RNA, 主要是因为体内Dicer酶消化双链RNA的产物为21nt[24-26]. 因而我们实验中也使用21个碱基对的siRNA. 进行RNAi实验时, siRNA能否对靶基因产生沉默效应, 关键在于siRNA序列的结构, 不同的siRNA序列沉默基因的效率差别很大. 因此, 理性设计有效的siRNA就成为实验成功的一个关键因素. 虽然Elbashir等[27]提出的siRNA设计方法具有一定的指导意义, 但是siRNA筛选效率仍然很低. 因此本实验设计了多条siRNA, 并通过半定量RT-PCR筛选干扰效果最佳的一条siRNA进行后续实验. 半定量RT-PCR结果显示, 各DcR3特异性siRNA均有抑制DcR3 mRNA表达的作用, 其中以siRNA4的作用更明显, 干扰作用达62.9%, siRNA1、siRNA2、siRNA3的干扰作用分别为60.7%、32.1%、23.0%, 而脂质体转染组和非特异性siRNA转染组对DcR3 mRNA的表达无影响. 将筛选出的siRNA4转染HepG2细胞, 免疫细胞化学染色结果显示其可明显抑制DcR3蛋白的表达. 为后续功能实验顺利进行奠定了基础.
细胞凋亡分为早期凋亡与晚期凋亡两个阶段. Annexin V和PI双染法检测的是凋亡早期细胞; DNA ladder检测的是凋亡晚期细胞, 出现DNA ladder说明有足够多的凋亡晚期细胞, 故我们应用Annexin V-FITC和PI双染法和DNA ladder实验分别检测凋亡早期和晚期细胞. 转染后72 h, 流式细胞仪检测细胞凋亡率结果显示, 特异性DcR3-siRNA转染组细胞与空白对照组、脂质体转染组和非特异性siRNA转染组细胞相比, 凋亡率明显增高. DNA ladder实验显示特异性DcR3-siRNA转染组出现DNA ladder, 而空白对照组、脂质体转染组和非特异性siRNA转染组均未出现DNA ladder, 说明特异性DcR3-siRNA转染组细胞的凋亡率明显高于其他组细胞. 这些结果与以前的研究者用DcR3反义mRNA和DcR3中和性抗体处理肝癌细胞所得的结果一致[28-31]. 表明以RNAi技术抑制DcR3表达后, 肿瘤细胞失去DcR3保护, 循FasL、LIGHT或其他凋亡途径进入死亡程序.
通过划痕实验, 我们发现转染后24、48和72 h各个时间点特异性DcR3-siRNA转染组细胞相对迁移率均低于空白对照组、脂质体转染组和非特异性siRNA转染组, 表明特异性DcR3-siRNA可以明显的降低肝癌细胞的运动和迁移能力, 在DcR3存在的情况下, 肝癌细胞能够更快速的运动, 从而发生临床上的浸润, 复发和转移. 这与陈罡等用DcR3中和性抗体处理肝癌细胞所得的结果一致[32]. Yang等[8,9]证实, DcR3在体内可诱导血管形成, 促进肿瘤的生长和转移. 我们在体外实验观察到特异性DcR3-siRNA可以直接抑制肝癌细胞的运动和迁移能力, 其具体机制未明, 值得进一步深入研究.
通过以上实验, 我们发现, DcR3基因沉默可以诱导肝癌细胞凋亡, 抑制肝癌细胞的运动和迁移能力, 表明DcR3在肿瘤的免疫逃逸和复发、转移中发挥重要作用. 以DcR3为靶点进行基因治疗可以作为临床治疗肝细胞癌的新方向.
肝癌是我国常见的恶性肿瘤之一, 其转移和复发率很高, 对健康危害大. DcR3在HCC中过表达, 抑制肿瘤细胞的凋亡并与肿瘤的浸润、转移有关, 若能抑制HCC中DcR3的表达, 则可能阻抑肿瘤的发生发展, 并为肿瘤的治疗提供新策略.
高润平, 教授, 吉林大学第一医院肝胆胰内科
肿瘤基因靶向治疗的研究目前备受关注, 在恶性肿瘤发生发展过程中起重要作用的癌基因的发现和抑制基因表达技术的发展, 将对提高肿瘤的治疗效果, 改善患者预后起积极的推动作用.
以往研究发现DcR3在多种恶性肿瘤中过表达, 抑制肿瘤细胞的凋亡并与肿瘤的浸润、转移有关, 可作为恶性肿瘤基因治疗的靶点.
本研究应用RNA干扰技术抑制人肝细胞癌细胞系HepG2细胞DcR3表达, 并研究DcR3基因沉默后对HepG2细胞凋亡和迁移能力的影响, 探讨以DcR3为靶点进行基因治疗可能性.
DcR3基因沉默可以诱导肝癌细胞凋亡, 抑制肝癌细胞的运动和迁移能力, 以DcR3为靶点进行基因治疗可以作为临床治疗肝细胞癌的新方向.
本研究通过siRNA有效阻断人肝细胞癌细胞系(HepG2)DcR3 mRNA 转录和蛋白的合成, 进而使HepG2细胞凋亡增加和迁移能力降低. 本研究是以人肝癌细胞为靶细胞, 诱捕受体(DcR3)为治疗靶点的实验研究, 对于探索肝癌基因治疗的可能性提供了实验基础.
编辑: 郭鹏 电编:鲁亚静
| 1. | Pitti RM, Marsters SA, Lawrence DA, Roy M, Kischkel FC, Dowd P, Huang A, Donahue CJ, Sherwood SW, Baldwin DT. Genomic amplification of a decoy receptor for Fas ligand in lung and colon cancer. Nature. 1998;396:699-703. [PubMed] [DOI] |
| 2. | Yu KY, Kwon B, Ni J, Zhai Y, Ebner R, Kwon BS. A newly identified member of tumor necrosis factor receptor superfamily (TR6) suppresses LIGHT-mediated apoptosis. J Biol Chem. 1999;274:13733-13736. [PubMed] [DOI] |
| 3. | Migone TS, Zhang J, Luo X, Zhuang L, Chen C, Hu B, Hong JS, Perry JW, Chen SF, Zhou JX. TL1A is a TNF-like ligand for DR3 and TR6/DcR3 and functions as a T cell costimulator. Immunity. 2002;16:479-492. [PubMed] [DOI] |
| 4. | Roth W, Isenmann S, Nakamura M, Platten M, Wick W, Kleihues P, Bähr M, Ohgaki H, Ashkenazi A, Weller M. Soluble decoy receptor 3 is expressed by malignant gliomas and suppresses CD95 ligand-induced apoptosis and chemotaxis. Cancer Res. 2001;61:2759-2765. [PubMed] |
| 5. | Shi G, Wu Y, Zhang J, Wu J. Death decoy receptor TR6/DcR3 inhibits T cell chemotaxis in vitro and in vivo. J Immunol. 2003;171:3407-3414. [PubMed] |
| 6. | Wan X, Shi G, Semenuk M, Zhang J, Wu J. DcR3/TR6 modulates immune cell interactions. J Cell Biochem. 2003;89:603-612. [PubMed] [DOI] |
| 8. | Yang CR, Hsieh SL, Teng CM, Ho FM, Su WL, Lin WW. Soluble decoy receptor 3 induces angiogenesis by neutralization of TL1A, a cytokine belonging to tumor necrosis factor superfamily and exhibiting angiostatic action. Cancer Res. 2004;64:1122-1129. [PubMed] [DOI] |
| 9. | Yang CR, Hsieh SL, Ho FM, Lin WW. Decoy receptor 3 increases monocyte adhesion to endothelial cells via NF-kappa B-dependent up-regulation of intercellular adhesion molecule-1, VCAM-1, and IL-8 expression. J Immunol. 2005;174:1647-1656. [PubMed] |
| 12. | Wu Y, Han B, Sheng H, Lin M, Moore PA, Zhang J, Wu J. Clinical significance of detecting elevated serum DcR3/TR6/M68 in malignant tumor patients. Int J Cancer. 2003;105:724-732. [PubMed] [DOI] |
| 13. | Takahama Y, Yamada Y, Emoto K, Fujimoto H, Takayama T, Ueno M, Uchida H, Hirao S, Mizuno T, Nakajima Y. The prognostic significance of overexpression of the decoy receptor for Fas ligand (DcR3) in patients with gastric carcinomas. Gastric Cancer. 2002;5:61-68. [PubMed] [DOI] |
| 14. | Shen HW, Gao SL, Wu YL, Peng SY. Overexpression of decoy receptor 3 in hepatocellular carcinoma and its association with resistance to Fas ligand-mediated apoptosis. World J Gastroenterol. 2005;11:5926-5930. [PubMed] |
| 15. | Shen HW, Wu YL, Peng SY. [Overexpression and genomic amplification of decoy receptor 3 in hepatocellular carcinoma and significance thereof]. Zhonghua Yixue Zazhi. 2003;83:744-747. [PubMed] |
| 19. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] [DOI] |
| 20. | Hutvagner G. Small RNA asymmetry in RNAi: function in RISC assembly and gene regulation. FEBS Lett. 2005;579:5850-5857. [PubMed] [DOI] |
| 21. | Scherer LJ, Rossi JJ. Approaches for the sequence-specific knockdown of mRNA. Nat Biotechnol. 2003;21:1457-1465. [PubMed] [DOI] |
| 22. | Ait-Si-Ali S, Guasconi V, Harel-Bellan A. [RNA interference and its possible use in cancer therapy]. Bull Cancer. 2004;91:15-18. [PubMed] |
| 24. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 25. | Czauderna F, Fechtner M, Dames S, Aygün H, Klippel A, Pronk GJ, Giese K, Kaufmann J. Structural variations and stabilising modifications of synthetic siRNAs in mammalian cells. Nucleic Acids Res. 2003;31:2705-2716. [PubMed] [DOI] |
| 26. | Zou GM, Wu W, Chen J, Rowley JD. Duplexes of 21-nucleotide RNAs mediate RNA interference in differentiated mouse ES cells. Biol Cell. 2003;95:365-371. [PubMed] [DOI] |
| 27. | Elbashir SM, Harborth J, Weber K, Tuschl T. Analysis of gene function in somatic mammalian cells using small interfering RNAs. Methods. 2002;26:199-213. [PubMed] [DOI] |
| 28. | 吴 泰璜, 段 伟宏, 苏 忠学, 吴 亚光. 反义DcR3 RNA转染诱导肝癌细胞凋亡的作用. 中华微生物学和免疫学杂志. 2005;25:799-802. |
| 29. | 段 伟宏, 苏 忠学, 吴 泰璜. DcR3反义RNA与顺铂对肝癌细胞凋亡影响的比较. 中国现代普通外科进展. 2005;8:90-92. |