修回日期: 2013-08-15
接受日期: 2013-08-23
在线出版日期: 2013-09-28
目的: 探讨缬沙坦对门脉高压性胃病大鼠门静脉血管病变的作用.
方法: 48只SD大鼠随机分为假手术组、门脉高压性胃病模型组、缬沙坦预防组、缬沙坦正常剂量组和加倍剂量组. 采用门静脉主干部分结扎法复制门脉高压性胃病模型. 测量门静脉压力(portal venous pressure, PVP)、心率(heart rate, HR), 免疫组织化学SABC法检测各组大鼠门静脉转化生长因子β1(transforming growth factor beta 1, TGF-β1)蛋白表达, Masson三色染色测定胶原纤维定量.
结果: 缬沙坦正常剂量组、加倍剂量组和预防组的PVP(9.54 cmH2O±0.80 cmH2O, 9.04 cmH2O±0.96 cmH2O, 8.30 cmH2O±0.41 cmH2O)明显下降, 与造模组(13.22 cmH2O±0.96 cmH2O)比较差异具有统计学意义(P<0.01). 假手术组门静脉TGF-β1表达(5.73±0.87)和胶原纤维定量(0.82±0.54)最低, 模型组TGF-β1表达(8.51±1.42)和胶原纤维定量(2.01±1.25)明显增高, 缬沙坦正常剂量组、加倍剂量组和预防组TGF-β1表达(6.54±1.09, 6.45±1.37, 6.42±1.98)和胶原纤维定量(0.92±0.53, 1.09±0.40, 1.03±0.36)与造模组(8.51±1.42, 2.01±1.25)比较差异均有统计学意义(P<0.05).
结论: 门脉高压性胃病时门静脉TGF-β1表达和胶原纤维定量升高, 缬沙坦不仅可以降低门脉压力, 而且抑制门静脉TGF-β1活性, 降低胶原纤维合成, 对门静脉血管病变具有一定治疗作用.
核心提示: 门脉高压性胃病时门静脉血管内膜受损、管腔增厚、附壁血栓形成, 管壁转化生长因子β1(transforming growth factor beta 1, TGF-β1)和胶原纤维表达明显升高, 提示门静脉血管病变形成. 缬沙坦除了能够降低门静脉压力, 而且通过抑制门静脉TGF-β1活性, 降低胶原纤维的合成, 对门静脉血管病变具有一定治疗作用.
引文著录: 黄蔚, 钱静蓉. 缬沙坦对门脉高压性胃病大鼠门静脉TGF-β1和胶原纤维的影响. 世界华人消化杂志 2013; 21(27): 2765-2771
Revised: August 15, 2013
Accepted: August 23, 2013
Published online: September 28, 2013
AIM: To investigate the effect of treatment with valsartan on portal vein lesions in rats with portal hypertensive gastropathy (PHG).
METHODS: Forty-eight SD rats were randomly divided into a sham operation group, a PHG model group, a valsartan prevention group, a normal dose valsartan group, and a double dose valsartan group. Partial portal vein ligation was used to induce PHG. Portal venous pressure (PVP) and heart rate (HR) were measured. Immunohistochemistry was used to detect TGF-β1 protein expression in the portal vein, and Masson's trichrome technique was used to determine the content of collagen fibers.
RESULTS: The PVP decreased significantly in the normal dose valsartan group, double dose valsartan group and prevention group compared with the model group (13.32 cmH2O ± 0.96 cmH2O vs 9.54 cmH2O ± 0.80 cmH2O, 9.04 cmH2O ± 0.96 cmH2O, 8.30 cmH2O ± 0.41 cmH2O, all P < 0.01). TGF-β1 expression and collagen fiber content were significantly higher in the model group than in the sham operation group (8.51 ± 1.42 vs 5.73 ± 0.87, 2.01 ± 1.25 vs 0.82 ± 0.54); however, TGF-β1 expression and collagen fiber content were significantly lower in the valsartan normal dose group, double dose group and prevention group than in the model group (6.54 ± 1.09, 6.45 ± 1.37, 6.42 ± 1.98 vs 8.51 ± 1.42; 0.92 ± 0.53, 1.09 ± 0.40, 1.03 ± 0.36 vs 2.01 ± 1.25, all P < 0.05).
CONCLUSION: TGF-β1 expression and collagen fiber content in the portal vein increase in rats with PHG. Treatment with valsartan can not only reduce portal pressure and TGF-β1 expression in the portal vein but also decrease collagen synthesis.
- Citation: Huang W, Qian JR. Treatment with valsartan reduces TGF-β1 expression and collagen fiber content in the portal vein of rats with portal hypertensive gastropathy. Shijie Huaren Xiaohua Zazhi 2013; 21(27): 2765-2771
- URL: https://www.wjgnet.com/1009-3079/full/v21/i27/2765.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i27.2765
门脉高压性胃病(portal hypertension gastropathy, PHG)是一种累及胃黏膜的血管性病变[1], 其发病机制主要与门脉高压症(portal hypertention, PHT)有关. PHT时门静脉系统阻力增加, 血流量随之增加, 形成高动力循环状态, 导致门静脉管壁平滑肌细胞肥大增生, 内膜增厚, 肌纤维增粗、致密, 出现明显的动脉化构型改变[2]. 转化生长因子β1(transforming growth factor beta 1, TGF-β1)在肝脏纤维化的发生和发展过程中发挥重要作用[3,4], 本课题组前期临床研究发现肝硬化PHG患者胃黏膜TGF-β1蛋白表达明显增加, 且随着胃黏膜病变程度加重, TGF-β1表达量明显增高, 提示TGF-β1可能参与了门静脉高压性胃病胃黏膜血管病变的形成[5]. 此外, PHG的治疗关键在于降低门静脉压力, 使用药物有效平稳地降低门静脉压力成为研究的热点[6-8]. 近年来国内外研究发现血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)1型受体拮抗剂有降低门脉压力、抗肝纤维化和改善胃黏膜血供的作用, 其作用机制可能主要与抑制TGF-β1的合成和激活有关[9,10], 但该类药物对PHG门静脉血管构型的影响, 目前国内未见相关报道. 因此, 本实验通过建立PHG大鼠模型, 应用AngⅡ1型受体拮抗剂缬沙坦进行干预后, 观察其降低门静脉压力的疗效及对门静脉血管壁TGF-β1蛋白表达和胶原纤维定量的影响, 以进一步明确缬沙坦的作用机制.
实验动物为成年健康♂Sprague-Dawley(SD)大鼠48只, 体质量200-220 g, 由上海第二军医大学实验动物中心提供(许可证号: scxk(沪)2008-0016). 缬沙坦(商品名: 代文, 北京诺华制药有限公司馈赠, 批号X0830), TGF-β1抗体(Santa Cruz公司, 货号为sc-146), SABC试剂盒(武汉博士德生物工程有限公司), Masson试剂盒(福州迈新生物技术开发有限公司).
1.2.1 动物分组和模型建立: 大鼠随机分成5组, 假手术组即对照组( n = 6)、模型组( n = 6)、缬沙坦预防组( n = 12)、缬沙坦正常剂量治疗组( n = 12)、缬沙坦加倍剂量治疗组( n = 12). 各组大鼠体质量、年龄相比无显著性差异. 本实验参照国内段进东等[11]的造模方法, 该方法可造成大鼠门静脉横截面积缩窄90%, 2 wk就能形成PHG模型. 具体方法如下: 模型组大鼠实验前24 h禁食, 自由饮水, 3%戊巴比妥钠溶液0.11-0.13 mL/100 g体质量腹腔内注射麻醉; 开腹后暴露并游离门静脉, 沿其纵轴外置一20 G钝性针头, 于近肝门处用3-0丝线结扎门静脉主干及外置针头后拔针, 形成肝前性门静脉狭窄; 假手术组仅游离门静脉主干而不结扎, 4 wk后与药物干预组一起进行指标检测. 缬沙坦预防组于造模开始每天清晨缬沙坦20 mg/kg灌胃, 1次/d, 连续4 wk. 缬沙坦常规剂量治疗组和加倍剂量治疗组在造模术后第3周给药, 前者每天清晨20 mg/kg灌胃, 1次/d; 后者40 mg/kg灌胃, 1次/d, 连续2 wk. 造模组和假手术组于术后第3周予等量0.9%NaCl溶液灌胃, 连续2 wk.
1.2.2 门静脉压力(portal venous pressure, PVP)及心率(heart rate, HR)测定: 造模4 wk后动物禁食12 h, 饮水, 3%戊巴比妥0.1 mL/100 g腹腔内麻醉后, 仰于一平面上, 用计时器记录其1 min的心跳数. 然后沿腹中线进腹, 切口长约3 cm, 暴露腹腔, 找到肠系膜上静脉和脾静脉汇合点上方, 将一充满肝素生理盐水的5号静脉输液针逆行穿刺刺入门静脉, 固定套管针后, 由助手连接到门静脉测压管, 测压管"0"点与大鼠右心房保持在同一水平面, 以最终水柱固定点为门静脉压力值. 术后结扎穿刺处血管.
1.2.3 门静脉血管标本制备: 完成门静脉压力和心率测定后取大鼠门静脉主干约1 cm, 4%多聚甲醛固定石蜡包埋, 4 μm厚连续切片, 行HE染色.
1.2.4 免疫组织化学染色检测门静脉血管壁TGF-β1蛋白表达: 采用SABC法, 严格按说明书操作. 免疫组织化学染色后先在光镜下做定性观察, 200倍高倍镜下每张切片测定3个视野, 通过显微摄像系统摄取图像, 在图像分析仪上测定其光密度值, 取平均值.
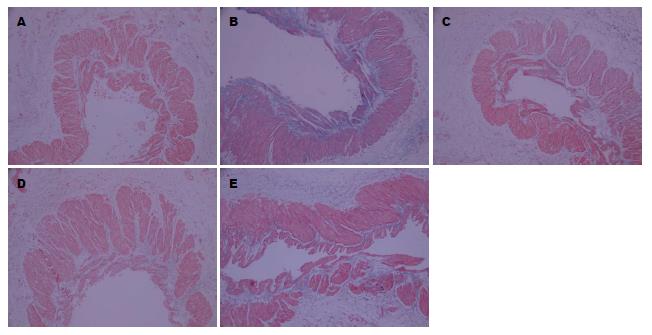
1.2.5 Masson三色染色法测定门静脉血管壁胶原纤维含量: 严格按说明书操作. 以蓝色胶原沉积为阳性信号, 染色后先在光镜下做定性观察, 200倍高倍镜下每张切片测定3个视野, 通过显微摄像系统摄取图像, 在图像分析仪上测定其光密度值, 取平均值.
统计学处理 采用SPSS13.0统计软件, 所得数据以mean±SD表示. 多组间比较采用单因素方差分析; 若方差齐性, 两两比较采用LSD法, 若方差不齐, 采用Dunnett T3检验. P<0.05为差异有统计学意义.
缬沙坦加倍剂量组大鼠死亡3只, 其中2只由于灌胃后呛咳、窒息死亡, 1只考虑为腹水伴腹腔感染, 缬沙坦预防组和正常剂量组分别有2只大鼠死亡, 死因为灌胃后呛咳、窒息. 造模组和假手术组无大鼠死亡.
造模组PVP明显上升, 与假手术组比较差异有统计学意义(P<0.01), 缬沙坦预防组、加倍剂量组和正常剂量组PVP与造模组比较明显降低(P<0.01), 虽然缬沙坦预防组、加倍剂量组和正常剂量组PVP逐渐升高, 但3组间比较无统计学差异(P>0.05, 表1).
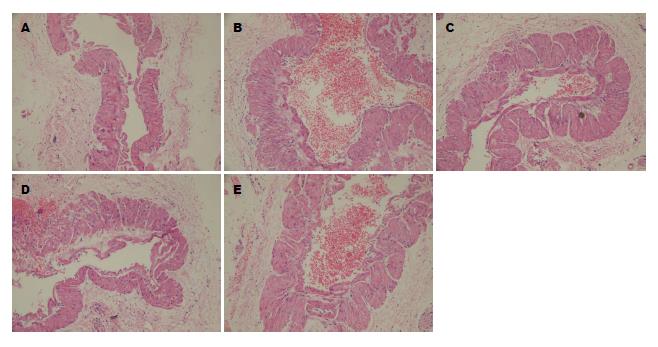
造模后1 wk大鼠开始厌食、懒动, 2 wk后腹腔增大, 厌食加剧. HE染色结果显示, 假手术组大鼠门静脉内膜光滑, 内皮细胞无破坏, 中膜平滑肌细胞排列整齐. 造模组门静脉管壁明显增厚, 内膜受损且增厚, 内皮细胞不完整, 附壁血栓形成. 中膜平滑肌细胞增多, 增大并排列紊乱. 缬沙坦预防组、正常剂量组和加倍剂量组大鼠内膜较光滑, 内皮细胞破坏不明显, 可见少量附壁血栓. 平滑肌细胞稍增多, 排列较整齐(图1).
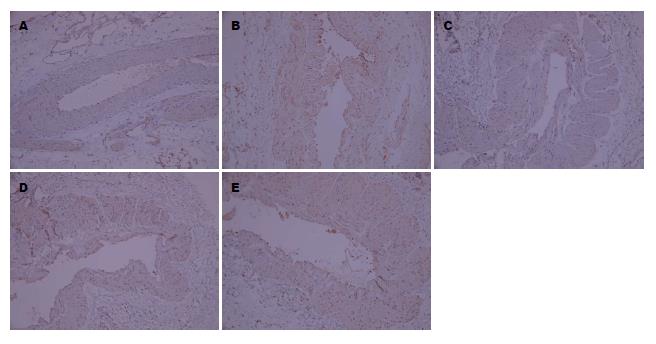
免疫组织化学结果显示, TGF-β1表达主要在门静脉血管内皮细胞和平滑肌细胞的细胞浆和细胞膜, 阳性结果为细胞质染成棕黄色, 细胞核染成淡蓝色. 造模组大鼠门静脉血管壁TGF-β1表达量明显增加, 与假手术组大鼠比较差异有统计学意义(P<0.01), 缬沙坦预防组、正常剂量组和加倍剂量组大鼠胃黏膜组织TGF-β1阳性表达水平较造模组降低(P<0.05), 但高于假手术组(图2, 表2).
PHG是指在门静脉高压基础上发生的胃黏膜病变, 常见于肝硬化伴PHT, 是发生上消化道出血的常见原因之一[12-14]. 该病的发生发展与PHT密切相关[15,16]. 近年国内外研究发现[2,17]PHT患者的内脏血管壁出现特征性的构型改变, 表现为内脏静脉的动脉化构型改建, 电镜下可见门静脉、脾静脉和胃冠状静脉均存在着明显的增殖、肥大、迁移、重构病变, 血管直径增加及弹性降低. 导致这种血管病变的机制目前仍未完全阐明[18,19], 门脉系统的血流动力学改变[20,21]、免疫反应[2]、基因调控[22,23]、血管活性物质[24,25]等因素可能参与了门脉高压性血管病变的过程. 有文献报道[2,26], PHT时门静脉血管病变格外明显, 具体表现为: (1)内膜明显增厚, 呈现弥漫性增厚和局灶性增厚斑, 形成新内膜, 增生斑块呈丘状突向腔内. 受损血管内皮表面有血小板和血细胞粘附聚集, 逐步形成微小血栓; (2)中膜明显增厚, 平滑肌增生肥大, 肌纤维粗大, 层次增多, 排列紊乱; (3)静脉壁增厚, 包括内膜下间隙和中膜内平滑肌细胞增多和细胞外基质的异常积聚. 我们通过直接光镜下观察门静脉血管壁发现, 造模组门静脉血管壁增厚, 内膜受损, 内皮细胞肿胀, 可见附壁血栓形成, 而假手术组血管壁内膜完整, 内皮细胞排列整齐, 内皮细胞损伤不明显, 与上述文献结果一致.
胶原纤维是一种重要的血管细胞外基质蛋白, 可保持血管壁的韧性和强度. TGF-β对于基质蛋白聚集和胶原纤维沉积具有重要调控作用. TGF-β在减少基质降解酶及增加抑制剂合成的同时, 还促进成纤维细胞增殖, 在血管病变的发生发展中起关键作用[27,28]. TGF-β1在哺乳动物体细胞中所占比例最高(>90%), 活性最强, 与疾病关系最密切[29]. 本课题组研究发现造模组大鼠门静脉血管壁TGF-β1蛋白水平及胶原纤维含量明显高于假手术组(P<0.01), 提示TGF-β1参与了门静脉血管胶原的合成, 促进血管壁纤维增生, 导致血管构型改变. 其原因可能是: (1)PHG时血管组织缺氧, 门静脉血管内皮层受损, 以及血管纤维化及平滑肌细胞大量增生影响氧和物质交换, 缺氧产生代谢物质和氧自由基, 刺激血管壁表达TGF-β1[30]; (2)PHT导致门静脉系统血流加速、血流量增加, 高动力循环直接导致门静脉血管壁受损, 内皮细胞完整性的破坏可以直接刺激血管壁表达TGF-β1; (3)循环及血管局部其他细胞因子如低氧诱导因子(hypoxia induced factor 1, HIF1)、结缔组织生长因子(connective tissue growth factor, CTGF)等可以刺激血管平滑肌表达TGF-β1[31].
目前, 缬沙坦作为一种新型降压药物, 在降低门静脉压力和保护肝脏方面的作用机制引起多数学者的关注[7,8]. 本研究发现, 缬沙坦确实能够降低门静脉压力, 缬沙坦干预各组大鼠的门静脉压力明显低于造模组(P<0.01), 进一步资料分析, 缬沙坦正常剂量组、加倍剂量组和预防组大鼠的门静脉压力逐渐降低, 但3组间比较差异无统计学意义, 提示我们尽早应用AngⅡ1型受体拮抗剂可能会取得较好的降低门脉压力疗效. 但是我们也看到缬沙坦并不能阻止门脉高压症和PHG的最终形成. 缬沙坦通过阻断AngⅡ1型受体来特异性拮抗AngⅡ的作用, 从而抑制TGF-β1合成和表达[32,33]. 应用缬沙坦干预后门静脉管壁轻度增厚, 内膜受损较轻, 内皮细胞稍有肿胀, 排列较规整, 附壁血栓减少. 缬沙坦预防组、正常剂量组和加倍剂量组大鼠门静脉TGF-β1蛋白表达水平与胶原纤维含量均明显低于造模组(P<0.05), 推测缬沙坦通过抑制TGF-β1蛋白表达进一步导致内皮细胞凋亡减少, 平滑肌细胞增殖、迁移、重构和细胞外基质合成明显减弱, 减少血管胶原纤维合成, 对门静脉血管壁具有一定保护作用. 但是我们也发现, 缬沙坦干预各组间门静脉血管壁TGF-β1蛋白表达水平与胶原纤维含量比较无显著性差异, 提示缬沙坦对门静脉血管壁的保护作用与用药剂量和时间无明显关系.
总之, 门静脉系统持续高压力和高血流量的刺激是引起门静脉血管内膜损伤的主要因素. 肝硬化时肝、肾功能障碍、氧自由基清除率下降, 门静脉血中有害物质及氧自由基可直接损伤血管内膜, 内皮损伤后处直接影响血管结构外, 其释放的血管活性物质对循环的影响更严重. 本研究证实, PHG大鼠存在门静脉血管内膜损伤, 血管活性物质TGF-β1释放增加, 缬沙坦可能通过抑制TGF-β1的释放, 减少血管壁胶原纤维合成, 有助减缓门静脉血管病变的发展.
肝硬化门脉高压性胃病是肝功能失代偿期的表现, 其所致的上消化道出血仅次于食管胃底静脉曲张破裂出血. 加之此类患者凝血功能差, 常导致肝脏功能进一步恶化, 加速肝性脑病、肝肾综合征等并发症出现, 影响患者预后. 选择既能平稳降低门脉压力, 又能改善肝脏功能药物已经成为人们关注的热点.
张宗明, 教授, 清华大学第一附属医院消化医学中心
肝硬化门脉高压症是导致门脉高压性胃病的重要发病机制之一, 有效降低门脉高压理论上可以阻止和改善胃黏膜病变. 目前治疗方法包括手术、介入和药物. 肝移植手术费用高, 肝源少; 经颈静脉肝内门腔静脉分流术(transjugular intrahepatic portosystemic shunt, TIPS)短期内能够降低门脉高压, 但远期并发症较多; 药物治疗是目前研究热点.
研究报道肝硬化门脉高压性胃病是一种血管性疾病, 血管紧张素Ⅱ与肝硬化门脉高压症的形成密切相关. 血管紧张素Ⅱ1型受体拮抗剂沙坦类药物能够降低门静脉压力, 改善胃黏膜微循环, 且不良反应少, 不引起明显的血压、心率改变.
缬沙坦改善肝硬化门脉高压性胃黏膜病变的作用机制目前不十分清楚. 本课题发现缬沙坦能够调控门静脉血管TGF-β1的合成和分泌, 减少门静脉管壁胶原纤维形成, 减少血管损伤, 减轻血管病变的程度.
肝硬化门脉高压性胃病及其并发症是肝硬化患者的主要威胁. 缬沙坦能够通过降低大鼠门静脉血管阻力、减少水钠潴留、减轻门静脉血管损伤, 降低血管构型改建等多种作用治疗门脉高压性胃病相关的内脏血管病变. 为临床使用缬沙坦提供了理论依据.
文章具有一定的科学性、创新性和可读性.
编辑: 郭鹏 电编:鲁亚静
| 1. | Khomeriki SG, Zhukov AG. [Morphological features of the gastric mucosa capillary network in patients with portal hypertension]. Arkh Patol. 2011;73:43-47. [PubMed] |
| 3. | Jia D, Duan F, Peng P, Sun L, Liu X, Wang L, Wu W, Ruan Y, Gu J. Up-regulation of RACK1 by TGF-β1 promotes hepatic fibrosis in mice. PLoS One. 2013;8:e60115. [PubMed] [DOI] |
| 4. | Sun YC, Liang Q, Qian KL, Xiao L, Liu Q, Shi XF. [Effect of TGF-b1 siRNA-mediated silencing on Smad proteins in hepatic fibrosis rats]. Zhonghua Ganzangbing Zazhi. 2012;20:289-293. [PubMed] |
| 6. | Al-Busafi SA, McNabb-Baltar J, Farag A, Hilzenrat N. Clinical manifestations of portal hypertension. Int J Hepatol. 2012;2012:203794. [PubMed] [DOI] |
| 7. | Fierbinteanu-Braticevici C, Dragomir P, Tribus L, Negreanu L, Bengus A, Usvat R, Andronescu D. The effect of valsartan, an angiotensin II receptor antagonist, on portal and systemic hemodynamics and on renal function in liver cirrhosis. J Gastrointestin Liver Dis. 2006;15:337-342. [PubMed] |
| 8. | Huo LJ, Zhang SJ, Liu Y. [Clinical evaluation of valsartan on portal hypertension in patients with hepatic cirrhosis]. Zhonghua Ganzangbing Zazhi. 2010;18:622-623. [PubMed] |
| 9. | Hidaka H, Nakazawa T, Shibuya A, Minamino T, Takada J, Tanaka Y, Okuwaki Y, Watanabe M, Koizumi W. Effects of 1-year administration of olmesartan on portal pressure and TGF-beta1 in selected patients with cirrhosis: a randomized controlled trial. J Gastroenterol. 2011;46:1316-1323. [PubMed] |
| 12. | Kalafateli M, Triantos CK, Nikolopoulou V, Burroughs A. Non-variceal gastrointestinal bleeding in patients with liver cirrhosis: a review. Dig Dis Sci. 2012;57:2743-2754. [PubMed] [DOI] |
| 13. | Fontana RJ, Sanyal AJ, Ghany MG, Bonkovsky HL, Morgan TR, Litman HJ, Reid AE, Lee WM, Naishadham D. Development and progression of portal hypertensive gastropathy in patients with chronic hepatitis C. Am J Gastroenterol. 2011;106:884-893. [PubMed] |
| 14. | de Macedo GF, Ferreira FG, Ribeiro MA, Szutan LA, Assef MS, Rossini LG. Reliability in endoscopic diagnosis of portal hypertensive gastropathy. World J Gastrointest Endosc. 2013;5:323-331. [PubMed] [DOI] |
| 16. | Cubillas R, Rockey DC. Portal hypertensive gastropathy: a review. Liver Int. 2010;30:1094-1102. [PubMed] |
| 17. | Kovaleva OI, Khomeriki SG, Zhukov AG, Koviazina IO, Golovanova EV. [Capillary collusion of gastric mucosa in patients with Helicobacter pylori gastritis and portal hypertension]. Eksp Klin Gastroenterol. 2010;13-18. [PubMed] |
| 18. | Li T, Yang Z. Research progress of vasculopathy in portal hypertension. World J Gastroenterol. 2005;11:6079-6084. [PubMed] |
| 19. | Lo GH. Mechanism of portal hypertensive gastropathy: an unresolved issue. J Gastroenterol Hepatol. 2009;24:1482-1483. [PubMed] [DOI] |
| 21. | Curvêlo LA, Brabosa W, Rhor R, Lanzoni V, Parise ER, Ferrari AP, Kondo M. Underlying mechanism of portal hypertensive gastropathy in cirrhosis: a hemodynamic and morphological approach. J Gastroenterol Hepatol. 2009;24:1541-1546. [PubMed] [DOI] |
| 22. | Marques C, Mauriz JL, Simonetto D, Marroni CA, Tuñon MJ, González-Gallego J, Marrón NP. Glutamine prevents gastric oxidative stress in an animal model of portal hypertension gastropathy. Ann Hepatol. 2011;10:531-539. [PubMed] |
| 23. | Lan C, Sun X, Dong L, Huang B, Yuan S, Wu K. The role of endotoxin in the pathogenesis of gastric mucosal damage in cirrhotic rats with portal hypertensive gastropathy. Asian Pac J Trop Med. 2011;4:212-214. [PubMed] [DOI] |
| 24. | Pan WD, Liu Y, Lin N, Xu R. The expression of PEDF and VEGF in the gastric wall of prehepatic portal hypertensive rats. Hepatogastroenterology. 2011;58:2152-2155. [PubMed] [DOI] |
| 25. | Shibuya M. Vascular endothelial growth factor-dependent and -independent regulation of angiogenesis. BMB Rep. 2008;41:278-286. [PubMed] |
| 26. | Kitao A, Sato Y, Sawada-Kitamura S, Harada K, Sasaki M, Morikawa H, Shiomi S, Honda M, Matsui O, Nakanuma Y. Endothelial to mesenchymal transition via transforming growth factor-beta1/Smad activation is associated with portal venous stenosis in idiopathic portal hypertension. Am J Pathol. 2009;175:616-626. [PubMed] [DOI] |
| 28. | 马 绍骏. 转化生长因子β1在血管损伤后再狭窄形成中的作用. 中国组织工程研究与临床康复. 2008;12:5965-5968. |
| 29. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] |
| 30. | Molina F, Rua A, Peinado MA, Del Moral ML. Short-term hypoxia/reoxygenation activates the angiogenic pathway in rat caudate putamen. J Biosci. 2013;38:363-371. [PubMed] |
| 31. | Lee YK, Kim EJ, Lee JE, Noh JW, Kim YG. Hypoxia induces connective tissue growth factor mRNA expression. J Korean Med Sci. 2009;24 Suppl:S176-S182. [PubMed] [DOI] |
| 32. | Subeq YM, Ke CY, Lin NT, Lee CJ, Chiu YH, Hsu BG. Valsartan decreases TGF-β1 production and protects against chlorhexidine digluconate-induced liver peritoneal fibrosis in rats. Cytokine. 2011;53:223-230. [PubMed] [DOI] |
| 33. | Gong ZJ, Song SL, Huang YQ, Ruan P. [Effects of perindopril and valsartan on the expression of TGF beta 1 and TGF beta receptor II mRNA, Smad3 and Smad7 in experimental hepatic fibrotic rats]. Zhonghua Ganzangbing Zazhi. 2004;12:737-740. [PubMed] |