修回日期: 2013-08-16
接受日期: 2013-08-29
在线出版日期: 2013-09-18
目的: 探讨信号转导和转录活化因子3(signal transducers and activators of transcription 3, STAT3)、p-STAT3蛋白在胃癌中表达与胃癌上皮间质转化的关系及其在胃癌浸润转移中的作用.
方法: 采用免疫组织化学方法检测53例胃癌组织中STAT3、p-STAT3蛋白及上皮标志物E-钙粘蛋白(E-cadherin)和间质标志物波形蛋白(Vimentin)的表达, 分析其与胃癌临床病理特征间的关系及相互之间的相关性.
结果: STAT3、p-STAT3、Vimentin蛋白在胃癌组织中的阳性表达率明显高于其在正常胃黏膜中的阳性表达率, 差异均有统计学意义(均P<0.01), 而E-cadherin在胃癌组织中的阳性表达率显著低于其在正常胃黏膜中的阳性表达率, 差异有统计学意义(P<0.01). STAT3、p-STAT3、E-cadherin、Vimentin蛋白的表达与胃癌分化程度、浸润深度、淋巴结转移、临床分期均明显相关(均P<0.05), 而与性别、年龄、肿瘤大小无明显相关性(P>0.05). STAT3、p-STAT3蛋白的表达和E-cadherin蛋白的表达均呈负相关(r = -0.360, P = 0.008; r = -0.335, P = 0.014), STAT3、p-STAT3蛋白的表达与Vimentin蛋白的表达均呈正相关(r = 0.443, P = 0.001; r = 0.346, P = 0.011).
结论: STAT3和p-STAT3蛋白在胃癌中表达上调, 与E-cadherin及Vimentin蛋白的表达显著相关, 提示STAT3蛋白活化可能参与调节胃癌EMT.
核心提示: 信号转导和转录活化因子(signal transducers and activators of transcription 3, STAT3)信号通路异常活化后, 可能下调E-cadherin蛋白的表达, 上调Vimentin蛋白的表达, 进而参与调节胃癌EMT、促进胃癌的侵袭转移, 阻断STAT3通路可能成为胃癌治疗的新策略.
引文著录: 卢书明, 陈美如, 宣金燕, 刘丽娜, 吕申, 李岩. 信号转导与转录活化因子3与胃癌上皮间质转化的关系及意义. 世界华人消化杂志 2013; 21(26): 2748-2753
Revised: August 16, 2013
Accepted: August 29, 2013
Published online: September 18, 2013
AIM: To detect the expression of signal transducer and activator of transcription 3 (STAT3) and phosphorylated STAT3 (p-STAT3) in gastric carcinoma (GC) and to analyze their relationship with epithelial-mesenchymal transition (EMT), tumor invasion and metastasis.
METHODS: The expression of STAT3, p-STAT3, E-cadherin and Vimentin proteins in 53 GC specimens and matched normal gastric mucosal specimens was detected by immunohistochemistry. The correlation of expression of STAT3, p-STAT3, E-cadherin and Vimentin proteins with clinicopathological parameters of GC was analyzed.
RESULTS: The positive rates of STAT3, p-STAT3 and Vimentin expression were significantly higher and that of E-cadherin was significantly lower in GC than that in normal gastric mucosal tissues (all P < 0.01). The expression of STAT3, p-STAT3, E-cadherin and Vimentin proteins was significantly correlated with tumor differentiation, depth of invasion, lymph node metastasis and clinical stage (all P < 0.05), but not with gender, age, tumor size (all P > 0.05). STAT3 and p-STAT3 expression was negatively correlated with E-cadherin expression (r = -0.360, -0.335; P = 0.008, 0.014), but positively with Vimentin expression (r = 0.443, 0.346; P = 0.001, 0.011) in GC.
CONCLUSION: STAT3 and p-STAT3 protein expression is up-regulated in GC, and up-regulation of STAT3 and p-STAT3 protein expression in GC is significantly correlated with E-cadherin and Vimentin expression. These findings suggest that EMT may be mediated by the activation of the STAT3 signaling pathway.
- Citation: Lu SM, Chen MR, Xuan JY, Liu LN, Lv S, Li Y. Relationship between STAT3 activation and epithelial-mesenchymal transition in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(26): 2748-2753
- URL: https://www.wjgnet.com/1009-3079/full/v21/i26/2748.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i26.2748
近年来研究发现信号转导和转录活化因子(signal transducers and activators of transcription, STAT)3与多种恶性肿瘤发生发展密切相关, 持续活化的STAT3能促进肿瘤细胞增殖及浸润转移, 参与肿瘤细血管生成以及免疫调节等过程[1,2]. 上皮间质转化(epithelial to mesenchymal transition, EMT)指上皮细胞失去上皮特征而获得间质特征, 是许多肿瘤侵袭和转移的一个重要的过程, EMT可能与多种信号通路的异常激活有关[3]. 本研究检测胃癌组织中STAT3及其活化形式即磷酸化的STAT3(phosphorylated STAT3, p-STAT3)蛋白和上皮间质标志物E-钙粘蛋白(E-cadherin)、波形蛋白(Vimentin)的表达, 分析其与胃癌临床病理特征的关系及其相互之间的相关性, 进而探讨STAT3信号通路激活在胃癌侵袭、转移及EMT中的作用及意义.
收集2010-2011年大连医科大学附属第一医院诊断明确的胃癌手术切除组织标本53例. 其中男34例, 女19例; 年龄37-86岁, 中位年龄63岁, <60岁23例, ≥60岁30例; 肿瘤大小: <5 cm者28例, ≥5 cm者25例; 肿瘤浸润未达浆膜层者10例, 已达浆膜层者43例; 高中分化腺癌16例, 低分化腺癌18例, 黏液细胞癌19例, 无淋巴结转移者17例, 有淋巴结转移者36例; 采用2010年国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)TNM分期标准: Ⅰ-Ⅱ期26例, Ⅲ-Ⅳ期27例. 所有病例均经术前和术后病理切片确诊, 术前均未接受放疗和化疗. 另取因上消化系症状行胃镜检查活检并经病理证实的正常胃黏膜组织44例. 鼠抗人STAT3多克隆抗体、羊抗人p-STAT3多克隆抗体购自美国Santa Cruz公司, 鼠抗人Vimentin单克隆抗体、E-cadherin抗体即用型购自福建迈新生物有限公司, SP检测试剂盒及DAB显色试剂盒购自北京中杉金桥生物技术有限公司.
1.2.1 免疫组织化学法: 采用免疫组织化学SP法染色, 所有标本经40 g/L的甲醛固定, 石蜡包埋, 以4 μm厚连续切片, 进行脱蜡水化, 3%过氧化氢消除内源性过氧化物酶20 min, PBS冲洗3次, 每次3 min, 微波抗原修复10 min, 再PBS冲洗3次, 每次3 min, 正常山羊血清室温下封闭15 min, 滴加一抗(鼠抗人STAT3多克隆抗体、羊抗人p-STAT3多克隆抗体工作浓度均为1:500), 4℃冰箱过夜, PBS冲洗后加入生物素标记二抗, 37℃孵育30 min, PBS冲洗后滴加辣根过氧化物酶37℃孵育30 min, PBS冲洗3次, 每次3 min, DAB显色, 流水冲洗10 min, 苏木素复染, 脱水、透明, 中性树胶封片, 镜检. 用已知阳性表达的组织切片作为阳性对照, 用PBS缓冲液代替一抗作为阴性对照.
1.2.2 结果判断: 以细胞核或细胞质内出现棕黄色或棕褐色颗粒为阳性细胞. 按阳性细胞所占的百分比及着色强度进行结果判定: (1)按着色强度评分: 0分为无着色; 1分为浅黄色; 2为黄色; 3分为棕黄色. (2)按阳性细胞数占同类细胞数的百分比评分: 0分为阴性, 1分为阳性细胞数≤10%, 2分为阳性细胞数11%-50%, 3分为阳性细胞数51%-75%, 4分为阳性细胞数>75%. 取两项评分之积作为总积分, 0-3分为阴性(-), 3分以上为阳性(+).
统计学处理 应用SPSS18.0软件进行数据分析. 免疫组织化学结果采用χ2检验、Fisher确切概率法, 相关性分析采用Spearman相关分析, 以P<0.05为差异具有统计学意义.
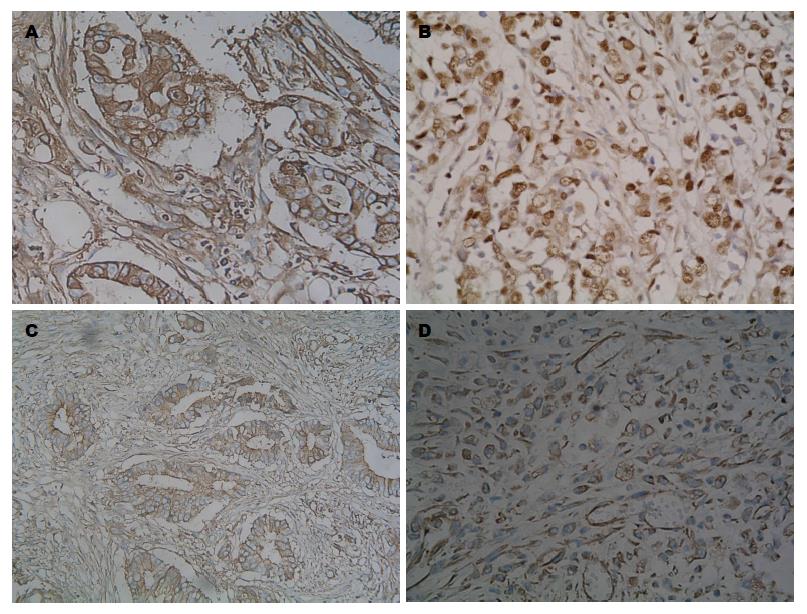
STAT3蛋白表达主要在细胞浆, 其在胃癌组织中阳性表达率(83.0%, 44/53)显著高于正常胃黏膜组织(22.7%, 10/44)(P<0.01); p-STAT3蛋白表达在细胞核和细胞浆, 以细胞核为主, 其在胃癌组织中的阳性表达率(79.2%, 42/53)显著高于正常胃黏膜组织(18.2%, 8/44)(P<0.01); E-cadherin蛋白表达主要在细胞膜和细胞浆, 在胃癌组织中的阳性表达率(49.1%, 26/53)显著低于正常胃黏膜组织(97.7%, 43/44)(P<0.01); Vimentin蛋白表达在细胞浆及间质, 在胃癌组织中的阳性表达率(67.9%, 36/53)显著高于正常胃黏膜组织(15.9%, 7/44)(P<0.01)(图1, 表1).
| 分组 | n | STAT3蛋白 | p-STAT3蛋白 | E-cadherin蛋白 | Vimentin蛋白 | ||||||||
| + | % | P值 | + | % | P值 | + | % | P值 | + | % | P值 | ||
| 胃癌 | 53 | 44 | 83.0 | 0.000 | 42 | 79.2 | 0.000 | 26 | 49.1 | 0.000 | 36 | 67.9 | 0.000 |
| 正常胃黏膜 | 44 | 10 | 22.7 | 8 | 18.2 | 43 | 97.7 | 7 | 15.9 | ||||
STAT3、p-STAT3、Vimentin蛋白在胃癌组织中的表达随着浸润深度加深、分化程度降低、发生淋巴结转移及临床分期越高而表达增高, 组别间的差异均有统计学意义(P<0.05); 而E-cadherin蛋白表达随着胃癌浸润深度加深、分化程度降低、发生淋巴结转移及临床分期越高而表达减少, 差异均有统计学意义(P<0.05); STAT3、p-STAT3、E-cadherin、Vimentin蛋白的表达与胃癌患者性别、年龄、肿瘤大小均无明显相关性(P>0.05)(表2).
| 分组 | n | STAT3蛋白 | p-STAT3蛋白 | E-cadherin蛋白 | Vimentin蛋白 | ||||||||
| + | % | P值 | + | % | P值 | + | % | P值 | + | % | P值 | ||
| 性别 | 1.000 | 1.000 | 0.569 | 1.000 | |||||||||
| 男 | 34 | 28 | 82.4 | 27 | 79.4 | 18 | 52.9 | 23 | 67.6 | ||||
| 女 | 19 | 16 | 84.2 | 15 | 78.9 | 8 | 42.1 | 13 | 68.4 | ||||
| 年龄(岁) | 0.478 | 0.501 | 0.785 | 0.772 | |||||||||
| <60 | 23 | 18 | 78.3 | 17 | 73.9 | 12 | 52.2 | 15 | 65.2 | ||||
| ≥60 | 30 | 26 | 86.7 | 25 | 83.3 | 14 | 46.7 | 21 | 70.0 | ||||
| 肿瘤大小(cm) | 0.474 | 0.183 | 0.586 | 0.257 | |||||||||
| <5 | 28 | 22 | 78.6 | 20 | 71.4 | 15 | 53.6 | 17 | 60.7 | ||||
| ≥5 | 25 | 22 | 88.0 | 22 | 88.0 | 11 | 44.0 | 19 | 76.0 | ||||
| 浸润深度 | 0.053 | 0.023 | 0.039 | 0.008 | |||||||||
| 未侵及浆膜 | 10 | 6 | 60.0 | 5 | 50.0 | 8 | 80.0 | 3 | 30.0 | ||||
| 侵及浆膜 | 43 | 38 | 88.4 | 37 | 86.0 | 18 | 41.9 | 33 | 76.7 | ||||
| 分化程度 | 0.002 | 0.001 | 0.018 | 0.003 | |||||||||
| 高中分化 | 16 | 9 | 56.3 | 8 | 50.0 | 12 | 75.0 | 6 | 37.5 | ||||
| 低分化/黏液癌 | 37 | 35 | 94.6 | 34 | 91.9 | 14 | 37.8 | 30 | 81.1 | ||||
| 淋巴结转移 | 0.023 | 0.000 | 0.008 | 0.010 | |||||||||
| 无 | 17 | 11 | 64.7 | 8 | 47.1 | 13 | 76.5 | 7 | 41.2 | ||||
| 有 | 36 | 33 | 91.7 | 34 | 94.4 | 13 | 36.1 | 29 | 80.6 | ||||
| 临床分期 | 0.050 | 0.015 | 0.029 | 0.008 | |||||||||
| Ⅰ-Ⅱ | 26 | 18 | 76.9 | 17 | 65.4 | 17 | 65.4 | 13 | 50.0 | ||||
| Ⅲ-Ⅳ | 27 | 26 | 96.3 | 25 | 92.6 | 9 | 33.3 | 23 | 85.2 | ||||
胃癌组织中STAT3蛋白表达与E-cadherin蛋白表达呈负相关(r = -0.360, P = 0.008), 与Vimentin蛋白的表达呈正相关(r = 0.443, P = 0.001); p-STAT3蛋白表达与E-cadherin蛋白表达呈负相关(r = -0.335, P = 0.014), 与Vimentin蛋白的表达呈正相关(r = 0.346, P = 0.011)(表3).
| E-cadherin | n | r | P值 | V imentin | n | r | P值 | ||||
| + | - | + | - | ||||||||
| STAT3 | + | 18 | 26 | 44 | -0.360 | 0.008 | 34 | 10 | 44 | 0.443 | 0.001 |
| - | 8 | 1 | 9 | 2 | 7 | 9 | |||||
| n | 26 | 27 | 53 | 36 | 17 | 53 | |||||
| p-STAT3 | + | 17 | 25 | 42 | -0.335 | 0.014 | 32 | 10 | 42 | 0.346 | 0.011 |
| - | 9 | 2 | 11 | 4 | 7 | 11 | |||||
| n | 26 | 27 | 53 | 36 | 17 | 53 | |||||
STAT3是STATs家族的重要成员之一, 是Janus激酶(Janus kinase, JAK)/STAT信号传导通路中的关键信号因子, 在受到生长因子、细胞因子等细胞外信号刺激后, 以活化的p-STAT3形式进入细胞核中, 启动相应靶基因的转录, 进而发挥其对细胞增殖、凋亡等的调控作用[1]. 研究发现在多种恶性肿瘤标本及肿瘤细胞株中存在STAT3的异常表达与激活, 并发现STAT3与肿瘤的增殖分化、细胞凋亡、血管生成、侵袭转移密切相关, 并可能作为预测肿瘤预后的指标[4,5].
Yakata等[6]报道人胃癌组织中及MKN28和SCH两种人胃癌细胞株中有STAT3蛋白的组成性激活, p-STAT3蛋白的表达与胃癌的浸润、淋巴结转移密切相关, 同时发现p-STAT3阳性表达患者预后更差, Xiong等[7]也报道p-STAT3可成为预测胃癌预后的分子生物学标记. 本研究发现胃癌组织中STAT3蛋白和p-STAT3蛋白的表达远高于正常胃黏膜组织(P<0.01), 进一步分析STAT3及p-STAT3蛋白表达与胃癌临床病理特征的关系, 发现随着胃癌分化程度降低、浸润深度增加、发生淋巴结转移及TNM分期升高, STAT3和p-STAT3蛋白的表达表达明显增加, 两者的表达与胃癌浸润深度、淋巴结转移及TNM分期密切相关(P<0.05), 提示STAT3蛋白激活不仅可能与胃癌的发生有关, 还可能在胃癌的进展中发挥重要作用. STAT3蛋白激活可能是胃癌发生及发展中的一个关键事件[8]. Okamoto等[9]报道STAT3蛋白激活既有助于胃癌细胞的生存, 还有助于癌细胞的运动. 沉默STAT3基因能够抑制胃癌细胞的生长[10], 还可诱导抗肿瘤的免疫效应, 联合自杀基因治疗可增加抗肿瘤效果[11], 一些药物通过抑制STAT3信号通路进而抑制胃癌细胞生长、诱导癌细胞周期停滞及诱导细胞凋亡, STAT3可望成为胃癌治疗的潜在靶点.
EMT与恶性肿瘤的浸润转移密切相关. 肿瘤发生EMT的一个重要特征就是在上皮标志物如E-cadherin和Cytokeratin等表达减少, 而间质标志物如N-cadherin和Vimentin等表达增加. E-cadherin是一种主要的上皮细胞黏附分子, 为钙依赖性跨膜糖蛋白, 介导细胞间黏附被、参与细胞的信号转导, 而且发现与肿瘤的侵袭和转移行为密切相关, 目前认为E-cadherin是一种肿瘤抑制基因, 其表达减少或缺失可能使癌细胞易从原发灶脱落向外周浸润性生长进而发生侵袭转移[12]. 我们研究发现E-cadherin蛋白在胃癌组织中表达较其在正常胃黏膜表达相比明显下降, E-cadherin蛋白表达与胃癌浸润和淋巴结转移密切相关, 提示E-cadherin胃癌的浸润转移中可能起重要作用.
Vimentin主要分布于间叶组织及细胞, 在维持和调节细胞功能中发挥着重要作用, 其表达增多使得细胞骨架结构变化, 上皮源性细胞由立方形变为纺锤形纤维样细胞, 更易于迁移游动, 而细胞骨架结构的变化可干扰信号传导系统的正常工作, 可导致细胞生物学性状改变, 如黏附性下降, 运动能力增强[3]. 研究发现Vimentin在上皮性肿瘤尤其是低分化癌中表达增高, 而且与肿瘤浸润及淋巴结转移密切相关, 在体外实验中发现癌细胞中间质细胞形态的出现、维持以及癌细胞的侵袭力, 需要Vimentin蛋白的参与[13]. 本研究发现Vimentin蛋白在胃癌组织中的表达明显高于其在正常胃黏膜组织中的表达, 且Vimentin蛋白的表达胃癌的分化、浸润、淋巴结转移及临床分期均明显相关, 提示Vimentin蛋白表达增高可能参与胃癌的发生、浸润和转移. Otsuki等[14]报道胃癌组织Vimentin mRNA的表达与胃癌的复发或远处转移有关, 而且Vimentin mRNA表达越高的患者预后越差, 单因素分析显示Vimentin mRNA与胃癌患者预后有关, 但多因素分析显示Vimentin mRNA不是独立预后因子. 我们发现胃癌组织中E-cadherin表达减少, Vimentin表达增加, 且与胃癌浸润、淋巴结转移、临床分期等均相关, 提示胃癌细胞发生EMT, 进而参与胃癌的浸润、转移. 有研究显示抑制肿瘤细胞的EMT可阻止肿瘤浸润和转移过程, 将为肿瘤的治疗带来希望.
研究发现EMT过程涉及到多种基因的改变, 也与多种信号通路的异常激活有关, 如转化生长因子-β(transforming growth factor-β, TGF-β)信号途径、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B, PI3K/Akt)信号途径、核转录因子κB(nuclear factor-κB, NF-κB)信号通路等[3]. 近来报道STAT3通路可能参与恶性肿瘤的EMT发生过程. LO等[15]发现表皮生长因子(epidermal growth factor, EGF)/表皮生长因子受体(epidermal growth factor receptor, EGFR)信号通路可通过STAT3通路上调Twist基因表达来诱导多种癌细胞的EMT. Colomiere等[16]报道EGF可激活JAK2/STAT3通路进而诱导卵巢癌细胞的EMT, 而阻断STAT3通路的激活不影响EGF诱导的卵巢癌细胞形态的变化, 但可抑制癌细胞的运动、Vimentin、N-cadherin蛋白的表达以及IL-6的产生. 本研究显示, STAT3、p-STAT3蛋白与E-cadherin蛋白的表达呈负相关, 与Vimentin蛋白的表达呈正相关, 提示胃癌中EMT的发生可能与STAT3信号通路的激活相关. STAT3信号通路异常活化后, 可能下调E-cadherin蛋白的表达, 上调Vimentin蛋白的表达, 最终诱导胃癌的EMT发生. STAT3通路激活可能参与调节胃癌细胞EMT, 进而促进胃癌的侵袭转移, 阻断STAT3通路可能成为胃癌治疗的新策略, 但尚需进一步研究.
信号转导和转录活化因子(signal transducers and activators of transcription, STAT)3与多种恶性肿瘤发生发展密切相关, 持续活化的STAT3能促进肿瘤细胞增殖及浸润转移. 上皮间质转化(epithelial to mesenchymal transition, EMT)是许多肿瘤侵袭和转移的一个重要过程. EMT可能与多种信号通路的异常激活有关.
潘阳林, 副教授, 副主任医师, 第四军医大学西京医院消化病医院消化六科
本研究探讨STAT3通路激活与胃癌EMT的关系, 有助于了解胃癌的侵袭转移的机制, 特异性阻断STAT3通路可望为胃癌的治疗提供新策略..
Okamoto等报道STAT3蛋白激活既有助于胃癌细胞的生存, 还有助于癌细胞的运动. 而特异性阻断STAT3信号通路能够抑制胃癌细胞生长、诱导癌细胞周期停滞及诱导细胞凋亡, STAT3通路可能成为胃癌的潜在治疗靶点.
有关STAT3通路是否参与调节胃癌EMT的研究报道较少. 本研究检测胃癌中STAT3、p-STAT3蛋白及上皮与间质标志物E-cadherin、Vimentin的表达, 探讨STAT3通路活化与胃癌EMT的关系及其在胃癌浸润转移中的作用.
研究结果显示STAT3和p-STAT3蛋白在胃癌中表达上调, 与E-cadherin及Vimentin蛋白的表达显著相关, 提示STAT3蛋白活化可能参与调节胃癌EMT, 为进一步揭示胃癌侵袭转移的机制及通过阻断信号通路治疗胃癌提供理论依据.
本课题设计合理、方法恰当、数据分析充分, 写作态度严谨, 具有较高的学术价值.
编辑: 田滢 电编: 闫晋利
| 1. | Devarajan E, Huang S. STAT3 as a central regulator of tumor metastases. Curr Mol Med. 2009;9:626-633. [PubMed] [DOI] |
| 2. | Schindler C, Levy DE, Decker T. JAK-STAT signaling: from interferons to cytokines. J Biol Chem. 2007;282:20059-20063. [PubMed] [DOI] |
| 3. | Zeisberg M, Neilson EG. Biomarkers for epithelial-mesenchymal transitions. J Clin Invest. 2009;119:1429-1437. [PubMed] [DOI] |
| 4. | Sato T, Neilson LM, Peck AR, Liu C, Tran TH, Witkiewicz A, Hyslop T, Nevalainen MT, Sauter G, Rui H. Signal transducer and activator of transcription-3 and breast cancer prognosis. Am J Cancer Res. 2011;1:347-355. [PubMed] |
| 5. | Huang C, Huang R, Chang W, Jiang T, Huang K, Cao J, Sun X, Qiu Z. The expression and clinical significance of pSTAT3, VEGF and VEGF-C in pancreatic adenocarcinoma. Neoplasma. 2012;59:52-61. [PubMed] [DOI] |
| 6. | Yakata Y, Nakayama T, Yoshizaki A, Kusaba T, Inoue K, Sekine I. Expression of p-STAT3 in human gastric carcinoma: significant correlation in tumour invasion and prognosis. Int J Oncol. 2007;30:437-442. [PubMed] |
| 7. | Xiong H, Du W, Wang JL, Wang YC, Tang JT, Hong J, Fang JY. Constitutive activation of STAT3 is predictive of poor prognosis in human gastric cancer. J Mol Med (Berl). 2012;90:1037-1046. [PubMed] [DOI] |
| 8. | Giraud AS, Menheniott TR, Judd LM. Targeting STAT3 in gastric cancer. Expert Opin Ther Targets. 2012;16:889-901. [PubMed] [DOI] |
| 9. | Okamoto W, Okamoto I, Arao T, Yanagihara K, Nishio K, Nakagawa K. Differential roles of STAT3 depending on the mechanism of STAT3 activation in gastric cancer cells. Br J Cancer. 2011;105:407-412. [PubMed] [DOI] |
| 10. | 童 强, 舒 晓刚, 卢 晓明, 黎 维勇, 陶 凯雄, 陈 道达, 王 国斌. shRNA干扰STAT3基因表达对胃癌细胞MKN-45体内外生物学特性的影响. 世界华人消化杂志. 2008;6:1568-1572. [DOI] |
| 11. | Ahn YH, Yi H, Shin JY, Lee KD, Shin SP, Lee SJ, Song J, Chun KH. STAT3 silencing enhances the efficacy of the HSV.tk suicide gene in gastrointestinal cancer therapy. Clin Exp Metastasis. 2012;29:359-369. [PubMed] |
| 12. | Stănculescu D, Mărgăritescu C, Stepan A, Mitruţ AO. E-cadherin in gastric carcinomas related to histological prognostic parameters. Rom J Morphol Embryol. 2011;52:1107-1112. [PubMed] |
| 13. | Vasko V, Espinosa AV, Scouten W, He H, Auer H, Liyanarachchi S, Larin A, Savchenko V, Francis GL, de la Chapelle A. Gene expression and functional evidence of epithelial-to-mesenchymal transition in papillary thyroid carcinoma invasion. Proc Natl Acad Sci USA. 2007;104:2803-2808. [PubMed] [DOI] |
| 14. | Otsuki S, Inokuchi M, Enjoji M, Ishikawa T, Takagi Y, Kato K, Yamada H, Kojima K, Sugihara K. Vimentin expression is associated with decreased survival in gastric cancer. Oncol Rep. 2011;25:1235-1242. [PubMed] [DOI] |
| 15. | Lo HW, Hsu SC, Xia W, Cao X, Shih JY, Wei Y, Abbruzzese JL, Hortobagyi GN, Hung MC. Epidermal growth factor receptor cooperates with signal transducer and activator of transcription 3 to induce epithelial-mesenchymal transition in cancer cells via up-regulation of TWIST gene expression. Cancer Res. 2007;67:9066-9076. [PubMed] [DOI] |
| 16. | Colomiere M, Ward AC, Riley C, Trenerry MK, Cameron-Smith D, Findlay J, Ackland L, Ahmed N. Cross talk of signals between EGFR and IL-6R through JAK2/STAT3 mediate epithelial-mesenchymal transition in ovarian carcinomas. Br J Cancer. 2009;100:134-144. [PubMed] [DOI] |