修回日期: 2013-09-06
接受日期: 2013-09-07
在线出版日期: 2013-09-18
目的: 观察肝移植术后早期麦考酚钠肠溶片(enteric-coated mycophenolate sodium, EC-MPS)药代动力学特点.
方法: 25例肝移植受者术后联合应用他克莫司Tacrolimus(FK506)和EC-MPS治疗. EC-MPS口服剂量为720 mg, 2次/d. 术后7、21 d分别在服药前及服药后1、1.5、2、2.5、3、4、6、8和12 h取外周血, 采用高效液相色谱法(high performance liquid chromalography, HPLC)测定血浆麦考酚酸(mycophenolic acid, MPA)浓度. WinNonlin软件计算MPA药时曲线下面积(area of concentration-time under the curve, AUC). 同时测定FK506谷浓度(FK506-C0 h)及肝、肾功能和血细胞记数.
结果: 合并43套数据, MPA-AUC0-12 h平均为40.36 (µg·h)/mL±17.20 (µg·h)/mL, Cmax为16.66 µg/mL±9.73 µg/mL, Tmax为3.14 h±1.78 h. MPA-C0 h -C12 h与MPA-AUC0-12 h的相关性不显著(r2<0.75). MPA-AUC0-12 h与FK506-C0 h、血清白蛋白水平及肌酐清除率显著相关性(P>0.05).
结论: 肝移植后早期患者服用EC-MPS MPA-AUC0-12 h个体间差异很大; 单个时间点MPA浓度不能有效反映MPA-AUC0-12 h; FK506-C0 h、血清白蛋白水平及肌酐清除率不影响MPA-AUC0-12 h.
核心提示: 本研究观察25例肝移植患者移植后口服麦考酚钠肠溶片(enteric-coated mycophenolate sodium, EC-MPS)早期麦考酚酸药代动力学特点, 了解在肝移植患者中EC-MPS药代动力学特点, 希望更好地为肝移植患者术后长期生存及临床指导用药带来帮助.
引文著录: 李鹏飞, 谢俊杰, 陈冰, 金佳斌, 邓侠兴, 陈皓, 沈柏用, 彭承宏. 肝移植受者早期EC-MPS药代动力学的临床特点. 世界华人消化杂志 2013; 21(26): 2728-2733
Revised: September 6, 2013
Accepted: September 7, 2013
Published online: September 18, 2013
AIM: To investigate the pharmacokinetics of enteric-coated mycophenolate sodium (EC-MPS) in liver transplant recipients early after transplantation.
METHODS: Twenty-five liver transplant recipient received tacrolimus and EC-MPS (720 mg, twice daily). Mycophenolic acid (MPA) concentrations were measured by high performance liquid chromalography (HPLC) before dosing (C0 h) and at 0.5 h (C0.5 h), 1 h (C1 h), 1.5 h (C1.5 h), 2 h (C2 h), 4 h (C4 h), 6 h (C6 h), 8 h (C8 h), 10 h (C10 h), and 12 h (C12 h) after dosing between days 7 and 21 postoperatively. Meanwhile, trough concentration (C0 h) of FK506, hepatic and renal function and blood cell counts were also measured. The WinNonlin software was used to calculate the area of concentration-time under the curve (AUC).
RESULTS: The average MPA-AUC0-12h was 40.36 (µg•h)/mL ± 17.20 (µg•h)/mL. The Cmax was 17.037 mg/L ± 7.632 mg/L, and the Tmax was 3.06 h ± 1.50 h. Individual concentrations of MPA-C0 h-C12 h were not significantly related with MPA-AUC0-12 h (r2 < 0.75). FK506-C0 h, serum albumin level and Cr-CL were not significantly correlated with MPA-AUC0-12 h (all P > 0.05).
CONCLUSION: The variability of MPA-AUC0-12 h is significant in liver transplant recipients early after transplantation. Single time-point MPA concentration can not reflect MPA-AUC0-12 h effectively. MPA-AUC0-12 h is less influenced by FK506 concentration, serum albumin and creatinine clearance.
- Citation: Li PF, Xie JJ, Chen B, Jin JB, Deng XX, Chen H, Shen BY, Peng CH. Pharmacokinetic characteristics of enteric-coated mycophenolate sodium in liver transplant recipients early after transplantation. Shijie Huaren Xiaohua Zazhi 2013; 21(26): 2728-2733
- URL: https://www.wjgnet.com/1009-3079/full/v21/i26/2728.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i26.2728
麦考酚钠肠溶片(enteric-coated mycophenolate sodium, EC-MPS), 商品名为米芙, 作为免疫抑制剂广泛应用于器官移植领域, 逐步成为器官移植免疫抑制的一线药物. EC-MPS是麦考酚酸(mycophenolic acid, MPA)的钠盐. MPA是一种选择性、非竞争性、可逆的次黄嘌呤单磷酸脱氢酶(hypoxanthine nucleotide dehydrogenase, IMPDH)抑制剂, 能够抑制鸟嘌呤核苷酸的经典合成途径, 阻止T淋巴细胞分裂及B细胞抗体形成. 本研究将观察25例肝移植患者移植后口服EC-MPS早期MPA药代动力学特点.
选择2010-05/2011-07在瑞金医院器官移植中心接受肝移植手术者25例. 乙型肝炎后肝硬化伴肝癌12例, 乙型肝炎后肝硬化7例, 重症肝炎肝硬化3例, 乙型肝炎后肝硬化肝豆状核变性2例, 多囊肝1例. 平均年龄46.96岁±12.69岁; 其中男20例, 女5例, 全部患者知情同意.
1.2.1 免疫抑制剂应用方案: 25例肝移植受者均采用三联免疫抑制方案EC-MPS+他克莫FK506+激素治疗. 术前6 h口服EC-MPS 720 mg. 术后每隔12 h口服EC-MPS 720 mg, 2次/d; 术后第2天起开始口服FK506, 同时监测FK506血药谷浓度(FK506-C0 h)以调整FK506口服剂量, 使其血药浓度维持在5-10 μg/mL. 其中15例患者术中及术后1 d静脉推注甲泼尼龙(methyl prednisolone, MP)500 mg, 以后停用. 10例患者, 术后第1-7天MP使用量从240 mg减至20 mg, 以后改用泼尼松20 mg口服.
1.2.2 检测指标: 患者于术后第7、21天采集外周静脉血, 进行下列检测: (1)血常规: 白细胞(white blood cell, WBC)、红细胞(red blood cell, RBC)、血红蛋白(hemoglobin, Hb)和血小板(platelet, PLT); (2)肝、肾功能、血清丙氨酸转氨酶(alanine aminotransferase, ALT)、血清天冬氨酸转氨酶(aspartate aminotransferase, AST)、血清碱性磷酸酶(alkaline phosphatase, AKP)、血清谷酞氨转肤酶(gamma-glutamyl transpeptidase, GGT)、总胆红素(total bilirubin, TBIL)、白蛋白(albumin, ALB)和血清肌酐(creatinine, Cr); (3)FK506谷浓度(FK506-C0 h). 观测指标: WBC<4×l09/L、Hb<110 g/L、PLT<100×l09/L、ALT>64 IU/L、TBIL>24 mmol/L、ALB<35 g/L、Cr>115 mmol/L视为异常.
1.2.3 MPA浓度测定方法: 于服药前及服药后0.5、1、l.5、2、4、6、8、10和12 h分别抽取外周血3 mL, 以肝素抗凝, 置4 ℃冰箱保存. 取血浆样品0.2 mL, 置于5 mL尖底试管中, 加人内标酞胺咪嗓溶液4 μL, 再加人2.5倍体积量的乙睛, 漩涡震荡30 s, 于4000 r/min离心10 min. 定量吸取上清液200 μL进行测定. 采用高效液相色谱法(high performance liquid chromalography, HPLC)测定患者各时段的血浆总MPA浓度, 分别标为MPA-C0-12 h并计算其药时曲线下面积(area of concentration-time under the curve, AUC). 探测的紫外线波长为254 nm, 血浆中MPA的最低检测浓度为0.25 ng/mL.
1.2.4 MPA药代动力学参数计算: 采用WinNonlin Professional 2.1药理学专用软件计算MPA药代动力学参数, MPA-AUC0-12 h采用梯形法则计算.
统计学处理 应用SPSS13.0统计软件处理数据. 计量资料用mean±SD表示. 同类数据间差异的比较采用独立样本t检验, 不同变量间比较采用Pearson相关分析和线性回归分析. P<0.05为差异具有统计学意义.
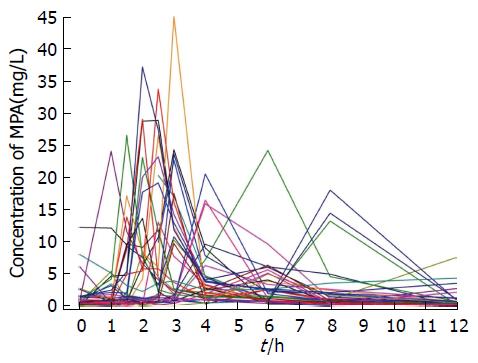
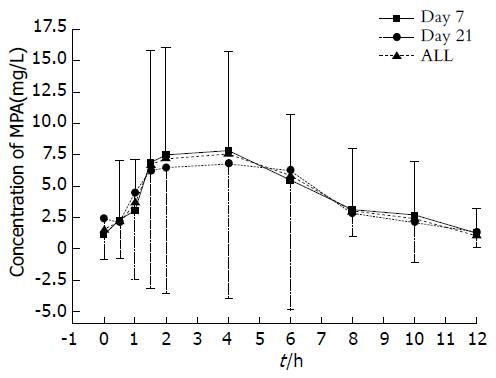
合并43套数据, MPA-AUC0-12 h为40.36 (μg·h)/mL±17.20 (μg·h)/mL, Cmax为16.66 μg/mL±9.73 μg/mL, Tmax为3.14 h±1.78 h. 药物半衰期平均为3.25 h±2.52 h. 术后7 d 25套及术后21 d 18套MPA药代动力学数据如表1所示. 术后1 mo内25例患者中3例发生白细胞减少、3例发生感染、1例出现恶心、呕吐及腹泻, 没有患者出现急性排斥反应.
| 检测项目 | 术后7 d | 术后21 d | 所有43套数据 |
| AUC[(μg·h)/mL] | 41.13±15.17 | 40.23±20.24 | 40.360±17.200 |
| Cmax(μg/mL) | 17.04±7.63 | 16.13±12.30 | 16.657±9.732 |
| Tmax(h) | 3.25±2.16 | 3.14±1.78 | 3.140±1.781 |
合计43套数据, MPA-C0 h-C12 h与MPA-AUC0-12 h相关性均很差, r2均小于0.75(表2).
| C0 h | C1 h | C1.5 h | C2 h | C2.5 h | C3 h | C4 h | C6 h | C8 h | C12 h | |
| r2 | 0.001 | 0.001 | 0.005 | 0.119 | 0.04 | 0.053 | 0.008 | 0.113 | 0.199 | 0.01 |
| P值 | 0.883 | 0.886 | 0.663 | 0.024 | 0.196 | 0.137 | 0.159 | 0.028 | 0.003 | 0.524 |
参照欧美移植人群MPA-AUC0-12 h最佳治疗窗30-60 (μg·h)/mL目标暴露范围. 本研究43套数据中MPA低暴露11例(25.58%), 目标暴露7例(58.14%), 高暴露组7例(16.28%). 低暴露组、目标暴露组、高暴露组的平均MPA-AUC0-12 h分别为: 20.94 (μg·h)/mL±6.66 (μg·h)/mL、40.68 (μg·h)/mL±8.14 (μg·h)/mL和69.74 (μg·h)/mL±5.82 (μg·h)/mL.
合计43套数据, 肝、肾功能、内生肌酐清除率和血WBC计数异常组与正常组相比MPA-AUC0-12 h无显著差异(P>0.05)(表3). MPA-AUC0-12 h与FK506-C0 h亦无显著相关性(P>0.05).
| 检测项目 | n | MPA-AUC0-12 h [(μg·h)/mL] | P值 |
| ALT(IU/L) | 0.11 | ||
| >64 | 26 | 40.80±16.95 | |
| <64 | 17 | 35.09±16.71 | |
| AST(IU/L) | 0.87 | ||
| >42 | 10 | 39.54±17.24 | |
| <42 | 33 | 40.61±17.45 | |
| AKP(IU/L) | 0.42 | ||
| >64 | 31 | 41.71±15.65 | |
| <64 | 12 | 36.88±21.07 | |
| GGT(IU/L) | 0.34 | ||
| >64 | 30 | 42.03 ±16.51 | |
| <64 | 13 | 36.52±18.83 | |
| ALB(g/L) | 0.34 | ||
| >35 | 31 | 41.94±18.22 | |
| <35 | 12 | 36.28±14.12 | |
| TBIL(mmol/L) | 0.46 | ||
| >24 | 34 | 39.35±17.23 | |
| <24 | 9 | 44.19±15.57 | |
| DBIL(IU/L) | 0.46 | ||
| >6.8 | 34 | 39.35±17.23 | |
| <6.8 | 9 | 44.19±17.57 | |
| Ccr(IU/L) | 0.91 | ||
| >120 | 17 | 40.00±16.02 | |
| <120 | 26 | 40.59±18.25 | |
| WBC(×109/L) | 0.13 | ||
| >4 | 15 | 34.87±14.31 | |
| <4 | 28 | 43.30±18.13 |
EC-MPS作为免疫抑制剂广泛应用于器官移植领域. EC-MPS是MPA的钠盐, 霉酚酸酯在体内通过转化为霉酚酸而发挥免疫抑制活性, MPA对淋巴细胞IMPDH的抑制导致了细胞内鸟苷酸的衰竭, 抑制DNA的合成, 限制淋巴细胞的增殖[1]. 肝移植受者口服霉酚酸酯后血清对白血病细胞(CEM)的增殖产生显著抑制作用, 其作用和霉酚酸浓度呈显著负相关[2]. EC-MPS在上消化道、血液、肝脏被酯酶水解成活性药物MPA, MPA在尿苷二磷酸-葡萄糖醛酸酶作用下变为没有活性的酚醛葡糖苷酸(mycophenolic acid glucuronide, MPAG), MPAG从尿液排出[3,4]. Kobayashi等[5]证实MPAG的胆汁排泄必须依赖多药耐药相关蛋白2(multi-drug resistance associated proteins 2, MRP2)才能完成, MRP2优先选择MPAG, 当胆汁进入小肠, MPAG在微生物的作用下被降解为MPA并被重新吸收进入体循环, 此过程即为MPA的肠肝循环(enterohepatic circulation, EHC). IMPDH次黄嘌呤单核苷酸脱氢酶活性的抑制作用被认为是MPA表达的一个很好的药效学指标. Bremer等[6]指出MPA的暴露引起CD4+细胞和全血IMPDH1和IMPDH2基因表达减少. Glander等[7]对EC-MPS标准剂量1440 mg/d组 vs 强化剂量组2880 mg/d进行对比, 发现强化剂量组在移植后3 d次黄嘌呤单磷酸脱氢酶活性较标准剂量组明显降低, 血液系统不良事件(adverse events, AES)和感染不良反应在2组剂量组中发生比类似, 而胃肠道AES在强化剂量组中发生率较高. de Winter等[8]报道EC-MPS在模拟胃pH的试管中不吸收, 而在模拟小肠pH值试管中高度溶解. Enteric-coated耐酸, 药物到达小肠才被吸收, 从而改善了胃肠道不良反应[9,10]. Reyes等[11]做过胃肠道症状评估量表(gastrointestinal symptom rating scale, GSRS)调查问卷, 用EC-MPS代替MMF后, GSRS得分有一个显著的改进.
本研究EC-MPS的第二个药时高峰不明显, 与Qiu等[12]报道10例肾移植患者每天服用1080 mg EC-MPS(分2次)没有表现出由于肝肠循环而形成的第二个药时高峰的结论基本一致. 本研究药时曲线下面积范围在8.5-75.5 (μg·h)/mL之间, 平均40.3 (μg·h)/mL±17.2 (μg·h)/mL, 最大浓度Cmax为16.6 μg/mL±9.7 μg/mL, 43套数据中65%在其范围内; 达峰时间为Tmax均值为3.1 h±1.7 h; T-Half为3.2 h±2.5 h. EC-MPS MPA浓度的个体差异(图1); EC-MPS MPA药代动力学参数(图2). Perry等[13]研究结果显示21例肝移植患者每天服用EC-MPS单剂量720 mg, MPA-AUC在17.3-90 (μg·h)/mL之间, 平均45.3 (μg·h)/mL±23.1 (μg·h)/mL; 最大浓度Cmax为28.4 μg/mL±16.1 μg/mL; Tmax为2.4 h±1.1 h; T-Half为5.3 h±4.3 h; Sommerer等[14]研究结果显示57例肾移植患者每天服用EC-MPS 1440 mg(分2次), MPA-AUC在7-130 (μg·h)/mL之间, 平均38 (μg·h)/mL, 最大浓度Cmax为12 mg/L; Tmax为3.0 h. Ettenger等[15]研究结果中显示25例肾移植患者每天服用EC-MPS 720 mg(分2次)T-Half为8 h. 因此, 移植受者MPA药时曲线各家报道基本一致, 但MPA-AUC0-12 h个体间变化很大.
MPA的暴露不受其他免疫抑制剂及肝、肾功能异常的影响; 白蛋白、肌酐、肌酐清除率不影响MPA-AUC0-12 h; 血清白蛋白、肌酐清除率不影响MPA清除率. 合计43套数据, 肝、肾功能、肌酐清除率(Ccr)和血WBC计数异常组与正常组相比MPA-AUC0-12 h无显著差异(P>0.05). MPA-AUC0-12 h与FK506-C0 h、白蛋白、肌酐、肌酐清除率无显著相关性(P>0.05). 同时MPA清除率与血清白蛋白、肌酐清除率亦无显著相关性(P>0.05). Stracke等研究结果中显示24例肾移植患者每天服用EC-MPS 720 mg血浆白蛋白浓度与EC-MPS MPA-AUC0-12 h没有显著相关性, 与本研究结果基本一致[16].
本研究MPA-C0 h -C12 h与MPA-AUC0-12 h相关性均很差, r2均小于0.75, MPA-C8 h的复相关系数最高(r2 = 0.19); 在统计学上, MPA单个时间点浓度与MPA-AUC0-12 h之间的复相关系数(r2)应超过0.75以上才具有应用价值, 本研究r2均小于0.75, 所以单个时间点MPA浓度不能有效反映MPA-AUC0-12 h. Perry等研究结果显示21例肝移植患者每天服用EC-MPS单剂量720 mg MPA-C5 h的复相关系数最高(r2 = 0.66)[14]. 肝移植术后早期移植受者EC-MPS MPA-AUC0-12 h个体差异很大; 单个时间点MPA浓度不能有效反映MPA-AUC0-12 h的变化. 我们通过上述数据分析逐步了解在肝移植患者中EC-MPS药代动力学特点, 希望更好的为肝移植患者术后长期生存及临床指导用药带来帮助.
麦考酚钠肠溶片(EC-MPS)作为免疫抑制剂广泛应用于器官移植领域. EC-MPS是麦考酚酸(MPA)的钠盐, 霉酚酸酯在体内通过转化为霉酚酸而发挥免疫抑制活性, MPA对淋巴细胞IMPDH的抑制导致了细胞内鸟苷酸的衰竭, 抑制DNA的合成, 限制淋巴细胞的增殖. 肝移植受者口服霉酚酸酯后血清对CEM细胞的增殖产生显著抑制作用, 其作用和霉酚酸浓度呈显著负相关.
胡安斌, 副教授, 副主任医师, 中山大学附属第一医院普外科-器官移植科
本研究MPA-C0 h-C12 h与MPA-AUC0-12 h相关性均很差, r2均<0.75, MPA-C8 h的复相关系数最高(r2 = 0.19); 在统计学上, MPA单个时间点浓度与MPA-AUC0-12 h之间的复相关系数(r2)应超过0.75以上才具有应用价值, 本研究r2均<0.75, 所以单个时间点MPA浓度不能有效反映MPA-AUC0-12 h.
Kobayashi等证实MPAG的胆汁排泄必须依赖多药耐药相关蛋白2(MRP2)才能完成, MRP2优先选择MPAG, 当胆汁进入小肠, MPAG在微生物的作用下被降解为MPA并被重新吸收进入体循环, 此过程即为MPA的肠肝循环.
本研究通过数据分析逐步了解在肝移植患者中EC-MPS药代动力学特点, 为肝移植患者术后长期生存及临床指导用药带来帮助.
编辑: 郭鹏 电编: 闫晋利
| 1. | Allison AC, Eugui EM. Mechanisms of action of mycophenolate mofetil in preventing acute and chronic allograft rejection. Transplantation. 2005;80:S181-S190. [PubMed] [DOI] |
| 3. | Staatz CE, Tett SE. Clinical pharmacokinetics and pharmacodynamics of mycophenolate in solid organ transplant recipients. Clin Pharmacokinet. 2007;46:13-58. [PubMed] [DOI] |
| 4. | Hesselink DA, van Gelder T. Genetic and nongenetic determinants of between-patient variability in the pharmacokinetics of mycophenolic acid. Clin Pharmacol Ther. 2005;78:317-321. [PubMed] [DOI] |
| 5. | Kobayashi M, Saitoh H, Kobayashi M, Tadano K, Takahashi Y, Hirano T. Cyclosporin A, but not tacrolimus, inhibits the biliary excretion of mycophenolic acid glucuronide possibly mediated by multidrug resistance-associated protein 2 in rats. J Pharmacol Exp Ther. 2004;309:1029-1035. [PubMed] [DOI] |
| 6. | Bremer S, Vethe NT, Rootwelt H, Bergan S. Expression of IMPDH1 is regulated in response to mycophenolate concentration. Int Immunopharmacol. 2009;9:173-180. [PubMed] [DOI] |
| 7. | Glander P, Sommerer C, Arns W, Ariatabar T, Kramer S, Vogel EM, Shipkova M, Fischer W, Zeier M, Budde K. Pharmacokinetics and pharmacodynamics of intensified versus standard dosing of mycophenolate sodium in renal transplant patients. Clin J Am Soc Nephrol. 2010;5:503-511. [PubMed] [DOI] |
| 8. | de Winter BC, van Gelder T, Mathot RA, Glander P, Tedesco-Silva H, Hilbrands L, Budde K, van Hest RM. Limited sampling strategies drawn within 3 hours postdose poorly predict mycophenolic acid area-under-the-curve after enteric-coated mycophenolate sodium. Ther Drug Monit. 2009;31:585-591. [PubMed] [DOI] |
| 9. | Nart A, Sipahi S, Aykas A, Uslu A, Hoşcoşkun C, Toz H. Efficacy and safety of enteric-coated mycophenolate sodium in de novo and maintenance renal transplant patients. Transplant Proc. 2008;40:189-192. [PubMed] [DOI] |
| 10. | Zimmerhackl LB, Jungraithmayr T, Wiesmayr S, Filler G. Myfortic in pediatric transplantation. Pediatr Transplant. 2008;12:614-616. [PubMed] [DOI] |
| 11. | Reyes H, Hernández AM, Valverde S, Cataneo A, Mendoza A, Barrera I, Ortíz L, García-Roca P, Lopéz-Martínez B, Castañeda-Hernández G. Efficacy and safety of conversion of mycophenolate mofetil to enteric-coated mycophenolate sodium in Mexican renal transplant children. Pediatr Transplant. 2010;14:746-752. [PubMed] [DOI] |
| 12. | Qiu K, Tian H, Wang W, Hu XP, Li XB, Gong LL, Luo W, Liu LH, Zhang XD, Yin H. Pharmacokinetics of enteric-coated mycophenolate sodium in Chinese renal transplantation recipients. Chin Med J (Engl). 2012;125:4226-4232. [PubMed] |
| 13. | Perry TW, Christians U, Trotter JF, Bendrick-Peart J. Pharmacokinetics of enteric-coated mycophenolate sodium in stable liver transplant recipients. Clin Transplant. 2007;21:413-416. [PubMed] [DOI] |
| 14. | Sommerer C, Müller-Krebs S, Schaier M, Glander P, Budde K, Schwenger V, Mikus G, Zeier M. Pharmacokinetic and pharmacodynamic analysis of enteric-coated mycophenolate sodium: limited sampling strategies and clinical outcome in renal transplant patients. Br J Clin Pharmacol. 2010;69:346-357. [PubMed] [DOI] |
| 15. | Ettenger R, Bartosh S, Choi L, Zhu W, Niederberger W, Campestrini J, Bastien MC, Schmouder R. Pharmacokinetics of enteric-coated mycophenolate sodium in stable pediatric renal transplant recipients. Pediatr Transplant. 2005;9:780-787. [PubMed] [DOI] |
| 16. | Stracke S, Shipkova M, Mayer J, Keller F, Zarghom A, Yang L, Henne-Bruns D, Wieland E. Pharmacokinetics and pharmacodynamics of mycophenolate sodium (EC-MPS) co-administered with cyclosporine in the early-phase post-kidney transplantation. Clin Transplant. 2012;26:57-66. [PubMed] [DOI] |