修回日期: 2013-08-12
接受日期: 2013-08-28
在线出版日期: 2013-09-18
目的: 检测细胞分裂周期蛋白25A(cell division cycle 25A , CDC25A)基因在原发性肝细胞癌组织中的表达, 探讨其与肝癌多勒超声影像特征的关联.
方法: 运用RT-PCR和Western blot的方法检测86例肝癌组织及对应癌旁组织中CDC25A基因的表达; 用B超观察肝癌患者肝脏肿瘤影像学特征.
结果: 在86例肝癌病例中, 75.58%(65/86)的肝癌组织CDC25A mRNA和蛋白表达明显高于对应癌旁组织(P<0.05); 肝癌组织中CDC25A的表达与多普勒超声影像特征如肿瘤的大小、血流分级、血流阻力指数及门静脉侵袭情况明显相关(P<0.05), 与肝脏肿瘤结节的个数无关(P>0.05).
结论: CDC25A基因可能在肝癌的发生及转移过程中发挥重要作用, 肝癌组织中CDC25A基因的表达与超声影像相结合可为肝癌临床治疗及预后判断提供理论依据.
核心提示: 肝癌组织中CDC25A表达呈过表达且与多普勒超声影像特征如肿瘤的大小、血流分级、血流阻力指数(resistance index)及门静脉侵袭情况明显相关.
引文著录: 郭艳, 王茜, 杨志杰. 原发性肝细胞癌CDC25A的表达与多普勒超声影像特征的关联性分析. 世界华人消化杂志 2013; 21(26): 2649-2654
Revised: August 12, 2013
Accepted: August 28, 2013
Published online: September 18, 2013
AIM: To investigate the expression of cell division cycle 25A (CDC25A) in primary hepatocellular carcinoma (PHC) and to explore its relationship with Doppler ultrasound imaging features.
METHODS: The expression of CDC25A in 86 PHC specimens and matched tumor-adjacent tissue specimens was detected by RT-PCR and Western blot. The imaging features of PHC was analyzed by Doppler ultrasound.
RESULTS: CDC25A was found to be overexpressed in 75.58% (65/86) of PHC cases (P < 0.05). The expression of CDC25A protein was significantly correlated with Doppler ultrasound imaging features including tumor size, blood flow grade, resistance index (RI) and portal vein invasion (all P < 0.05), but not with the number of liver tumor nodes (P > 0.05).
CONCLUSION: CDC25A may play an important role in the development and metastasis of PHC. Detection of CDC25A expression combined with ultrasound imaging may be used clinically for evaluation of treatment response and prognosis in PHC patients.
- Citation: Guo Y, Wang Q, Yang ZJ. Correlation between expression of CDC25A and Doppler ultrasound features in primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(26): 2649-2654
- URL: https://www.wjgnet.com/1009-3079/full/v21/i26/2649.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i26.2649
原发性肝细胞性肝癌(primary hepatocellular carcinoma, PHC)是我国乃至世界上恶性程度最高的肿瘤之一, 其发生发展是一个多步骤多阶段的复杂过程, 每一个过程都受多个基因或蛋白的精确调节[1-8]. 细胞分裂周期蛋白25A(cell division cycle 25A , CDC25A)是CDC25家族的重要成员之一, 近年研究发现CDC25A在G1/S、G2/M期转换过程中发挥关键调节作用, 并且证实在肺癌、乳腺癌和结肠癌等多种恶性肿瘤中表达上调[9-20], 且与肿瘤的侵袭和不良预后相关[21]. 总之, CDC25A在恶性肿瘤的发生发展中起重要作用. 本研究采用RT-PCR及Western blot的方法检测CDC25A基因在肝癌组织中的表达, 运用彩色多普勒超声观察肿瘤的影像学特征, 探讨其相互关联及其意义.
收集2008-09/2012-12南昌市中西医结合医院86例肝癌及对应癌旁组织手术标本, 所有标本均经病理学检查确诊, 其中男49例, 女37例, 年龄33-64岁, 平均46.1岁. 其中肿瘤直径<5 cm患者47例, ≥5 cm患者39例; 单个肿瘤的57例, ≥2个肿瘤的29例; 超声血流分级: Ⅰ级12例, Ⅱ级34例, Ⅲ级40例. 有门静脉侵袭38例, 无门静脉侵袭48例. 所有患者术前均未接受放化疗. RNA提取试剂盒(美国Invitrogen公司); 总蛋白提取试剂盒(北京普利莱)、兔抗人CDC25A单克隆抗体(美国Santa Cruz公司)、β-actin二抗(北京中杉金桥公司); 彩色蛋白Marker(北京普利来公司); BCA蛋白定量试剂盒(江苏碧云天公司); 1kb plus Marker(北京TIANGEN公司); 西门子中狮王彩色多普勒超声诊断仪(德国西门子公司).
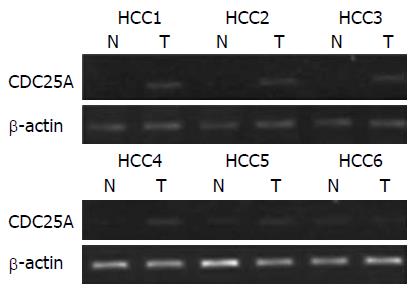
1.2.1 RT-PCR检测CDC25A mRNA的表达: 采用RNA提取试剂盒提取瘤组织及对应癌旁组织中总RNA, 测定浓度, -80 ℃保存. 首先取2 μg总RNA为反应模板与3 μL逆转录酶相互混合, 反应体系为20 μL, 反应条件为: 16 ℃ 30 min, 45 ℃ 30 min, 85 ℃ 5 min. 反应结束后, 收集cDNA. 进行PCR扩增反应. 反应条件: 95 ℃ 5 min; 94 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s, 共40个循环, 最后72 ℃延伸7 min. 琼脂糖凝胶电泳, 拍照. 以β-actin作为内参. 实验重复3次. CDC25A上游引物: 5'-GAGGAGTCTCACCTGGAAGTACA-3', 下游引物: 5'-GCCATTCAAAACCAGATGCCATAA-3'.
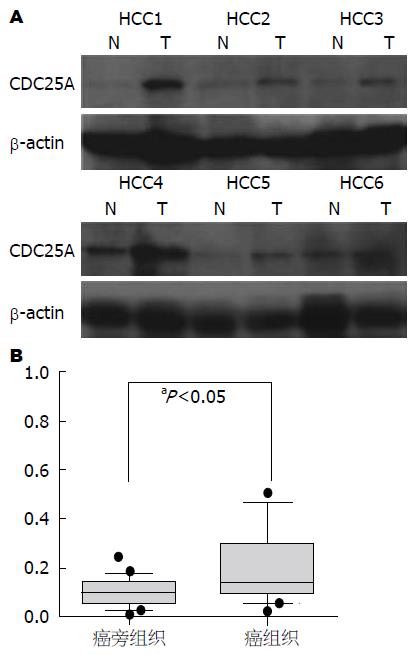
1.2.2 Western blot检测CDC25A蛋白表达: 运用总蛋白提取试剂盒提取肝癌组织及癌旁组织中的总蛋白, 经10%SDS-PAGE电泳后转膜, 将膜放在含5%脱脂奶粉的TBST缓冲液中37 ℃封闭2 h, 加一抗稀释液1:500稀释兔抗人CDC25A单克隆抗体在4 ℃孵育过夜, 1×TBST缓冲液3次(每次10 min), 加辣根过氧化物酶标记的山羊抗兔IgG(1:5000稀释), 置于37 ℃孵育2 h, 1×TBST缓冲液3次(每次10 min), 运用ECL化学发光法检测目的蛋白条带. 以β-actin作为内参.
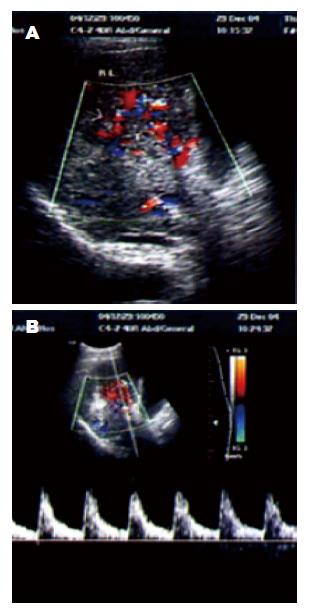
1.2.3 肝脏的彩色多普勒成像: 运用德国西门子中狮工彩超仪. 3.5兆探头, 观察整个肝脏及其周围器官的回声, 记录肝脏肿块的大小及个数; 调整多普勒血流参数至瘤体血流显示最佳状态, 然后行血流分级, I级: 瘤体内及周边见稀疏星点状血流信号; Ⅱ级: 肿瘤体内及周边见3条以上线状血流信号; Ⅲ级: 瘤体内及周边见密集的彩色血流信号. 查找瘤体内波动性血流, 测其最高收缩期峰值流速所对应的血流阻力指数(resistance index, RI)为记录值. 同时观察记录门静脉癌栓大小形态及彩色血流的特点.
统计学处理 采用SPSS17.0统计软件包进行分析. 计量资料以mean±SD表示, 癌及癌旁组织比较采用配对样本t检验; 两样本均数间的比较采用t检验; χ2检验用于多组间率或百分比的比较; P<0.05为差异有统计学意义.
运用RT-PCR检测86例肝癌患者癌及癌旁组织中CDC25A mRNA的表达情况, 结果发现: 75.58%(65/86)的病例肝癌组织CDC25A mRNA的表达明显高于相对应的癌旁组织中的表达, 结果有统计学意义(t = 23.54, P<0.05)(图1). 其他24.42%(21/86)的病例肝癌组织CDC25A mRNA的表达与癌旁比无明显差别(t = 0.86, P>0.05).
进一步运用Western blot的方法检测86例肝癌患者癌及癌旁组织中CDC25A蛋白的表达情况, 结果发现: CDC25A蛋白在癌和癌旁组织的表达与CDC25A mRNA一致, 75.58%(65/86)的病例肝癌组织CDC25A蛋白的表达明显高于相对应的癌旁组织中的表达(t = 27.32, P<0.05)(图2).
彩色多普勒显示肝细胞癌瘤体内为星点状及线状血流信号(图3). 肝癌组织中CDC25A蛋白的表达与肝癌超声影像特征如肿瘤的大小、血流的分级、RI及门静脉侵袭情况明显相关(CDC25A蛋白表达越高, 瘤体的直径越大, 血流分级及RI越高, 门静脉侵袭越多)(P<0.05)(表1, 2). 而CDC25A蛋白的表达与肿瘤结节的个数无关(P>0.05). 另外, 研究发现肿瘤直径增大, RI值也增高(P<0.05)(表2).
| n | 血流阻力指数 | t值 | P值 | |
| CDC25A | 3.24 | 0.01 | ||
| 过表达 | 65 | 0.84±0.09 | ||
| 非过表达 | 31 | 0.62±0.08 | ||
| 肿瘤大小(cm) | 2.92 | 0.02 | ||
| <5 | 47 | 0.68±0.08 | ||
| ≥5 | 39 | 0.82±0.09 |
原发性肝细胞癌是全球发病率最高的恶性肿瘤之一, 具有生长快、容易发生侵袭和转移等特点. 肝癌的发生发展是一个多步骤、多阶段、多途径、多个因素共同调控的复杂生物学过程[22-28]. 研究报道CDC25A肝癌等在多种恶性肿瘤中过表达[9-21]. 我们利用RT-PCR和Western blot方法也发现CDC25A mRNA和蛋白在肝癌组织中的表达明显高于癌旁组织, 结果有统计学意义. 说明CDC25A基因可能在肝癌中起着非常重要的作用.
彩色多普勒超声具有廉价、无创伤、无辐射、可重复检查等优点, 对病变的诊断和随访具有重要的临床应用价值. 我们采用彩色多普勒技术术前检测患者的瘤体大小、个数以及门静脉侵袭情况, 分析其与CDC25A蛋白表达的关联, 结果发现肝癌组织中CDC25A蛋白的表达与肿瘤的大小及门静脉侵袭情况密切相关. 这与Xu等[21]报道发现肝癌中CDC25A高表达与肿瘤的门静脉侵袭显著相关的结果一致. 研究已经证实瘤体的血流参数与肿瘤的一些基本生物学特征有关联, 通过了解瘤体内的血流信号参数可以估计肿瘤的生物学行为. 我们利用多普勒技术观察肝细胞癌肿块内的血流信号, 以评估瘤体内的血供以并分析其与CDC25A基因表达的关系, 结果发现CDC25A蛋白表达与瘤体内血流分级显著相关. 以上结果表明说明CDC25A高表达在促进肝癌的血管侵袭方面起重要作用.
RI是评价动脉血流阻力的主要参数之一, 因RI值不会受测量角度因素的干扰, 故其测量的结果较客观. 我们研究发现肝脏瘤体直径增大, RI值也高. 我们分析其原因可能为随着肿瘤直径的增大, 肝固有动脉的直径及最大流速都明显高于正常值, 血管分支增多, 走向异常, 并具有收缩和波动性的高速动脉血流[29]. 因瘤体内的血管管壁无平滑肌, 韧性差, 此外加上门静脉癌栓生成、肿瘤假包膜的破坏及动、静脉瘘生成, 所以肿瘤内的血管形成窦腔, 从而舒张末期的血流速度变慢, 导致RI升高[30]. 另外, 我们还发现RI值与CDC25A基因的表达显著相关, 随着RI的增高, CDC25A基因表达也逐渐增多. 这进一步表明CDC25A的表达与肝癌的血管生成情况相关. 所以检测肝癌组织中CDC25A蛋白的表达及肿瘤的血管情况将有助于提高肿瘤血管侵袭的阳性率.
总之, CDC25A蛋白的表达与肝癌的多普勒超声影像特征显著相关, 分析肝癌组织中CDC25A蛋白的表达联合术前超声多普勒技术可以用于初步评估肿瘤的发生和发展, 对临床治疗方案的选择和预后的评估具有指导意义.
CDC25A是CDC25家族的重要成员之一, 近年研究发现CDC25A在G1/S、G2/M期转换过程中发挥关键调节作用, 并且证实在多种恶性肿瘤中表达上调, 且与肿瘤的侵袭和不良预后相关.
李孟森, 教授, 海南医学院/海南省肿瘤发生和干预重点实验室.
彩色多普勒超声具有廉价、无创伤、无辐射、可重复检查等优点. 分析与肝癌密切相关蛋白的表达联合术前超声多普勒技术可以用于初步评估肿瘤的发生和发展, 对临床治疗方案的选择和预后的评估具有指导意义.
研究发现CDC25A细胞周期转换过程中发挥重要作用, 并且证实在肝癌等多种恶性肿瘤中表达增加, 然而其与肝细胞癌影像学特征之间的关联还不清楚.
本研究首次分析肝癌组织中CDC25A的表达与肝细胞癌影像学特征之间的关联.
肝癌组织中CDC25A的表达联合术前超声多普勒技术可以用于初步评估肿瘤的临床病理进展.
肿瘤血流阻力指数: 评价肿瘤血管血流阻力的主要参数之一, 可反映肿瘤的血液供应情况.
本文能利用肝细胞癌CDC25A蛋白表达与多普勒超声影像的关联性, 分析CDC25A 蛋白表达对肝细胞癌的转移与影象学的吻合性. 研究结果有较好的创新性, 是影象学和分子生物研究肿瘤的一个较好的例子.
编辑: 郭鹏 电编: 闫晋利
| 1. | Lin YS, Wang TY, Lin JC, Wang HY, Chou KF, Shih SC, Chen MJ. Hepatic carcinosarcoma: clinicopathologic features and a review of the literature. Ann Hepatol. 2013;12:495-500. [PubMed] |
| 2. | Suh SJ, Yim HJ. [Current status of molecular targeted therapies in hepatocellular carcinoma]. Korean J Gastroenterol. 2013;61:136-146. [PubMed] |
| 3. | Zheng Z, Zhou L, Gao S, Yang Z, Yao J, Zheng S. Prognostic role of C-reactive protein in hepatocellular carcinoma: a systematic review and meta-analysis. Int J Med Sci. 2013;10:653-664. [PubMed] [DOI] |
| 4. | Liu L, Dai Y, Chen J, Zeng T, Li Y, Chen L, Zhu YH, Li J, Li Y, Xie D. Maelstrom promotes hepatocellular carcinoma metastasis by inducing epithelial-mesenchymal transition via Akt/GSK-3β/snail signaling. Hepatology. 2013; Aug 8. [Epub ahead of print]. [PubMed] [DOI] |
| 5. | Chang HF, Wu CH, Yang LL. Antitumour and free radical scavenging effects of γ-mangostin isolated from Garcinia mangostana pericarps against hepatocellular carcinoma cell. J Pharm Pharmacol. 2013;65:1419-1428. [PubMed] [DOI] |
| 6. | Takeda A, Sanuki N, Eriguchi T, Kobayashi T, Iwabutchi S, Matsunaga K, Mizuno T, Yashiro K, Nisimura S, Kunieda E. Stereotactic ablative body radiotherapy for previously untreated solitary hepatocellular carcinoma. J Gastroenterol Hepatol. 2013; Aug 8. [Epub ahead of print]. [PubMed] [DOI] |
| 7. | Xu HS, Li SY, Liang X, Shou JD, Xu K, He YT. Hepatocellular Carcinoma Presenting as a Wandering Abdominal Lump with Atypical CEUS. Ultraschall Med. 2013;34:388-390. [PubMed] |
| 8. | Hata S, Miki Y, Saito R, Ishida K, Watanabe M, Sasano H. Aromatase in human liver and its diseases. Cancer Med. 2013;2:305-315. [PubMed] [DOI] |
| 9. | Younis RH, Cao W, Lin R, Xia R, Liu Z, Edelman MJ, Mei Y, Mao L, Ren H. CDC25A(Q110del): a novel cell division cycle 25A isoform aberrantly expressed in non-small cell lung cancer. PLoS One. 2012;7:e46464. [PubMed] [DOI] |
| 10. | Brunetto E, Ferrara AM, Rampoldi F, Talarico A, Cin ED, Grassini G, Spagnuolo L, Sassi I, Ferro A, Cuorvo LV. CDC25A protein stability represents a previously unrecognized target of HER2 signaling in human breast cancer: implication for a potential clinical relevance in trastuzumab treatment. Neoplasia. 2013;15:579-590. [PubMed] |
| 11. | Jin Y. 3,3'-Diindolylmethane inhibits breast cancer cell growth via miR-21-mediated Cdc25A degradation. Mol Cell Biochem. 2011;358:345-354. [PubMed] [DOI] |
| 12. | Chang HY, Shih MH, Huang HC, Tsai SR, Juan HF, Lee SC. Middle infrared radiation induces G2/M cell cycle arrest in A549 lung cancer cells. PLoS One. 2013;8:e54117. [PubMed] [DOI] |
| 13. | Feng X, Wu Z, Wu Y, Hankey W, Prior TW, Li L, Ganju RK, Shen R, Zou X. Cdc25A regulates matrix metalloprotease 1 through Foxo1 and mediates metastasis of breast cancer cells. Mol Cell Biol. 2011;31:3457-3471. [PubMed] [DOI] |
| 14. | Jin Y, Zou X, Feng X. 3,3'-Diindolylmethane negatively regulates Cdc25A and induces a G2/M arrest by modulation of microRNA 21 in human breast cancer cells. Anticancer Drugs. 2010;21:814-822. [PubMed] [DOI] |
| 15. | Naderi A, Liu J. Inhibition of androgen receptor and Cdc25A phosphatase as a combination targeted therapy in molecular apocrine breast cancer. Cancer Lett. 2010;298:74-87. [PubMed] [DOI] |
| 16. | Mehdipour P, Pirouzpanah S, Sarafnejad A, Atri M, Shahrestani ST, Haidari M. Prognostic implication of CDC25A and cyclin E expression on primary breast cancer patients. Cell Biol Int. 2009;33:1050-1056. [PubMed] [DOI] |
| 17. | Wang P, Zou F, Zhang X, Li H, Dulak A, Tomko RJ, Lazo JS, Wang Z, Zhang L, Yu J. microRNA-21 negatively regulates Cdc25A and cell cycle progression in colon cancer cells. Cancer Res. 2009;69:8157-8165. [PubMed] [DOI] |
| 18. | Yun HJ, Hyun SK, Park JH, Kim BW, Kwon HJ. Widdrol activates DNA damage checkpoint through the signaling Chk2-p53-Cdc25A-p21-MCM4 pathway in HT29 cells. Mol Cell Biochem. 2012;363:281-289. [PubMed] [DOI] |
| 19. | de Oliveira PE, Zhang L, Wang Z, Lazo JS. Hypoxia-mediated regulation of Cdc25A phosphatase by p21 and miR-21. Cell Cycle. 2009;8:3157-3164. [PubMed] |
| 20. | Sørensen CS, Melixetian M, Klein DK, Helin K. NEK11: linking CHK1 and CDC25A in DNA damage checkpoint signaling. Cell Cycle. 2010;9:450-455. [PubMed] |
| 21. | Xu X, Yamamoto H, Sakon M, Yasui M, Ngan CY, Fukunaga H, Morita T, Ogawa M, Nagano H, Nakamori S. Overexpression of CDC25A phosphatase is associated with hypergrowth activity and poor prognosis of human hepatocellular carcinomas. Clin Cancer Res. 2003;9:1764-1772. [PubMed] |
| 22. | Chen YL, Wang TH, Hsu HC, Yuan RH, Jeng YM. Overexpression of CTHRC1 in Hepatocellular Carcinoma Promotes Tumor Invasion and Predicts Poor Prognosis. PLoS One. 2013;8:e70324. [PubMed] [DOI] |
| 23. | He SL, Shen J, Sun XJ, Zhu XJ, Liu LM, Dong JC. Efficacy of capecitabine and oxaliplatin regimen for extrahepatic metastasis of hepatocellular carcinoma following local treatments. World J Gastroenterol. 2013;19:4552-4558. [PubMed] [DOI] |
| 24. | Yan H, Dong X, Zhong X, Ye J, Zhou Y, Yang X, Shen J, Zhang J. Inhibitions of epithelial to mesenchymal transition and cancer stem cells-like properties are involved in miR-148a-mediated anti-metastasis of hepatocellular carcinoma. Mol Carcinog. 2013; Jul 17. [Epub ahead of print]. [PubMed] [DOI] |
| 25. | Wang F, Qiao Y, Yu J, Ren X, Wang J, Ding Y, Zhang X, Ma W, Ding Y, Liang L. FBX8 Acts as an Invasion and Metastasis Suppressor and Correlates with Poor Survival in Hepatocellular Carcinoma. PLoS One. 2013;8:e65495. [PubMed] |
| 26. | Vega FM, Fruhwirth G, Ng T, Ridley AJ. RhoA and RhoC have distinct roles in migration and invasion by acting through different targets. J Cell Biol. 2011;193:655-665. [PubMed] [DOI] |
| 27. | Fidler IJ. The pathogenesis of cancer metastasis: the 'seed and soil' hypothesis revisited. Nat Rev Cancer. 2003;3:453-458. [PubMed] |
| 28. | Steeg PS. Tumor metastasis: mechanistic insights and clinical challenges. Nat Med. 2006;12:895-904. [PubMed] |
| 30. | Yang ZF, Poon RT. Vascular changes in hepatocellular carcinoma. Anat Rec (Hoboken). 2008;291:721-734. [PubMed] [DOI] |