修回日期: 2013-04-10
接受日期: 2013-08-13
在线出版日期: 2013-09-08
目的: 探讨艾灸对幽门螺杆菌(Helicobacter pylori, H. pylori)胃炎大鼠胃黏膜HE染色镜检胃黏膜炎症积分值和单核细胞核因子-κB(nuclear factor-κB, NF-κB)、IκBα含量的影响, 初步揭示艾灸干预H. pylori胃黏膜炎性损伤, 保护胃黏膜的机制.
方法: 50只健康大鼠随机分为5组, 即A空白组、B模型组、C艾灸组、D艾灸非穴点组和E电针组, 每组10只. 采用H. pylori灌胃造模, 蛋白免疫印记法检测大鼠外周血单核细胞NF-κB、IκBα的含量.
结果: 与A组比较, B组大鼠胃黏膜HE染色镜检胃黏膜炎症积分值和单核细胞NF-κB含量显著升高(0±2.0 vs 2.5±2.5, 0.54±0.11/β-actin vs 0.36 ±0.13/β-actin, P<0.01), IκBα含量显著降低(0.21±0.03/β-actin vs 0.65±0.18/β-actin, P<0.01); 与B组比较, C组大鼠胃黏膜HE染色镜检胃黏膜炎症积分值和单核细胞NF-κB含量显著减低(2.5±2.5 vs 0±2.00, 0.36±0.13/β-actin vs 0.50±0.04/β-actin, P<0.01), IκBα含量显著升高(0.65±0.18/β-actin vs 0.24±0.06/β-actin, P<0.01); 与D组相比, C组大鼠胃黏膜HE染色镜检胃黏膜炎症积分值和单核细胞NF-κB含量明显升高(3.00±2.5 vs 0±2.00, 0.36±0.12/β-actin vs 0.50±0.04/β-actin, P<0.01), IκBα含量显著降低(0.64±0.19/β-actin vs 0.24±0.06/β-actin, P<0.01); 与E组相比, C组大鼠胃黏膜HE染色镜检胃黏膜炎症积分值和单核细胞NF-κB含量明显升高(3±2.75 vs 0±2.00, 0.35±0.10/β-actin vs 0.50±0.04/β-actin, P<0.01), IκBα含量显著降低(0.52±0.17/β-actin vs 0.24±0.06/β-actin, P<0.01).
结论: 艾灸穴位可减轻H. pylori胃炎胃黏膜炎性损伤, 此作用可能与艾灸诱导单核细胞IκBα大量表达, 抑制NF-κB表达, 减少炎性细胞因子的释放, 减轻胃黏膜炎症损伤有关.
核心提示: 本研究从细胞核因子κB(nuclear factor-κB, NF-κB)入手探讨艾灸穴位是否能干预幽门螺杆菌(Helicobacter pylori, H. pylori)所致胃黏膜炎性损伤, 是否通过调节NF-κB、IκBα的释放来抑制胃黏膜局部炎性细胞的浸润, 减轻胃黏膜炎性损伤, 从而为艾灸防治H. pylori胃炎提供理论依据.
引文著录: 林亚平, 封迎帅, 易受乡, 彭艳, 史冬梅, 侯艳玲. 艾灸对Helicobacter pylori胃炎大鼠单核细胞NF-κB、IκBα含量的影响. 世界华人消化杂志 2013; 21(25): 2563-2570
Revised: April 10, 2013
Accepted: August 13, 2013
Published online: September 8, 2013
AIM: To explore the effect of moxibustion treatment on gastric inflammatory injury and expression of NF-κB and IκBα in peripheral blood monocytes of rats with Helicobacter pylori (H. pylori)-associated gastritis, to reveal the mechanisms underlying the protective effect of moxibustion treatment against gastric inflammatory injury.
METHODS: Fifty healthy rats were randomly divided into five groups, namely, a control group (A), a H. pylori model group (B), a moxibustion at acupoints group (C), a moxibustion at non-acupoints group (D) and an electro-acupuncture group (E). Gastritis was induced by oral gavage with live H. pylori. The expression of NF-κB and IκBα in peripheral blood monocytes was detected by Western blot.
RESULTS: Compared to group A, gastric mucosal inflammation score and expression of NF-κB in monocytes were significantly increased (0 ± 2.0 vs 2.5 ± 2.5, 0.54 ± 0.11/β-actin vs 0.36 ± 0.13/β-actin, both P < 0.01), and expression of IκBα in monocytes was significantly decreased in group B (0.21 ± 0.03/β-actin vs 0.65 ± 0.18/β-actin, P < 0.01). Compared to group B, gastric mucosal inflammation score and expression of NF-κB in monocytes were significantly decreased (2.5 ± 2.5 vs 0 ± 2.00, 0.36 ± 0.13/β-actin vs 0.50 ± 0.04/β-actin, both P < 0.01), and expression of IκBα in monocytes was significantly increased in group C (0.65 ± 0.18/β-actin vs 0.24 ± 0.06/β-actin, P < 0.01). Compared to group D, gastric mucosal inflammation score and expression of NF-κB in monocytes were significantly decreased (3.00 ± 2.5 vs 0 ± 2.00, 0.36 ± 0.12/β-actin vs 0.50 ± 0.04/β-actin, both P < 0.01), and expression of IκBα in monocytes was significantly increased in group C (0.64 ± 0.19/β-actin vs 0.24 ± 0.06/β-actin, P < 0.01). Compared to group E, gastric mucosal inflammation score and expression of NF-κB in monocytes were significantly decreased (3 ± 2.75 vs 0 ± 2.00, 0.35 ± 0.10/β-actin vs 0.50 ± 0.04/β-actin, both P < 0.01), and expression of IκBα in monocytes was significantly increased in group C (0.52 ± 0.17/β-actin vs 0.24 ± 0.06/β-actin, P < 0.01).
CONCLUSION: Moxibustion at acupoints can reduce H. pylori-induced gastric mucosal inflammatory injury possibly via mechanisms associated with reducing NF-κB expression in monocytes and decreasing the release of inflammatory cytokines.
- Citation: Lin YP, Feng YS, Yi SX, Peng Y, Shi DM, Hou YL. Effect of moxibustion treatment on expression of NF-κB and IκBα in peripheral blood monocytes of rats with Helicobacter pylori-associated gastritis. Shijie Huaren Xiaohua Zazhi 2013; 21(25): 2563-2570
- URL: https://www.wjgnet.com/1009-3079/full/v21/i25/2563.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i25.2563
研究认为核因子κB(nuclear factor-κB, NF-κB)可参与炎症反应, 介导多种炎性细胞因子的生成[1-4], IκBα的降解和磷酸化是NF-κB活化的关键因素[5]. 幽门螺杆菌(Helicobacter pylori, H. pylori)感染是引起胃黏膜炎性损伤的主要病因[6], 本组前期研究发现艾灸穴位预处理能增强机体免疫功能[7], 减轻H. pylori胃炎大鼠的胃黏膜炎性损伤[8], 但是艾灸是否可以通过调节NF-κB、IκBα的释放来干预H. pylori胃炎的炎性损伤过程还不明确. 因此, 本研究采用H. pylori灌胃建立大鼠H.pylori胃炎模型, 观察艾灸对H. pylori胃炎大鼠NF-κB、IκBα的影响, 初步探讨灸干预H. pylori胃黏膜炎性损伤的作用机制.
健康SD大鼠, SPF级, 雌雄各半, 体质量180-220 g, 共50只, 由湖南中医药大学实验动物中心提供(合格证号SCXK(湘)2009-2004), 饲养于湖南中医药大学实验动物中心. 控制室温20 ℃-22 ℃, 相对湿度65%-70%, 大鼠在自然光暗周期的环境中饲养, 所用颗粒饲料和垫料均由湖南中医药大学动物实验中心提供. 施灸材料为苏州东方艾绒厂生产的"神灸300灸"艾炷(型号: 东方一型), 直径0.5 cm, 高0.8 cm. H. pylori菌株(由南华大学微生物实验室提供H. pylori国际标准菌株SS1菌种, 湖南中医药大学微生物实验室培养H. pylori菌株); 小牛血清(上海瑞齐生物科技有限公司), H. pylori快速尿素酶试验试剂盒(三明市安信生物技术有限公司), 10%乌拉坦、0.9%NaCl和多聚甲醛(湖南中医药大学针灸推拿实验室配制); 阿莫西林(华北制药); 华佗牌针灸针由苏州医疗用品厂有限公司生产, G6805-2型电针治疗仪(上海医用机器厂); AUE-210电子分析天平(长沙湘仪天平仪器厂); DK-8B电热恒温水槽(上海精宏实验设备有限公司); ZLSC-5型不锈钢电热重蒸馏水器(上海申安医疗器械厂); DHG-9246A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司); 石蜡切片机(美国820型AO切片机); 低温离心机(上海安亭科学医学仪器厂); MDF-U32V超低温冰箱(日本三洋); BCD-216/226STC海尔冰箱(海尔公司); 淋巴细胞的分离(天津市灏洋生物制品科技有限责任公司); NF-κB抗体(EPI 1546-1)、IκBα抗体(EPI 1130-s)、β-actin(Santa Sc-1616r).
1.2.1 动物分组: 所有大鼠按随机数字表法分为5组: A: 空白组, B: H. pylori胃炎模型(模型组), C: 模型+艾灸穴位组(艾灸组), D: 模型+艾灸非穴点组(艾灸对照点组), E: 模型+电针穴位组(电针组), 每组10只.
1.2.2 穴位定位: 动物穴位定位参考李忠仁主编《实验针灸学》常用动物穴位定位法及拟人对照法定位[9]. 足三里: 膝关节后外侧, 腓骨小头下约5 mm处; 中脘: 脐与胸骨剑突连线中点; 关元: 脐与趾骨联合上缘连线上3/5与下2/5交点, 约脐下25 mm处; 脾俞: 第十二胸椎棘突下, 旁开5 mm; 胃俞: 第十三胸椎棘突下, 旁开5 mm; 足三里的对照点: 在足阳明经和足太阳经之间, 平足三里; 中脘、关元的对照点: 分别在平中脘、关元穴的左侧腰部; 脾俞、胃俞的对照点: 在腋后线和肩胛下角的中线上, 分别平胸12、胸13.
1.2.3 动物造模方法: (1)H. pylori胃炎造模: 大鼠禁食12 h, 先以NaHCO3+消炎痛溶液0.5 mL/只灌胃, 禁食6 h后再以H. pylori(含量109/mL)1.5 mL/只灌胃, 隔天1次, 连续5次, 灌胃完毕后, 禁食禁水4 h, 之后正常喂养; (2)造模成功指标: 尿素酶试验阳性, 胃黏膜涂片革兰染色发现H. pylori, 胃黏膜组织HE染色镜检显示有炎性损伤即胃黏膜上皮细胞脱落并有炎性细胞浸润.
1.2.4 艾灸、电针方法: (1)艾灸方法: 取大鼠双侧足三里、中脘、关元、双侧脾俞和双侧胃俞穴及这些穴位的对照点(非穴点). 局部剪毛, 艾炷粘于穴位或非穴对照点上点燃施灸. 单日大鼠仰卧位固定, C组灸足三里、中脘和关元穴, D组灸足三里、中脘和关元穴的对照点; 双日大鼠俯卧位固定, C组灸脾俞和胃俞, D组灸脾俞和胃俞的对照点. 采用苏州东方艾绒厂提供的"神灸300灸"艾柱进行施灸, 每个艾灸部位连续艾灸5壮, 总延时约20 min左右, 每日1次, 连续16 d; (2)电针方法: 取大鼠双侧足三里、中脘、关元、双侧脾俞和双侧胃俞穴后穴位局部剪毛、络合碘消毒, 采用1寸、30号的华佗牌针灸针分别进行针刺, 针刺深度约4 mm左右, 针刺后连电针, 其中两侧足三里穴接在G6805-2型电针仪的第一组输出线上, 中脘和关元、两侧脾俞、两侧胃俞分别接在电针仪的第二、三、四组输出线上. 单日大鼠仰卧位固定, E组电针足三里、中脘和关元穴; 双日大鼠俯卧位固定, E组电针脾俞和胃俞. 一只大鼠每次共接两组输出线, 采用疏密波, 频率4-50 Hz, 脉宽0.5 ms, 输出电压2-4 V, 强度以肢体出现轻微颤抖为度, 电针时间20 min, 1次/d, 连续16 d.
1.2.5 实验步骤: 所有动物分组后予以浓度为2.5 g/L的阿莫西林生理盐水溶液0.5 mL/只灌胃, 2次/d, 连续3 d(杀灭大鼠上消化道可能定植的H. pylori; 第4天起每天13点所有大鼠捆缚于鼠板上, A、B组每日仅捆绑不做治疗, C、D组予以艾灸治疗, E组予以电针治疗, 1次/d, 连续16 d; 同时, 从实验第11天(即艾灸的第8天)开始灌胃, 隔天1次, 连续5次(即9 d), 灌胃前所有的大鼠禁食12 h, 上午10点左右A组先予以生理盐水0.5 mL/只灌胃, B、C、D、E组予以NaHCO3+消炎痛溶液0.5 mL/只灌胃; 再禁食不禁水6 h后, 在下午16:30开始进行第2次灌胃, A组予以生理盐水1.5 mL/只灌胃, B、C、D、E组予以H. pylori(1×109)1.5 mL/只灌胃, 灌胃完毕后, 禁食禁水4 h, 之后正常喂养; 于最后一次灌胃(艾灸)结束后的第4周(28 d), 禁食12 h后全部大鼠以10%乌拉坦(1 mL/100 g)麻醉固定取材. 胃黏膜处理: 大鼠剖腹取胃, 沿胃大弯剖开, 用冷生理盐水冲洗胃内残留物, 计数胃黏膜损伤指数. 血清处理: 腹主动脉采血, 常温放置2-3 h, 4 ℃ 2000 r/min, 离心10 min, 取上清液, EP管分装, -20 ℃保存, 待测.
1.2.6 观察指标: (1)胃黏膜组织HE染色镜检炎症程度评分积分值, 根据参考文献[10-13], 从下面3个方面对胃组织炎症损伤进行评分: (1)炎性细胞浸润: 无(0分), 炎症细胞较少(1分), 数量较多(2分), 炎症细胞密集(3分); (2)浸润深度: 局限于黏膜浅层不超过黏膜层的1/3(1分), 炎症细胞浸入黏膜下层黏膜全层的2/3(2分), 浸入黏膜全层或肌层(3分); (3)破损程度: 无(0分), 上皮(1分), 黏膜固有层(2分), 黏膜肌层(3分). 将上述分值相加作为炎性损伤总分值进行组间比较. 胃黏膜组织HE染色镜检按下面步骤进行HE染色: 组织入4%多聚甲醛固定24 h以上; 梯度乙醇脱水: 750 mL/L乙醇(ALC)2-4 h, 80%ALC 2-4 h, 95%ALC 3-4 h, 无水乙醇4 h, 二甲苯透明4 h; 包埋、自然冷却后修整蜡块置低温保存备用; 切片: 切片厚4-5 μm, 铺片, 60 ℃温箱中烤片; 染色: 切片脱蜡, 二甲苯2次各10 min, 无水乙醇3-5 min, 950 mL/L乙醇3-5 min, 800 mL/L乙醇5-10 min, 自来水洗约5 min, 苏木素液染色约5-10 min, 自来水洗去多余染液, 入750 mL/L乙醇(100 mL乙醇中加浓盐酸1 mL)分色数秒钟立即水洗并蓝化; 1%伊红水液染色3-5 min水洗; 入750-800 mL/L乙醇分色2-4 min, 950 mL/L乙醇脱水3-5 min, 无水乙醇脱水3-5 min; 二甲苯透明中性树胶封片; 干后镜下观察并显微采图; (2)外周血单核细胞NF-κB、IκBα含量测定: 按照EPI公司的大鼠外周血单核细胞NF-κB、IκBα的测定检测试剂盒的要求, 采用蛋白免疫印记检测, 具体步骤如下: 蛋白提取: 在每106单核细胞中加250 μL细胞总蛋白提取试剂(使用前数分钟内加入cooktail、PMSF和磷酸化蛋白酶抑制剂), 振荡. 如果需要提高蛋白浓度, 可以适当减少细胞总蛋白提取试剂体积; 将加有蛋白提取试剂的细胞放在冰上孵育30 min. 其间每5 min用200 μL移液器反复吹打. 直至悬液清澈、不黏稠; 1200 r/min离心10 min, 上清即为提取的总蛋白. 蛋白浓度测定: 采用Bradford方法测定; 标准曲线制作; 10 mg/mL BSA用生理盐水稀释为1 mg/mL; 样品浓度测定; 900 μL Bradford加入1 μL待测蛋白和99 μL 0.9%生理盐水, 混匀后在595 nm处检测吸光度. 根据标准品做出的标准曲线上计算出各样本蛋白浓度; 测完蛋白含量后, 计算含40 μg蛋白的溶液体积即为上样量; 在蛋白标本中加入适当体积的蛋白上样缓冲液, 沸水浴5 min; SDS-PAGE电泳: 清洗玻璃板; 灌胶与上样: 将玻璃板对齐后放入夹中卡紧, 操作时要使两玻璃对齐, 以免漏胶; 按实验安排配制分离胶, 加入TEMED后立即摇匀即可灌胶. 大约45 min后可倒去胶上层水并用吸水纸将剩余水吸干; 按前面方法配5%的浓缩胶, 加入TEMED后立即摇匀即可灌胶. 将剩余空间灌满浓缩胶然后将梳子插入浓缩胶中; 加足够的电泳液后上样电泳: 将样品加入电泳孔中, 电泳; 浓缩胶电压75 V, 分离胶用120 V; 电泳至溴酚蓝刚跑出即可终止电泳, 进行转膜; 转膜: 准备6张7 cm×9 cm的滤纸和一张大小适中的0.45 μm PVDF膜, PVDF膜在使用之前要先用甲醇活化; 在加有转移液的盆里放入转膜用的夹子, 两块海绵垫, 一支玻棒, 滤纸和经过活化的PVDF膜; 将夹子打开使黑的一面保持水平; 在垫子上垫海绵、三层滤纸; 小心剥下分离胶盖于滤纸上, 将膜盖于胶上, 并除气泡; 在膜上盖三张滤纸并除去气泡, 最后盖上另一个海绵垫; 转膜条件: 200 mA, 1 h; 免疫反应: 将转好的膜于室温下脱色摇床上用5%的脱脂牛奶(0.5%TBST配), 封闭1 h; 稀释一抗(TBST溶解的5%脱脂牛奶), 4℃过夜; 用TBST在室温下脱色摇床上洗3次, 每次5 min; 将二抗用TBST稀释3000倍, 室温下孵育30 min后, 用TBST在室温下脱色摇床上洗3次, 每次5 min; 化学发光: 将A和B两种试剂在离心管中等体积混合, 将膜蛋白面朝上与此混合液充分接触, 1-2 min后, 去尽残液, 包好, 放入X-光片夹中曝光; 根据不同的光强度调整曝光条件, 显影、定影; 凝胶图像分析: 将胶片进行扫描存档, Alpha软件处理系统分析目标带的灰度值, 以目的蛋白的灰度值除以内参β-actin的灰度值以校正上样误差, 最后与对照组比较, 测定其相对光密度值即蛋白表达差异倍数(单位为/β-actin), 其中光密度值高说明表达多, 光密度值低说明表达少.
统计学处理 所有资料进行正态性检验, 符合正态分布的数据用mean±SD表示, 多组计量资料采用单因素方差分析(One-way ANOVA), 方差齐者用LSD法, 方差不齐者用Tamhane's T2法; 非正态分布数据用中位数与四分位数间距[M(Q)]表示, 采用秩和检验. 所有数据使用SPSS19 for Windows软件进行处理, P<0.05为差异有统计学意义.
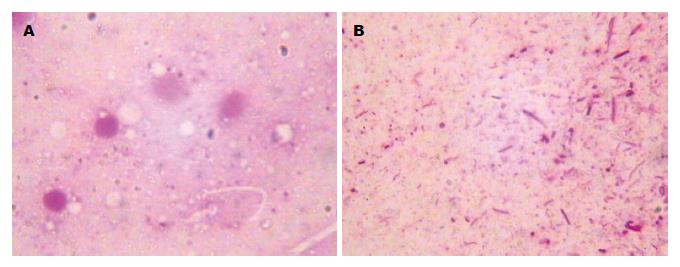
空白组胃黏膜革兰染色后镜检没有发现有红色的弧形或H. pylori; 模型组胃黏膜染色后镜检可见大量红色的弧形或H. pylori(图1), 说明H. pylori灌胃后大鼠感染了H. pylori.
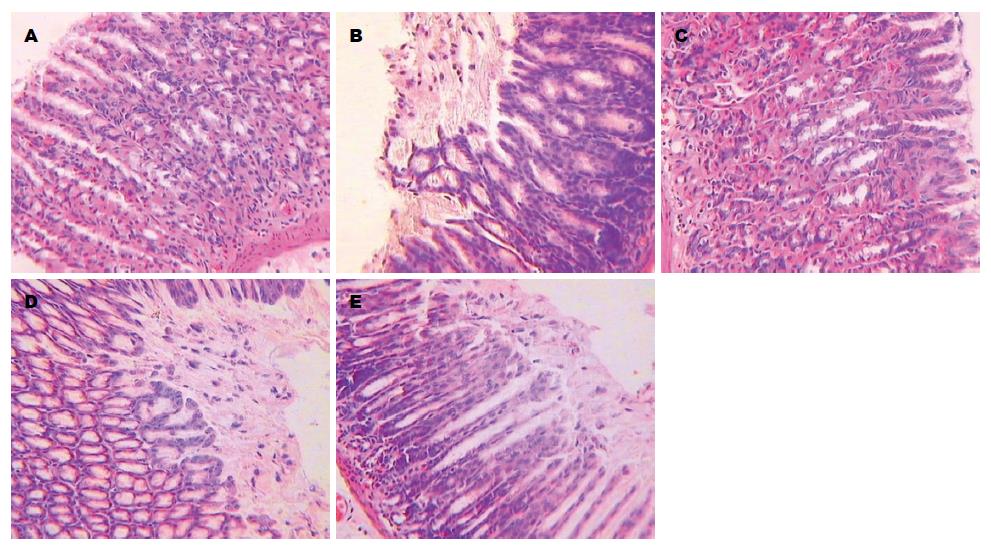
与A组比较, B、D、E组大鼠胃黏膜上皮明显破损、脱落, 固有层中腺体浅层被破坏, 有少数炎症细胞浸润, 胃黏膜上皮损伤明显; 与B、D、E组比较, C组大鼠胃黏膜破损、脱落较轻, 炎症细胞浸润较少, 说明艾灸预处理对胃黏膜损伤的炎性浸润有抑制作用, 能促进胃黏膜的修复(图2).
与A组比较, B组大鼠胃黏膜组织HE染色镜检炎症程度评分积分值升高(P<0.01); 与B组相比, C组大鼠胃黏膜组织HE染色镜检炎症程度评分积分值降低(P<0.01), D、E组大鼠胃黏膜组织HE染色镜检炎症程度评分积分值无明显降低(P>0.05); 与D、E组相比, C组大鼠胃黏膜组织HE染色镜检炎症程度评分积分值明显降低(P<0.01), 以上结果提示: H. pylori灌胃造模后, 胃黏膜受损; 艾灸预处理可降低胃黏膜组织HE染色镜检炎症程度评分积分值, 减轻胃黏膜炎性损伤, 且减轻胃黏膜炎性损伤作用优于艾灸非穴位与电针组(表1).
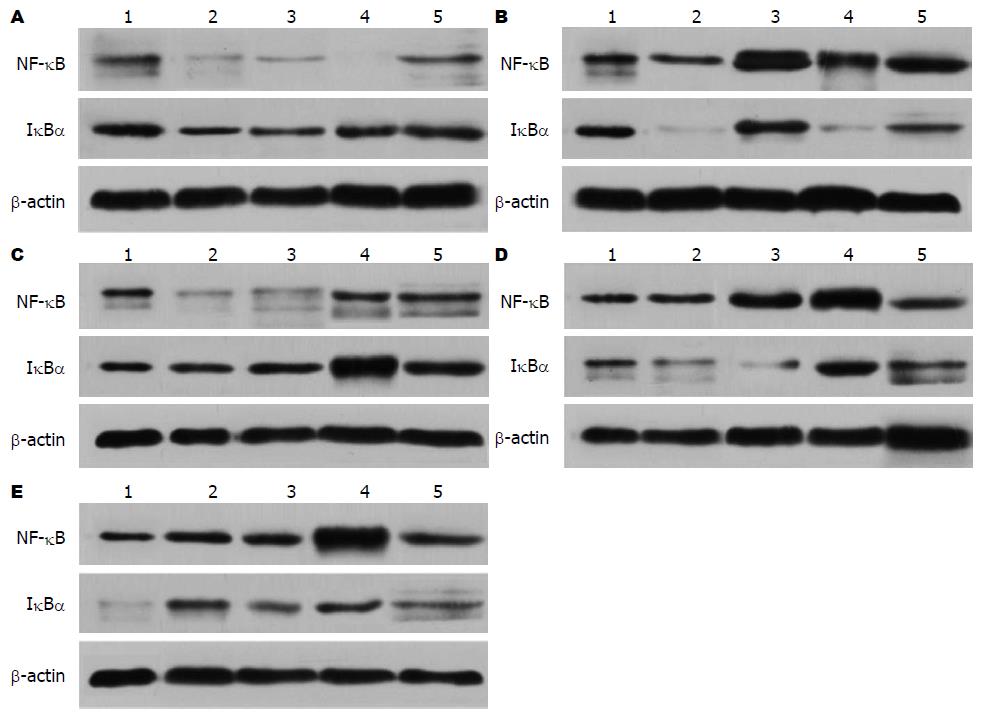
与A组比较, B组大鼠单核细胞IκBα含量降低(P<0.05); 与B组比较, C组大鼠单核细胞IκBα含量增加(P<0.05), D、E组大鼠单核细胞IκBα含量无明显增加(P>0.05); 与D、E组比较, C组大鼠单核细胞IκBα表达增加(P<0.05), 以上提示: H. pylori灌胃造模后, 大鼠单核细胞IκBα表达量显著下降, 艾灸穴位组可以使H. pylori胃炎大鼠单核细胞IκBα表达增加, 而电针穴位和艾灸对照点组不能增加H. pylori胃炎大鼠单核细胞IκBα含量, 艾灸穴位组增加大鼠单核细胞IκBα表达效果优于电针和艾灸非对照点组的效果(表2, 图3). 与A组比较, B组大鼠单核细胞NF-κB表达量增强(P<0.01); 与B组比较, C组大鼠单核细胞NF-κB表达量下降(P<0.01), D、E组大鼠单核细胞NF-κB表达量无明显下降(P>0.05); 与D、E组比较, C组大鼠单核细胞NF-κB表达降低(P<0.01), 提示: H. pylori灌胃造模后, 大鼠单核细胞NF-κB表达量显著上升, 艾灸穴位组可以使H. pylori胃炎大鼠单核细胞NF-κB表达降低, 而电针穴位和艾灸对照点预处理不能降低H. pylori胃炎大鼠单核细胞NF-κB表达, 艾灸穴位组降低大鼠单核细胞NF-κB表达效果优于电针和艾灸非对照点组的效果(表2, 图3).
慢性胃炎属于祖国医学"胃脘痛"范围, 临床上约70%-80%的患者可无任何症状, 有症状者主要表现为上腹不适、饱胀、钝痛、烧灼痛等非特异性的消化不良症状[6]. H. pylori感染是导致胃炎的主要原因, H. pylori感染活动期胃黏膜固有层、小凹上皮和腺上皮之间可出现中性粒细胞浸润, 炎症的静息期则以淋巴细胞和浆细胞慢性炎症浸润为主. 目前关于H. pylori相关性慢性胃炎的诊断主要是组织学、尿素酶、细菌培养、14C-尿素呼气试验任一项阳性证实有H. pylori现症感染, 病理切片检查有慢性胃炎的组织学改变[14].
NF-κB命名是因为他是作为B细胞细胞核转录因子被发现, 免疫球蛋白κ轻链基因是他的结合位点, 他是以p50/p65异二聚体形式存在于哺乳动物细胞浆中的转录因子, 在静息状态下, 与抑制性蛋白IκB结合在一起, 以无活性的形式存在于细胞质中. 当他被细菌、病毒、LPS、氧化剂和自由基等刺激后[15-17], IκB被磷酸化和降解, 使NF-κB与IκB解离, 游离的NF-κB转入细胞核内, 启动基因转录[18], 诱导细胞因子的转录. NF-κB被认为是最重要的炎症调节信号通路之一[19,20]. 抑制蛋白IκB主要由IκBα、IκBβ和IκBε 3种分子组成的蛋白家族, 其中IκBα是NF-κB激活途径中主要的调节分子, IκB与NF-κB结合可以阻止细胞质中的NF-κB进入细胞核和调控其转录功能, 抑制NF-κB活化[21]. NF-κB信号通路[22]参与了感染、炎症、免疫反应和细胞凋亡等病理过程[23-25], IκBα的降解和磷酸化是NF-κB活化的最关键因素. 因此, 研究证明可以通过阻止IκBα降解来抑制NF-κB的活化, 从而阻断NF-κB炎性信号转导途径, 缓解组织炎性损伤[19,20].
总之, H. pylori灌胃造模后, 大鼠胃黏膜HE染色镜检胃黏膜炎症积分值和单核细胞NF-κB含量显著升高, IκBα含量显著降低; 艾灸穴位处理后大鼠胃黏膜HE染色镜检胃黏膜炎症积分值和单核细胞NF-κB含量显著降低, IκBα含量显著增加; 电针穴位和艾灸对照点处理后大鼠胃黏膜HE染色镜检胃黏膜炎症积分值和单核细胞NF-κB无明显降低, IκBα含量无明显增加; 提示:H. pylori直接灌胃后, 大鼠胃黏膜明显受损; 电针穴位和艾灸对照点处理不能减轻对H. pylori胃炎的炎性损伤; 艾灸穴位可减轻H. pylori胃炎胃黏膜炎性损伤, 此作用可能与艾灸诱导单核细胞IκBα大量表达, 抑制NF-κB表达, 减少炎性细胞因子的释放, 干预胃黏膜局部炎性细胞的浸润, 减轻胃黏膜炎症损伤有关.
本组以往从艾灸对胃黏膜保护作用进行了系统研究, 发现艾灸足三里等穴能诱导eHSP72表达, 增强机体免疫功能, 干预胃黏膜炎性损伤过程; 但是艾灸对幽门螺杆菌(Helicobacter pylori, H. pylori)胃炎的干预作用, 是否与细胞核因子κB(nuclear factor-κB, NF-κB)、IκBα有关还有待进一步研究.
郑鹏远, 教授, 主任医师, 郑州大学第二附属医院消化科
艾灸、NF-κB与胃黏膜炎性损伤有密切关系, 研究报道艾灸穴位处理能增强机体免疫功能, 干预胃黏膜炎性损伤. 艾灸对H. pylori所致胃黏膜损伤的保护是否与NF-κB、IκBα有关, 艾灸是否能通过调节 NF-κB、IκBα的表达来干预胃黏膜局部炎性细胞的浸润, 是本研究的主要目的.
研究发现艾灸对胃黏膜损伤有保护作用, 灸疗对机体的免疫作用是一切作用的基础, 目前从单核细胞NF-κB、IκBα方面来研究艾灸的免疫调节作用是近年研究的热点.
本研究结果显示艾灸足三里等穴可降低H. pylori胃炎大鼠胃黏膜HE染色镜检胃黏膜炎症积分值, 增高单核细胞IκBα含量, 降低NF-κB含量. 说明艾灸足三里等穴能通过调节单核细胞IκBα、NF-κB含量, 达到对胃黏膜的保护作用, 并有一定穴位特异性.
本文设计合理, 实验方法科学, 结论中肯, 具有一定指导意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Mizgerd JP, Spieker MR, Doerschuk CM. Early response cytokines and innate immunity: essential roles for TNF receptor 1 and type I IL-1 receptor during Escherichia coli pneumonia in mice. J Immunol. 2001;166:4042-4048. [PubMed] |
| 2. | Mizgerd JP, Lupa MM, Hjoberg J, Vallone JC, Warren HB, Butler JP, Silverman ES. Roles for early response cytokines during Escherichia coli pneumonia revealed by mice with combined deficiencies of all signaling receptors for TNF and IL-1. Am J Physiol Lung Cell Mol Physiol. 2004;286:L1302-L1310. [PubMed] [DOI] |
| 3. | Jones MR, Simms BT, Lupa MM, Kogan MS, Mizgerd JP. Lung NF-kappaB activation and neutrophil recruitment require IL-1 and TNF receptor signaling during pneumococcal pneumonia. J Immunol. 2005;175:7530-7535. [PubMed] |
| 4. | Lee JS, Frevert CW, Matute-Bello G, Wurfel MM, Wong VA, Lin SM, Ruzinski J, Mongovin S, Goodman RB, Martin TR. TLR-4 pathway mediates the inflammatory response but not bacterial elimination in E. coli pneumonia. Am J Physiol Lung Cell Mol Physiol. 2005;289:L731-L738. [PubMed] [DOI] |
| 5. | Perkins ND. The Rel/NF-kappa B family: friend and foe. Trends Biochem Sci. 2000;25:434-440. [PubMed] [DOI] |
| 6. | 王 吉耀, 廖 二元, 胡 品津. 内科学. 第2版. 北京: 人民卫生出版社 2005; 414-418. |
| 8. | 封 迎帅, 易 受乡, 林 亚平, 彭 艳, 史 冬梅, 侯 艳玲. 艾灸预处理对幽门螺杆菌胃黏膜炎性损伤大鼠血清IgG和eHSP72含量的影响. 世界华人消化杂志. 2012;20:1131-1136. [DOI] |
| 9. | 李 忠仁. 实验针灸学. 第1版. 北京: 中国中医药出版社 2003; 327-329. |
| 10. | Price AB. The Sydney System: histological division. J Gastroenterol Hepatol. 1991;6:209-222. [PubMed] [DOI] |
| 11. | Nagahata Y, Kawakita N, Azumi Y, Numata N, Yano M, Saitoh Y. Etiological involvement of Helicobacter pylori in "reflux" gastritis after gastrectomy. Am J Gastroenterol. 1996;91:2130-2134. [PubMed] |
| 13. | 陈 曦, 杨 世忠, 迟 宝荣. 大鼠炎症性肠病模型的复制及中药的干预作用. 吉林大学学报(医学版). 2008;34:262-266. |
| 15. | Grumont RJ, Gerondakis S. Rel induces interferon regulatory factor 4 (IRF-4) expression in lymphocytes: modulation of interferon-regulated gene expression by rel/nuclear factor kappaB. J Exp Med. 2000;191:1281-1292. [PubMed] [DOI] |
| 16. | Chen F, Castranova V, Shi X, Demers LM. New insights into the role of nuclear factor-kappaB, a ubiquitous transcription factor in the initiation of diseases. Clin Chem. 1999;45:7-17. [PubMed] |
| 17. | Gugasyan R, Grumont R, Grossmann M, Nakamura Y, Pohl T, Nesic D, Gerondakis S. Rel/NF-kappaB transcription factors: key mediators of B-cell activation. Immunol Rev. 2000;176:134-140. [PubMed] [DOI] |
| 18. | May MJ, Ghosh S. Signal transduction through NF-kappa B. Immunol Today. 1998;19:80-88. [PubMed] |
| 19. | Janssen-Heininger YM, Poynter ME, Baeuerle PA. Recent advances towards understanding redox mechanisms in the activation of nuclear factor kappaB. Free Radic Biol Med. 2000;28:1317-1327. [PubMed] [DOI] |
| 20. | Pahl HL. Activators and target genes of Rel/NF-kappaB transcription factors. Oncogene. 1999;18:6853-6866. [PubMed] [DOI] |
| 22. | Silverman N, Maniatis T. NF-kappaB signaling pathways in mammalian and insect innate immunity. Genes Dev. 2001;15:2321-2342. [PubMed] [DOI] |
| 23. | Aradhya S, Nelson DL. NF-kappaB signaling and human disease. Curr Opin Genet Dev. 2001;11:300-306. [PubMed] [DOI] |
| 24. | Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest. 2001;107:7-11. [PubMed] [DOI] |
| 25. | Baldwin AS. Series introduction: the transcription factor NF-kappaB and human disease. J Clin Invest. 2001;107:3-6. [PubMed] [DOI] |