修回日期: 2013-07-11
接受日期: 2013-07-31
在线出版日期: 2013-09-08
目的: 评价白介素(interleukin, IL)-17A在结直肠癌及腺瘤间质中的表达及意义.
方法: 回顾性收集我院消化内镜室2009-2011年行肠镜检查后诊为结直肠癌与结直肠腺瘤患者的临床病理资料及组织标本, 通过免疫组织化学方法评价IL-17A的表达及其意义, 同时评价其与腺瘤组织β-连接素(catenin)表达状态的相关性.
结果: 结直肠癌53例, IL-17A阳性细胞数为21.6±14.4, 高表达率54.2%; 结直肠腺瘤48例, IL-17A阳性细胞数为20.42±17.16, 高表达率45.8%; 溃疡性结肠炎14例, IL-17A阳性细胞数为20.24±12.17, 高表达率50.0%; 正常对照12例, IL-17A阳性细胞数为6.85±4.66, 高表达率0.0%, 癌、腺瘤与溃疡性结肠炎中的表达均显著高于正常对照(P<0.01), 但三者之间没有统计学差异(P>0.05). 结直肠癌中, IL-17A的表达与结肠癌的部位、分化程度、Duke's分期、淋巴结转移、微血管密度(microvessel density, MVD)以及Ki-67表达均不相关(P>0.05). 结直肠腺瘤中, IL-17A的表达与腺瘤组织学类型、MVD、部位、大小、颜色、形态、是否多发及患者是否伴发结直肠癌均不相关(P>0.05); 重度异型增生的腺瘤组织IL-17A的表达明显高于轻度和中度异型增生的腺瘤组织(29.62±26.77与16.98±10.62), 但差异没有统计学意义(P>0.05). β-catenin胞核表达的结直肠腺瘤组织中IL-17A计数(29.11±6.16)明显高于胞浆(16.95±7.99)及胞膜(15.10±11.46)表达的结直肠腺瘤(P值分别为0.038与0.021), 结直肠腺瘤中IL-17A的表达强度与β-catenin的表达部位显著相关(P = 0.002).
结论: 结直肠腺瘤与结直肠癌间质中存在IL-17A高表达, IL-17A可能具有促进结直肠腺瘤组织中β-catenin胞核转位的作用.
核心提示: 本文通过免疫组织化学方法对白介素(interleukin, IL)-17A在结直肠腺瘤-腺癌间质中的表达情况及其与各项临床病理指标以及血管生成、细胞增殖、β-catenin表达状态之间的关系进行了评价. 证实了IL-17A在结直肠癌及结直肠腺瘤中均存在高表达, 同时发现腺瘤中IL-17A的表达可能与异型增生程度具有一定关系, 且可能影响腺瘤癌变过程中的β-catenin通路, 提示有必要对于IL-17A在结肠腺瘤癌变过程中的作用进行进一步的研究.
引文著录: 刘揆亮, 余瑞金, 吴静, 林香春. 白介素17A在结直肠癌及腺瘤组织中的表达及其意义. 世界华人消化杂志 2013; 21(25): 2522-2529
Revised: July 11, 2013
Accepted: July 31, 2013
Published online: September 8, 2013
AIM: To investigate the expression and role of interleukin-17 (IL-17) in colorectal cancer and adenoma.
METHODS: Tissue samples taken from patients with colorectal cancer or adenoma who were treated in our gastrointestinal endoscopy unit between 2009 and 2011 were used in this retrospective study. The expression of IL-17A in the above tissue samples was detected by immunohistochemistry. The relationship between IL-17A expression and clinicopathological characteristics and β-catenin localization was analyzed.
RESULTS: The positive rate of IL-17A expression was significantly higher in colorectal cancer, colorectal adenoma and ulcerative colitis than in normal colorectal tissue (54.2%, 45.8%, 50.0% vs 0.0%, all P < 0.01). IL-17A expression was not associated with tumor location, degree of differentiation, Duke's stage, lymph node metastasis, MVD or Ki-67 expression in colorectal cancer (all P > 0.05). IL-17A expression was also not associated with histological type, MVD, concomitant colorectal cancer, location, size, color, number or shape of adenomas (all P > 0.05) in colorectal adenoma. The expression of IL-17A was higher in adenomas with high-grade dysplasia than in those with mild to moderate dysplasia, but the difference was not significant (29.62 ± 26.77 vs 16.98 ± 10.62, P > 0.05). The expression of IL-17A was significantly higher in adenomas with nuclear expression of β-catenin than in those with cytoplasmic or membrane expression of β-catenin (29.11 ± 6.16 vs 16.95 ± 7.99, 15.10 ± 11.46, P = 0.038, 0.021).
CONCLUSION: IL-17A expression is elevated in colorectal cancer and adenomas and may mediate nuclear translocation of β-catenin.
- Citation: Liu KL, Yu RJ, Wu J, Lin XC. Significance of interleukin 17-A expression in colorectal cancer and adenoma. Shijie Huaren Xiaohua Zazhi 2013; 21(25): 2522-2529
- URL: https://www.wjgnet.com/1009-3079/full/v21/i25/2522.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i25.2522
肿瘤微环境是上皮性恶性肿瘤的主要特征之一, 胃肠道肿瘤的微环境由间质细胞、免疫细胞、肠神经系统以及基质组成, 在肿瘤发生、进展及转移过程中起到重要作用[1]. 肿瘤间质中的大量炎性细胞因子构成的炎性微环境对于肿瘤的发生发展具有极其重要的促进作用, "促进肿瘤的炎症"已被列为肿瘤的十大特征之一[2]. 白介素(interleukin, IL)-17A是Th17细胞产生的一种细胞因子, 参与了多种自身免疫性疾病和慢性炎症性疾病的发展[3], 近年的研究发现其在肿瘤的发病中也可能发挥重要作用, 但其确切作用机制尚未完全阐明. 本研究收集本单位近年来的结直肠癌及结直肠腺瘤的病例, 通过免疫组织化学方法, 对IL-17A在结直肠癌及腺瘤等组织中的表达及其意义进行了初步探讨.
回顾性收集我院消化内镜室于2009-2011年行肠镜检查后发现结肠腺瘤及结肠癌患者行活检或手术及内镜下切除的病理组织石蜡标本, 常规切片备用. 选取肠镜检查提示小增生性息肉的患者的增生性息肉组织作为正常对照, 另选取一部分溃疡性结肠炎患者的活检组织进行比较.
1.2.1 实验: 免疫组织化学染色采用Envision二步法, IL-17A兔抗人多克隆抗体购自美国Santa Cruz公司(编号sc-7927, 浓度1:100); CD34鼠抗人单克隆抗体购自丹麦Dako公司(编号M7165, 浓度1:100); β-连接素(catenin)鼠抗人单克隆抗体购自中杉金桥公司(编号ZM-0442, 浓度1:200); 二抗(工作液)购自丹麦Dako公司; 阴性对照以PBS代替一抗进行. 染色方法如下: 切片常规脱蜡置水, pH 6.0枸橼酸缓冲液抗原修复, 3%过氧化氢蒸馏水溶液室温避光封闭, 5%羊血清室温封闭, 滴加一抗和二抗, DAB显色后苏木素复染15 s.
1.2.2 免疫组织化学结果观察及判断标准: IL-17A以黏膜固有层或肿瘤间质内可见棕黄色或褐色颗粒的细胞为阳性细胞, 在400×视野下, 对每个标本选取5个阳性细胞集中的视野(热点区域)摄片[4,5], 采用Image Pro Plus 6.0软件计数视野中的阳性细胞数, 取其平均值作为该标本的IL-17阳性细胞数, 以≥20个(因数据统计显示本课题中IL-17阳性细胞数均值接近20)为高表达; β-catenin的染色以细胞膜、细胞浆或细胞核见棕黄色或褐色颗粒为染色阳性, 胞核着色细胞>5%时为胞核表达, 胞浆着色细胞>10%时为胞浆表达; 对CD34染色后呈现单个内皮或内皮细胞群形成的管状或窄隙状结构均视为微血管, 400×视野下, 对每个标本选取3个微血管集中的视野摄片计算微血管密度(microvessel density, MVD).
统计学处理 采用SPSS15.0软件进行统计学分析. 计数资料以率表示, 计量资料以mean±SD表示, 计数资料的比较采用χ2检验, 计量资料的比较采用独立样本t检验或方差分析, 等级资料的相关性比较采用Spearman相关性分析, 以P<0.05为差异有统计学意义.
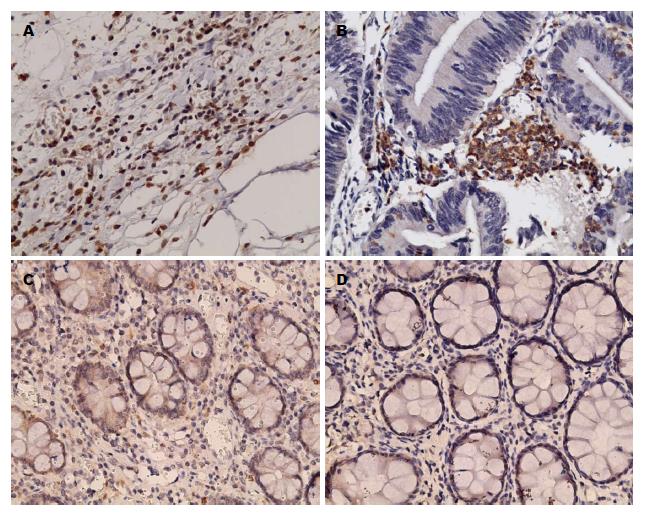
IL-17A的表达情况: 结直肠癌间质中可见散在或聚集的IL-17A染色为阳性的单个核细胞, 部分切片中可见肿瘤细胞着色; 结直肠腺瘤间质中可见到散在或聚集的IL-17A染色为阳性的单个核细胞, 部分切片中有少许上皮细胞着色; 溃疡性结肠炎黏膜固有层中可见到散在或聚集的IL-17A染色为阳性的单个核细胞; 正常对照组中黏膜固有层可见少许IL-17A染色阳性的单个核细胞(图1).
不同组织中IL-17A表达的比较: 结直肠癌53例, IL-17A阳性表达的单个核细胞计数为21.6±14.4; 其中高表达者28例, 高表达率54.2%; 结直肠腺瘤48例, IL-17A阳性表达的单个核细胞计数为20.42±17.16, 高表达者22例, 高表达率45.3%, 溃疡性结肠炎14例, IL-17A阳性表达的单个核细胞计数为20.24±12.17, 高表达率50.0%. 正常对照12例, IL-17A阳性表达的单个核细胞计数为6.85±4.66, 无高表达者. 结肠癌、结肠腺瘤及溃疡性结肠炎(ulcerative colitis, UC)中IL-17A的表达均明显高于正常对照(P<0.01), 但三组之间相比均无明显差异(P>0.05)(图1, 表1).
IL-17A在结直肠癌中的表达情况及其临床病理意义: 结直肠癌53例, IL-17A阳性表达的单个核细胞计数为21.6±14.4; MVD为34.18±7.35; Ki-67阳性(>50%)43例. IL-17A的表达与结肠癌的部位、分化程度、Dukes分期以及Ki-67的表达均不相关(表2), IL-17A的表达强度与MVD不相关(P>0.05).
| 项目 | 数量 | IL-17A计数 | P值 |
| 53 | 21.6±14.4 | ||
| 部位 | >0.05 | ||
| 右半结肠 | 13 | 20.89±11.08 | |
| 左半结肠及直肠 | 40 | 21.84±15.46 | |
| 临床分期 | >0.05 | ||
| Duke's B | 6 | 11.87±10.75 | |
| Duke's C | 34 | 23.07±14.34 | |
| Duke's D | 13 | 22.26±15.27 | |
| 分化程度 | >0.05 | ||
| 低分化 | 14 | 24.04±14.32 | |
| 中-高分化 | 39 | 20.73±14.53 | |
| 淋巴结转移 | >0.05 | ||
| 有 | 17 | 22.56±15.47 | |
| 无 | 36 | 21.15±14.09 | |
| Ki-67 | >0.05 | ||
| 阳性 | 43 | 23.17±14.63 | |
| 阴性 | 10 | 14.88±11.85 |
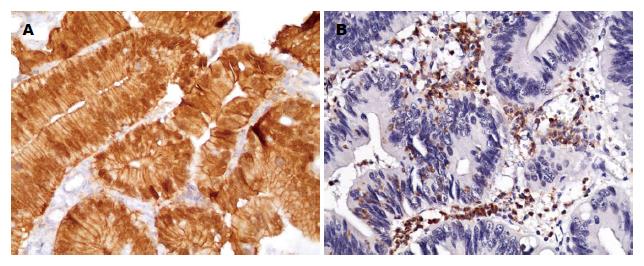
IL-17A在结直肠腺瘤中的表达情况及其临床病理意义: 结直肠腺瘤48例, IL-17A阳性表达的单个核细胞计数为20.42±17.16, MVD为21.92±5.36; 其中管状腺瘤15例, IL-17A阳性细胞计数为15.64±11.00, 高表达率40.0%; 绒毛管状腺瘤30例, 单个核细胞计数为23.13±19.75, 高表达率50.0%; 锯齿状腺瘤3例, 单个核细胞计数为17.20±10.76, 高表达者1例. 管状腺瘤与绒毛管状腺瘤中, 轻度异型增生9例, IL-17A阳性细胞计数11.87±3.96, 高表达率33.3%, 中度异型增生23例, IL-17阳性细胞计数18.98±11.76, 高表达率56.5%; 重度异型增生13例, IL-17A阳性细胞计数29.62±26.77, 高表达率61.5%. IL-17A的表达与腺瘤组织学类型、MVD、部位、大小、颜色、形态、是否多发以及患者是否伴发结直肠癌均不相关(P>0.05), 重度异型增生的腺瘤组织中IL-17A的表达明显高于轻度和中度异型增生的腺瘤组织, 但差异没有统计学意义. β-catenin胞核表达的结直肠腺瘤组织中IL-17A计数(29.11±6.16)明显高于胞浆(16.95±7.99)及胞膜(15.10±11.46)表达的结直肠腺瘤(P值分别为0.038与0.021, 图2, 表3), 相关性分析显示IL-17A的表达强度与β-catenin的表达部位显著相关(P = 0.002, 表4).
| 项目 | 数量 | IL-17A计数 | 高表达率(%) | P值 |
| 48 | 20.42±17.16 | 45.8 | ||
| 部位 | >0.05 | |||
| 右半结肠 | 12 | 23.37±28.05 | ||
| 左半结肠及直肠 | 36 | 19.43±12.00 | ||
| 颜色 | >0.05 | |||
| 色红 | 18 | 21.9±12.6 | ||
| 色同周围 | 30 | 19.53±19.54 | ||
| 大小(cm) | >0.05 | |||
| ≥1 | 14 | 24.04±14.32 | ||
| <1 | 39 | 20.73±14.53 | ||
| 形态 | >0.05 | |||
| 分叶 | 26 | 21.28±20.57 | ||
| 不分叶 | 22 | 19.4±12.38 | ||
| 是否多发 | >0.05 | |||
| 多发 | 27 | 22.72±19.89 | ||
| 单发 | 21 | 17.46±12.67 | ||
| 患者是否伴发结直肠癌 | >0.05 | |||
| 是 | 8 | 22.82±17.47 | ||
| 否 | 40 | 19.94±17.28 | ||
| 组织学类型 | >0.05 | |||
| 管状 | 15 | 15.64±11.00 | 40.0 | |
| 绒毛管状 | 30 | 23.13±19.75 | 50.0 | |
| 锯齿状 | 3 | 17.20±10.76 | 33.3 | |
| 异型增生程度1 | >0.05 | |||
| 轻度 | 9 | 11.87±3.96 | 33.3 | |
| 中度 | 23 | 18.98±11.76 | 56.5 | |
| 重度 | 13 | 29.65±26.73 | 61.5 | |
| β-catenin表达 | <0.05 | |||
| 胞膜 | 13 | 15.10±11.46a | 23.1 | |
| 胞浆 | 16 | 16.95±7.99a | 37.5 | |
| 胞核 | 16 | 29.11±6.16 | 75.0 |
| IL-17A表达强度 | β-catenin表达位置 | ||
| 胞膜表达 | 胞浆表达 | 胞核表达 | |
| 总数 | 13 | 16 | 16 |
| 高表达 | 3 | 6 | 9 |
| 一般表达 | 10 | 10 | 7 |
IL-17A是由Th17细胞产生的一种细胞因子, 主要通过与上皮细胞、成纤维细胞、血管内皮细胞等多种细胞表面的IL-17受体结合而发挥作用, 可诱导多种促炎细胞因子及趋化因子的释放, 参与多种慢性炎症的发生与维持过程[3]. 研究表明卵巢癌[6]、胃癌[7]、肺癌[8]、乳腺癌[9]、前列腺癌[10]、肝癌[11]等多种肿瘤组织中IL-17A表达也均有增加, 但其在肿瘤发生发展过程中的确切作用机制仍不十分清楚[12,13]. 有研究发现IL-17A可调节IL-6及STAT3通路[14]以及基质金属蛋白酶7(matrixmetalloproteinase 7, MMP7)[15], 还可通过血管内皮生长因子(vascular endothelial growth factor, VEGF)促进肿瘤新生血管的形成[5,16], 可通过影响肿瘤微环境而促进肿瘤生长, 可能主要起到促肿瘤作用; 但也有研究提出IL-17可能具有抗肿瘤免疫作用[17], 还有研究将肿瘤细胞注入IL-17-/-小鼠体内后肿瘤生长较野生型小鼠加快且肿瘤转移增加[18]. 有人提出IL-17A在不同微环境背景及肿瘤不同生长阶段时可能具有促肿瘤生长或抑制肿瘤生长的不同作用[12,13].
动物实验及临床研究均证实IL-17在炎症性肠病中表达增高[19,20], 而炎症性肠病患者合并结肠炎相关性结肠癌明显增多[21], 另外, IL-17A敲除的小鼠中结肠炎相关结肠癌中明显减轻, 这些均提示IL-17可能参与炎症-异型增生-结肠癌途径[22]. 而近年来的研究提示IL-17A在散发性结直肠癌的结肠腺瘤-腺癌癌变途径中可能同样具有重要的作用[4,23], 动物实验表明, 在肠内多发新生物(multiple intestinal neoplasia, Min)小鼠(体内Apc基因为杂合子)中进一步敲除IL-17A后结肠内肿瘤的形成明显减少[24]; 而采用肠中毒性脆弱拟杆菌(enterotoxigenic bacteroides fragilis, ETBF)诱导IL-17A生成后Min小鼠的结肠肿瘤明显增加[25]. 临床研究也证实IL-17A在结肠癌患者的血清与结肠癌组织中均存在高表达[4,5,26,27]. 这些结果均提示IL-17A在结直肠癌的发生和发展过程中起到了重要作用, 但其确切机制, 尤其是在散发性结直肠癌中的作用仍不清楚[23].
在本研究中, 我们首先证实了IL-17A在散发性结直肠癌组织中存在高表达. 温玉婷等报道IL-17A在结肠癌组织的肿瘤细胞及固有层的单个核细胞内表达均有明显升高[28], 但一般认为IL-17A主要表达于结肠黏膜的固有层中, 在上皮组织内也可有部分上皮内淋巴细胞散在表达[4], 由于IL-17A在肿瘤间质中的表达可能更能体现其在肿瘤微环境中的作用, 我们在本研究中选取肿瘤间质内IL-17A阳性的单个核细胞的表达计数作为IL-17A表达强度的评判标准. 此前有研究提示结肠癌组织中IL-17A的表达水平与结肠癌的预后相关[5], 我们对IL-17A表达的临床病理意义也进行了评价, 但没有发现IL-17A与各临床病理指标的相关性, 这一点与Cui等[4]的研究结果类似. 一些研究提出IL-17A具有促进血管生成以及肿瘤细胞生长的作用[5,16], 但我们的研究未能证实IL-17A表达与MVD及Ki-67之间的相关性, 这一结果可能与我们研究的样本量相对不足有关. 其次, 本研究证实了结直肠腺瘤组织中IL-17A的高表达,这一结果与Cui等相符[4]. Cui等还发现重度异型增生的腺瘤组织中IL-17A表达水平明显高于轻度和中度异型增生的腺瘤[4], 而我们的研究中, 重度异型增生的腺瘤中IL-17A的表达也明显高于轻中度异型增生的腺瘤, 但差异没有统计学意义, 这可能与Cui等所用的PCR方法较我们所使用的免疫组织化学方法更为精确有关. IL-17A在结肠腺瘤癌变中所起作用尚不清楚[23], 此前有研究发现Foxp3和IL-17阳性的T细胞具有诱导结肠癌肿瘤干细胞的作用[29]. 我们也对IL-17A在腺瘤癌变中可能的作用进行了初步探讨, 评价了IL-17A的表达强度与腺瘤中MVD及β-catenin表达状态之间的相关性. 与结直肠癌组织中的结果相同, 我们未能证实IL-17A与MVD的相关性. Wnt/β-catenin是参与结肠腺瘤癌变的关键通路之一, β-catenin是细胞间粘着连接的主要结构成分, 正常情况下主要表达于胞膜, Wnt/β-catenin通路的突变可导致β-catenin出现胞浆及胞核内的异位表达, 核内的β-catenin表达水平是Wnt信号通路激活或结直肠癌启动细胞的重要标志[30]. β-catenin的异位表达是腺瘤癌变途径中的关键事件之一[21]. 最近的研究表明, β-catenin的核内表达可能较胞浆表达更具意义. Brand等[31]发现结肠腺瘤中β-catenin的核内表达与腺瘤切除后的复发相关; 而Chen等[30]的一项荟萃分析也发现结肠癌患者肿瘤组织内β-catenin的核内表达与患者预后相关, 而胞浆表达则不相关. 我们在本研究中发现, β-catenin核内表达的腺瘤组织中IL-17A阳性细胞的数量明显高于胞浆和胞膜表达的组织, 相关性分析显示IL-17A的表达强度与β-catenin的核内表达显著相关(P = 0.002). 研究表明, 抗炎药物5-氨基水杨酸可通过抑炎作用抑制慢性溃疡性结肠炎患者肠上皮中的β-catenin激活[32]; 分泌IL-17A的T辅助细胞17(Th17)上游的模式识别受体Toll样受体-4也可通过激活小鼠肠上皮内的β-catenin而导致肠道肿瘤[33], 还有研究显示IL-1β可显著增加大鼠正常肠道来源的IEC-18细胞系中β-catenin的表达水平[34], 这些结果均提示炎症及炎症细胞因子可能具有影响β-catenin表达的作用, 因此, 有理由推测IL-17A可能起到了促进β-catenin胞核转位的作用.
总之, 本研究通过免疫组织化学方法证实了IL-17A在结直肠癌及腺瘤中表达的增加, 并发现IL-17A有可能影响β-catenin的胞核转位, 这一结果提示IL-17A可能在结肠腺瘤癌变的过程中发挥重要作用, 有必要对IL-17A在结肠腺瘤癌变过程中的作用进行更多的研究.
肿瘤微环境中的炎性细胞因子在肿瘤发生、进展及转移等各个阶段均具有极其重要的作用, "促进肿瘤的炎症"已被列为肿瘤的十大特征之一.
王阁, 教授, 中国人民解放军第三军医大学第三附属医院
炎性细胞因子白介素17A(interleukin 17A, IL-17A)在各种慢性炎症性疾病中具有关键作用, 大量研究显示其在多种肿瘤中均表达增高, 并可能发挥重要的促瘤作用, 但确切作用仍不完全清楚. 其作用有可能与所处微环境和肿瘤不同阶段有关. 对于IL-17A在结直肠腺瘤-腺癌序列中的作用研究较少.
Cui等发现结直肠腺瘤-腺癌序列中IL-17A表达逐渐增强, 其表达强度也与腺瘤异型增生程度相关, 提示IL-17A可能在结直肠腺瘤癌变过程中有重要作用.
本文重点关注肿瘤间质中IL-17A在结直肠腺瘤及结直肠癌中的的表达情况, 并关注其与各项临床病理指标以及血管生成、细胞增殖及β-catenin表达状态之间的关系, 有助于初步揭示IL-17A在腺瘤癌变过程中的可能作用.
本文发现炎性细胞因子IL-17A在结直肠腺瘤中的表达可能与促进β-catenin的胞核转位表达有关, 对于IL-17A在腺瘤癌变过程中Wnt/β-catenin通路中的作用有必要进行进一步研究.
本文具有一定指导意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Quante M, Varga J, Wang TC, Greten FR. The gastrointestinal tumor microenvironment. Gastroenterology. 2013;145:63-78. [PubMed] [DOI] |
| 2. | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-674. [PubMed] [DOI] |
| 3. | Liu JZ, Pezeshki M, Raffatellu M. Th17 cytokines and host-pathogen interactions at the mucosa: dichotomies of help and harm. Cytokine. 2009;48:156-160. [PubMed] [DOI] |
| 4. | Cui G, Yuan A, Goll R, Florholmen J. IL-17A in the tumor microenvironment of the human colorectal adenoma-carcinoma sequence. Scand J Gastroenterol. 2012;47:1304-1312. [PubMed] [DOI] |
| 5. | Liu J, Duan Y, Cheng X, Chen X, Xie W, Long H, Lin Z, Zhu B. IL-17 is associated with poor prognosis and promotes angiogenesis via stimulating VEGF production of cancer cells in colorectal carcinoma. Biochem Biophys Res Commun. 2011;407:348-354. [PubMed] [DOI] |
| 6. | Chen JG, Xia JC, Liang XT, Pan K, Wang W, Lv L, Zhao JJ, Wang QJ, Li YQ, Chen SP. Intratumoral expression of IL-17 and its prognostic role in gastric adenocarcinoma patients. Int J Biol Sci. 2011;7:53-60. [PubMed] |
| 7. | Kato T, Furumoto H, Ogura T, Onishi Y, Irahara M, Yamano S, Kamada M, Aono T. Expression of IL-17 mRNA in ovarian cancer. Biochem Biophys Res Commun. 2001;282:735-738. [PubMed] [DOI] |
| 8. | Li Y, Cao ZY, Sun B, Wang GY, Fu Z, Liu YM, Kong QF, Wang JH, Zhang Y, Xu XY. Effects of IL-17A on the occurrence of lung adenocarcinoma. Cancer Biol Ther. 2011;12:610-616. [PubMed] [DOI] |
| 9. | Chen WC, Lai YH, Chen HY, Guo HR, Su IJ, Chen HH. Interleukin-17-producing cell infiltration in the breast cancer tumour microenvironment is a poor prognostic factor. Histopathology. 2013;63:225-233. [PubMed] [DOI] |
| 10. | Sfanos KS, Bruno TC, Maris CH, Xu L, Thoburn CJ, DeMarzo AM, Meeker AK, Isaacs WB, Drake CG. Phenotypic analysis of prostate-infiltrating lymphocytes reveals TH17 and Treg skewing. Clin Cancer Res. 2008;14:3254-3261. [PubMed] [DOI] |
| 11. | Zhang JP, Yan J, Xu J, Pang XH, Chen MS, Li L, Wu C, Li SP, Zheng L. Increased intratumoral IL-17-producing cells correlate with poor survival in hepatocellular carcinoma patients. J Hepatol. 2009;50:980-989. [PubMed] [DOI] |
| 12. | Murugaiyan G, Saha B. Protumor vs antitumor functions of IL-17. J Immunol. 2009;183:4169-4175. [PubMed] [DOI] |
| 13. | Hemdan NY. Anti-cancer versus cancer-promoting effects of the interleukin-17-producing T helper cells. Immunol Lett. 2013;149:123-133. [PubMed] [DOI] |
| 14. | Su X, Ye J, Hsueh EC, Zhang Y, Hoft DF, Peng G. Tumor microenvironments direct the recruitment and expansion of human Th17 cells. J Immunol. 2010;184:1630-1641. [PubMed] [DOI] |
| 15. | Zhang Q, Liu S, Ge D, Zhang Q, Xue Y, Xiong Z, Abdel-Mageed AB, Myers L, Hill SM, Rowan BG. Interleukin-17 promotes formation and growth of prostate adenocarcinoma in mouse models. Cancer Res. 2012;72:2589-2599. [PubMed] [DOI] |
| 16. | Numasaki M, Watanabe M, Suzuki T, Takahashi H, Nakamura A, McAllister F, Hishinuma T, Goto J, Lotze MT, Kolls JK. IL-17 enhances the net angiogenic activity and in vivo growth of human non-small cell lung cancer in SCID mice through promoting CXCR-2-dependent angiogenesis. J Immunol. 2005;175:6177-6189. [PubMed] |
| 17. | Benchetrit F, Ciree A, Vives V, Warnier G, Gey A, Sautès-Fridman C, Fossiez F, Haicheur N, Fridman WH, Tartour E. Interleukin-17 inhibits tumor cell growth by means of a T-cell-dependent mechanism. Blood. 2002;99:2114-2121. [PubMed] [DOI] |
| 18. | Kryczek I, Wei S, Szeliga W, Vatan L, Zou W. Endogenous IL-17 contributes to reduced tumor growth and metastasis. Blood. 2009;114:357-359. [PubMed] [DOI] |
| 19. | Fujino S, Andoh A, Bamba S, Ogawa A, Hata K, Araki Y, Bamba T, Fujiyama Y. Increased expression of interleukin 17 in inflammatory bowel disease. Gut. 2003;52:65-70. [PubMed] [DOI] |
| 20. | 刘 揆亮, 吕 愈敏, 顾 芳. 白介素17在三硝基苯磺酸诱导结肠炎小鼠结肠内的表达及益生菌的作用. 胃肠病学和肝病学杂志. 2011;20:363-366, 370. |
| 21. | Terzić J, Grivennikov S, Karin E, Karin M. Inflammation and colon cancer. Gastroenterology. 2010;138:2101-2114. e5. [PubMed] [DOI] |
| 22. | Hyun YS, Han DS, Lee AR, Eun CS, Youn J, Kim HY. Role of IL-17A in the development of colitis-associated cancer. Carcinogenesis. 2012;33:931-936. [PubMed] [DOI] |
| 23. | Shi Y, Lin H, Cui J, Qi H, Florholmen J, Liu Z, Cui G. The Role of Interleukin-17A in Colorectal Tumorigenesis. Cancer Biother Radiopharm. 2013;28:429-432. [PubMed] |
| 24. | Chae WJ, Gibson TF, Zelterman D, Hao L, Henegariu O, Bothwell AL. Ablation of IL-17A abrogates progression of spontaneous intestinal tumorigenesis. Proc Natl Acad Sci USA. 2010;107:5540-5544. [PubMed] [DOI] |
| 25. | Wu S, Rhee KJ, Albesiano E, Rabizadeh S, Wu X, Yen HR, Huso DL, Brancati FL, Wick E, McAllister F. A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses. Nat Med. 2009;15:1016-1022. [PubMed] [DOI] |
| 26. | Radosavljevic G, Ljujic B, Jovanovic I, Srzentic Z, Pavlovic S, Zdravkovic N, Milovanovic M, Bankovic D, Knezevic M, Acimovic LJ. Interleukin-17 may be a valuable serum tumor marker in patients with colorectal carcinoma. Neoplasma. 2010;57:135-144. [PubMed] [DOI] |
| 27. | Wägsäter D, Löfgren S, Hugander A, Dimberg J. Expression of interleukin-17 in human colorectal cancer. Anticancer Res. 2006;26:4213-4216. [PubMed] |
| 29. | Yang S, Wang B, Guan C, Wu B, Cai C, Wang M, Zhang B, Liu T, Yang P. Foxp3+IL-17+ T cells promote development of cancer-initiating cells in colorectal cancer. J Leukoc Biol. 2011;89:85-91. [PubMed] [DOI] |
| 30. | Chen Z, He X, Jia M, Liu Y, Qu D, Wu D, Wu P, Ni C, Zhang Z, Ye J. β-catenin overexpression in the nucleus predicts progress disease and unfavourable survival in colorectal cancer: a meta-analysis. PLoS One. 2013;8:e63854. [PubMed] [DOI] |
| 31. | Brand L, Munding J, Pox CP, Ziebarth W, Reiser M, Hüppe D, Schmiegel W, Reinacher-Schick A, Tannapfel A. ß-catenin, Cox-2 and p53 immunostaining in colorectal adenomas to predict recurrence after endoscopic polypectomy. Int J Colorectal Dis. 2013;28:1091-1098. [PubMed] |
| 32. | Munding J, Ziebarth W, Pox CP, Ladigan S, Reiser M, Hüppe D, Brand L, Schmiegel W, Tannapfel A, Reinacher-Schick AC. The influence of 5-aminosalicylic acid on the progression of colorectal adenomas via the β-catenin signaling pathway. Carcinogenesis. 2012;33:637-643. [PubMed] [DOI] |
| 33. | Santaolalla R, Sussman DA, Ruiz JR, Davies JM, Pastorini C, España CL, Sotolongo J, Burlingame O, Bejarano PA, Philip S. TLR4 activates the β-catenin pathway to cause intestinal neoplasia. PLoS One. 2013;8:e63298. [PubMed] [DOI] |
| 34. | Wang L, Liu Z, Li Y, Pappan L, Galliher-Beckley A, Shi J. Pro-inflammatory cytokine interleukin-1β promotes the development of intestinal stem cells. Inflamm Res. 2012;61:1085-1092. [PubMed] [DOI] |