修回日期: 2013-07-05
接受日期: 2013-07-18
在线出版日期: 2013-08-28
目的: 观察联合姜黄素和奥沙利铂对诱导人肠癌RKO细胞凋亡以及对凋亡相关蛋白表达的影响.
方法: 姜黄素和奥沙利铂单独及联合作用于RKO细胞, MTT法检测细胞增殖抑制率, 流式细胞术检测细胞凋亡, 免疫印记检测凋亡相关蛋白的表达.
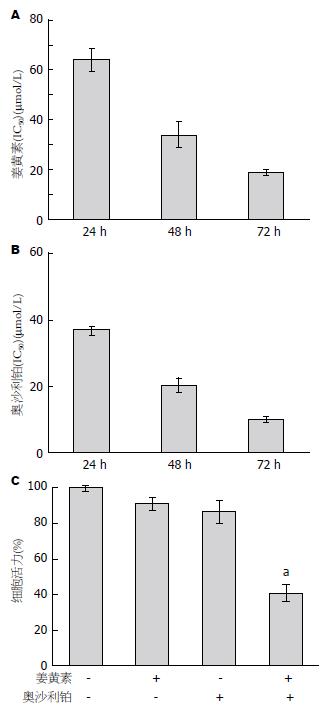
结果: MTT结果表明单药姜黄素作用RKO细胞24、48和72 h的IC50值分别为64.14 μmol/L±3.97 μmol/L、34.02 μmol/L±2.47 μmol/L和18.66 μmol/L±0.29 μmol/L. 单药奥沙利铂作用24、48和72 h的IC50值为36.97 μg/mL±1.26 μg/mL、20.34 μg/mL±2.29 μg/mL和9.92 μg/mL±0.92 μg/mL. 选用低浓度的药物(20 μmol/L的姜黄素和10 μg/mL的奥沙利铂) 联合处理RKO细胞24 h, 结果显示与相应浓度姜黄素、奥沙利铂单药组相比, 两药联合组对RKO的增殖抑制率显著增强, 细胞凋亡率显著提高(P<0.05). 进一步研究发现姜黄素和奥沙利铂联合后, 诱导了PARP、caspase3和caspase8活化裂解.
结论: 姜黄素和奥沙利铂联合用药后, 可能通过诱导PARP、caspase3和caspase8裂解, 进而抑制肠癌RKO细胞增殖和诱导细胞凋亡.
核心提示: 低剂量姜黄素和奥沙利铂联合, 可协同抑制肠癌细胞增殖, 同时通过诱导caspase3、caspase8及PARP裂解, 诱导肠癌细胞凋亡.
引文著录: 张璐璐, 谭欣, 孙虓, 何灏澜. 姜黄素联合奥沙利铂对肠癌RKO细胞增殖的抑制和凋亡的诱导. 世界华人消化杂志 2013; 21(24): 2429-2433
Revised: July 5, 2013
Accepted: July 18, 2013
Published online: August 28, 2013
AIM: To explore whether curcumin and oxaliplatin have a synergistic effect on cell proliferation and apoptosis in human colorectal cancer cell line RKO.
METHODS: RKO cells were treated with curcumin and/or oxaliplatin. Cell proliferation was assessed by MTT assay. Cell apoptosis was determined using flow cytometry. Expression of apoptosis-related proteins was detected by Western blot.
RESULTS: The IC50 of curcumin in RKO cells at 24, 48 and 72 h after treatment were 64.14 μmol/L ± 3.97 μmol/L, 34.02 μmol/L ± 2.47 μmol/L and 18.66 μmol/L ± 0.29 μmol/L, respectively. The IC50 of oxaliplatin at 24, 48 and 72 h were 36.97 μg/mL ± 1.26 μg/mL, 20.34 μg/mL ± 2.29 μg/mL and 9.92 μg/mL ± 0.92 μg/mL, respectively. Curcumin (20 μmol/L) and oxaliplatin (10 μg/mL) synergistically inhibited cell proliferation and induced cell apoptosis. The expression of cleaved PARP, caspase 3, and caspase 8 was up-regulated after the combination treatment.
CONCLUSION: Curcumin combined with oxaliplatin inhibits cell proliferation and promotes cell apoptosis by regulating apoptosis-related protein expression in human colorectal cancer cell line RKO.
- Citation: Zhang LL, Tan X, Sun X, He HL. Curcumin combined with oxaliplatin inhibits cell proliferation and induces apoptosis in human colorectal cancer cell line RKO. Shijie Huaren Xiaohua Zazhi 2013; 21(24): 2429-2433
- URL: https://www.wjgnet.com/1009-3079/full/v21/i24/2429.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i24.2429
大肠癌是我国常见的消化系恶性肿瘤之一, 其发病率仅次于胃癌和食管癌, 且呈逐年上升趋势[1]. 对于中晚期肠癌以化疗为基础的内科治疗成为首选治疗, 尽管新型化疗药物的应用使晚期肠癌患者的生存期有所提高, 但中位总生存时间仍然不超过24 mo[2]. 奥沙利铂是继顺铂、卡铂之后第3代铂类金属抗肿瘤药物, 他通过产生烷化物, 作用于DNA并以此为靶点, 与DNA链上的G共价键相结合, 形成链内、链间交链及DNA蛋白质交联, 造成DNA损伤, 从而抑制DNA的合成和复制, 使细胞发生死亡[3,4]. 有研究报道奥沙利铂可通过诱导细胞凋亡杀伤肿瘤细胞, 但因其药物不良反应、耐药性等问题大大地限制了临床应用[5,6].
姜黄素是从植物姜黄中提取出来的一种酚类色素, 属于天然酚类抗氧化剂, 具有抗氧化、抗炎、抗肿瘤及清除自由基等多方面的药理作用, 其抗肿瘤作用日益引起人们的重视. 实验研究表明, 姜黄素可诱导肝癌、食管癌等多种肿瘤细胞凋亡[7,8]. 本研究观察了姜黄素联合奥沙利铂对人肠癌RKO细胞的作用以及对凋亡相关蛋白表达的影响, 旨在为肠癌的临床治疗提供相关的理论依据.
姜黄素购自华美生科生物技术有限公司; 奥沙利铂为Sanofi-Aventis公司产品; RPML1640培养基购自美国GIBCO公司; 小牛血清购自上海实生细胞生物技术有限公司; 四甲基偶氮唑盐、二甲基亚砜购自美国Sigma公司; 鼠抗人聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase, PARP]、兔抗人caspase3和caspase8以及兔抗人β-actin抗体购自Santa Cruz公司; 辣根过氧化物酶标记的二抗购自北京中杉金桥生物技术有限公司; ECL试剂盒购自PIERCE公司.
1.2.1 细胞培养: 人肠癌细胞系RKO为沈阳医学院中心实验室保存. 上述细胞在含10%胎牛血清、12 kU/L庆大霉素的RPMI 1640培养液中, 在37 ℃、饱和湿度及5%CO2的孵育箱内传代培养. 每周换液2-3次, 胰酶消化后传代.
1.2.2 细胞活力检测: 取对数生长期的肠癌RKO细胞株, 接种于96孔板内, 待细胞贴壁后加入各实验组药物. 每种浓度设4个复孔, 并设空白组(不接种细胞)、对照组(只含等量溶剂). 之后每孔加入MTT 溶液(5 mg/mL)25 μL, 继续孵育4 h, 小心吸弃孔内上清液. 加入二甲亚砜200 μL/孔, 振荡至结晶物充分溶解, 在酶联免疫测定仪上选择570 nm波长, 空白孔凋零, 测定各孔光吸收值, 计算各浓度组的增殖抑制率.
1.2.3 细胞凋亡检测: 将肠癌RKO细胞接种于6孔板内, 分别用药物处理24 h后, 收集对照组、姜黄素和/或奥沙利铂处理组细胞. 常规消化离心, 冷PBS洗2次, 加1 mL 700 mL/L乙醇(预冷) 固定, 4 ℃过夜保存. 次日弃上清, 将细胞悬于0.5 mL冷PBS中, 加10 mg/mL的RNase 10 μL, 37 ℃水浴30 min, 加0.5 mg/mL的PI染剂10 μL, 避光30 min, 流式细胞仪检测. CELLQUEST软件分析结果.
1.2.4 蛋白表达检测: 分别收集姜黄素和/或奥沙利铂处理的RKO细胞, 冰上裂解后离心, 提取上清蛋白, 紫外分光光度计法进行蛋白定量. 10%SDS-PAGE凝胶电泳分离, 通过电转移法将蛋白质转移到硝酸纤维素膜后, 在含5%脱脂奶粉的TBST中室温封闭2 h. 加入一抗孵育过夜, TBST漂洗4次后, 加入辣根过氧化物酶标记二抗, 室温作用30 min, ECL法显色, GIS凝胶图像分析系统照相并分析处理.
统计学处理 所有实验重复3次, 以mean±SD表示, 组间比较采用t检验, P<0.05差异有统计学意义.
分别将姜黄素(0、10、20、40、60、80 μmol/L)作用RKO细胞, MTT结果表明24、48和72 h的IC50值分别为64.14 μmol/L±3.97 μmol/L、34.02 μmol/L±2.47 μmol/L和18.66 μmol/L±0.29 μmol/L(图1A). 奥沙利铂(0.1、1、10、100 μg/mL)作用于RKO细胞, 24、48和72 h的IC50值为36.97 μg/mL±1.26 μg/mL、20.34 μg/mL±2.29 μg/mL和9.92 μg/mL±0.92 μg/mL(图1B). 为了观察两药的协同效应, 我们选用低浓度药物(20 μmol/L的姜黄素和10 μg/mL的奥沙利铂)单独及联合处理RKO细胞24 h. 结果显示, 与相应浓度姜黄素、奥沙利铂单药组相比, 联合组对RKO的增殖抑制率显著增强(P<0.05)(图1C). 我们的结果表明, 姜黄素和奥沙利铂联合应用能够有效抑制人肠癌RKO细胞增殖.
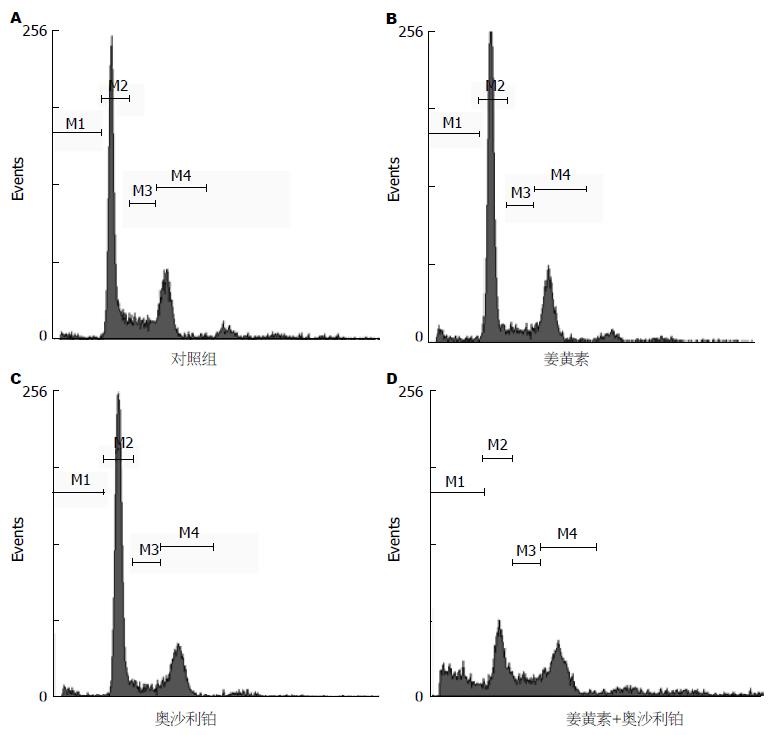
流式分析发现, RKO细胞经低毒剂量的姜黄素(20 μmol/L)作用24 h后, 细胞凋亡率为2.79%, 而单药奥沙利铂(10 μg/mL)作用细胞24 h, 细胞凋亡率为4.01%, 与对照组相比均无统计差异. 姜黄素(20 μmol/L)联合奥沙利铂(10 μg/mL)作用细胞24 h, 细胞凋亡率增加至36.79%(P<0.05)(图2). 上述结果提示, 姜黄素和奥沙利铂协同诱导肠癌RKO细胞凋亡.
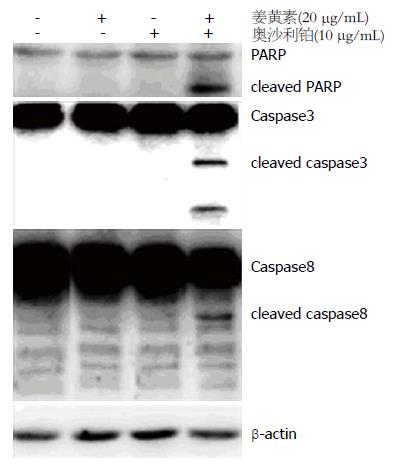
Western blot结果显示, 单药姜黄素(20 μmol/L)及单药奥沙利铂(10 μg/mL)分别作用RKO细胞24 h, 对凋亡相关蛋白PARP、caspase3和caspase8蛋白的表达无显著影响. 而姜黄素与奥沙利铂联合用药组, 诱导了PARP、caspase3和caspase8裂解(图3).
大肠癌是当今世界范围内发病和死亡最常见的恶性肿瘤之一. 在我国的城市及农村均高居死亡原因前列. 随着生活方式的变化、期望寿命的延长、环境污染的加重, 其发病率仍在逐年上升. 目前研究认为大肠癌的发生、发展是一个多因素、多步骤、多基因参与的复杂病理过程, 在此过程中, 涉及癌基因的突变和活化、抑癌基因的丢失或表达失调以及凋亡调节机制紊乱等遗传学改变. 临床研究表明, 奥沙利铂联合5-氟尿嘧啶/四氢叶酸可作为晚期结直肠癌的一线治疗方案, 对不同分化程度的肠癌均有较好的治疗效果[9,10]. 但大部分化疗药物在大剂量使用时不良反应较大, 并且长期使用容易产生耐药性.
近年来从天然植物中提取抗肿瘤药物已日益引起人们的重视. 姜黄素属于天然酚类抗氧化剂, 以往有学者在多种肿瘤中的研究初步证实: 姜黄素可抑制肿瘤细胞增殖, 诱导细胞发生凋亡. 赵东利等[11]研究发现姜黄素对小鼠移植瘤S180细胞具有显著增殖抑制作用. 李刚等[12]研究证实姜黄素对肾癌ACHN细胞生长具有显著抑制作用, 此外还发现姜黄素具有放射增敏作用. 陈小芬等[13]研究发现姜黄素呈剂量-时间依赖性方式抑制SKOV-3细胞增殖. 为了减少药物的不良反应, 并能够有效的杀伤肿瘤细胞, 我们选用低浓度的姜黄素及奥沙利铂联合作用于肠癌RKO细胞, 结果显示20 μmol/L的姜黄素和10 μg/mL的奥沙利铂联合应用时, 具有协同抑制肠癌RKO细胞增殖的作用. 进一步深入探讨其分子机制, 结果表明经低毒剂量的姜黄素(20 μmol/L)和奥沙利铂(10 μg/mL)单独作用RKO细胞24 h后, 细胞凋亡率分别为2.79%和4.01%, 与对照组相比无统计差异; 联合上述浓度的姜黄素和奥沙利铂作用RKO细胞24 h后, 凋亡细胞显著增加, 细胞凋亡率增至36.79%, 差异有统计学意义. 研究结果提示, 姜黄素和奥沙利铂联合用药能够协同抑制RKO细胞增殖, 同时诱导细胞凋亡.
细胞凋亡是一个受基因调控的多种信号传递系统参与的主动过程, 在细胞凋亡途径中, 首先激活的是启动型caspase, 如caspase8、caspase9, 而后通过级联放大过程激活执行型caspase, 如caspase3、caspase7等, 最终特异性地裂解其底物即PARP, 使细胞发生生化及形态学改变, 导致细胞凋亡[14-16]. 本研究中采用Western blot检测发现, 低剂量的姜黄素和奥沙利铂联合应用时, caspase3、caspase8及PARP出现了明显的裂解带, 而姜黄素和奥沙利铂单药组则未见明显裂解带, 结果提示低剂量的姜黄素和奥沙利铂联合用药后, 通过诱导caspase3、caspase8及PARP裂解, 进而抑制肠癌RKO细胞增殖和诱导细胞凋亡.
总之, 本研究证实联合低剂量的姜黄素和奥沙利铂, 可协同抑制肠癌细胞增殖, 同时通过诱导caspase3、caspase8及PARP裂解, 进而增加肠癌细胞凋亡, 为今后大肠癌的临床治疗提供了理论依据.
奥沙利铂联合5-氟尿嘧啶/四氢叶酸作为晚期结直肠癌的一线治疗方案, 对不同分化程度的肠癌均有较好的治疗效果, 但长期使用容易产生耐药性. 以往研究初步证实姜黄素可抑制肿瘤细胞增殖, 诱导细胞发生凋亡.
白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
姜黄素具有抗氧化、抗炎、抗肿瘤及清除自由基等多方面的药理作用, 其抗肿瘤作用日益引起人们的重视. 本研究观察了姜黄素联合奥沙利铂对人肠癌细胞的作用, 旨在为肠癌的临床治疗提供相关的理论依据.
赵东利等发现姜黄素对小鼠移植瘤具有显著增殖抑制作用. 李刚等证实姜黄素对肾癌生长具有显著抑制作用, 还发现其具有放射增敏作用. 陈小芬等发现姜黄素显著抑制SKOV-3细胞增殖.
本研究观察了姜黄素联合奥沙利铂对人肠癌RKO细胞的作用以及对凋亡相关蛋白表达的影响, 旨在为肠癌的临床治疗提供相关的理论依据.
联合低剂量的姜黄素和奥沙利铂, 可协同抑制肠癌细胞增殖, 同时通过诱导caspase3、caspase8及PARP裂解, 进而增加肠癌细胞凋亡, 为今后大肠癌的临床治疗提供了理论依据.
本文的科学性、创新性和可读性能较好地反映我国胃肠病学临床基础研究水平.
编辑: 田滢 电编: 闫晋利
| 1. | Li Y, Yang H, Cao J. Association between alcohol consumption and cancers in the Chinese population--a systematic review and meta-analysis. PLoS One. 2011;6:e18776. [PubMed] [DOI] |
| 2. | Chen J, Ye Y, Sun H, Shi G. Association between KRAS codon 13 mutations and clinical response to anti-EGFR treatment in patients with metastatic colorectal cancer: results from a meta-analysis. Cancer Chemother Pharmacol. 2013;71:265-272. [PubMed] [DOI] |
| 3. | Alian OM, Azmi AS, Mohammad RM. Network insights on oxaliplatin anti-cancer mechanisms. Clin Transl Med. 2012;1:26. [PubMed] [DOI] |
| 4. | Chaney SG, Campbell SL, Bassett E, Wu Y. Recognition and processing of cisplatin- and oxaliplatin-DNA adducts. Crit Rev Oncol Hematol. 2005;53:3-11. [PubMed] [DOI] |
| 5. | Yu YJ, Li YM, Hou XD, Guo C, Cao N, Jiao ZY. Effect of tissue factor on invasion inhibition and apoptosis inducing effect of oxaliplatin in human gastric cancer cell. Asian Pac J Cancer Prev. 2012;13:1845-1849. [PubMed] [DOI] |
| 6. | Jani TS, DeVecchio J, Mazumdar T, Agyeman A, Houghton JA. Inhibition of NF-kappaB signaling by quinacrine is cytotoxic to human colon carcinoma cell lines and is synergistic in combination with tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) or oxaliplatin. J Biol Chem. 2010;285:19162-19172. [PubMed] [DOI] |
| 7. | Shiu TY, Huang SM, Shih YL, Chu HC, Chang WK, Hsieh TY. Hepatitis C virus core protein down-regulates p21(Waf1/Cip1) and inhibits curcumin-induced apoptosis through microRNA-345 targeting in human hepatoma cells. PLoS One. 2013;8:e61089. [PubMed] [DOI] |
| 8. | Subramaniam D, Ponnurangam S, Ramamoorthy P, Standing D, Battafarano RJ, Anant S, Sharma P. Curcumin induces cell death in esophageal cancer cells through modulating Notch signaling. PLoS One. 2012;7:e30590. [PubMed] [DOI] |
| 9. | Failli A, Legitimo A, Orsini G, Castagna M, Spisni R, Miccoli P, Consolini R. Antiproliferative effects of 5-fluorouracil and oxaliplatin in colon cancer cell lines: comparison of three different cytotoxicity assays. J Biol Regul Homeost Agents. 2013;27:275-284. [PubMed] |
| 10. | Gavin PG, Colangelo LH, Fumagalli D, Tanaka N, Remillard MY, Yothers G, Kim C, Taniyama Y, Kim SI, Choi HJ. Mutation profiling and microsatellite instability in stage II and III colon cancer: an assessment of their prognostic and oxaliplatin predictive value. Clin Cancer Res. 2012;18:6531-6541. [PubMed] [DOI] |
| 11. | 赵 东利, 谢 小卫, 李 明众, 王 书文. 姜黄素对S180小鼠体内抗肿瘤作用的实验研究. 西安交通大学学报(医学版). 2007;28:70-73, 82. |
| 12. | 李 刚, 王 子明, 种 铁. 姜黄素对人肾癌ACHN细胞放射的增敏作用及其机制. 西安交通大学学报(医学版). 2011;32:299-302. |
| 14. | Muñoz-Pinedo C. Signaling pathways that regulate life and cell death: evolution of apoptosis in the context of self-defense. Adv Exp Med Biol. 2012;738:124-143. [PubMed] [DOI] |
| 15. | Wen X, Lin ZQ, Liu B, Wei YQ. Caspase-mediated programmed cell death pathways as potential therapeutic targets in cancer. Cell Prolif. 2012;45:217-224. [PubMed] [DOI] |
| 16. | Andrabi SA, Dawson TM, Dawson VL. Mitochondrial and nuclear cross talk in cell death: parthanatos. Ann N Y Acad Sci. 2008;1147:233-241. [PubMed] [DOI] |