修回日期: 2013-07-07
接受日期: 2013-07-15
在线出版日期: 2013-08-18
目的: 探讨纤溶酶(原)级联蛋白在胰腺癌细胞解离和侵袭过程中的作用.
方法: 利用Western blot、免疫细胞化学、免疫组织化学和体外侵袭试验检测胰腺癌细胞系和组织中纤溶酶(原)、尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, uPA)和uPA受体(uPAR)的表达, 分析其与细胞解离和侵袭的相关性.
结果: 纤溶酶(原)、uPA和uPAR蛋白在解离型高转移株胰腺癌细胞PC-1.0的条件培养基中高表达, 而在非解离型低转移株胰腺癌细胞PC-1的条件培养基中低表达. 然而, 经uPA处理后的PC-1细胞的条件培养基中纤溶酶(原)和uPAR表达显著增加. 并且, 纤溶酶(原)和uPAR在胰腺癌组织的侵袭前端的表达强于其在组织中心处的表达. 此外, 纤溶酶处理可诱导基质金属蛋白酶(matrix metalloproteinase, MMP)-2、MMP-7和MMP-9在PC-1细胞中的表达. PC-1细胞通过纤溶酶或uPA处理后可显著增强细胞解离和体外侵袭能力.
结论: 在胰腺癌细胞侵袭过程中, 纤溶酶(原)级联反应与细胞早期解离密切相关. 纤溶酶(原)级联反应可作为抗胰腺癌侵袭转移分子靶向治疗的新靶点.
核心提示: 本研究通过检测纤溶酶(原)级联蛋白在胰腺癌细胞和组织中的表达情况, 明确其密切参与胰腺癌肿瘤侵袭早期阶段的细胞解离过程. 本实验为胰腺癌侵袭转移的研究提供了理论依据, 也为抗胰腺癌侵袭转移分子靶向治疗提供新的靶点.
引文著录: 王怀涛, 郭鸿飞, 谭晓冬, 张峻, 李捍司, 杨一帆, 王兆平, 孙杨, 张小薄. 纤溶酶(原)级联蛋白在胰腺癌细胞侵袭过程中的作用. 世界华人消化杂志 2013; 21(23): 2258-2266
Revised: July 7, 2013
Accepted: July 15, 2013
Published online: August 18, 2013
AIM: To discuss the potential role of plasminogen cascade proteins in the dissociation and subsequent invasion of pancreatic cancer cells.
METHODS: The expression of plasminogen, urokinase type plasminogen activator (uPA) and uPA receptor (uPAR) was detected by Western blot and immunocytochemistry in cell lines and by immunohistochemistry in tissue samples of pancreatic cancer. The correlation between expression of plasminogen cascade proteins and cell dissociation and invasion was analyzed.
RESULTS: Plasminogen, uPA and uPAR were strongly expressed in conditioned medium of dissociated pancreatic cancer cells (PC-1.0), but weakly expressed in conditioned medium of non-dissociated pancreatic cancer cells (PC-1). uPA treatment significantly induced the expression of plasminogen and uPAR in conditioned medium of non-dissociated pancreatic cancer cells (PC-1). Stronger expression of plasminogen and uPAR was observed at the invasive front end than at the center of human pancreatic cancer tissue. Plasmin treatment induced matrix metalloproteinase-2 (MMP-2), MMP-7 and MMP-9 expression in PC-1 cells. Treatment with plasmin or uPA obviously induced invasiveness and dissociation of cell colonies in PC-1 cells.
CONCLUSION: The plasminogen cascade is involved in cell dissociation in the early stage of invasion of pancreatic cancer cells. The plasminogen cascade may be a potential molecular target for anti-invasion and anti-metastasis therapy for pancreatic cancer.
- Citation: Wang HT, Guo HF, Tan XD, Zhang J, Li HS, Yang YF, Wang ZP, Sun Y, Zhang XB. Involvement of plasminogen cascade proteins in the invasion of pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2013; 21(23): 2258-2266
- URL: https://www.wjgnet.com/1009-3079/full/v21/i23/2258.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i23.2258
胰腺癌是人类恶性程度最高的肿瘤之一, 具有很强的侵袭和转移特性[1,2]. 肿瘤的侵袭转移是一个多步骤的复杂过程[3]. 然而, 迄今为止, 胰腺癌侵袭转移过程的细胞和分子机制尚未完全明确.
在早期研究中, 我们已确定两种具有不同侵袭转移潜能的仓鼠胰腺癌细胞系[解离型高转移株胰腺癌细胞系, PC-1.0和非解离型低转移株胰腺癌细胞系, 非解离型细胞(pancreatic cancer, PC-1)][4]. 在近期的研究中我们发现胰腺癌细胞中基质金属蛋白酶-7(matrix metalloproteinase, MMP-7)和表皮生长因子受体(epidermal growth factor receptor, EGFR)介导的促分裂素原活化蛋白激酶激酶(mitogen-activated protein kinase kinase, MEK)/细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)信号转导通路的活化与细胞解离和侵袭密切相关[5-7]. 另一方面, 分泌性蛋白酶的两个家族, 丝氨酸蛋白酶[本质上, 纤溶酶(原)]和MMP对细胞外基质(extracellular matrix, ECM)是非常重要的[8,9]. 纤溶酶的最重要的生理功能之一就是激活MMP-7[10]. 纤溶酶原激活物有两种类型, 分别为尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, uPA)和组织型纤溶酶原激活物(tissue-type plasminogen activator, tPA). 纤溶酶原活化形成纤溶酶是通过tPA或者uPA结合到其受体(uPAR)上引起细胞外基质成分和基膜的逐步降解, 也可能引起金属蛋白激酶、潜在的生长因子的活化以及膜糖蛋白的水解[11-13]. 所有的这些过程都可能导致肿瘤的侵袭转移. 然而关于胰腺癌早期侵袭转移过程(细胞解离)中纤溶酶(原)级联反应的作用的文章却很少. 并且纤溶酶(原)级联反应与MMP在胰腺癌侵袭转移的早期阶段的关系尚未明确.
本研究通过检测纤溶酶(原)级联蛋白和MMP在胰腺癌中的表达情况来分析纤溶酶(原)级联蛋白参与胰腺癌细胞解离和侵袭过程以及在此过程中和MMP的关系.
本实验采用仓鼠胰腺癌细胞系PC-1.0和PC-1. 其中非解离型低转移株细胞PC-1是通过BOP诱导的叙利亚仓鼠实验性胰腺癌模型建立. 解离型高转移株细胞PC-1.0是由同系仓鼠皮下接种PC-1细胞产生的肝转移瘤建立[4]. PC-1细胞呈岛样细胞克隆方式生长, 而PC-1.0细胞呈单个细胞方式生长. 上述细胞均以RPMI 1640(Gibco-BRL, Grand Island, NY)培养, 并加10%胎牛血清(Bioserum, Victoria, Australia)、100 U/mL青霉素G和100 μg/mL链霉素, 在含5%CO2的37 ℃孵箱内培养. 实验前上述细胞需无血清培养过夜. 所有的组织样本均取自中国医科大学附属盛京医院胰腺甲状腺外科2009-10/2012-07实行手术治疗的37位胰腺癌患者, 其中男14例, 女23例, 年龄35-78岁, 平均63.5岁. 这些样本在组织学上包括13例高分化, 20例中分化和4例低分化腺癌. 上述标本类型均经过组织学检查和病理诊断证实. 本研究采用鼠抗纤溶酶原/纤溶酶抗体(American Diagnostica, CT), 兔抗uPA抗体(Innovative Research, Southield, MI), 兔抗uPAR抗体(American Diagnostica)和山羊抗MMP-2、MMP-7和MMP-9抗体(Santa Cruz Biotechnology, Santa Cruz, CA). FITC标记的荧光抗体(Santa Cruz Biotechnology)作为二抗.
1.2.1 细胞裂解产物的制备和细胞培养液的缩合: 上述胰腺癌细胞在含10%胎牛血清的10 mL RPMI 1640培养液的90 mm 细胞培养皿中培养. 当细胞生长到亚融合状态时, 培养液用无血清培养液代替, 并孵育36 h. 实验组PC-1细胞用1 μg/mL uPA处理(Innovative Research). 然后收集培养液上清, 使用Vivaspin concentrator(Vivascience, Hannover, Germany)浓缩50倍. 同时, 细胞培养皿中加入1 mL RIPA蛋白裂解液(50 mmol/L Tris, 150 mmol/L NaCl, 1%NP-40, 0.5%脱氧胆酸钠, 0.1%SDS, pH 7.5. 使用前加入1 mmol/L苯甲磺酰氟, 1 g/L亮肽酶素, 1 g/L抑肽酶), 冰上反应15 min. 4 ℃ 5000 r/min离心5 min后将细胞裂解产物的上清液和浓缩的细胞培养液保存于-80 ℃中备用.
1.2.2 Western blot分析: 蛋白样本与4倍加样缓冲液混合, 95 ℃加热. 取等量的20 μg样本行7.5%聚丙烯酰胺平板凝胶电泳, 利用PVDF膜(Bio-Rad), 以含5%脱脂奶粉和0.1%Tween-20的PBS液在室温下封闭转膜2 h, 然后用0.1%PBS/Tween-20稀释的一抗在4 ℃下培养过夜. 漂洗后用0.1%PBS/Tween-20以1:5000稀释马源性过氧化物酶结合的二抗, 漂洗2次15 min. 以柯达科学成像胶片(Eastman Kodak Company, Rochester, NY)化学发光法检测信号强度. 人纤溶酶原, 纤溶酶(Innovative Research), uPA和uPAR阳性对照组(American Diagnostica)作为阳性对照.
1.2.3 免疫荧光染色和荧光强度(fluorescent intensity, FI)的分析: 上述各组细胞系种植于chamber slides中孵育. 实验组PC-1细胞用5 μg/mL纤溶酶处理36 h. 培养后, 将细胞室温下以0.5%多聚甲醛固定10 min. 为了明确纤溶酶(原)在细胞膜上的表达情况, 细胞处理液中不含Triton X-100. 用10%正常山羊血清阻滞30 min防止非特异性染色. 之后加多克隆抗体(1:200, 以含1%小牛白蛋白的PBS液稀释), 在4 ℃下培养过夜. 在室温下加若丹明标记的二抗培养2 h. 上述各步骤间均以PBS液冲洗3次, 封片后上述细胞于共聚焦激光显微镜(FV500-IX, Olympus, Japan)下观察并摄取图像. 对照组标本制备如下: (1)切片不用一抗处理; (2)正常山羊或鼠血清和非特异山羊或鼠IgG代替一抗. 最后, 利用Fluoview 500(version 4.3, Olympus, Japan)软件随机选取6处不同图像中纤溶酶(原)、MMP-2、MMP-7和MMP-9的表达在细胞总体、细胞核、细胞质及细胞膜的平均FI值, 并将6个FI值的均值作为最终FI分析值.
1.2.4 体外侵袭实验: 体外侵袭实验采用Invasion Chamsters(Bectn Dickinson Labware, Bedford, MA)检测细胞的体外侵袭能力. Transwell培养板上室加入500 μL细胞悬液(1×105/mL)和相同体积的无血清培养液. 将含1 mL含10%FBS的RPMI 1640培养基和等体积的Balb/3T3细胞的无血清培养基作为趋化因子的加入培养板下室中. PC-1.0细胞和PC-1细胞在37 ℃下培养12 h, 实验组PC-1细胞用5 μg/mL纤溶酶或1 μg/mL uPA处理. 取出小室, 用湿棉签轻轻擦去凝胶和聚碳酯膜上表面的细胞, 留下侵袭至Transwell底部膜的癌细胞, 以固定后行Diff-Quik染色. 在显微镜下(100倍视野)计数, 以任意5个视野的细胞数的平均数作为侵袭至膜上的细胞, 计算侵袭率, 侵袭率 = 侵袭至膜上的细胞/种植的细胞数.
1.2.5 免疫组织化学分析: 免疫组织化学染色应用亲和素-生物素-过氧化物酶复合物技术(Vectastain Elite ABC Kit; Vector Laboratories, Burlingame, CA). 外科切除组织样本应尽快用40g/L甲醛固定. 然后用石蜡包埋并切成5 μm的连续切片. 脱蜡复水后, 用1.5%H2O2(甲醇)浸泡30 min以消除内源性过氧化物酶活性, 并用蒸馏水洗3次. 用正常山羊血清做非特异性封闭. 加入一抗(含1%小牛血清PBS 1:200稀释, pH 7.4)室温2 h孵育. PBS洗涤3遍, 生物素化二抗室温50 min孵育, 洗涤3次, 加卵白素过氧化物酶结合物孵育1 h, 洗涤. 最后, DAB-H2O2(Vector Laboratories)室温显色. 洗涤后, 苏木精复染3 s, 脱水, 封片. 对照组标本制作如下: (1)切片不用一抗处理; (2)正常鼠或兔血清和非特异鼠或兔IgG代替一抗.
统计学处理 采用Stat View计算机软件(SAS Institute Inc., Cary, NC)利用非配对Student's t检验分析不同实验组总细胞内、细胞核、细胞质及细胞膜的纤溶酶(原), MMP-2、MMP-7和MMP-9表达的平均FI值以及体外侵袭试验中胰腺癌细胞的数目. P<0.05认为差异具有统计学意义.
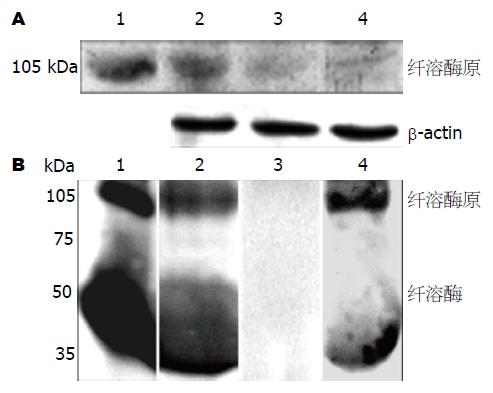
2.1.1 PC-1.0和PC-1细胞中纤溶酶(原)的表达: Western blot分析结果表明纤溶酶(原)在PC-1.0细胞中表达强于其在PC-1细胞中的表达. 经uPA处理后的PC-1细胞中纤溶酶(原)的诱导表达没有明显变化(图1A). 相对于其在细胞中的表达, 应用Western blot检测纤溶酶原和纤溶酶在PC-1.0和PC-1细胞的培养液中的表达明显不同(图1B). 在PC-1.0细胞的培养液中检测出大量的纤溶酶原和纤溶酶蛋白, 而在PC-1细胞的培养液中未检测出. 然而经uPA处理后的PC-1细胞的条件培养基中检测出纤溶酶原和纤溶酶蛋白的表达.
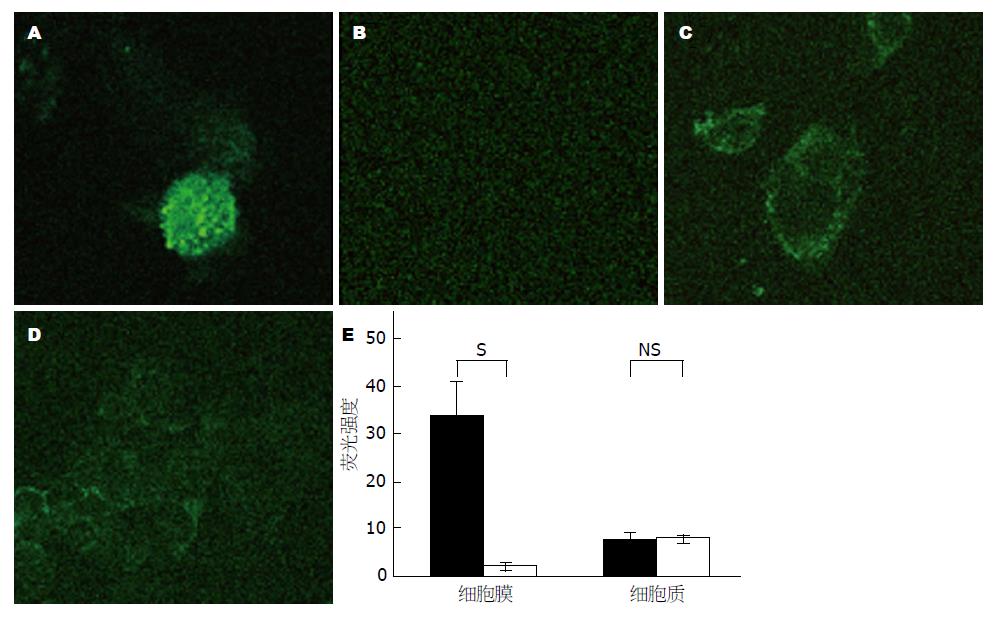
另外, 荧光染色图像进一步表明细胞膜上的纤溶酶(原)在PC-1.0细胞(FI: 33.6±7.1, 图2A)中的表达显著强于其在PC-1细胞(FI: 2.2±0.8, P<0.05, 图2B)中的表达. 然而胞浆中的纤溶酶原在PC-1.0细胞(FI: 7.5±1.8, 图2C)和PC-1细胞(FI: 8.0±1.1, P>0.05, 图2D)中表达均较弱. 荧光强度(FI)值列于图2E.
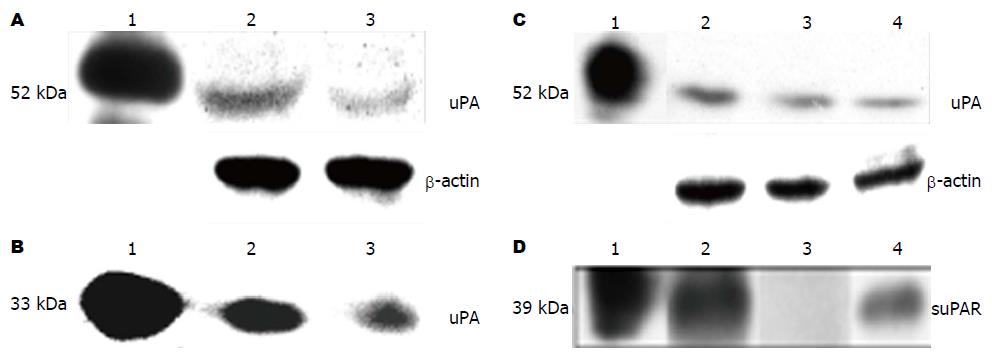
2.1.2 PC-1.0和PC-1细胞中uPA的表达: Western blot分析表明pro-uPA蛋白在PC-1.0和PC-1细胞内表达均很弱, 并无明显差异(图3A). 与此相反, 在PC-1.0细胞的条件培养基中发现了更多的uPA蛋白(图3B).
2.1.3 PC-1.0和PC-1细胞中uPAR的表达: Western blot结果表明uPAR蛋白在PC-1.0和PC-1细胞内的表达无明显差异. 并且, PC-1细胞经uPA处理后细胞内uPAR的表达无明显的改变(图3C).
然而, 在PC-1.0细胞的条件培养基中检测出可溶性uPAR(suPAR)蛋白, 而在PC-1细胞的条件培养基中几乎未检测出suPAR. uPA处理后的PC-1细胞的条件培养基中suPAR蛋白的表达显著增加(图3D).
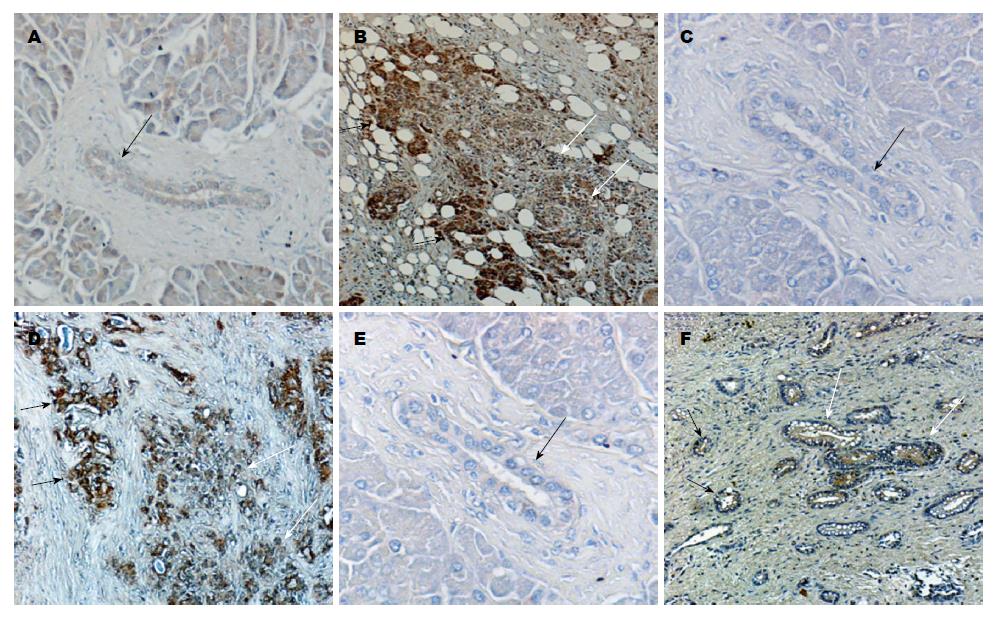
在胰腺非恶性肿瘤组织中, 纤溶酶(原)蛋白呈现微弱的免疫染色(图4A), 而uPAR(图4C)和uPA (图4E)蛋白无免疫染色. 在胰腺癌组织中心(白色箭头)和侵袭前端(黑色箭头), 纤溶酶(原)(图4B)、uPAR(图4D)和uPA(图4F)蛋白的表达显著增加.并且在同一胰腺癌组织中, 侵袭前端处的纤溶酶(原)和uPAR蛋白的表达明显强于组织中间处的表达(图4B, D).
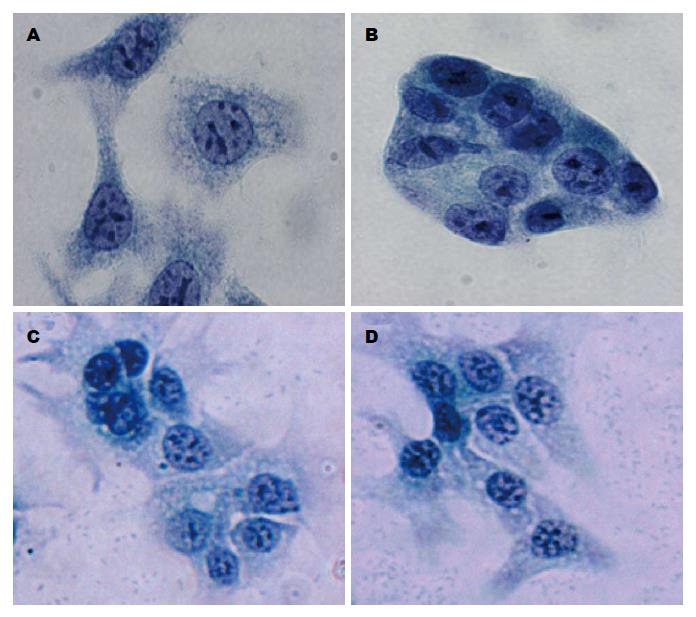
2.3.1 PC-1细胞经纤溶酶或uPA处理后细胞解离的变化: 解离型胰腺癌细胞(PC-1.0)呈单个细胞方式生长(图5A), 而非解离型胰腺癌细胞(pancreatic cancer, PC-1)呈岛样细胞克隆方式生长(图5B). 然而, PC-1细胞经5 μg/mL纤溶酶或1 μg/mL uPA处理36 h后出现明显的细胞克隆团解离(图5C, D).
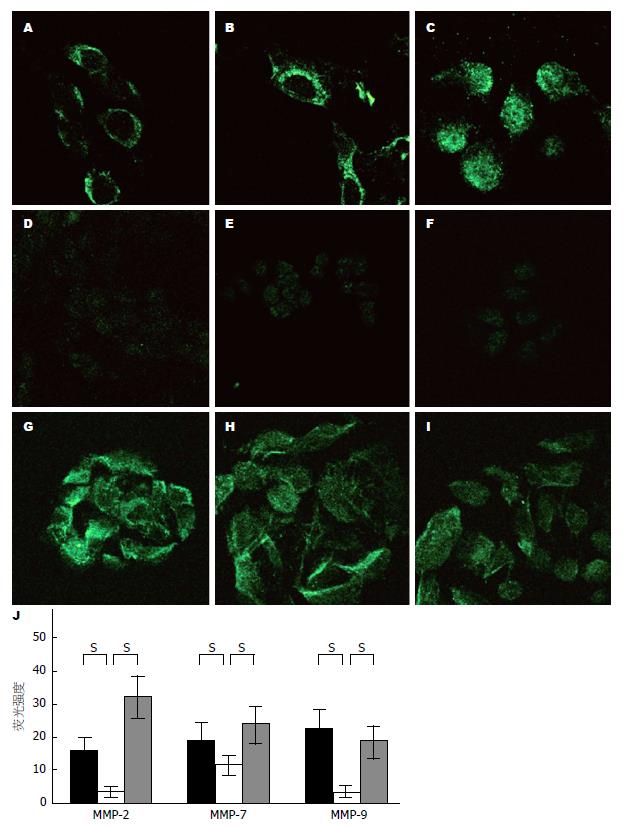
2.3.2 PC-1细胞经纤溶酶处理后MMP-2、MMP-7和MMP-9表达的变化: 在解离型胰腺癌细胞(PC-1.0)中, 可观察到细胞内MMP-2[荧光强度(FI): 15.6±4.3, 图6A], MMP-7(FI: 19.2±5.2, 图6B), 和MMP-9(FI: 22.6±5.6, 图6C)蛋白的强表达. 然而, PC-1细胞内MMP-2(FI: 3.5±1.7, P<0.05, 图6D), MMP-7(FI: 11.5±2.9, P<0.05, 图6E)和MMP-9(FI: 3.4±1.9, P<0.05, 图6F)蛋白的表达却很微弱. 相比之下, 经纤溶酶处理后的PC-1细胞内MMP-2(FI: 32.0±6.7, P<0.05, 图6G), MMP-7(FI: 23.7±5.4, P<0.05, 图6H), MMP-9(FI: 18.6±4.9, P<0.05, 图6I)蛋白的表达发生了明显的改变. MMP-2, MMP-7和MMP-9蛋白表达的FI值列于图6J.
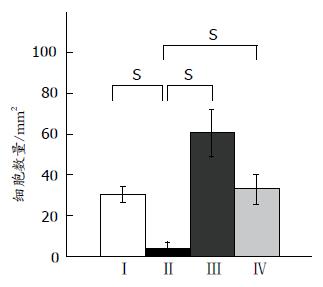
2.3.3 PC-1细胞经纤溶酶或uPA处理后体外侵袭能力的变化: 如图7表示, 解离型细胞(PC-1.0)呈现出一种强侵袭力(侵袭细胞数量 = 31.3±4.2). PC-1却呈现出一种弱侵袭力(侵袭细胞数量 = 10.7±3.1, P<0.01), 然而PC-1细胞经过纤溶酶或uPA处理12 h后侵袭力显著增强, 侵袭细胞数量分别为60.3±11.5, P<0.01和32.7±7.4, P<0.01.
细胞周围蛋白水解在肿瘤细胞侵袭过程中起到关键作用[14-16]. 纤溶酶可直接和间接(通过激活某些MMP)降解细胞外基质和基底膜的蛋白质, 从而促进细胞外基质降解、肿瘤细胞增殖、侵袭和转移[17]. 本研究表明, 纤溶酶(原)蛋白在不同解离状态和侵袭力的胰腺癌细胞中均强表达. 解离型胰腺癌细胞呈单个细胞生长方式, 具有高侵袭能力, 纤溶酶(原)蛋白在此类细胞胞膜和培养液中呈现强表达状态. 相比之下, PC-1呈岛样细胞克隆方式生长, 具有较弱的侵袭力, 纤溶酶(原)蛋白在此类细胞胞膜和培养液中不表达. 此外, PC-1经纤溶酶处理后细胞解离和体外侵袭能力明显地增加. 纤溶酶(原)蛋白在人类胰腺癌组织中呈现强表达, 并且纤溶酶在肿瘤组织侵袭前端处的表达强于其在肿瘤中心处的表达. 总的来说, 目前的结果表明, 纤溶酶(原)密切参与胰腺癌细胞的侵袭转移过程, 尤其是细胞解离过程, 这是其第一个重要步骤[18,19]. 纤溶酶(原)在胰腺癌细胞膜和培养液中存在差异表达, 而不是在胞质中, 这可能意味着纤溶酶(原)和其他分子的相互作用对于纤溶酶(原)功能的激活是必需的.
另一方面, 基底膜的主要成分是Ⅳ型胶原、层粘连蛋白、硫酸乙酰肝素蛋白多糖和巢蛋白[20]. 明胶酶A(MMP-2)和明胶酶B(MMP-9)在肿瘤细胞中的平衡被认为是和细胞的侵袭性有关[21,22]. 此外, 有报道称MMP-7阳性和胰腺癌肿瘤侵袭、淋巴结及远端转移程度密切相关[23-25]. 在本研究中, PC-1经纤溶酶处理后细胞解离和MMP-2, MMP-7和MMP-9蛋白的表达明显改变. 这些结果表明, 纤溶酶(原)级联蛋白和MMPs的相互作用降解细胞外基质. 此外, 几种激活的MMP可以激活其他的MMP, 从而形成一个正反馈机制[26,27], 从而胰腺癌细胞的解离和侵袭力被诱导增强了.
uPA, 纤溶酶(原)级联反应中另一个重要的分子, 在解离型和PC-1的培养液中存在差异表达. uPA处理非解离型细胞可诱导纤溶酶(原)的表达, 细胞解离以及细胞侵袭力. 然而, tPA是另一种纤溶酶原的激活物, 在初步实验(数据未示出)中证实其在解离型和非解离型细胞的胞质或培养液中的表达没有差异. 虽然tPA也可将纤溶酶原转换成纤溶酶, 但他主要参与纤维蛋白溶解[28,29]. 这些结果表明, uPA可能是胰腺癌细胞解离中纤溶酶原的激活剂, 并参与随后的侵袭转移过程.
与细胞内的uPAR相比, 存在于体液中的uPAR(可溶性的uPAR, suPAR)被认为是一个更重要的预后指标[30,31]. 虽然uPAR蛋白在解离型和非解离型细胞内的表达无明显差异, 但是解离型细胞的培养液中suPAR蛋白多于非解离型细胞的条件培养基中的suPAR蛋白. 另外, 在uPA处理后的非解离型细胞的条件培养基中suPAR蛋白的表达显著增加. uPAR蛋白在人类胰腺癌组织中也呈现强表达, 并且uPAR在肿瘤组织侵袭前端处的表达强于其在肿瘤中心处的表达. 因此, 所有这些数据表明, uPAR也是参与胰腺癌的侵袭转移过程的重要分子之一. 然而, uPA在胰腺癌组织侵袭前端和中心处表达无差异, 而uPAR和uPA在这两处的表达却存在差异, 这可能意味着, 在胰腺癌侵袭转移过程中除了和uPA结合外, uPAR可能独立发挥作用.
总之, 纤溶酶(原)级联反应密切参与胰腺癌细胞的细胞解离和侵袭过程. 纤溶酶原的产生、分泌和激活, 可能是胰腺癌细胞解离和侵袭过程的限速步骤. 通过研究胰腺癌的侵袭特性, 如纤溶酶(原)级联反应, 可能为胰腺癌的抗肿瘤治疗提供一个具有重要参考价值的新靶标.
胰腺癌恶性程度高, 发病率呈逐年上升趋势, 诊断困难, 手术创伤大, 预后差, 加强其侵袭转移机制研究有助于治疗. 纤溶酶(原)参与多种肿瘤早期细胞解离过程, 在肿瘤发生发展中起到重要的作用.
陈洪, 副教授, 主任医师, 东南大学附属中大医院消化科; 夏时海, 副教授, 副主任医师, 行政主任, 武警后勤学院附属医院肝胆胰脾科(中心)
纤溶酶(原)级联蛋白参与肿瘤侵袭的机制不清楚, 有少量相关研究报道其在胃癌、膀胱移行细胞癌、肾母细胞瘤、肝癌等恶性肿瘤中的作用, 目前关于其在胰腺癌中的作用机制不明确.
目前, 已有研究发现纤溶酶(原)级联蛋白在多种肿瘤细胞中表达增强, 介导基底膜的破坏和和细胞外基质的降解, 从而参与肿瘤的侵袭转移. 但其具体作用机制有待进一步探索.
本研究利用多方法, 多角度检测尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator)及其受体, 纤溶酶(原)在不同侵袭潜能的胰腺癌细胞系中的表达情况, 通过增加不同的处理因素来观察表达的变化情况来探讨其对胰腺癌细胞解离过程中的作用机制.
本实验明确了纤溶酶(原)在胰腺癌侵袭过程早期的细胞解离阶段的具体机制. 为胰腺癌分子靶向治疗提供了新靶点.
本文设计合理, 角度全面, 结果客观, 具有一定的科学意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Jaffee EM, Hruban RH, Canto M, Kern SE. Focus on pancreas cancer. Cancer Cell. 2002;2:25-28. [PubMed] [DOI] |
| 2. | Real FX. A "catastrophic hypothesis" for pancreas cancer progression. Gastroenterology. 2003;124:1958-1964. [DOI] |
| 3. | Torimura T, Ueno T, Kin M, Harada R, Nakamura T, Kawaguchi T, Harada M, Kumashiro R, Watanabe H, Avraham R. Autocrine motility factor enhances hepatoma cell invasion across the basement membrane through activation of beta1 integrins. Hepatology. 2001;34:62-71. [PubMed] [DOI] |
| 4. | Egami H, Tomioka T, Tempero M, Kay D, Pour PM. Development of intrapancreatic transplantable model of pancreatic duct adenocarcinoma in Syrian golden hamsters. Am J Pathol. 1991;138:557-561. [PubMed] |
| 5. | Hofmann I, Weiss A, Elain G, Schwaederle M, Sterker D, Romanet V, Schmelzle T, Lai A, Brachmann SM, Bentires-Alj M. K-RAS mutant pancreatic tumors show higher sensitivity to MEK than to PI3K inhibition in vivo. PLoS One. 2012;7:e44146. [PubMed] [DOI] |
| 6. | Tan X, Egami H, Kamohara H, Ishikawa S, Kurizaki T, Yoshida N, Tamori Y, Takai E, Hirota M, Ogawa M. Involvement of the mitogen-activated protein kinase kinase 2 in the induction of cell dissociation in pancreatic cancer. Int J Oncol. 2004;24:65-73. [PubMed] |
| 7. | Tan X, Egami H, Ishikawa S, Sugita H, Kamohara H, Nakagawa M, Nozawa F, Abe M, Ogawa M. Involvement of matrix metalloproteinase-7 in invasion-metastasis through induction of cell dissociation in pancreatic cancer. Int J Oncol. 2005;26:1283-1289. [PubMed] [DOI] |
| 8. | Keely PJ. Proteolytic remodeling of the ECM and the geometric control of stem cell fate. Dev Cell. 2013;25:325-326. [PubMed] [DOI] |
| 10. | Farina AR, Cappabianca L, Di Ianni N, Ruggeri P, Ragone M, Merolle S, Gulino A, Mackay AR. Alendronate promotes plasmin-mediated MMP-9 inactivation by exposing cryptic plasmin degradation sites within the MMP-9 catalytic domain. FEBS Lett. 2012;586:2366-2374. [PubMed] [DOI] |
| 11. | Zhou DH, Yang LN, Roder C, Kalthoff H, Trauzold A. TRAIL-induced expression of uPA and IL-8 strongly enhanced by overexpression of TRAF2 and Bcl-xL in pancreatic ductal adenocarcinoma cells. Hepatobiliary Pancreat Dis Int. 2013;12:94-98. [PubMed] [DOI] |
| 12. | Taubert H, Magdolen V, Kotzsch M. Impact of expression of the uPA system in sarcomas. Biomark Med. 2013;7:473-480. [PubMed] [DOI] |
| 13. | Mani T, Wang F, Knabe WE, Sinn AL, Khanna M, Jo I, Sandusky GE, Sledge GW, Jones DR, Khanna R. Small-molecule inhibition of the uPAR·uPA interaction: synthesis, biochemical, cellular, in vivo pharmacokinetics and efficacy studies in breast cancer metastasis. Bioorg Med Chem. 2013;21:2145-2155. [PubMed] [DOI] |
| 14. | Martin KH, Hayes KE, Walk EL, Ammer AG, Markwell SM, Weed SA. Quantitative measurement of invadopodia-mediated extracellular matrix proteolysis in single and multicellular contexts. J Vis Exp. 2012;e4119. [PubMed] [DOI] |
| 15. | Bourboulia D, Stetler-Stevenson WG. Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs): Positive and negative regulators in tumor cell adhesion. Semin Cancer Biol. 2010;20:161-168. [PubMed] [DOI] |
| 16. | Sugiyama N, Gucciardo E, Tatti O, Varjosalo M, Hyytiäinen M, Gstaiger M, Lehti K. EphA2 cleavage by MT1-MMP triggers single cancer cell invasion via homotypic cell repulsion. J Cell Biol. 2013;201:467-484. [PubMed] [DOI] |
| 17. | He XJ, Jiang XT, Ma YY, Xia YJ, Wang HJ, Guan TP, Shao QS, Tao HQ. REG4 contributes to the invasiveness of pancreatic cancer by upregulating MMP-7 and MMP-9. Cancer Sci. 2012;103:2082-2091. [PubMed] [DOI] |
| 18. | Wang W, Tan X, Zhou L, Gao F, Dai X. Involvement of the expression and redistribution of claudin-23 in pancreatic cancer cell dissociation. Mol Med Rep. 2010;3:845-850. [PubMed] [DOI] |
| 19. | Tang Z, Geng G, Huang Q, Xu G, Hu H, Chen J, Li J. Expression of tissue factor pathway inhibitor 2 in human pancreatic carcinoma and its effect on tumor growth, invasion, and migration in vitro and in vivo. J Surg Res. 2011;167:62-69. [PubMed] [DOI] |
| 20. | Kawada M, Umezawa K. Suppression of in vitro invasion of human fibrosarcoma cells by a leupeptin analogue inhibiting the urokinase-plasmin system. Biochem Biophys Res Commun. 1995;209:25-30. [PubMed] [DOI] |
| 21. | Van Tubergen EA, Banerjee R, Liu M, Vander Broek R, Light E, Kuo S, Feinberg SE, Willis AL, Wolf G, Carey T. Inactivation or loss of TTP promotes invasion in head and neck cancer via transcript stabilization and secretion of MMP9, MMP2, and IL-6. Clin Cancer Res. 2013;19:1169-1179. [PubMed] [DOI] |
| 22. | Gao J, Ding F, Liu Q, Yao Y. Knockdown of MACC1 expression suppressed hepatocellular carcinoma cell migration and invasion and inhibited expression of MMP2 and MMP9. Mol Cell Biochem. 2013;376:21-32. [PubMed] [DOI] |
| 23. | Ito TK, Ishii G, Saito S, Yano K, Hoshino A, Suzuki T, Ochiai A. Degradation of soluble VEGF receptor-1 by MMP-7 allows VEGF access to endothelial cells. Blood. 2009;113:2363-2369. [PubMed] [DOI] |
| 24. | Park JK, Kim MA, Ryu JK, Yoon YB, Kim SW, Han HS, Kang GH, Kim H, Hwang JH, Kim YT. Postoperative prognostic predictors of pancreatic ductal adenocarcinoma: clinical analysis and immunoprofile on tissue microarrays. Ann Surg Oncol. 2012;19:2664-2672. [PubMed] [DOI] |
| 25. | Shi WD, Meng ZQ, Chen Z, Lin JH, Zhou ZH, Liu LM. Identification of liver metastasis-related genes in a novel human pancreatic carcinoma cell model by microarray analysis. Cancer Lett. 2009;283:84-91. [PubMed] [DOI] |
| 26. | Ashina M, Tvedskov JF, Lipka K, Bilello J, Penkowa M, Olesen J. Matrix metalloproteinases during and outside of migraine attacks without aura. Cephalalgia. 2010;30:303-310. [PubMed] [DOI] |
| 27. | Lin L, Bankaitis E, Heimbach L, Li N, Abrink M, Pejler G, An L, Diaz LA, Werb Z, Liu Z. Dual targets for mouse mast cell protease-4 in mediating tissue damage in experimental bullous pemphigoid. J Biol Chem. 2011;286:37358-37367. [PubMed] [DOI] |
| 28. | Baron A, Hommet Y, Cassé F, Vivien D. Tissue-type plasminogen activator induces plasmin-dependent proteolysis of intracellular neuronal nitric oxide synthase. Biol Cell. 2010;102:539-547. [PubMed] [DOI] |
| 29. | Dejouvencel T, Doeuvre L, Lacroix R, Plawinski L, Dignat-George F, Lijnen HR, Anglés-Cano E. Fibrinolytic cross-talk: a new mechanism for plasmin formation. Blood. 2010;115:2048-2056. [PubMed] |
| 30. | Jacobsen B, Muley T, Meister M, Dienemann H, Christensen IJ, Santoni-Rugiu E, Lærum OD, Ploug M. Ly6/uPAR-related protein C4.4A as a marker of solid growth pattern and poor prognosis in lung adenocarcinoma. J Thorac Oncol. 2013;8:152-160. [PubMed] [DOI] |