修回日期: 2013-07-08
接受日期: 2013-07-18
在线出版日期: 2013-08-18
目的: 研究磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B, PI3K/Akt)信号通路抑制剂渥曼青霉素对人肝癌HepG2细胞增殖、细胞周期与凋亡的影响以及相关基因pAkt、Skp2及P27kip1表达的变化.
方法: 将不同浓度的渥曼青霉素(0、10、50、100、200 nmol/L)分别作用于对数生长期的人肝癌HepG2细胞3、10、24 h, MTT法测定细胞增殖抑制率, 流式细胞术检测细胞凋亡率及细胞周期的变化, Western blot检测pAkt、Skp2及P27kip1蛋白表达变化, RT-PCR检测Skp2及P27kip1 mRNA表达变化.
结果: 渥曼青霉素可明显抑制HepG2细胞的增殖, 在一定范围内具有时间和浓度依赖性. 渥曼青霉素可导致G0/G1期HepG2细胞比例明显升高, S期细胞比例明显降低(P<0.05). 随着渥曼青霉素浓度的增加及作用时间的延长, HepG2细胞凋亡率逐渐升高(8.46%±1.17%至28.03%±2.67%)(P<0.05). Western blot结果显示渥曼青霉素可下调pAkt和Skp2蛋白的表达, 上调P27kip1蛋白表达(P<0.05). RT-PCR结果显示渥曼青霉素可明显下调Skp2 mRNA的表达, 而P27kip1 mRNA表达无明显变化.
结论: PI3K/Akt信号通路抑制剂渥曼青霉素可抑制人肝癌HepG2细胞的增殖, 引发G0/G1期阻滞并诱导其凋亡, 其机制可能与PI3K/Akt信号通路参与Skp2及P27kip1调控有关.
核心提示: 阻断磷脂酰肌醇-3-激酶/蛋白激B(phosphatidylinositol-3-kinase/protein kinase B, PI3K/Akt)信号通路可抑制人肝癌HepG2细胞的增殖, 引发细胞周期阻滞并诱导凋亡, 其机制可能与PI3K/Akt信号通路参与Skp2及P27kip1的调控有关. 这一研究结果为以PI3K/Akt信号通路为靶点的肝细胞癌临床辅助治疗提供了一定的实验基础及理论依据.
引文著录: 张萌, 彭利, 乔治斌, 何宏涛, 周烨, 徐卓. PI3K/Akt信号通路抑制剂对人肝癌HepG2细胞的体外抑制作用及其机制. 世界华人消化杂志 2013; 21(23): 2250-2257
Revised: July 8, 2013
Accepted: July 18, 2013
Published online: August 18, 2013
AIM: To investigate the effect of the PI3K/Akt signaling pathway inhibitor wortmannin on cell proliferation, apoptosis and expression of pAkt, Skp2 and P27kip1 in human hepatocellular carcinoma cell line HepG2.
METHODS: After treatment with different concentrations of wortmannin (0, 10, 50, 100, 200 nmol/L) for different durations (3, 10, 24 h), proliferation of HepG2 cells was analyzed by MTT assay, cell cycle and apoptosis were detected by flow cytometry, expression of pAkt, Skp2 and P27kip1 proteins was detected by Western blot, and the mRNA expression of Skp2 and P27kip1 was detected by reverse transcription-polymerase chain reaction.
RESULTS: Wortmannin inhibited the proliferation of HepG2 cells in a dose- and time-dependent manner. The apoptosis rates of HepG2 cells significantly increased from 8.46% ± 1.17% to 28.03% ± 2.67% after treatment with wortmannin (P < 0.05). Wortmannin induced an increase in the percentage of cells in G0/G1 phase and a decrease in the percentage of cells in S phase cells (both P < 0.05). After treatment with wortmannin, the expression of pAkt and Skp2 proteins was down-regulated, while that of P27kip1 protein was up-regulated (all P < 0.05). In addition, Skp2 mRNA expression in HepG2 cells was significantly down-regulated (P < 0.05), although the expression of P27kip1 mRNA was not changed.
CONCLUSION: Wortmannin inhibits cell proliferation and induces apoptosis in human hepatocellular carcinoma cell line HepG2 possibly by regulating the expression of Skp2 and P27kip1.
- Citation: Zhang M, Peng L, Qiao ZB, He HT, Zhou Y, Xu Z. Inhibition of the PI3K/Akt signaling pathway inhibits cell proliferation and induces apoptosis in hepatocellular carcinoma cell line HepG2. Shijie Huaren Xiaohua Zazhi 2013; 21(23): 2250-2257
- URL: https://www.wjgnet.com/1009-3079/full/v21/i23/2250.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i23.2250
原发性肝癌是临床上最常见的恶性肿瘤之一, 其中90%为肝细胞癌, 发病率居全世界恶性肿瘤的第5位, 每年死亡病例约69.6万, 居肿瘤相关死因的第3位[1]. 我国是肝癌发病率最高的国家, 每年新发病例数占全球总数的55%, 在我国肿瘤相关死因中仅次于肺癌, 位居第2位[2]. 肝细胞癌侵袭性强、易复发、预后差, 是我国恶性肿瘤防治研究的重点. 目前研究发现, 多条信号通路参与肿瘤的恶性生物学行为[3], 其中磷脂酰肌醇-3-激酶/蛋白激B(phosphatidylinositol-3-kinase/protein kinase B, PI3K/Akt)通路在调控肿瘤细胞的增殖、分化、存活和迁移等方面发挥功能, 是十分重要的凋亡抑制通路, 以这条通路为靶点的肿瘤治疗策略正在广泛研究中[4,5]. P27kip1蛋白为细胞周期依赖性蛋白激酶抑制剂Cip/Kip蛋白家族的重要成员, 研究发现几乎所有人类恶性肿瘤中均存在P27kip1蛋白的表达下调或缺失, 是公认的抑癌蛋白[6]. 而S期激酶相关蛋白2(S-phase kinase associated protein 2, Skp2)参与P27kip1的降解, 使细胞周期调节失控, 最终导致癌变的发生[7]. 我们的前期研究发现, 在肝细胞癌组织中也存在PI3K/Akt通路的异常激活, 同时伴有Skp2及P27kip1蛋白的表达失调, 并且与患者的预后有密切相关[8]. 目前有关肝细胞癌中PI3K/Akt通路与Skp2及P27kip1关系的报道较少. 本实验选取体外培养的人肝癌HepG2细胞为研究对象, 加入PI3K/Akt信号通路抑制剂渥曼青霉素, 观察HepG2增殖、细胞周期与凋亡的变化, 检测pAkt、Skp2和P27kip1蛋白及mRNA的表达, 进一步研究PI3K/Akt信号通路的作用机制, 为临床治疗肝细胞癌提供新的实验依据.
人肝癌细胞系HepG2由河北医科大学第四医院科研中心提供. 渥曼青霉素购自美国Sigma公司, 分子量428.43, 纯度>99%, 用二甲基亚砜(DMSO)配置成储存液, 过滤除菌后分装, 置-20 ℃冰箱保存、备用. RT-PCR试剂盒购自北京华美公司, GAPDH、Skp2和P27kip1基因引物由上海生工生物工程公司合成. 鼠抗人β-actin和P27kip1单克隆抗体及兔抗人Skp2多克隆抗体均购自美国Santa Cruz公司, 兔抗人pAkt单克隆抗体购自美国Epitomics公司. 四甲基偶氮唑蓝[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT]及PI染液购自美国Sigma公司. 细胞蛋白提取试剂盒、Bradford法蛋白定量试剂盒购自北京索莱宝有限公司. DAB试剂盒购自北京中杉金桥生物技术有限公司. RPMI 1640培养基和TRIzol总RNA提取试剂购自美国Gibco公司.
1.2.1 细胞培养: 用含有100 U/mL青霉素、100 μg/mL链霉素, 不含胎牛血清的RPMI 1640培养基在5%CO2、37 ℃恒温培养箱中培养人肝癌细胞系HepG2. 每2-3 d传代1次, 取对数生长期的细胞进行实验.
1.2.2 MTT法检测细胞增殖: 将对数生长期的HepG2细胞按1×104个/孔接种于96孔培养板, 孵育24 h待细胞贴壁后加入以DMSO溶解的渥曼青霉素(终浓度分别为0、10、50、100、200 nmol/L), 每组设6个复孔, 设阴性对照(只加等量DMSO)及空白对照(只加培养液). 分别培养3、10、24 h后, 每孔加入MTT 20 μL(5 mg/mL), 继续孵育4 h, 弃上清液, 每孔加入100 μL DMSO, 振荡10 min待结晶充分溶解后在酶标仪490 nm波长处测定每孔吸光度(A)值. 计算细胞增殖抑制率, 抑制率 = (对照组A值-试验组A值)/(对照组A值-空白组A值)×100%. 实验重复3次.
1.2.3 流式细胞仪检测细胞凋亡及细胞周期的变化: 取对数生长期的HepG2细胞(5×105个/培养瓶), 经渥曼青霉素(终浓度分别为0、50、100、200 nmol/L)作用10 h后收获细胞. 另取细胞经终浓度为100 nmol/L的渥曼青霉素分别作用3、10、24 h后收获细胞. 用预冷700 mL/L乙醇固定12 h. 离心弃固定液, PBS重悬5 min后300目筛网过滤, 加入PI染液, 4 ℃避光染色30 min, 采用美国Beckman公司的Epics-XLⅡ型流式细胞仪, 分析细胞周期和细胞凋亡的变化. 实验重复3次.
1.2.4 Western blot检测蛋白表达变化: 按照方法1.2.3进行细胞培养和分组, 收集细胞, 按照细胞蛋白质提取试剂盒的步骤提取细胞总蛋白. Bradford比色法检测蛋白浓度. 取50 μg样品进行聚丙烯酰胺凝胶电泳, 将凝胶中分离的蛋白转印PVDF膜. 5%脱脂牛奶封闭2 h后, 分别加入1:200稀释的鼠抗人β-actin单克隆抗体、兔抗人Skp2多克隆抗体、鼠抗人P27kip1单克隆抗体及1:150稀释的兔抗人pAkt单克隆抗体, 4 ℃孵育过夜, 加入辣根过氧化物酶标记的相应二抗溶液, 37 ℃孵育2 h, 洗膜后DAB显色, β-actin为内参照. 条带进行光密度值分析, 将目标条带与β-actin条带的灰度值之比作为其蛋白表达水平的参数. 实验重复3次.
1.2.5 RT-PCR检测mRNA表达变化: 按照方法1.2.3进行细胞培养和分组, 收集细胞, 提取各组细胞的总RNA, 进行RNA完整性及纯度的鉴定. 使用一步法反转录试剂盒, 合成cDNA. 以GAPDH为内参照, GAPDH上游引物序列: 5'-GGAAGGTGAAGGTCGGAGT-3', 下游引物序列: 5'-CCTGGAAGATGGTGATGGG-3', 扩增产物大小为250 bp. Skp2上游引物序列: 5'-GACAGTGAGAACATCCCCC-3', 下游引物序列: 5'-GAGAGACAGTATGCCGTGGA-3', 扩增产物大小为476 bp. P27kip1上游引物序列: 5'-CCGACGATTCTTCTACTC-3', 下游引物序列: 5'-CTGATAAACAAGGAAACATA-3', 扩增产物大小为165 bp. 扩增条件: 95 ℃预变性5 min, 94 ℃变性30 s, 相应退火温度(55 ℃-62 ℃)30 s, 72 ℃延伸30 s, 30个循环; 72 ℃延伸7 min. 产物在1.5%琼脂糖凝胶中电泳, 紫外凝胶成像仪拍照. 条带进行光密度值分析, 将目标条带与GAPDH条带的光密度值之比作为其mRNA表达水平的参数. 实验重复3次.
统计学处理 实验数据采用SPSS17.0统计软件进行分析. 计量资料以mean±SD表示, 多组间均数比较采用χ2分析, 其中两两比较用S-N-K检验. 两组均数比较用t检验, P<0.05时被认为差异具有统计学意义.
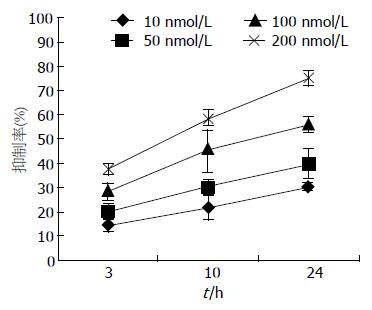
MTT结果显示, 渥曼青霉素能够明显抑制HepG2细胞的增殖, 且具有一定的时间及浓度依赖性(图1). 50 nmol/L渥曼青霉素作用3 h后, HepG2细胞的抑制率为(20.13%±2.52%), 而200 nmol/L渥曼青霉素作用24 h后抑制率可达到(74.93%±3.25%, P<0.05, 表1).
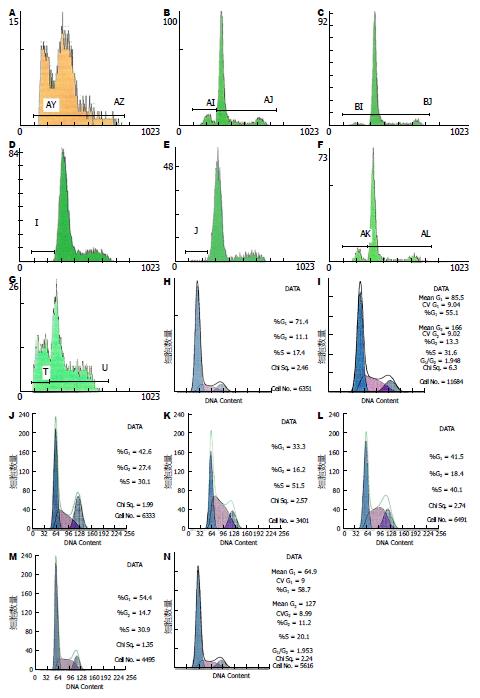
流式细胞检测结果显示, 渥曼青霉素可诱导HepG2细胞发生凋亡, 随着药物浓度增加及作用时间延长, HepG2细胞凋亡率逐渐升高, 呈现明显的时间和浓度依赖性(P<0.05). 同时HepG2细胞周期进程有所改变, 表现为G0/G1期细胞比例显著升高, S期细胞比例显著降低, 且呈时间及浓度依赖性(P<0.05) (表2, 图2).
| 分组 | 凋亡率(%) | 细胞周期分布 (%) | ||
| G0/G1 | S | G2/M | ||
| 处理10 h浓度(nmol/L) | ||||
| 0(Control) | 2.10±0.12 | 33.77±2.93 | 50.90±5.52 | 15.33±2.60 |
| 50 | 8.46±1.17a | 42.20±4.11a | 39.93±3.92a | 17.90±0.50 |
| 100 | 13.76±2.47c | 55.23±3.90c | 31.87±2.31a | 12.90±1.64 |
| 200 | 28.03±2.67e | 71.00±5.17e | 17.17±1.86e | 11.80±3.90 |
| 浓度100 nmol/L处理时间(h) | ||||
| 3 | 3.95±1.07 | 41.17±4.71 | 39.80±4.16a | 19.03±0.78 |
| 24 | 26.34±3.25g | 68.10±5.42g | 19.67±3.87g | 12.23±1.79 |
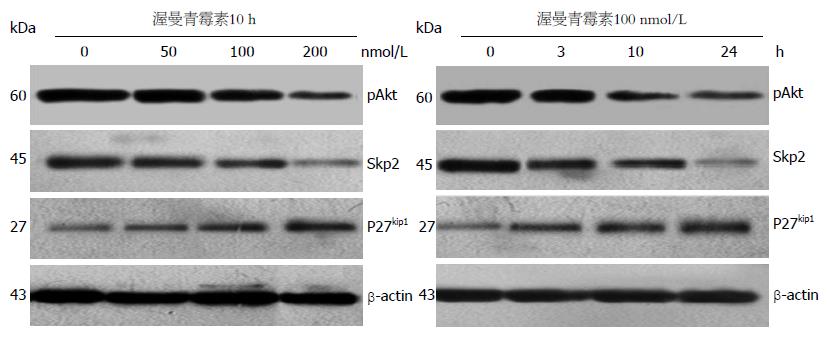
Western blot结果显示: 随着药物浓度的增加和作用时间的延长, pAkt和Skp2蛋白的表达水平逐渐降低, P27kip1蛋白的表达水平逐渐升高, 组间差异有统计学意义(P<0.05) (图3).
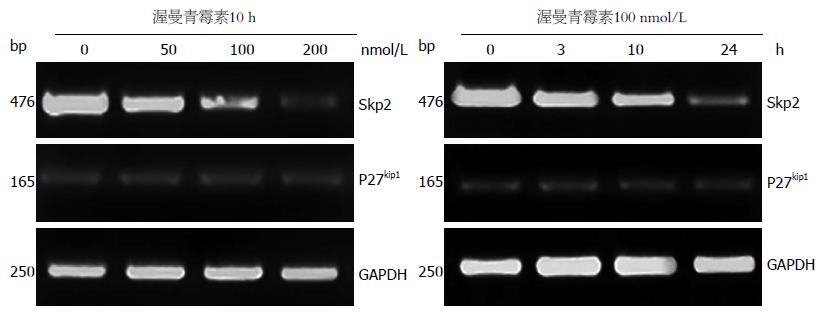
RT-PCR检测结果显示: 随着药物浓度的增加和作用时间的延长, Skp2 mRNA表达水平逐渐降低, 组间差异有统计学意义(P<0.05), 而P27kip1 mRNA表达水平无明显变化(图4).
PI3K/Akt信号通路在广泛的人类肿瘤中表达失调, 如胃癌、前列腺癌、卵巢癌及乳腺癌等[9-12]. 目前认为, Akt的活性调节主要依赖于PI3K, Ser473和Thr308位点的磷酸化是Akt激活的必要条件, 磷酸化Akt(pAkt)是PI3K/Akt信号通路的效应核心[13], 而且pAkt处于细胞内多种信号途径的交汇点, 通过激活或抑制下游30余种靶蛋白, 参与多种细胞活动、物质代谢调节, 尤其是与促进细胞增殖、抑制细胞凋亡、调控细胞周期等有密切关系[14]. 渥曼青霉素分离自丝状真菌, 通过与PI3K的催化亚基p110结合, 不可逆的抑制PI3K的激酶活性, 从而阻断PI3K/Akt信号通路[15]. 本实验发现, 渥曼青霉素可抑制HepG2细胞的增殖、诱导凋亡并导致细胞发生G0/G1期阻滞, 同时伴有pAkt蛋白表达水平明显下调, 且此效应一定范围内具有明显的时间及浓度依赖性, 说明人肝癌HepG2细胞中存在PI3K/Akt信号通路, 渥曼青霉素的上述作用与阻断PI3K/Akt信号通路有关. Yun等[16]将渥曼青霉素作用于人乳腺癌MCF-7细胞, 也得出了与本实验一致的结论.
P27kip1是细胞周期负性调控因子, 主要抑制CyclinE-CDK2和CyclinD-CDK4等G1期激酶复合物活性, 使细胞停滞于G1期, 防止细胞过度增殖, 并与细胞凋亡有着密切的关系[17]. 本实验经流式细胞学检测发现, 渥曼青霉素引发了HepG2细胞的G0/G1期阻滞, 同时细胞凋亡率也明显升高, 故此我们考虑P27kip1可能参与其中. 我们进一步以浓度和时间两种方式研究了经渥曼青霉素处理后HepG2细胞P27kip1的表达变化, 发现P27kip1在mRNA水平无明显变化, 而蛋白表达水平明显升高, 此结果提示阻断PI3K/Akt信号通路引发的效应与P27kip1蛋白水平上调有关. 许多研究发现, 大多数肿瘤中P27kip1很少发生基因缺失或突变, 转录水平也很少发生改变, 对P27kip1的调控主要发生在翻译后水平[18,19]. 我们的实验也发现P27kip1在转录水平未受到渥曼青霉素的影响. P27kip1蛋白在肿瘤组织中的表达下调或缺失主要为其降解加速所致. 虽然目前对于P27kip1蛋白降解的机制尚未完全明了, 但一般认为其主要的负性调节方式为Skp2介导的泛素-蛋白酶体途径[20]. G1晚期P27kip1第187位苏氨酸被磷酸化, 随后被包括Skp2在内的泛素连接酶复合体(SCFSkp2)结合, 泛素化的P27kip1在蛋白酶体内降解, 细胞由G1期进入S期, 其中Skp2的参与是P27kip1的泛素化和降解所必需的[21].
人正常细胞中Skp2蛋白的表达水平是较低的, 而在绝大多数恶性肿瘤如大肠癌[22]、前列腺癌[23]、胃癌[24]及肝细胞癌[8]中表达明显增高, 与肿瘤的恶性生物学行为密切相关, 提示预后不良, 并且大都同时伴有P27kip1蛋白的负性表达变化[25]. 近期研究发现, PI3K/Akt信号通路可通过控制转录因子E2F1与Skp2启动子的结合调节Skp2基因的表达, 还可以通过直接磷酸化激活Skp2调控其稳定性, 从而减少Skp2的降解[26,27]; 因此可以将Skp2定义为PI3K/Akt信号通路的下游底物[28]. 我们进一步研究也证实, 阻断PI3K/Akt信号通路可以在mRNA水平及翻译后水平同时下调HepG2细胞中Skp2的表达, 说明Skp2为pAkt下游的靶基因, 同时提示我们阻断PI3K/Akt信号通路可能通过下调Skp2间接上调P27kip1蛋白的表达水平. Ho等[29]在乳腺癌的研究中发现, 钙蛋白酶2缺失导致的Akt活性降低, 可通过叉头转录因子FoxO上调P27kip1蛋白的表达. 也有研究发现在肝癌细胞中pAkt可磷酸化P27kip1蛋白的多个位点, 其中第157位苏氨酸位于P27kip1的核内定位信号区域, 被磷酸化后P27kip1将无法进入细胞核内发挥细胞周期调控的作用[30]. 这就说明P27kip1蛋白功能的发挥不但与其表达水平有关, 而且与其亚细胞定位有关, PI3K/Akt信号通路可直接参与P27kip1蛋白功能的调控.
总之, PI3K/Akt信号通路抑制剂渥曼青霉素可抑制人肝癌HepG2细胞的增殖, 引发G0/G1期阻滞并诱导其凋亡, 其机制可能与PI3K/Akt信号通路参与Skp2及P27kip1调控有关. 本实验也为以PI3K/Akt信号通路为靶点的肝细胞癌临床辅助治疗提供了一定的理论依据.
原发性肝癌是临床上最常见的恶性肿瘤之一, 侵袭性强、易复发、预后差, 深入研究其发生发展的机制有助于寻找新的有效的治疗靶点. PI3K/Akt通路是十分重要的"凋亡抑制"通路, 通过调控下游多种靶蛋白发挥效应, 但在肝细胞癌中该通路的具体作用机制尚未明确.
李胜, 研究员, 山东省肿瘤防治研究院肝胆外科
PI3K/Akt通路在肿瘤细胞增殖、凋亡和放、化疗抵抗方面起重要作用, 目前以这条信号通路为靶点的肿瘤治疗策略正在广泛的研究中, 有关Skp2及P27kip1在该通路中发挥的作用报道较少.
Ecker等研究表明PI3K/Akt信号通路可通过控制转录因子E2F1与Skp2启动子的结合调节Skp2基因的表达, 还可以直接磷酸化激活Skp2调控其稳定性, 从而减少Skp2的降解, 因此认为Skp2为PI3K/Akt信号通路的下游底物.
本实验证实阻断PI3K/Akt通路可导致肝癌细胞的增殖抑制并引发周期阻滞及凋亡, 并从mRNA及蛋白水平分析了Skp2及P27kip1在其中发挥的作用, 发现PI3K/Akt信号通路直接或间接的参与Skp2及P27kip1的调控.
本实验发现PI3K/Akt通路抑制剂渥曼青霉素具有一定的抑癌作用, 并初步分析了其作用机制, 为以PI3K/Akt信号通路为靶点的肝细胞癌临床辅助治疗提供了一定的实验基础及理论依据.
本实验通过研究不同浓度的渥曼青霉素(0、10、50、100、200 nmol/L)分别作用于对数生长期的人肝癌HepG2细胞, 观察细胞凋亡率及细胞周期的变化, 得出渥曼青霉素抑制人肝癌HepG2细胞的增殖, 有一定科学价值.
编辑: 黄新珍 电编: 鲁亚静
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 5. | De Luca A, Maiello MR, D'Alessio A, Pergameno M, Normanno N. The RAS/RAF/MEK/ERK and the PI3K/AKT signalling pathways: role in cancer pathogenesis and implications for therapeutic approaches. Expert Opin Ther Targets. 2012;16 Suppl 2:S17-S27. [PubMed] [DOI] |
| 6. | Borriello A, Bencivenga D, Criscuolo M, Caldarelli I, Cucciolla V, Tramontano A, Borgia A, Spina A, Oliva A, Naviglio S. Targeting p27Kip1 protein: its relevance in the therapy of human cancer. Expert Opin Ther Targets. 2011;15:677-693. [PubMed] [DOI] |
| 7. | Barré B, Perkins ND. The Skp2 promoter integrates signaling through the NF-kappaB, p53, and Akt/GSK3beta pathways to regulate autophagy and apoptosis. Mol Cell. 2010;38:524-538. [PubMed] [DOI] |
| 8. | 张 萌, 彭 利, 乔 治斌, 何 宏涛, 周 烨, 徐 卓, 杨 涛, 梁 占强. pAkt、Skp2和P27kip1蛋白在肝细胞癌中的表达及意义. 肿瘤防治研究. 2011;38:1283-1287. |
| 10. | Priulla M, Calastretti A, Bruno P, Azzariti A, Paradiso A, Canti G, Nicolin A. Preferential chemosensitization of PTEN-mutated prostate cells by silencing the Akt kinase. Prostate. 2007;67:782-789. [PubMed] |
| 11. | Huang J, Zhang L, Greshock J, Colligon TA, Wang Y, Ward R, Katsaros D, Lassus H, Butzow R, Godwin AK. Frequent genetic abnormalities of the PI3K/AKT pathway in primary ovarian cancer predict patient outcome. Genes Chromosomes Cancer. 2011;50:606-618. [PubMed] [DOI] |
| 12. | Foubert E, De Craene B, Berx G. Key signalling nodes in mammary gland development and cancer. The Snail1-Twist1 conspiracy in malignant breast cancer progression. Breast Cancer Res. 2010;12:206. [PubMed] [DOI] |
| 13. | Almhanna K, Strosberg J, Malafa M. Targeting AKT protein kinase in gastric cancer. Anticancer Res. 2011;31:4387-4392. [PubMed] |
| 14. | Mosca E, Barcella M, Alfieri R, Bevilacqua A, Canti G, Milanesi L. Systems biology of the metabolic network regulated by the Akt pathway. Biotechnol Adv. 2012;30:131-141. [PubMed] [DOI] |
| 15. | Workman P, Clarke PA, Raynaud FI, van Montfort RL. Drugging the PI3 kinome: from chemical tools to drugs in the clinic. Cancer Res. 2010;70:2146-2157. [PubMed] [DOI] |
| 16. | Yun J, Lv YG, Yao Q, Wang L, Li YP, Yi J. Wortmannin inhibits proliferation and induces apoptosis of MCF-7 breast cancer cells. Eur J Gynaecol Oncol. 2012;33:367-369. [PubMed] |
| 17. | Mitrea DM, Yoon MK, Ou L, Kriwacki RW. Disorder-function relationships for the cell cycle regulatory proteins p21 and p27. Biol Chem. 2012;393:259-274. [PubMed] [DOI] |
| 18. | Lee J, Kim SS. The function of p27 KIP1 during tumor development. Exp Mol Med. 2009;41:765-771. [PubMed] [DOI] |
| 19. | Yoon MK, Mitrea DM, Ou L, Kriwacki RW. Cell cycle regulation by the intrinsically disordered proteins p21 and p27. Biochem Soc Trans. 2012;40:981-988. [PubMed] |
| 20. | Hershko DD. Oncogenic properties and prognostic implications of the ubiquitin ligase Skp2 in cancer. Cancer. 2008;112:1415-1424. [PubMed] [DOI] |
| 21. | Kitagawa K, Kotake Y, Kitagawa M. Ubiquitin-mediated control of oncogene and tumor suppressor gene products. Cancer Sci. 2009;100:1374-1381. [PubMed] [DOI] |
| 23. | Wang Z, Gao D, Fukushima H, Inuzuka H, Liu P, Wan L, Sarkar FH, Wei W. Skp2: a novel potential therapeutic target for prostate cancer. Biochim Biophys Acta. 2012;1825:11-17. [PubMed] [DOI] |
| 24. | Wei Z, Jiang X, Liu F, Qiao H, Zhou B, Zhai B, Zhang L, Zhang X, Han L, Jiang H. Downregulation of Skp2 inhibits the growth and metastasis of gastric cancer cells in vitro and in vivo. Tumour Biol. 2013;34:181-192. [PubMed] [DOI] |
| 25. | Wang G, Chan CH, Gao Y, Lin HK. Novel roles of Skp2 E3 ligase in cellular senescence, cancer progression, and metastasis. Chin J Cancer. 2012;31:169-177. [PubMed] [DOI] |
| 26. | Chan CH, Lee SW, Wang J, Lin HK. Regulation of Skp2 expression and activity and its role in cancer progression. ScientificWorldJournal. 2010;10:1001-1015. [PubMed] [DOI] |
| 27. | Lin HK, Wang G, Chen Z, Teruya-Feldstein J, Liu Y, Chan CH, Yang WL, Erdjument-Bromage H, Nakayama KI, Nimer S. Phosphorylation-dependent regulation of cytosolic localization and oncogenic function of Skp2 by Akt/PKB. Nat Cell Biol. 2009;11:420-432. [PubMed] [DOI] |
| 28. | Ecker K, Hengst L. Skp2: caught in the Akt. Nat Cell Biol. 2009;11:377-379. [PubMed] [DOI] |
| 29. | Ho WC, Pikor L, Gao Y, Elliott BE, Greer PA. Calpain 2 regulates Akt-FoxO-p27(Kip1) protein signaling pathway in mammary carcinoma. J Biol Chem. 2012;287:15458-15465. [PubMed] [DOI] |