修回日期: 2013-06-02
接受日期: 2013-07-03
在线出版日期: 2013-08-08
目的: 研究SLP-2(stomatin like protein 2)基因在结肠癌及正常结肠黏膜中的表达情况.
方法: 应用RT-PCR法及免疫组织化学法分别检测40例和50例结肠癌及其癌旁正常结肠黏膜中SLP-2 mRNA和蛋白的表达, 并结合免疫组织化学结果及结肠癌患者的临床病理资料进行分析.
结果: RT-PCR结果显示, 结肠癌及配对癌旁正常组织中SLP-2 mRNA的表达水平分别为1.31±0.28和0.74±0.16, 前者较后者明显升高(P<0.05). 免疫组织化学结果显示, SLP-2蛋白在结肠癌及配对癌旁正常组织中的高表达率分别为70.0%(35/50)和22%(11/50), 两者差异有统计学意义(P<0.05). 且SLP-2蛋白的表达与有无淋巴结转移及TNM分期相关(均P<0.05).
结论: SLP-2基因在结肠癌组织中高表达, 可能参与结肠癌的发生发展和转移.
核心提示: 本实验检测了结肠癌及其癌旁正常结肠组织中SLP-2(stomatin like protein 2)的表达, 并结合免疫组织化学结果及结肠癌患者的临床病理资料进行分析. 结果发现, SLP-2基因在结肠癌组织中高表达, 并与有无淋巴结转移及临床分期相关, 提示SLP-2可能参与结肠癌的发生发展和转移.
引文著录: 张剑, 吴敏, 王利娟, 张红巧, 师广勇, 巴楠, 张自森, 闫琳, 郑晓珂, 邢鑫. SLP-2在结肠癌中的表达. 世界华人消化杂志 2013; 21(22): 2228-2231
Revised: June 2, 2013
Accepted: July 3, 2013
Published online: August 8, 2013
AIM: To investigate the expression of stomatin like protein 2 (SLP-2) in colorectal cancer.
METHODS: The mRNA and protein expression of SLP-2 was detected by RT-PCR in 40 cases and by immunohistochemistry in 50 cases of human colorectal cancer and matched tumor-adjacent tissue. The relationship between SLP-2 protein expression and clinical and pathologic characteristics of colorectal cancer was analyzed.
RESULTS: The expression level of SLP-2 mRNA was significantly higher in colorectal cancer than in tumor-adjacent tissue (1.31 ± 0.28 vs 0.74 ± 0.16, P < 0.05). The positive rate of SLP-2 protein expression was also significantly higher in colorectal cancer than in tumor-adjacent tissue (70.0% vs 22%, P < 0.05). Expression of SLP-2 protein in colorectal cancer was associated with lymph nodes metastasis and TNM stage (both P < 0.05).
CONCLUSION: The expression of SLP-2 is increased in colorectal cancer. SLP-2 may play important roles in the occurrence, development and metastasis of colorectal cancer.
- Citation: Zhang J, Wu M, Wang LJ, Zhang HQ, Shi GY, Ba N, Zhang ZS, Yan L, Zheng XK, Xing X. Expression of SLP-2 in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(22): 2228-2231
- URL: https://www.wjgnet.com/1009-3079/full/v21/i22/2228.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i22.2228
结肠癌是常见的消化系恶性肿瘤, 其在欧美国家发病率较高, 在发展中国家发病率较低, 但近30年来, 随着生活水平及饮食习惯的改变, 我国结肠癌的发病率和死亡率明显升高[1]. 癌基因的激活和抑癌基因的失活是恶性肿瘤发生发展过程中的重要事件, 寻找并研究新的癌基因有助于揭示恶性肿瘤的发生机制, 并能为恶性肿瘤的基因治疗提供线索. SLP-2(stomatin like protein 2)基因是2000年发现的一个新基因, 属于stomatin基因超家族的一个新成员[2]. 近年来的研究显示, SLP-2基因在多种恶性肿瘤中高表达[3-8], 推测SLP-2可能是一个新的癌基因. 目前SLP-2在消化系肿瘤中的研究较少, 本实验采用RT-PCR和免疫组织化学法检测SLP-2在人结肠癌组织中的表达情况, 并分析SLP-2蛋白的表达水平与临床病理资料的关系, 旨在研究SLP-2在结肠癌中的表达特点及其临床意义.
收集郑州大学第五附属医院2010-01/2011-06手术切除结肠癌标本50例, 取癌组织及癌旁正常组织(距离癌组织边缘>5 cm). 所有标本均经病理学检查确诊为结肠癌, 术前未接受过放、化疗. 其中男27例, 女23例; 年龄40-72岁, 中位年龄63岁. 临床分期按TNM分期标准(AJCC 2010年第7版).
1.2.1 SLP-2蛋白表达的免疫组织化学检测: 所有组织均用40 g/L甲醛溶液固定, 经脱水、包埋、3 μm厚连续切片. 鼠抗人SLP-2单克隆抗体购自美国proteintech公司, 稀释度为1:200. 即用型一步法(非生物素)检测试剂盒购自迈新公司. 操作步骤按试剂盒说明书进行. 用PBS代替一抗作阴性对照, 用已知阳性片作阳性对照.
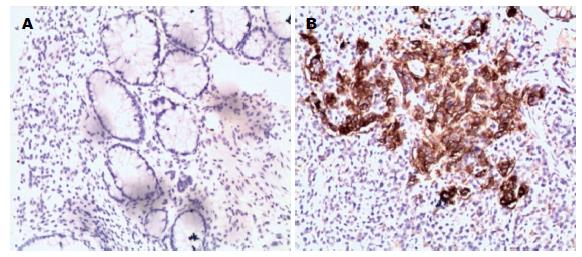
1.2.2 免疫组织化学结果判定: 免疫组织化学染色由两位高年资病理科医师在双盲条件下进行评定, 判定标准参照文献[9], 每张切片根据阳性细胞染色程度及细胞阳性百分数的多少进行分级. 计数阳性细胞百分数: 没有阳性细胞赋值为0, 1%-25%为1, 26%-50%为2, 51%-75%为3, >75%为4. 染色程度根据每张切片的大多数细胞染色特征决定: 细胞膜及细胞浆无着色赋值为0, 浅黄色为1, 黄色为2, 棕黄色为3. 最终评分由两者分数相乘得到, 总值≥8分为高表达, <8分为阴性或低表达.
1.2.3 SLP-2 mRNA表达的RT-PCR检测: 细胞总RNA的提取及cDNA第一链合成按照TRIzol试剂盒及逆转录试剂盒(美国Invitrogen公司产品)说明书进行.
用于扩增SLP-2基因的上游引物5'-CTGGAGCCTGGTTTGAACAT-3'; 下游引物为5'-AGGATCTGGGCCTGTTTCTT-3', 扩增片断长度为500 bp. 以β-actin为内对照, 上游引物为5'-ACACTGTGCCCATCTACGACC-3'; 下游引物为5'-AGGGGCCGGACTCGTCATAGA-3', 扩增片断长度为242 bp. PCR反应体系: 2×Taq PCR MasterMix 12.5 µL, β-actin上、下游引物各1 µL, SLP-2上、下游引物各1 µL, cDNA 2 µL, ddH2O补至25 µL. PCR反应在2400型PCR仪(美国PE公司产品)上进行, 预变性: 94℃, 5 min, 进入循环: 94℃、30 s, 55℃、30 s, 72℃、50 s, 共30个循环, 最后延伸72℃、7 min, 获取扩增片断.
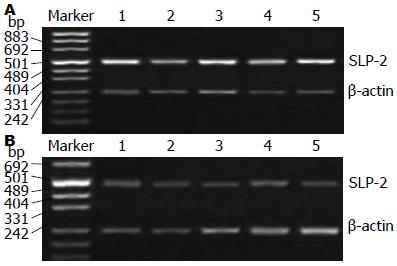
1.2.4 RT-PCR结果判定: 扩增产物进行1.5%琼脂糖凝胶电泳后, 电泳条带图像用Fluor-S MutiImager凝胶成像仪(美国Bio-Rad公司产品)扫描, 用Multi-Analyst软件包(美国Bio-Rad公司产品)定量分析电泳分离的各特异扩增条带的原始A值, 以SLP-2与β-actin的A值的比值表示SLP-2 mRNA的相对表达水平.
统计学处理 应用SPSS16.0统计软件进行统计分析. 采用χ2检验及t检验, P<0.05为差异有统计学意义.
在50例结肠癌中有35例SLP-2蛋白高表达, 在50例癌旁正常结肠黏膜中有11例SLP-2蛋白高表达, 高表达率分别为70.0%(35/50)和22%(11/50), 差异有统计学意义(χ2 = 23.188, P = 0.000)(图1).
40例结肠癌组织及正常结肠黏膜组织中SLP-2 mRNA表达水平分别为1.31±0.28和0.74±0.16, 前者较后者明显升高, 差异有统计学意义(t = 4.36, P = 0.012)(图2).
收集整理50例结肠癌患者的临床病理资料, 分析SLP-2蛋白在不同性别、年龄、分化程度、肿瘤大小、TNM分期、转移情况的结肠癌病例中的表达. 结果显示, SLP-2蛋白在有淋巴结转移及TNM较晚期病例的结肠癌中表达较高(P = 0.000及P = 0.001), 而与其他临床病理特征无明显相关(均P>0.05)(表1).
| 分组 | n | SLP-2蛋白表达 | χ2值 | P值 | |
| 高 | 低 | ||||
| 性别 | 0.004 | 0.951 | |||
| 男 | 27 | 19 | 8 | ||
| 女 | 23 | 16 | 7 | ||
| 年龄(岁) | 0.192 | 0.662 | |||
| ≤50 | 21 | 14 | 7 | ||
| >50 | 29 | 21 | 8 | ||
| 肿瘤大小(cm) | 0.066 | 0.797 | |||
| ≤5 | 32 | 22 | 10 | ||
| >5 | 18 | 13 | 5 | ||
| 分化程度 | 0.000 | 1.000 | |||
| 高-中分化 | 35 | 24 | 11 | ||
| 低分化 | 15 | 11 | 4 | ||
| 淋巴结转移 | 19.647 | 0.000 | |||
| 有 | 34 | 31 | 3 | ||
| 无 | 16 | 4 | 12 | ||
| 临床分期 | 10.474 | 0.001 | |||
| Ⅰ+Ⅱ | 13 | 4 | 9 | ||
| Ⅲ+Ⅳ | 37 | 31 | 6 | ||
SLP-2基因定位于染色体9p13.1, 长约3250 bp, 2000年由美国耶鲁大学病理科首次发现, 是stomatin家族的一个新成员[2]. 研究推测, SLP-2蛋白是一种细胞质膜相关蛋白, 可能作为外周膜蛋白起作用, 调控离子通道和脂筏结构[2,10]. SLP-2还存在于细胞的线粒体中[11], 可能通过与线粒体内膜相关蛋白结合, 调节线粒体膜相关蛋白的稳定性[12,13].
本实验从mRNA及蛋白水平检测了人结肠癌及癌旁正常结肠黏膜组织中SLP-2基因的表达. 结果显示, SLP-2基因在结肠癌中的表达高于正常结肠黏膜组织(均P<0.05). 且较晚期病例的结肠癌组织中SLP-2蛋白表达高于较早期病例的结肠癌组织, 有淋巴结转移的病例中SLP-2蛋白高于无淋巴结转移的病例; 而与患者性别、年龄、肿瘤大小、分化程度等因素无明显相关(均P>0.05). 提示SLP-2可能参与结肠癌的发展和转移.
SLP-2在恶性肿瘤发生发展中的作用机制尚未明确, 推测可能与调节细胞信号传导通路及线粒体能量代谢有关. 有文献报道, SLP-2蛋白可能通过与Rho家族蛋白的相互作用, 参与细胞信号传导通路来调节肿瘤细胞的侵袭转移能力[14]. 祁代华等[15]的研究也显示, 结直肠癌组织中SLP-2和Rho家族CDC42蛋白表达呈正相关, 且与结直肠癌的Dukes分期、淋巴结转移相关. 此外, 转染siRNA降低Hela细胞中SLP-2的表达, 可引起线粒体膜电势的降低[11]; 转染siRNA降低食管癌KYSE150细胞中SLP-2表达后, 细胞线粒体膜电势和ATP水平均降低, 同时伴细胞运动能力和增殖能力减弱[8], 推测SLP-2可能通过影响细胞的能量代谢参与肿瘤细胞的增殖和转移.
本研究发现SLP-2在结肠癌组织中表达高于正常结肠黏膜组织, 且SLP-2蛋白表达与结肠癌的淋巴结转移和TNM分期相关. TNM分期及淋巴结转移情况是恶性肿瘤预后的相关指标. 提示SLP-2可指导结肠癌患者的预后生存, 并有可能作为一个新的肿瘤靶向治疗的靶点.
SLP-2基因是2000年发现并命名的一个新基因. 研究表明, SLP-2基因在食管癌、肺癌、子宫内膜癌、前列腺癌等恶性肿瘤中高表达. 推测其可能是一个新的癌基因.
卢宁, 副主任医师, 兰州军区乌鲁木齐总医院肿瘤科
目前SLP-2与恶性肿瘤的关系及其作用机制是研究的热点.
研究显示, SLP-2基因在食管癌、肺癌、子宫内膜癌、乳腺癌、前列腺癌、肝癌等恶性肿瘤中存在高表达. 将SLP-2正义核酸和反义核酸导入食管癌、肺癌和子宫内膜癌细胞系, 发现SLP-2正义核酸可促进癌细胞增殖、抑制细胞凋亡, 并能提高癌细胞的转移能力, 而反义核酸的作用相反.
目前关于SLP-2基因在消化系肿瘤中表达情况的研究较少, 本实验应用RT-PCR法及免疫组织化学法检测了结肠癌及其癌旁正常结肠组织中SLP-2的表达, 并结合免疫组织化学结果及结肠癌患者的临床病理资料进行分析. 结果提示, SLP-2 mRNA及蛋白在结肠癌组织中均表达升高, 且SLP-2蛋白的表达与有无淋巴结转移及TNM分期相关.
本实验结果提示SLP-2可指导结肠癌患者的预后生存, 并有可能作为一个新的肿瘤靶向治疗的靶点.
本文目标明确, 设计尚合理, 实验数据可靠, 具有一定的创新性, 有一定的科学意义.
编辑: 田滢 电编:闫晋利
| 2. | Wang Y, Morrow JS. Identification and characterization of human SLP-2, a novel homologue of stomatin (band 7.2b) present in erythrocytes and other tissues. J Biol Chem. 2000;275:8062-8071. [PubMed] [DOI] |
| 4. | Chang D, Ma K, Gong M, Cui Y, Liu ZH, Zhou XG, Zhou CN, Wang TY. SLP-2 overexpression is associated with tumour distant metastasis and poor prognosis in pulmonary squamous cell carcinoma. Biomarkers. 2010;15:104-110. [PubMed] [DOI] |
| 7. | Cao W, Zhang B, Liu Y, Li H, Zhang S, Fu L, Niu Y, Ning L, Cao X, Liu Z. High-level SLP-2 expression and HER-2/neu protein expression are associated with decreased breast cancer patient survival. Am J Clin Pathol. 2007;128:430-436. [PubMed] [DOI] |
| 9. | Wang Y, Cao W, Yu Z, Liu Z. Downregulation of a mitochondria associated protein SLP-2 inhibits tumor cell motility, proliferation and enhances cell sensitivity to chemotherapeutic reagents. Cancer Biol Ther. 2009;8:1651-1658. [PubMed] [DOI] |
| 10. | Sprenger RR, Speijer D, Back JW, De Koster CG, Pannekoek H, Horrevoets AJ. Comparative proteomics of human endothelial cell caveolae and rafts using two-dimensional gel electrophoresis and mass spectrometry. Electrophoresis. 2004;25:156-172. [PubMed] [DOI] |
| 11. | Chevallet M, Lescuyer P, Diemer H, van Dorsselaer A, Leize-Wagner E, Rabilloud T. Alterations of the mitochondrial proteome caused by the absence of mitochondrial DNA: A proteomic view. Electrophoresis. 2006;27:1574-1583. [PubMed] [DOI] |
| 12. | Hájek P, Chomyn A, Attardi G. Identification of a novel mitochondrial complex containing mitofusin 2 and stomatin-like protein 2. J Biol Chem. 2007;282:5670-5681. [PubMed] [DOI] |
| 13. | Da Cruz S, Parone PA, Gonzalo P, Bienvenut WV, Tondera D, Jourdain A, Quadroni M, Martinou JC. SLP-2 interacts with prohibitins in the mitochondrial inner membrane and contributes to their stability. Biochim Biophys Acta. 2008;1783:904-911. [PubMed] |
| 14. | Horiuchi A, Imai T, Wang C, Ohira S, Feng Y, Nikaido T, Konishi I. Up-regulation of small GTPases, RhoA and RhoC, is associated with tumor progression in ovarian carcinoma. Lab Invest. 2003;83:861-870. [PubMed] |