修回日期: 2013-06-25
接受日期: 2013-07-03
在线出版日期: 2013-08-08
目的: 探讨候选抑癌基因SASH1在食管鳞状细胞癌中的表达及与肿瘤相关的临床病理特征的关系.
方法: 应用免疫组织化学SP法检测72例食管鳞癌组织及40例癌旁组织中SASH1蛋白的表达.
结果: SASH1蛋白在癌组织阳性表达率显著低于癌旁组织, 统计学分析表明两者差异有显著意义(41.67% vs 80.00%, P<0.001). 其表达率在食管鳞癌伴淋巴结转移组中较不伴淋巴结转移组明显降低(χ2 = 6.583, P<0.05). 其在食管鳞癌组织中的表达水平与肿瘤分化程度及TNM分期相关(P<0.05).
结论: SASH1基因在食管鳞癌中表达下调, 该基因可能是食管鳞癌的肿瘤抑制基因, 可能作为分子标记而用于食管鳞癌的诊断和治疗.
核心提示:SASH1基因在食管鳞癌中的表达下调, 并与肿瘤的分化程度、临床分期、淋巴结转移有关. SASH1基因可能作为候选抑癌基因, 用于肿瘤的诊断、治疗及预后判断.
引文著录: 刘秋菊, 贺远龙, 刘红云, 卫红军, 许琳, 王青. SASH1基因在食管鳞癌中的表达及临床意义. 世界华人消化杂志 2013; 21(22): 2198-2201
Revised: June 25, 2013
Accepted: July 3, 2013
Published online: August 8, 2013
AIM: To detect the expression of SAM- and SH3-domain containing 1 (SASH1) in human esophageal squamous cell carcinoma (ESCC), and to analyze the relationship between SASH1 expression and clinical and pathological parameters of ESCC.
METHODS: The expression of SASH1 was detected by immunohistochemistry in 72 ESCC specimens and 40 tumor-adjacent specimens.
RESULTS: The positive rate of SASH1 protein expression in ESCC was significantly lower than that in tumor-adjacent non-carcinoma tissue (41.67% vs 80.00%, P < 0.001). The positive rate of SASH1 protein expression was significantly higher in patients without lymph node metastasis than in those with lymph node metastasis (χ2 = 6.583, P < 0.05). Expression of SASH1 was associated with tumor differentiation and TNM stage in ESCC (both P < 0.05).
CONCLUSION: Down-regulation of SASH1 expression occurs in ESCC. SASH1 may be a novel tumor suppressor in ESCC and can be used as a molecular maker for the diagnosis and treatment of ESCC.
- Citation: Liu QJ, He YL, Liu HY, Wei HJ, Xu L, Wang Q. Clinical significance of expression of SASH1 in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(22): 2198-2201
- URL: https://www.wjgnet.com/1009-3079/full/v21/i22/2198.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i22.2198
SASH1基因是进化保守的SLY(SH3-domain containing expressed in lymphocytes)基因家族的一员, 广泛表达于人体多种正常组织(淋巴样干细胞除外)[1]. 近年来SASH1基因作为候选抑癌基因, 在肿瘤中的表达受到越来越多的重视. 研究表明, SASH1基因在结肠癌[2]、肺癌[3]、骨肉瘤[4]、黑色素瘤[5]、神经胶质瘤[6]等多种肿瘤中表达下降, 并与肿瘤侵袭性生长、转移灶的形成及预后有关. 但迄今为止, 国内外尚未见SASH1基因在食管鳞癌中表达的有关报道. 本研究分析了SASH1基因在食管鳞癌中的表达情况, 并探讨其临床意义.
选取青岛市立医院2009-02/2013-02手术切除的食管癌标本72例. 病理诊断确诊为食管鳞状细胞癌, 为原发性, 且病灶位于齿状线上方. 其中男55例, 女17例, 年龄35岁-84岁, 平均57.4岁±6.1岁. 食管鳞癌组无淋巴结转移者40例, 伴淋巴结转移者32例. 所有病例根据国际抗癌联盟(Union for International Cancer Control, UICC)2009年修订的食管癌TNM分期标准进行分期, 其中Ⅰ期12例, Ⅱ期34例, Ⅲ期26例. 另取癌旁组织(距瘤块组织5 cm以上)40例. 患者术前均未经放、化疗及免疫治疗. 标本经40 g/L甲酫固定, 常规石蜡包埋后, 进行4 μm连续切片. 兔抗人SASH1多克隆抗体(浓缩型)购自ABGENT公司. 快捷型酶标羊抗鼠/兔IgG复合物(二抗)、非免疫动物血清(牛)、DAB显色试剂盒、柠檬酸组织抗原修复液均购自福州迈新生物技术有限公司.
1.2.1 免疫组织化学: 切片逐级脱蜡、水化至水. 置于1:100柠檬酸溶液(pH 6.0) 中, 高压修复5 min. 自然冷却至室温. 3%过氧化氢(灭内源过氧化物酶)10 min. 非免疫动物血清(牛)封闭10 min. 滴加一抗(浓缩液1:300稀释), 4 ℃冰箱过夜. 复温20 min后, 滴加二抗工作液, 静置10 min. DAB显色. 苏木素复染20 s. 脱水、透明、封片. 用PBS代替一抗作空白对照.
1.2.2 结果判定: 采用双盲法统计实验结果. 以细胞核中出现明显的棕黄色颗粒为SASH1蛋白表达阳性. 400倍视野下每张切片选择5个代表区. 分别进行细胞计数, 按照阳性细胞百分数评分, 阳性细胞百分数5%以下为0分, 5%-24%为1分, 25%-49%为2分, 50%-74%为3分, 75%以上为4分. 按染色强度评分, 无着色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 最后以阳性细胞百分数计分和染色强度计分相乘所得的总分进行结果判定. 0-4分作为阴性, 5分以上作为阳性.
统计学处理 应用SPSS19.0软件进行统计学分析. SASH1的表达与食管鳞癌临床病理特征的关系采用χ2检验, 检验水准α = 0.05, 以P<0.05为差异有统计学意义.
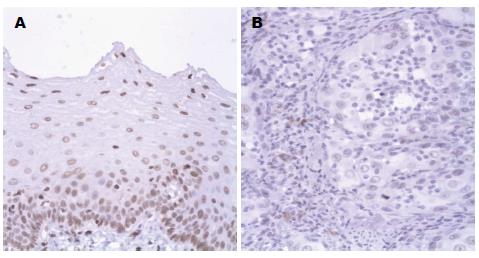
SASH1蛋白阳性表达主要表现在细胞核出现明显棕黄色颗粒(图1). 本实验中, SASH1蛋白在癌组织阳性表达率(41.67%)较癌旁组织(80.00%)明显下降, 差异有统计学意义(P<0.001, 表1).
| n | SASH1的表达 | 阳性率(%) | χ2值 | P值 | ||
| 阳性 | 阴性 | |||||
| 癌组织 | 72 | 30 | 42 | 41.7 | 24.464 | 0.000 |
| 癌旁组织 | 40 | 32 | 8 | 80.0 | ||
SASH1蛋白在中-高分化食管鳞癌组织阳性率高于低分化组织(P<0.05), 食管鳞癌伴淋巴结转移组阳性表达率低于无淋巴结转移组(P<0.05), TNM分期Ⅲ期SASH1蛋白的阳性表达率低于Ⅰ-Ⅱ期病例(P<0.05). 结果表明: SASH1蛋白在食管鳞癌组织中的表达水平与肿瘤分化程度、淋巴结转移情况及食管鳞癌的进展程度有关, 而其表达与患者年龄、性别无关(P>0.05, 表2).
| 临床病理特征 | n | SASH1的表达 | 阳性率(%) | χ2值 | P值 | |
| 阳性 | 阴性 | |||||
| 年龄(岁) | 0.411 | 0.521 | ||||
| ≥60 | 32 | 12 | 20 | 37.5 | ||
| <60 | 40 | 18 | 22 | 45.0 | ||
| 性别 | 1.164 | 0.281 | ||||
| 女 | 17 | 9 | 8 | 52.9 | ||
| 男 | 55 | 21 | 34 | 38.2 | ||
| 分化程度 | 8.102 | 0.004 | ||||
| 高-中 | 52 | 27 | 25 | 51.9 | ||
| 低 | 20 | 3 | 17 | 15.0 | ||
| 淋巴结转移 | 6.583 | 0.010 | ||||
| 无 | 40 | 22 | 18 | 55.0 | ||
| 有 | 32 | 8 | 24 | 25.0 | ||
| TNM分期 | 8.428 | 0.004 | ||||
| Ⅰ-Ⅱ | 46 | 25 | 21 | 54.4 | ||
| Ⅲ | 26 | 5 | 21 | 19.2 | ||
SASH1基因是编码衔接蛋白的SLY基因家族的一员[7]. 该基因是2003年德国学者Zeller等[1]研究人染色体6q23-25的杂合性缺失时发现的. SASH1蛋白的结构包括两种介导蛋白间相互作用的基序: 一个Src同源结构域3(Src homology domain 3, SH3)结构域, 两个不育α基序(sterile α-module, SAM)结构域. SH3结构域能够识别富含脯氨酸和疏水残基的序列而介导蛋白之间的相互作用[8], SAM结构域可与含相同结构域的蛋白发生同源和异源的寡聚化作用[9,10]. 自从Zeller等[1]研究发现乳腺癌中SASH1基因表达下调后, 大量研究证明其在多种肿瘤组织中存在表达下调现象. 本试验通过免疫组织化学的方法检测SASH1基因在食管鳞癌中的表达, 分析SASH1基因与食管鳞癌分化程度等临床病理特征之间的关系, 探讨其在食管癌发生发展中的作用.
Zeller等[1]报道, 在其研究的65例乳腺癌样本中, SASH1基因30%缺失, 70%表达下调. 而在Rimkus等[2]研究的113例结肠癌组织中, SASH1基因48例呈阳性表达, 表达率为42.5%. 本研究结果中, SASH1蛋白在食管鳞癌组织阳性表达率41.7%, 与上述报道相近. SASH1基因在肿瘤组织中出现表达缺失或下调的机制及其意义尚不清楚, 可能与以下因素有关: (1)影响信号转导通路. Lindvall等[11]研究发现SASH1基因可能是Bruton酪氨酸激酶相关信号转导途径的调节者. Dubois等[12]研究发现信号接头蛋白SASH1结合14-3-3蛋白应答于磷脂酰肌醇3-激酶相关信号转导途径. 而磷脂酰肌醇3-激酶是Bruton酪氨酸激酶的上游信号分子; (2)调节微丝骨架及促进细胞基质的黏附作用. Martini等[13]证明SASH1蛋白可能通过与皮动蛋白结合来调节细胞伪足的活动, 且SASH1的表达导致细胞黏附于纤维连接蛋白和层黏连蛋白的增多, 因而抑制了细胞转移. 黏附功能下降是恶性肿瘤细胞发生转移的关键步骤之一, 而皮动蛋白与细胞基质的黏附有关[14]. 少数已知的皮动蛋白结合伴侣富含脯氨酸序列, 可与SASH1所含脯氨酸序列结合而发挥作用[15,16]. Rimkus等[2]研究表明, 随着结肠癌TNM分期的升高, SASH1的表达明显下降, 同时证明, 结肠癌伴肝转移组与不伴肝转移组相比, 其表达下降. 本实验研究证明, 食管鳞癌伴淋巴结转移组的阳性表达率(25.0%)明显低于无淋巴结转移组(55.0%), 且SASH1的表达与食管鳞癌的进展程度密切相关. 因而, SASH1基因表达缺失或下调可能与食管鳞癌的侵袭和转移密切相关(P<0.05), 是预后不良的因素. 此外, 还有证据表明, SASH1基因可影响肿瘤细胞的成瘤能力及通过核质穿梭而影响肿瘤的发生、发展[6,13].
本研究结果显示, SASH1蛋白在食管鳞癌组织中表达明显低于癌旁组织, 并与肿瘤分化程度、淋巴结转移情况及临床分期相关. SASH1基因的表达下调可能是食管鳞癌发生的重要分子事件. SASH1基因在食管癌中的异常表达及其机制值得进一步深入研究, 以期为食管癌的诊断、临床治疗及预后判断等探寻新的思路和策略.
SASH1基因是2003年发现的一种新的候选抑癌基因. 该基因在多种肿瘤中表达缺失或下调, 此现象与肿瘤临床病理特征的关系日益受到关注. 本研究旨在揭示SASH1基因在食管癌中的表达及与肿瘤生物学行为的关系.
王建明, 副教授, 南京医科大学公共卫生学院流行病与卫生统计学系
目前, SASH1基因与恶性肿瘤关系的研究已成为热点. 然而, SASH1基因的作用机制尚不清楚, 还有不少问题需要进一步阐明: (1)SASH1与肿瘤相关信号转导通路的关系; (2)微卫星状态和SASH1基因之间的关系; (3)SASH1表达水平变化是否与表观遗传学有关, 比如启动子的过甲基化.
Chen等通过转染SASH1进入人肺腺癌细胞系A549发现, 转染的A549细胞其SASH1蛋白表达升高, 而细胞周期蛋白D1、MMP-2/9的表达均下降, 且细胞活力降低; 并用PI法证明SASH1基因的表达升高导致A549细胞系的细胞周期阻滞在G0/G1期. 这表明SASH1基因可能抑制癌细胞的生长、增殖、转移, 促进凋亡.
本研究首次采用免疫组织化学技术检测SASH1基因在食管鳞癌组织、癌旁组织中的表达情况, 并探讨其与食管鳞癌临床病理特征之间的关系.
SASH1基因的异常表达可作为食管鳞癌诊断的生物学标志, 并对食管鳞癌的临床治疗及预后判断有一定指导意义.
本文选题新颖, 设计合理, 结果可靠, 具有一定的意义.
编辑: 田滢 电编:闫晋利
| 1. | Zeller C, Hinzmann B, Seitz S, Prokoph H, Burkhard-Goettges E, Fischer J, Jandrig B, Schwarz LE, Rosenthal A, Scherneck S. SASH1: a candidate tumor suppressor gene on chromosome 6q24.3 is downregulated in breast cancer. Oncogene. 2003;22:2972-2983. [PubMed] [DOI] |
| 2. | Rimkus C, Martini M, Friederichs J, Rosenberg R, Doll D, Siewert JR, Holzmann B, Janssen KP. Prognostic significance of downregulated expression of the candidate tumour suppressor gene SASH1 in colon cancer. Br J Cancer. 2006;95:1419-1423. [PubMed] [DOI] |
| 3. | Chen EG, Chen Y, Dong LL, Zhang JS. Effects of SASH1 on lung cancer cell proliferation, apoptosis, and invasion in vitro. Tumour Biol. 2012;33:1393-1401. [PubMed] [DOI] |
| 4. | Meng Q, Zheng M, Liu H, Song C, Zhang W, Yan J, Qin L, Liu X. SASH1 regulates proliferation, apoptosis, and invasion of osteosarcoma cell. Mol Cell Biochem. 2013;373:201-210. [PubMed] [DOI] |
| 5. | Lin S, Zhang J, Xu J, Wang H, Sang Q, Xing Q, He L. Effects of SASH1 on melanoma cell proliferation and apoptosis in vitro. Mol Med Rep. 2012;6:1243-1248. [PubMed] [DOI] |
| 6. | Yang L, Liu M, Gu Z, Chen J, Yan Y, Li J. Overexpression of SASH1 related to the decreased invasion ability of human glioma U251 cells. Tumour Biol. 2012;33:2255-2263. [PubMed] [DOI] |
| 7. | Beer S, Scheikl T, Reis B, Hüser N, Pfeffer K, Holzmann B. Impaired immune responses and prolonged allograft survival in Sly1 mutant mice. Mol Cell Biol. 2005;25:9646-9660. [PubMed] [DOI] |
| 9. | Kim CA, Gingery M, Pilpa RM, Bowie JU. The SAM domain of polyhomeotic forms a helical polymer. Nat Struct Biol. 2002;9:453-457. [PubMed] |
| 10. | Kim CA, Phillips ML, Kim W, Gingery M, Tran HH, Robinson MA, Faham S, Bowie JU. Polymerization of the SAM domain of TEL in leukemogenesis and transcriptional repression. EMBO J. 2001;20:4173-4182. [PubMed] [DOI] |
| 11. | Lindvall JM, Blomberg KE, Wennborg A, Smith CI. Differential expression and molecular characterisation of Lmo7, Myo1e, Sash1, and Mcoln2 genes in Btk-defective B-cells. Cell Immunol. 2005;235:46-55. [PubMed] [DOI] |
| 12. | Dubois F, Vandermoere F, Gernez A, Murphy J, Toth R, Chen S, Geraghty KM, Morrice NA, MacKintosh C. Differential 14-3-3 affinity capture reveals new downstream targets of phosphatidylinositol 3-kinase signaling. Mol Cell Proteomics. 2009;8:2487-2499. [PubMed] [DOI] |
| 13. | Martini M, Gnann A, Scheikl D, Holzmann B, Janssen KP. The candidate tumor suppressor SASH1 interacts with the actin cytoskeleton and stimulates cell-matrix adhesion. Int J Biochem Cell Biol. 2011;43:1630-1640. [PubMed] [DOI] |
| 14. | Bryce NS, Clark ES, Leysath JL, Currie JD, Webb DJ, Weaver AM. Cortactin promotes cell motility by enhancing lamellipodial persistence. Curr Biol. 2005;15:1276-1285. [PubMed] [DOI] |
| 15. | Buday L, Downward J. Roles of cortactin in tumor pathogenesis. Biochim Biophys Acta. 2007;1775:263-273. [PubMed] |
| 16. | van Rossum AG, Moolenaar WH, Schuuring E. Cortactin affects cell migration by regulating intercellular adhesion and cell spreading. Exp Cell Res. 2006;312:1658-1670. [PubMed] [DOI] |