修回日期: 2013-07-19
接受日期: 2013-07-20
在线出版日期: 2013-08-08
目的: 测定不同途径5-氟尿嘧啶(5-fluorouracil, 5-FU)化疗后家兔门静脉血及肝脏组织中的药物浓度.
方法: 以家兔为模型动物分别进行5-FU静脉化疗、腹腔化疗和缓释化疗, 用高效液相色谱法测定门静脉血及组织中5-FU浓度. 根据各组门静脉血药浓度-时间曲线, 计算曲线下面积(area under the concentration-time curve, AUC).
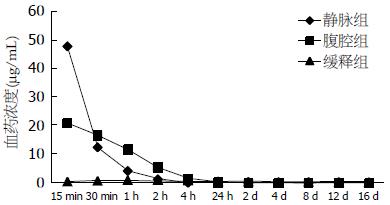
结果: 静脉组血药浓度在给药后即刻达到峰值, 15 min仍高达47.89 μg/mL, 但仅能维持4 h; 腹腔组给药后15 min达到血药浓度峰值(20.67 μg/mL), 维持时间较静脉组稍长, 可达到24 h; 缓释组在给药后2 h达到最高值0.82 μg/mL, 且持续时间较长, 16 d后仍可在检测到. 3组血药浓度AUC依次升高, 分别为21.57 μg/(mL•h)、42.85 μg/(mL•h)和70.08 μg/(mL•h). 同时, 缓释组各组织5-FU浓度消除显著减慢, 给药12 d后肝组织中仍可测到, 腹腔组组织药物浓度仅维持至给药后24 h.
结论: 5-FU腹腔内缓释化疗可显著延长门静脉血及肝脏组织中5-FU持续时间, 有助于增强化疗效果.
核心提示: 腹腔注射5-氟尿嘧啶(5-fluorouracil)缓释剂能够显著延缓血药浓度上升, 延长有效药物浓度维持时间, 增加肝转移癌局部药物浓度, 有利于提高治疗效果.
引文著录: 杨建武, 姜福全, 江文俊, 黄玉玲, 崔彦. 通过测定不同途径5-FU化疗后家兔门静脉血及组织中的药物浓度比较各途径的化疗效果. 世界华人消化杂志 2013; 21(22): 2176-2180
Revised: July 19, 2013
Accepted: July 20, 2013
Published online: August 8, 2013
AIM: To determine the concentration of 5-fluorouracil (5-FU) in the portal vein blood and liver in a rabbit model after chemotherapy with 5-FU given via different routes of administration.
METHODS: The portal vein blood and liver biopsy were collected at different time points after intravenous chemotherapy, intraperitoneal chemotherapy or intraperitoneal sustained-releasing chemotherapy with 5-FU. The concentration of 5-FU was measured by HPLC. The area under the concentration-time curve (AUC) was calculated based on the concentration-time curve.
RESULTS: The concentration of 5-FU in the portal vein reached the peak (0.82 μg/mL) two hours after intraperitoneal administration of sustained-releasing agents. The concentration of 5-FU in the portal vein was stable and the drug could be detected until day 16 after treatment. In contrast, the average concentration of 5-FU in the portal vein of animals receiving intraperitoneal injection of 5-FU was 20.67 μg/mL 15 minutes after injection and the drug was undetectable 24 h later. 5-FU in the portal vein of animals receiving intravenous chemotherapy was undetectable 4 h later. AUC in the intravenous, intraperitoneal and sustained-releasing groups was 21.57 μg/(mL•h), 42.85 μg/(mL•h) and 70.08 μg/(mL•h), respectively. 5-FU in liver biopsy could be detected until day 12 after intraperitoneal administration of sustained-releasing agents. In contrast, 5-FU in liver biopsy was undetectable 24 h later in animals receiving intraperitoneal injection of 5-FU.
CONCLUSION: Intraperitoneal sustained-releasing chemotherapy may prolong the effective exposure time of 5-FU in the portal vein and enhance chemotherapeutic effects in the liver.
- Citation: Yang JW, Jiang FQ, Jiang WJ, Huang YL, Cui Y. Different chemotherapy effects of 5-FU given via different routes of administration. Shijie Huaren Xiaohua Zazhi 2013; 21(22): 2176-2180
- URL: https://www.wjgnet.com/1009-3079/full/v21/i22/2176.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i22.2176
腹腔内化疗最早应用于控制卵巢癌患者腹水[1], 因其较静脉给药能够显著提高腹腔药物浓度, 现已广泛应用于多种腹腔内肿瘤或转移灶的治疗, 但此种给药方式往往瞬间达到血药峰值, 而后迅速衰减, 不良反应较大且不利于持续杀灭肿瘤. 因此, 本研究将以家兔为模型动物, 探讨腹腔内缓释化疗方案对腹腔内化疗的改进作用.
家兔56只, 雌雄各半, 平均体质量2.5 kg±0.1 kg, 由中国人民解放军第二军医大学实验动物中心提供, 清洁级动物实验室条件下饲养.
1.2.1 分组方法: 56只家兔按照雌雄配对的原则随机分为静脉组(n = 8): 股静脉注入5-FU(60 mg/kg), 同时腹腔内注入100 mL 37 ℃生理盐水; 腹腔组(n = 20): 腹腔内注入5-氟尿嘧啶(5-fluorouracil, 5-FU)(60 mg/kg)+100 mL 37 ℃生理盐水; 缓释组(n = 28): 腹腔内注入5-FU缓释剂5-FU(60 mg/kg)+100 mL 37 ℃生理盐水. 5-FU: 上海海普制药厂; 5-FU缓释剂(sustained released fluorouracil): 芜湖中人药业有限责任公司.
1.2.2 标本采集: 分别于给药后15、30 min、1、2、4、24 h、2、4、8、12和16 d取门静脉血3 mL, 并对腹腔组和缓释组取肝、胃、结肠、肾、肺各3 g.
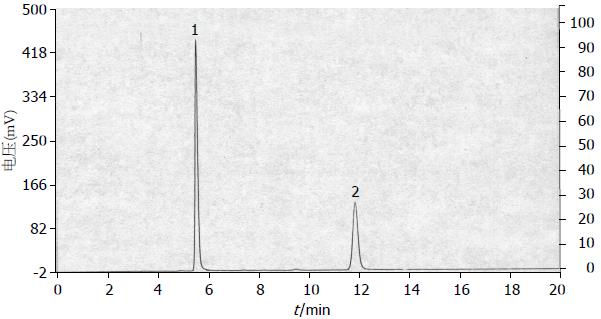
1.2.3 检测方法: 采用高效液相色谱法测定样本中5-FU浓度, 条件如下: 流动相: 甲醇-水(5:95), 比例可根据需要进行微调, 微调范围4:96-7:93(甲醇-水), 流动相流速: 0.8-1.0 mL/min. 检测器: 紫外分光光度计, 测定波长: 266 nm. 经色谱适用性试验研究, 5-FU出峰时间(tR5-FU)约6 min附近, 5-Bru出峰时间(tR5-Bru)约12 min附近. 仪器的基线噪声为RN = 0.05 mV, 按3 RN计算的血浆及腹腔液5-FU最小检出浓度为0.02 μg/mL, 定量限为0.06 μg/mL. 组织样的5-FU最小检出浓度为0.03 μg/g, 定量限为0.06 μg/g.
5-FU色谱质量血浆和组织中5-FU色谱图均显示5-FU峰和内标物峰均能达到良好分离(图1).
静脉组、腹腔组和缓释组达峰时间依次推迟, 静脉组在给药即刻达到血药浓度峰值, 并随时间推移逐渐衰减, 腹腔组在给药后15 min达到血药浓度峰值, 缓释组在给药后2 h达到血药浓度峰值; 3组药物浓度持续时间依次延长, 静脉组仅能维持至给药后4 h, 腹腔组可延长至24 h, 缓释组在给药后16 d仍可测到少量5-FU(图2). 根据以上数据绘制门静脉血药浓度-时间曲线, 静脉组、腹腔组和缓释组依次增加, 分别为21.57 μg/(mL•h)、42.85 μg/(mL•h)和70.08 μg/(mL•h).
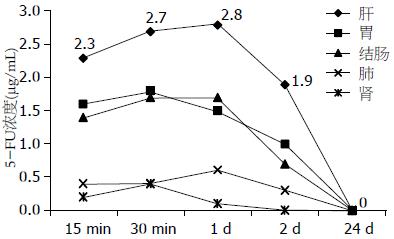
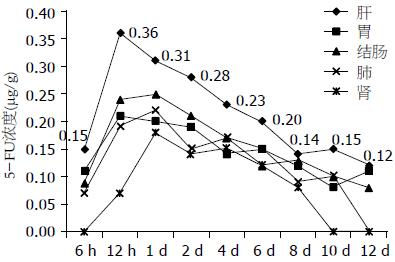
除了静脉组外, 腹腔组和缓释组均对肝、胃、结肠、肾、肺进行组织药物浓度测定. 从组织角度来看, 两组均以肝组织中的药物浓度最高, 其次是胃和结肠, 以肺和肾中的药物浓度最低; 从时间角度来看, 缓释组较腹腔组药物浓度消除显著减缓, 甚至在给药后12 d仍可测得(图3, 4).
消化系肿瘤晚期常见肝脏转移, 对于部分丧失手术机会的患者而言, 化疗是唯一能够改善症状、延长生命的治疗方法[2], 尤其是提高肝脏内化疗药物浓度, 对于抑制肿瘤细胞生长繁殖, 具有预防和治疗的双重意义[3]; 门静脉是肝脏最主要的血运管道, 门静脉药物浓度越高, 药物维持有效浓度时间越长, 对肝脏转移灶的预防和治疗效果越好[4]. 本实验通过对3组实验动物门静脉血中药物浓度的测定, 旨在比较不同化疗方式对肝脏转移灶的治疗作用.
大剂量腹腔化疗方法治疗中晚期消化系恶性肿瘤已经成为国内外共识, 某些抗肿瘤药物经腹腔直接注入可显著提高腹腔药物浓度, 腹腔内药物的代谢主要是通过门静脉循环入肝, 也有部分通腹膜吸收, 因此作为腹腔液体主要回流血管, 腹腔给药时门静脉的血药浓度也较静脉给药大幅增加, 有助于控制肝脏肿瘤细胞增殖[5,6]; 有学者分别采用大剂量5-FU对家兔进行腹腔化疗、静脉化疗和口服化疗, 发现腹腔化疗的腹腔液5-FU浓度最高, 其次是门静脉, 分别达到了股静脉的206倍和6.7倍, 而静脉化疗组的门静脉血药浓度和股静脉十分接近, 腹腔液的血药浓度还要低于门静脉和股静脉的血药浓度[7]. 而也有学者发现腹腔内接种结肠癌细胞的裸鼠在经过腹腔化疗后, 致瘤率较静脉化疗显著降低, 且裸鼠存活时间也更长[8], 这些均证实了腹腔内化疗的优越性. Archer等[9]进一步对比了不同给药方式对大鼠门静脉和腹腔结肠癌种植的治疗效果, 结果显示, 静脉给药和腹腔给药对于肝脏肿瘤的抑制作用接近, 但后者对腹腔内转移的抑制作用更显著. 不仅是5-FU, 其他部分化疗药物也具有类似特点, 如奥沙利铂, 腹腔给药时其腹腔液曲线下面积(area under the concentration-time curve, AUC)是血浆AUC的15倍[10], 腹膜的药物峰值浓度是血浆的25倍[11]; 此外, Hofstra等[12]还证实, 拓朴替康腹腔化疗的平均腹腔液AUC是血浆的54倍±34倍, 此外还包括伊利替康等, 均有实验显示腹腔给药能够使药物在肝脏和腹腔内保持较长时间; 与静脉给药相比更有利于控制腹膜转移和肝脏转移[13].
我们在本实验中观察到静脉组动物给药后门静脉血中5-FU浓度最高, 但持续时间较短,给药4 h后门静脉血中已经无法检测到5-FU; 腹腔组动物给药后15 min门静脉中5-FU达20.67 μg/mL, 但浓度下降十分迅速, 在给药4 h后已降至1.27 μg/mL, 24 h后降至0.09 μg/mL, 与以往研究结果相近. 有研究显示, 大剂量5-FU(100 mg/kg)腹腔化疗后腹腔内5-FU的半衰期约为3.8 h[4]. 虽然腹腔化疗已经比静脉化疗延长了门静脉血药物持续时间, 并增大了药物浓度时间曲线中的AUC, 但其维持时间仍不足24 h. 同时我们还发现缓释组动物约在给药后2 h门静脉血药浓度最高, 且持续时间较长, 其最大的优势在于随时间延长门静脉血药浓度变化较小, 在给药后16 d仍可测出, 并且药物浓度-时间曲线中的AUC更大, 提示腹腔缓释化疗更加有利于延长化疗药物对肝脏组织作用的时间, 进而提高其对消化系肿瘤肝脏转移的治疗效果. 而对肝脏组织的药物浓度测定也得出了相似的结果, 腹腔组动物组织内药物仅能维持24 h, 而缓释组各组织中药物浓度维持时间均均较长, 其中肝在给药后12 d仍可测出5-FU. 梁寒等[14]用活性炭吸附丝裂霉素行裸鼠模型的腹腔内缓释化疗, 其结果表明腹腔液、大网膜和腹腔淋巴结等均可达到较高的药物浓度, 并可维持24 h以上, 其浓度比静脉化疗组和常规腹腔注射丝裂霉素组均高, 且差异均有统计学意义.
化疗药物疗效除与肿瘤细胞对药物的敏感性有关外, 还取决于作用于靶组织的化疗药物浓度(C)以及药物与肿瘤细胞的作用持续时间(T)等[15]. 多数化疗药物在一定范围内呈浓度依赖性和时间依赖性, 即局部组织药物浓度越高, 药物与肿瘤相互作用时间的越长, 则肿瘤杀灭效果越好. 5-FU也是一种时间依赖性抗化疗药, 通过比较AUC面积, 即门静脉5-FU的C×T值, 可以发现缓释组对肿瘤杀灭的作用优于腹腔组, 而腹腔组的疗效又优于静脉组, 提示5-FU腹腔内缓释化疗方案与腹腔化疗相比, 对预防恶性肿瘤的肝脏转移有更好的疗效.
本实验证实了腹腔内缓释化疗较腹腔化疗具有增加靶组织药物浓度和作用时间的双重优势, 同时还能够延长门静脉血中药物的维持时间, 增强对肝脏的化疗效果, 进一步放大了腹腔内化疗的优势, 由于其血药浓度缓慢升高且始终处于较低水平因此也可减少全身不良反应, 为临床上腹腔内肿瘤转移的患者提供更为合理的治疗方式. 同时, 考虑临床实际情况, 术中可将该药物在剥离创面和可能的肿瘤残余部位选择性应用, 更有助于提高对腹腔内残留肿瘤治疗的针对性.
腹腔内化疗最早应用于控制卵巢癌患者腹水, 因其较静脉给药能够显著提高腹腔药物浓度, 现已广泛应用于多种腹腔内肿瘤或转移灶的治疗, 但此种给药方式往往造成血药浓度迅速达到峰值而后快速衰减, 不良反应较大且不利于持续杀灭肿瘤, 本文利用缓释剂使药物缓慢释放, 观察血药浓度的达峰和衰减情况.
刘克辛, 教授, 大连医科大学临床药理学教研室; 俞继卫, 副主任医师, 上海交通大学医学院附属第三人民医院普外一科(胃肠外科)
为了提高化疗药物治疗消化系肿瘤肝转移的效果, 大量研究从给药方式、药物配伍等方面给出了建议, 但如何在不降低疗效的前提下减少化疗药物的剂量, 从而减轻化疗药物的不良反应一直是亟待解决的问题.
消化系肿瘤肝转移可以选择采用5-FU腹腔注射缓释制剂的办法, 有利于减少血药浓度波动, 长期维持有效药物浓度.
缓释剂: 能够使药物缓慢释放入血, 延长药物作用时间的制剂, 通常是采用胶囊包裹的方式.
本文设计合理, 结果可靠, 结论可信, 对临床工作者有很好的参考价值.
编辑: 田滢 电编:闫晋利
| 1. | Gaillard S, Armstrong D. Intraperitoneal chemotherapy for advanced epithelial ovarian cancer: many questions, much promise. Oncology (Williston Park). 2011;25:176, 178, 180. [PubMed] |
| 2. | Rammohan A, Sathyanesan J, Rajendran K, Pitchaimuthu A, Perumal SK, Srinivasan U, Ramasamy R, Palaniappan R, Govindan M. A gist of gastrointestinal stromal tumors: A review. World J Gastrointest Oncol. 2013;5:102-112. [PubMed] [DOI] |
| 3. | Haraldsdottir S, Wu C, Bloomston M, Goldberg RM. What is the optimal neo-adjuvant treatment for liver metastasis? Ther Adv Med Oncol. 2013;5:221-234. [PubMed] [DOI] |
| 4. | Yu DS, Li Y, Huang XE, Lu YY, Wu XY, Liu J, Cao J, Xu X, Xiang J, Wang GP. Effect of portal vein chemotherapy on liver metastasis after surgical resection of colorectal cancer. Asian Pac J Cancer Prev. 2012;13:4699-4701. [PubMed] [DOI] |
| 5. | Speyer JL. The rationale behind intraperitoneal chemotherapy in gastrointestinal malignancies. Semin Oncol. 1985;12:23-28. [PubMed] |
| 6. | Gyves J. Pharmacology of intraperitoneal infusion 5-fluorouracil and mitomycin-C. Semin Oncol. 1985;12:29-32. [PubMed] |
| 9. | Archer S, Gray B. Intraperitoneal 5-fluorouracil infusion for treatment of both peritoneal and liver micrometastases. Surgery. 1990;108:502-507. [PubMed] |
| 10. | Pestieau SR, Belliveau JF, Griffin H, Stuart OA, Sugarbaker PH. Pharmacokinetics of intraperitoneal oxaliplatin: experimental studies. J Surg Oncol. 2001;76:106-114. [PubMed] [DOI] |
| 11. | Elias D, Bonnay M, Puizillou JM, Antoun S, Demirdjian S, El OA, Pignon JP, Drouard-Troalen L, Ouellet JF, Ducreux M. Heated intra-operative intraperitoneal oxaliplatin after complete resection of peritoneal carcinomatosis: pharmacokinetics and tissue distribution. Ann Oncol. 2002;13:267-272. [PubMed] [DOI] |
| 12. | Hofstra LS, Bos AM, de Vries EG, van der Zee AG, Beijnen JH, Rosing H, Mulder NH, Aalders JG, Willemse PH. A phase I and pharmacokinetic study of intraperitoneal topotecan. Br J Cancer. 2001;85:1627-1633. [PubMed] [DOI] |
| 13. | Maruyama M, Nagahama T, Ebuchi M, Yuasa Y. [Experimental study on intraperitoneal versus intravenous CPT-11 for peritoneal seeding and liver metastasis]. Gan To Kagaku Ryoho. 2000;27:1855-1857. [PubMed] |
| 15. | Clive Page. Principles of cell proliferation and chemotherapy. Intergrated Pharmacology. London: Mosby, UK 2002; 167. |