修回日期: 2013-06-26
接受日期: 2013-07-03
在线出版日期: 2013-07-28
目的: 探讨脂多糖(lipopolysacoharides, LPS)对胆管癌细胞上皮间质转化(epithelial-mesenchymal transition, EMT)的影响和可能机制.
方法: 将胆管癌ICBD细胞分为4组: 正常对照组、LPS诱导实验组(终浓度10 μg/mL)、LPS+siRNA转染组和LPS+SB-203580诱导实验组. 应用Real-time RT-PCR与Western blot法检测上皮细胞表面标志E-钙黏蛋白(E-cadherin)和间质细胞表面标志波形蛋白(Vimentin)的表达变化以及Toll样受体4(Toll-like receptors 4, TLR4)和p38的表达变化.
结果: LPS促进胆管癌细胞系ICBD的EMT发生; ICBD细胞的EMT过程伴随TLR4、p38表达增加; 应用siRNA阻断TLR4后, ICBD细胞的EMT消失, LPS导致p38的上调表达作用也消失; 应用SB-203580阻断p38后, 与正常对照组相比, TLR4的表达增加, 与LPS诱导实验组相比无明显变化, 但ICBD细胞的EMT消失.
结论: LPS可以激活TLR4, 并通过p38/MAPK促进胆管癌细胞ICBD的上皮间质转化.
核心提示: 本研究证实脂多糖(lipopolysacoharides)能够通过TLR4/p38/MAPK信号通路调控胆管癌细胞上皮间质转化(epithelial-mesenchymal transition, EMT)的发生, 这对胆管癌侵袭和转移机制的研究及治疗具有一定的价值. 如果能够使具有间质特性的细胞恢复上皮细胞特性, 就有可能逆转EMT, 阻止癌细胞的侵袭和转移, 这为临床上胆管癌的治疗提供了新的思路.
引文著录: 李航宇, 李岩, 刘丹, 孙宏治, 刘金钢. LPS通过p38/MAPK调控胆管癌细胞系ICBD的上皮间质转化. 世界华人消化杂志 2013; 21(21): 2070-2075
Revised: June 26, 2013
Accepted: July 3, 2013
Published online: July 28, 2013
AIM: To investigate the effect of LPS on epithelial-mesenchymal transition (EMT) of cholangiocarcinoma ICBD cells and to explore the possible mechanisms involved.
METHODS: ICBD cells were randomly divided into four groups: a control group, a LPS (final concentration, 10 μg/mL) group, a LPS + siRNA group, and a LPS + SB203580 group. The expression of epithelial cell surface marker E-Cadherin, stromal cell surface marker Vimentin, TLR4 and p38 was examined by real-time RT-PCR and Western blot.
RESULTS: LPS promoted the initiation of EMT of ICBD cells. The expression of TLR4 and p38 significantly increased in the process of EMT of ICBD cells. SiRNA-mediated blockage of TLR4 inhibited the occurrence of EMT and the up-regulation of p38 in ICBD cells. When p38 was blocked by SB-203580, the expression of TLR4 was still up-regulated, but EMT of ICBD cells did not occur compared to the control group.
CONCLUSION: LPS may activate TLR4 and promote EMT of cholangiocarcinoma cells via the p38/MAPK signaling pathway.
- Citation: Li HY, Li Y, Liu D, Sun HZ, Liu JG. LPS regulates epithelial-mesenchymal transition in cholangiocarcinoma cell line ICBD via the p38/MAPK signaling pathway. Shijie Huaren Xiaohua Zazhi 2013; 21(21): 2070-2075
- URL: https://www.wjgnet.com/1009-3079/full/v21/i21/2070.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i21.2070
上皮间质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞失去极性和上皮表型, 通过特定程序转化为间质细胞的生物学过程[1]. EMT的主要分子特征是: 上皮细胞标记物(如细胞角蛋白, cytokeratin; E-钙黏蛋白, E-cadherin)表达下调, 间质表型标志物[如α-平滑肌肌动蛋白( α-smooth muscle actin, α-SMA)]; 波形蛋白(Vimentin)表达上调, 从而获得迁移与侵袭的能力, 这一过程与恶性肿瘤的浸润转移密切相关[2]. 近年来研究发现在胆管癌中也存在EMT现象[3], 但目前关于胆管癌中EMT发生的机制尚不明确.
Toll样受体家族(Toll-like receptors, TLRs)是最重要的模式识别受体之一, 通过识别病原微生物的病原相关分子模式(pathogen-associated molecular patterns, PAMPs)介导免疫反应, 另外, TLRs还能够识别某些内源性配体, 这些配体称之为损伤相关分子模型(damage-associated molecular patterns, DAMPs)[4]. 在肿瘤的侵袭和转移过程中, 有大量的DAMPs和PAMPs释放. 越来越多的证据表明, TLRs通过识别肿瘤组织中的DAMPs和PAMPs参与多种肿瘤的发生和发展[5]. 在肿瘤微环境中, 脂多糖(lipopolysacoharides, LPS)作为一种PAMPs发挥作用, 最初研究认为是被免疫细胞表面的TLRs识别, 近年来发现肿瘤细胞表面的TLRs也能够识别LPS, 调控肿瘤的生物学行为. 但在胆管癌中LPS如何调控胆管癌的发生发展尚不清楚.
LPS是革兰氏阴性杆菌外膜的重要组成部分, 作为TLR4的重要配体参与信号的跨膜转导. LPS激活TLRs信号转导通路, 活化下游的多种效应蛋白, 进而激活多种信号通路, 包括MAPK通路、PI3K通路等[6,7]. p38是丝裂素活化蛋白激酶(mitogen activated protein kinases, MAPK)家族的成员之一, 他能感受外界刺激信号, 并将转导至细胞及其核内, 引起细胞的增殖、分化、侵袭和凋亡等细胞生物学反应[8]. 我们的前期实验已证实在胆管癌中TLR4表达水平明显高于癌旁组织, 那么LPS能否通过激活TLR4, 活化p38/MAPK通路, 进而介导胆管癌细胞EMT的发生有待于进一步研究. 本研究应用LPS对胆管癌细胞ICBD进行体外干预, 探讨其对胆管癌EMT发生的影响及其机制, 并为临床胆管癌的治疗寻找新的靶点.
人胆管癌细胞系ICBD购自上海艾研生物科技有限公司, LPS购自Sigma公司, p38与p-p38抗体购自Santa Cruz公司(Santa Cruz, CA, USA), E-cadherin、Vimentin抗体购自Abcam公司, HRP标记的羊抗鼠IgG和HRP标记的羊抗兔IgG购自武汉博士德生物有限公司, RNA提取试剂盒购自大连宝生物工程有限公司, RNA PCR Kit购自Promega公司, p38抑制剂SB-203580购自Sigma公司, siRNA由Sigma公司提供.
1.2.1 细胞培养: 人胆管癌细胞系ICBD于10%胎牛血清DMEM培养液中, 37 ℃, 5%CO2培养, 2-3 d用0.25%胰酶消化传代. 取对数生长期的细胞进行试验.
1.2.2 实验分组: ICBD细胞培养方式同前. 细胞分成4组: 正常对照组、LPS诱导实验组(终浓度10 μg/mL)、LPS+siRNA转染组和LPS+SB-203580诱导实验组.
1.2.3 Western blot检测E-cadherin、Vimentin、TLR4、p38、p-p38蛋白的表达: 按分子克隆方法提取细胞总蛋白, 经Bradford法测定蛋白浓度; 各组取60-100 g总蛋白进行10%SDS-聚丙烯酰胺凝胶电泳, 电泳后转膜, 5%脱脂奶粉于室温封闭1 h, 加入相应一抗, 4 ℃孵育过夜, 辣根过氧化物酶二抗(1:3000)于室温孵育2 h, ECL显色后以GAPDH为内参照, 用Image J图像分析软件进行灰度分析.
1.2.4 Real-time RT-PCR检测E-cadherin、Vimentin、TLR4、p38 mRNA的表达: LPS刺激24 h后, 分别收集各组细胞, 提取总RNA, 测定A260/280为1.75-1.95. 取2 μg RNA, 应用逆转录试剂盒按20 μL逆转录体系合成cDNA. PCR引物由应用软件Prima5.0设计(表1), 由北京鼎国合成. 荧光定量PCR反应体系为25 μL, 内含500 ng cDNA模板, 终浓度为250 nmol/L的上下游引物及SYBR Green Real-time PCR Master Mix 12.5 μL. 反应条件为95 ℃ 60 s; 95 ℃ 15 s; 退火15 s; 72 ℃ 45 s, 荧光收集, 40个循环. 每个样本重复3次. 以相对Ct值(即2-∆∆Ct)表示目的基因的相对表达量, 以空白细胞为对照.
| 引物名称 | 扩增片段(bp) | |
| E-cadherin | F: 5'-CCGCCATCGCTTACA-3' | 262 |
| R: 5'-GGCACCTGACCCTTGTA-3' | ||
| Vimentin | F: 5'-ACAGGCTTTAGCGAGTTATT-3' | 296 |
| R: 5'-AAGAGGCGAACGAGGG-3' | ||
| Toll样受体4 | F: 5'-AGCTCTGCCTTCACTAC-3 | 191 |
| R: 5'-GATGATACCAGCACGAC-3' | ||
| p38 | F: 5'-GCTGAAGATTCTGGATTTTG-3' | 173 |
| R: 5'-GTTCTTCCAGTCAACAGCTC-3' | ||
| GAPDH | F: 5'-GGATTTGGTCGTATTGGG-3' | 312 |
| R: 5'-TCGCTCCTGGAAGATGG-3' |
统计学处理 采用SPSS13.0统计软件, 对上述检测结果进行t检验和方差分析, 检验水准P<0.05为差异有统计学意义.
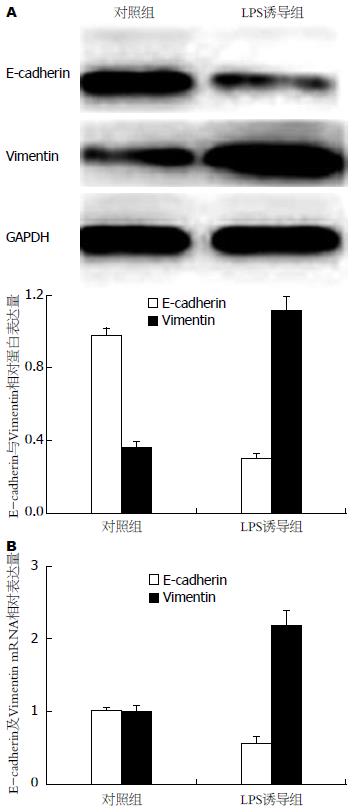
Western blot结果显示, 与对照组细胞相比, 经过LPS诱导的胆管癌细胞ICBD中上皮细胞标志物E-cadherin蛋白的表达显著降低, 而间皮细胞的标志物Vimentin蛋白的表达显著升高(图1A). Real-time RT-PCR结果显示: LPS诱导实验组E-cadherin mRNA的表达显著降低, 而间皮细胞的标志物Vimentin mRNA的表达显著升高(图1B). 以上结果提示: 经过LPS处理后, ICBD细胞中上皮细胞标志物表达逐渐消失, 而间质细胞标志物表达逐渐增加, LPS可以促进ICBD细胞EMT的发生.
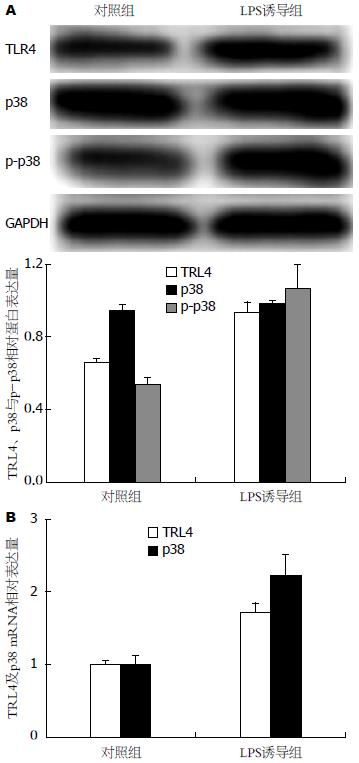
Western blot结果显示(图2A), 与对照组细胞相比, LPS诱导发生EMT的ICBD细胞中TLR4与p-p38蛋白表达显著增加(P<0.05), p38总蛋白的表达无明显变化(P>0.05). Real-time PCR结果显示(图2B), TLR4、p38 mRNA水平的表达情况与蛋白水平一致(P<0.05).
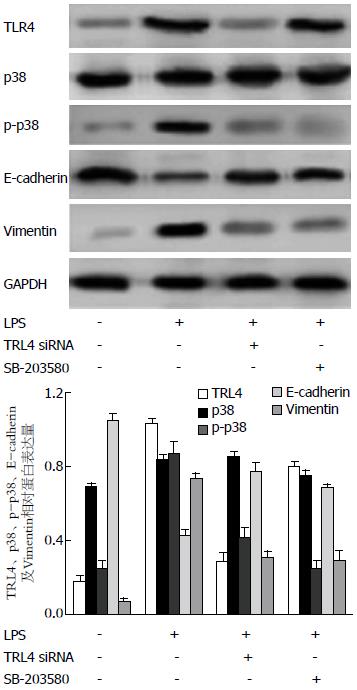
如图3所示, 应用siRNA阻断TLR4后, LPS刺激ICBD细胞, 与对照组相比, E-cadherin、Vimentin以及p-p38的表达无明显变化, 说明没有发生EMT. 经过SB-203580预处理后的ICBD细胞, 与对照组相比, 在LPS的作用下TLR4的表达仍上调, 但E-cadherin和Vimentin的表达无明显变化, 也没有发生EMT. 此结果说明, LPS促进ICBD细胞EMT是通过TLR4和p38来实现的, 而且p38位于TLR4的下游, 可以通过阻断TLR4抑制LPS对p38表达的影响.
EMT是指某些生理或者病理刺激下上皮细胞失去其上皮特征, 获得间质特性的过程, 如组织修复, 伤口愈合和器官发育等生理过程[9,10], 而病理刺激包括组织纤维化以及肿瘤发生发展的过程, 是导致肿瘤发生侵袭转移的重要机制之一[11,12]. 肿瘤细胞发生EMT后, 最重要的标志性变化是上皮细胞标志物E-cadherin的缺失, 这也是上皮肿瘤细胞侵袭的前提条件, 同时也伴有间质细胞表型Vimentin表达的上调[13], 因此可以通过检测这两类细胞表面的特异性标志物来鉴定EMT的发生.
胆管癌的发生发展过程极其复杂, 一般认为对胆道的长期炎症刺激导致胆管壁慢性增生性炎症, 继而引起胆管黏膜上皮的不典型增生, 这种不典型增生是胆管癌的癌前病变, 所以胆管癌多伴有胆道感染, 胆道感染与其解剖学位置有关, 细菌经胆胰壶腹逆行进入胆道, 主要以革兰阴性菌感染为主. LPS即革兰阴性菌内毒素(endotoxin), 是革兰阴性细菌的细胞壁组成成分, 具有广泛的生物学活性. 那么, 在胆管癌细胞的微环境中存在LPS, 并可能对胆管癌的发生发展起重要作用. 我们的实验发现, 在LPS的刺激下胆管癌细胞ICBD上皮细胞标志E-cadherin消失, 间质细胞标志Vimentin的表达上调, 使其获得间质化表型, 也就说胆管癌细胞ICBD在LPS的诱导下发生EMT.
LPS是通过何种方式调控胆管癌细胞EMT发生的呢?以往的研究发现, p38/MAPK通路能够调控多种肿瘤的EMT发生[14]. MAPK是细胞内重要的信号转导通路之一, 其信号转导异常可导致恶性肿瘤快速增殖、无限生长, 并参与调控肿瘤细胞的基因表达、分化、凋亡、侵袭和转移等生物学效应[15]. p38是MAPK家族成员之一, 研究发现, 在肿瘤细胞中细胞外多种应激如低氧、一些促炎细胞因子(如肿瘤坏死因子-α、白介素-6)、脂多糖和革兰氏阳性菌的细胞壁成分等均可激活p38/MAPK通路[16,17]. TLRs属于Ⅰ型跨膜受体, 他能够感受肿瘤微环境的改变, 将信号转导至细胞内, 启动一系列免疫反应, 进而促进肿瘤的增殖、侵袭等. LPS作为TLR4的一种主要配体, 能够激活TLR4信号转导通路, 导致下游的多种效应蛋白表达上调, 进而活化MAPK通路, 调控肿瘤的发生发展. 我们通过Western blot与Real-time RT-PCR法证实, 在LPS诱导ICBD细胞EMT的同时, TLR4、p38的表达明显上调, 说明TLR4、p38可能参与了LPS诱导胆管癌ICBD细胞 EMT的过程. 进一步的阻断实验发现, 阻断TLR4, EMT消失, p38的表达上调消失, 说明LPS是通过TLR4调控胆管癌细胞的EMT; 阻断p38, EMT消失, 与对照组相比, TLR4的表达仍增加, 说明LPS通过TLR4和p38调控胆管癌的EMT, 而且p38位于TLR4的下游. 该结果提示LPS诱导胆管癌细胞EMT改变是通过TLR4/p38/MAPK发挥作用.
总之, 我们的实验证实了LPS能够诱导胆管癌细胞EMT的发生, 这一过程是通TLR4/p38/MAPK信号通路调控, 这对胆管癌侵袭和转移机制的研究及治疗具有一定的价值. 如果能够使具有间质特性的细胞恢复上皮细胞特性, 就有可能逆转EMT, 阻止细胞的侵袭和转移, 这为临床上胆管癌的治疗提供了新的思路.
在我国, 胆管癌是死亡率很高的恶性肿瘤之一, 导致患者预后差、死亡率高的重要原因是肿瘤的侵袭转移. 上皮间质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞失去极性和上皮表型, 通过特定程序转化为间质细胞的生物学过程, 与恶性肿瘤的浸润转移密切相关. 因此研究胆管癌的EMT过程对于改善预后、降低患者死亡率至关重要, 并为临床胆管癌的治疗寻找新靶点.
宋振顺, 教授, 西京医院肝胆外科; 康春博, 副主任医师, 北京大学航天临床医院普通外科
胆管癌的侵袭转移机制非常复杂, EMT对胆管癌侵袭转移的机制日益引起人们的关注, 对于胆管癌EMT过程的调控是目前研究的热点问题.
EMT与恶性肿瘤的浸润转移密切相关, 以往的研究发现在多种肿瘤组织存在EMT现象. Antoon等最新研究发现p38/MAPK通路能够调控多种肿瘤的EMT过程.
本研究应用脂多糖(lipopolysacoharides, LPS)对胆管癌细胞ICBD进行体外干预, 探讨LPS对胆管癌细胞上皮间质转化的影响和可能机制, 旨在为将来组织水平研究胆管癌的浸润转移机制提供理论基础, 并为胆管癌的治疗打开一个新的思路. 截至目前, 有关EMT在胆管癌浸润转移中的研究鲜见报道.
本研究结果表明LPS促进胆管癌细胞系ICBD的EMT发生; LPS激活TLR4, 通过p38/MAPK促进胆管癌细胞ICBD的EMT过程. 这对胆管癌浸润转移机制的阐明和治疗提供理论基础.
本课题设计合理, 研究过程严谨, 数据分析方法正确, 立题新颖, 具有一定的科研价值, 为胆管癌的临床治疗提供了一个新的思路.
编辑: 田滢 电编:鲁亚静
| 1. | Gheldof A, Berx G. Cadherins and epithelial-to-mesenchymal transition. Prog Mol Biol Transl Sci. 2013;116:317-336. [PubMed] [DOI] |
| 2. | Thiery JP. Epithelial-mesenchymal transitions in development and pathologies. Curr Opin Cell Biol. 2003;15:740-746. [PubMed] [DOI] |
| 3. | Araki K, Shimura T, Suzuki H, Tsutsumi S, Wada W, Yajima T, Kobayahi T, Kubo N, Kuwano H. E/N-cadherin switch mediates cancer progression via TGF-β-induced epithelial-to-mesenchymal transition in extrahepatic cholangiocarcinoma. Br J Cancer. 2011;105:1885-1893. [PubMed] [DOI] |
| 4. | Takeda K, Akira S. Toll-like receptors in innate immunity. Int Immunol. 2005;17:1-14. [PubMed] [DOI] |
| 5. | Rakoff-Nahoum S, Medzhitov R. Toll-like receptors and cancer. Nat Rev Cancer. 2009;9:57-63. [PubMed] [DOI] |
| 6. | Sato Y, Goto Y, Narita N, Hoon DS. Cancer Cells Expressing Toll-like Receptors and the Tumor Microenvironment. Cancer Microenviron. 2009;2 Suppl 1:205-214. [PubMed] [DOI] |
| 7. | Krishnan J, Selvarajoo K, Tsuchiya M, Lee G, Choi S. Toll-like receptor signal transduction. Exp Mol Med. 2007;39:421-438. [PubMed] [DOI] |
| 9. | Klymkowsky MW, Savagner P. Epithelial-mesenchymal transition: a cancer researcher's conceptual friend and foe. Am J Pathol. 2009;174:1588-1593. [PubMed] [DOI] |
| 10. | 张 志发, 秦 仁义, 朱 峰, 王 敏, 李 旭, 石 程剑. TGF-β1诱导的上皮间质转化对人胆囊癌细胞系GBC-SD中侧群细胞表达的影响. 世界华人消化杂志. 2011;19:1680-1685. [DOI] |
| 11. | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition. J Clin Invest. 2009;119:1420-1428. [PubMed] [DOI] |
| 12. | Thiery JP, Acloque H, Huang RY, Nieto MA. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139:871-890. [PubMed] [DOI] |
| 13. | Zeisberg M, Neilson EG. Biomarkers for epithelial-mesenchymal transitions. J Clin Invest. 2009;119:1429-1437. [PubMed] [DOI] |
| 14. | Antoon JW, Nitzchke AM, Martin EC, Rhodes LV, Nam S, Wadsworth S, Salvo VA, Elliott S, Collins-Burow B, Nephew KP. Inhibition of p38 mitogen-activated protein kinase alters microRNA expression and reverses epithelial-to-mesenchymal transition. Int J Oncol. 2013;42:1139-1150. [PubMed] [DOI] |
| 15. | Lawrence MC, Jivan A, Shao C, Duan L, Goad D, Zaganjor E, Osborne J, McGlynn K, Stippec S, Earnest S. The roles of MAPKs in disease. Cell Res. 2008;18:436-442. [PubMed] [DOI] |
| 16. | Kiemer AK, Weber NC, Fürst R, Bildner N, Kulhanek-Heinze S, Vollmar AM. Inhibition of p38 MAPK activation via induction of MKP-1: atrial natriuretic peptide reduces TNF-alpha-induced actin polymerization and endothelial permeability. Circ Res. 2002;90:874-881. [PubMed] [DOI] |
| 17. | Jiang Y, Gram H, Zhao M, New L, Gu J, Feng L, Di Padova F, Ulevitch RJ, Han J. Characterization of the structure and function of the fourth member of p38 group mitogen-activated protein kinases, p38delta. J Biol Chem. 1997;272:30122-30128. [PubMed] [DOI] |