修回日期: 2013-06-02
接受日期: 2013-06-05
在线出版日期: 2013-07-18
目的: 构建人FOXQ1(homo sapiens forkhead box Q1)基因真核表达载体pAcGFP1-N1-FOXQ1, 并在大肠癌细胞系Colo-320中瞬时表达.
方法: 利用PCR方法从YR Gene装载了FOXQ1基因全长cDNA序列(NM_033260)的质粒中扩增出FOXQ1的cDNA片段, 与真核表达载体pAcGFP1-N1连接, 重组质粒经PCR、双酶切和测序鉴定无误后, 采用Lipofectamine 2000瞬时转染Colo-320细胞, 应用荧光显微镜观察转染效率、Western blot检测FOXQ1蛋白表达水平.
结果: 成功构建了真核表达载体pAcGFP1-N1-FOXQ1, PCR、双酶切和测序鉴定结果均正确, 载体能在Colo-320细胞中正确表达FOXQ1蛋白.
结论: 成功构建FOXQ1真核表达载体, 为进一步开展体内、体外实验, 研究FOXQ1基因在肿瘤发生发展中的功能奠定了实验基础.
核心提示: 研究FOXQ1(homo sapiens forkhead box Q1)基因在大肠癌肿瘤生成中的功能及其分子机制, 有望发现FOXQ1基因参与的与大肠癌发生发展密切相关的信号通路及其下游靶分子, 为寻找新的大肠癌治疗靶点奠定基础.
引文著录: 岳柯琳, 唐慧, 郭强. pAcGFP1-N1-FOXQ1真核表达载体的构建及在大肠癌细胞系Colo-320中的表达. 世界华人消化杂志 2013; 21(20): 1966-1971
Revised: June 2, 2013
Accepted: June 5, 2013
Published online: July 18, 2013
AIM: To construct a eukaryotic expression vector expressing FOXQ1 (pAcGFP1-N1-FOXQ1) and investigate its transient expression in colorectal cancer cell line Colo-320.
METHODS: The full-length FOXQ1 cDNA sequence was amplified from the plasmid containing full-length FOXQ1 cDNA (NM_033260) and inserted into eukaryotic expression vector pAcGFP1-N1. The resulting pAcGFP1-N1-FOXQ1 plasmid was identified by PCR, double digestion and DNA sequencing. The constructed plasmid was then transfected into colorectal cancer cell line Colo-320 using Lipofectamine 2000, and transfection efficiency was assessed by fluorescence microscopy. The expression level of FOXQ1 protein was detected by Western blot.
RESULTS: Eukaryotic expression vector pAcGFP1-N1-FOXQ1 was constructed successfully and verified by PCR, double digestion and DNA sequencing. The constructed vector could express mature FOXQ1 protein correctly in colorectal cancer cell line Colo-320.
CONCLUSION: Successful construction of the eukaryotic expression vector pAcGFP1-N1-FOXQ1 provides an experimental basis for further study of functions of the FOXQ1 gene in tumorigenesis.
- Citation: Yue KL, Tang H, Guo Q. Construction of a eukaryotic expression vector expressing FOXQ1 and its expression in colorectal cancer cell line Colo-320. Shijie Huaren Xiaohua Zazhi 2013; 21(20): 1966-1971
- URL: https://www.wjgnet.com/1009-3079/full/v21/i20/1966.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i20.1966
叉头框蛋白(forkhead box, FOX)家族, 是一类进化保守的转录调控因子家族[1], 发挥广泛的生物学效应, 不仅在胚胎发育过程中起关键性的调控作用, 与动物的生长发育、免疫调控等生命过程密切相关[2], 近年来, FOX基因家族在肿瘤发生发展中的重要作用逐渐凸显, 众多FOX家族成员通过其参与的多条信号通路成为肿瘤靶向治疗的直接或间接的作用靶点[3,4]. FOXQ1(homo sapiens forkhead box Q1)基因属于FOXQ亚族成员之一, 在多种组织中广泛表达, 作为一类转录调控因子, 可通过识别并结合相关下游靶基因的近端或远端顺式作用元件, 实现对众多下游靶基因表达水平的正向或负向调控. 为了更好地研究FOXQ1基因在肿瘤发生发展中的作用, 本研究成功构建了pAcGFP1-N1-FOXQ1真核表达载体, 为进一步开展体内、体外实验, 研究其在肿瘤发生发展中的功能奠定了坚实的实验基础.
pAcGFP1-N1真核表达质粒由中国科学院昆明动物研究所馈赠; 大肠癌细胞系Colo-320购自中国科学院细胞库; 装载有FOXQ1基因cDNA全长的质粒购自YR Gene公司; 大肠杆菌(Escherichia coli, E. coli) DH-5α感受态细胞、质粒小提试剂盒及无内毒素质粒大提试剂盒购自北京天根生化科技有限公司; KpnⅠ酶、SacⅠ酶、CIAP酶、T4 DNA连接酶、TaKaRa LA Taq(with GC Buffer)、DNA凝胶回收试剂盒、西班牙琼脂糖(Biowest Agarose)均购自宝生物工程(大连)有限公司; 鼠抗人FOXQ1抗体和兔抗人β-actin抗体均购自Abcam公司; HRP-Goat Anti-Mouse IgG(H+L)与HRP-Goat Anti-Rabbit IgG(H+L)均购自Proteintech公司; 6孔细胞培养板购自BD falcon公司; RPMI 1640培养基购自Hyclone公司; 澳洲特级胎牛血清和青霉素-链霉素溶液购自Bioind公司; 0.05%胰蛋白酶购自Hyclone公司; Lipofectamine 2000购自Invitrogen公司; Tween-20购自Amresco; 疏水性PVDF转印膜购自Millipore公司; 脱脂奶粉购自完达山公司; 细胞蛋白提取液、蛋白酶抑制剂混合物Ⅲ型、SDS-PAGE凝胶配制试剂盒及SDS蛋白上样缓冲液均购自武汉博士德生物有限工程公司; BCA蛋白定量试剂盒购自碧云天生物技术研究所; SuperSignal West Pico HRP化学发光底物购自美国Pierce公司; 预染蛋白Marker购自Thermo公司; 琼脂糖凝胶成像及Western blot凝胶成像所用仪器为Chemidoc XRS化学发光成像系统; PCR扩增所用仪器为ABI 2720 PCR基因扩增仪; 重组真核表达质粒pAcGFP1-N1-FOXQ1 GFP观测所用显微镜为XYS-13三目落射荧光显微镜; 重组真核表达质粒pAcGFP1-N1-FOXQ1测序由北京天根公司完成.
1.2.1 引物设计与合成: 根据FOXQ1基因序列(NM_033260)设计引物: 上游引物: FOXQ1_F: 5'-CCGAGCTCGCCACCATGAAGTTGGAGGTGTTCG-3'; FOXQ1_F2: 5'-CCGAGCTCATGAAGTTGGAGGTGTTCG-3'; 下游引物FOXQ1_R: 5'GCGGTACCGTGGCTAGGAGCGTCTCCAC-3', 引物由上海生物工程有限公司合成, 其中GAGCTC与GGTACC分别为SacⅠ及KpnⅠ的酶切位点, 前面的碱基为保护性序列, ATG为起始密码子, FOXQ1_F上游引物中插入了Kozak序列, 扩增片段全长约1200 bp.
1.2.2 FOXQ1基因的扩增及克隆: 用购自YR Gene公司的FOXQ1 cDNA质粒为模板进行PCR扩增, PCR反应体积为50 μL, 含10×PCR反应Buffer 5.0 μL; dNTP 各2.0 mmol/L; 上下游引物各2.5 μmol/L; Takara LA Taq酶5 U; DNA模板0.5 μL; 其余加水补足. 反应条件为95 ℃预变性5 min, 95℃ 30 s, 66 ℃ 30 s, 72 ℃ 1 min, 20个循环后, 72 ℃延伸7 min. PCR产物和载体pAcGFP1-N1分别经SacⅠ和KpnⅠ双酶切、载体pAcGFP1-N1双酶切产物再经CIAP去磷酸化后, 1.0%琼脂糖凝胶电泳, 分别切胶纯化回收相应DNA片段; 经酶切纯化的PCR产物和pAcGFP1-N1载体用T4DNA连接酶连接后, 转化到E. coli DH5α感受态细菌中, 涂布于LB培养板, 37 ℃孵育过夜, 挑取细菌克隆提质粒.
1.2.3 pAcGFP1-N1-FOXQ1质粒的鉴定: (1)PCR鉴定: 将提取的pAcGFP1-N1-FOXQ1质粒0.5 μL作为模板, PCR反应体积为20 μL, 引物各2.5 μmol/L, Takara LA Taq 0.1 μL, 反应条件为95 ℃预变性5 min, 95 ℃ 30 s, 66 ℃ 30 s, 72 ℃ 1 min, 20个循环后, 72 ℃延伸7 min. PCR反应完毕, 取5 μL进行琼脂糖凝胶电泳检测; (2)双酶切鉴定: 酶切反应体系为20 μL, 含pAcGFP1-N1-FOXQ1质粒4.0 μL, SacⅠ和KpnⅠ各5.0 U和10×L Buffer 2.0 μL, 混匀后于37 ℃水浴过夜, 1.0%琼脂糖凝胶电泳检测.
1.2.4 pAcGFP1-N1-FOXQ1质粒的测序鉴定: 经PCR和双酶切鉴定无误的pAcGFP1-N1-FOXQ1质粒, F/R组及F2/R组各选取5个质粒小提样本, 送至北京天根测序, 两组分别选取一个cDNA序列正确无误的质粒样本进行质粒的大提, 用于后续的细胞转染.
1.2.5 pAcGFP1-N1-FOXQ1质粒转染Colo-320细胞: 以每孔1.6×106个细胞数铺板(六孔板), 用含10%胎牛血清的RPMI 1640培养基(不含双抗)放置于37 ℃、5%CO2培养箱中培养, 24 h后取出, 参照Lipofectamine 2000说明书以DNA: Lipofectamine 2000 = 4 μg: 8 μL比例将重组质粒转染6孔板中的Colo-320细胞, 待转染后6 h弃去转染的上清液, 重新加入含10%胎牛血清的RPMI 1640完全培养基继续培养48 h. 分为: (1)转染pAcGFP1-N1-FOXQ1质粒(F/R组、F2/R组); (2)转染空质粒pAcGFP1-N; (3)未经任何处理的Colo-320细胞3个组.
1.2.6 蛋白的提取: 48 h后, 分别收集以上3组的细胞, 加入蛋白裂解混合液4 ℃震荡孵育30 min后, 1200 r/min离心10 min, 吸取上清液, 按照BCA法蛋白浓度检测试剂盒操作步骤进行蛋白定量后, 加入等体积的上样缓冲液煮沸5 min, -80 ℃保存备用.
1.2.7 蛋白的Western blot检测: 以每孔20 μg的蛋白总量将样品在10%SDS-PAGE上分离后湿转到PVDF膜上, 5%脱脂奶粉封闭1 h后, 分别与β-actin及FOXQ1一抗于4 ℃摇床孵育过夜, 之后分别以辣根过氧化物酶标记的山羊抗鼠IgG-HRP及辣根过氧化物酶标记的山羊抗兔IgG-HRP为二抗, 室温摇床孵育1 h, 经洗液洗脱30 min后, 表面滴加SuperSignal West Pico HRP化学发光底物, 于Chemidoc XRS化学发光成像系统中曝光显影.
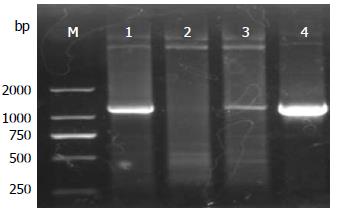
含有FOXQ1基因全长cDNA序列的质粒经PCR扩增, 1.0%琼脂糖凝胶电泳检测见一特异性条带, 相对分子大小为1200 bp(图1), 与预期相符, FOXQ1基因cDNA片段得到特异性扩增.
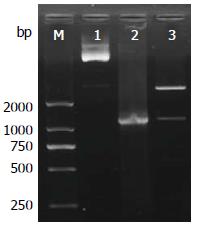
重组真核表达质粒pAcGFP1-N1-FOXQ1经PCR扩增可见一单一条带, 大小约为1200 bp; 经SacⅠ和KpnⅠ双酶切可得到大约为2900和1200 bp的两条带, 均与预期相符(图2).
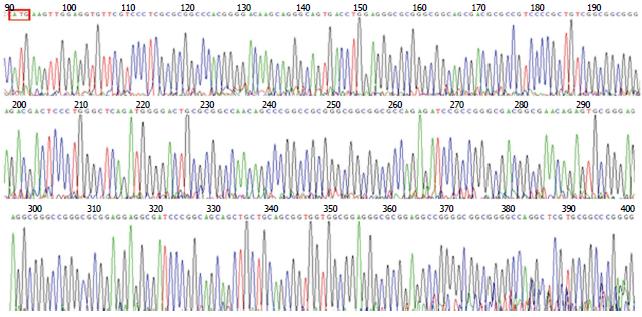
测序所用引物为pMV-F和PR, 均为pAcGFP1-N1质粒通用引物, 运用Seqman软件将测序结果与FOXQ1基因标准序列(NM_033260)进行比对, 结果显示构建的真核表达质粒pAcGFP1-N1-FOXQ1所携带的FOXQ1基因序列与标准序列完全相符. 部分测序图谱(图3).
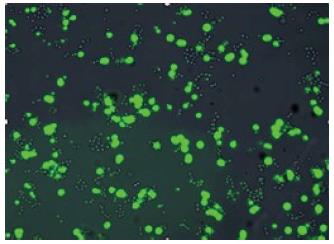
修改重组真核表达质粒pAcGFP1-N1-FOXQ1经Lipofectamine 2000转染Colo-320细胞24 h后在荧光显微镜下观察报告基因GFP的表达情况, Colo-320细胞经重组质粒转染后, 细胞内报告基因绿色荧光蛋白的表达清晰且强度高, 转染效率约为40%-50%(图4).
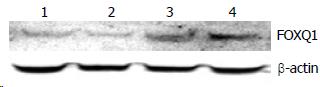
运用Western blot检测经重组真核表达质粒pAcGFP1-N1-FOXQ1转染的Colo-320细胞中FOXQ1蛋白的表达情况, 可见β-actin组各蛋白条带深浅一致, 无明显差异, FOXQ1组均有不同深浅度的免疫杂交条带出现, 与Colo-320细胞空白对照组比较, pAcGFP1-N1空载体对照组FOXQ1蛋白表达未发生明显变化, F2/R及F/R重组真核表达质粒组FOXQ1蛋白表达均增强, 并且F/R组的FOXQ1蛋白表达增强较F2/R组更明显(图5).
人FOXQ1基因属于FOXQ基因亚家族, 定位于人体6号染色体短臂25.3区(6p25.3), 全长2319 bp, 仅含1个外显子, 编码403个氨基酸[4].
研究表明FOXQ1基因参与调控毛发的分化[5]; 在体外实验中可观察到FOXQ1基因的等位突变可以导致NK细胞功能缺失、CD4+ T细胞增殖能力降低, 并且可抑制平滑肌分化[6]; FOXQ1基因在黑素瘤中, 作为前凋亡因子, 表达下调64倍, 并随着肿瘤的发生、发展其表达逐渐下调[7]; 应用免疫组织化学技术对宫颈癌和癌旁组织中FOXQ1基因表达的研究则表明FOXQ1基因在宫颈癌旁组织中表达升高, 而在宫颈癌组织中表达显著降低, 虽然其表达降低与宫颈癌肿瘤分期、分级无关, 但仍提示FOXQ1基因与宫颈癌的发生有一定相关性[8]; Kaneda等[9]研究发现FOXQ1基因在结直肠癌组织中高表达, p21是其重要的靶基因, 并且推测FOXQ1基因主要参与正向调控血管内皮生长因子-A的表达, 参与了消化系肿瘤中抗细胞凋亡和肿瘤血管生长通路的调节, 从而进一步促进了消化系肿瘤的发生及发展; Zhang等[10]应用基因芯片分别对人和小鼠具有不同侵袭能力的乳腺癌细胞系基因表达谱进行比较后发现FOXQ1基因的表达在高侵袭力的细胞系中远高于低侵袭力的细胞系, 体内研究亦表明FOXQ1基因表达的异常增高能促进肿瘤细胞的转移和侵袭; 最近的研究证实FOXQ1基因的表达升高能促进上皮-间质转化(epithelial-mesenchymal transition, EMT). EMT是公认的肿瘤细胞侵袭和转移的重要过程, EMT中最具代表性的变化就是E-钙粘蛋白(E-cadherin)的減少, 造成细胞间附着能力的下降, 同时亦造成E-钙粘蛋白复合物(E-cadherin adhesion complex)的降解, 使得β-catenin进入细胞核的几率上升, 引发下游基因表达, 促进细胞的增生与移动[11], 而FOXQ1基因促进肿瘤侵袭的分子机制正是通过其能特异性地结合到E-cadherin的启动子区从而抑制其表达[12].
FOXQ1基因是FOX基因家族成员之一, 是一个维持细胞生命活动的关键性调控因子[13], 可以通过识别并结合下游靶基因的启动子区, 实现对下游靶基因表达的正向或负向调节[14]. 我们的前期研究表明, FOXQ mRNA和蛋白质的表达水平随着大肠腺瘤→大肠腺癌这一病理过程逐步升高[15,16], 并提示FOXQ1基因在大肠腺瘤癌变过程中, 在包括表皮生长因子受体(epithelial growth factor receptor, EGFR)信号通路在内的众多信号通路中发挥一定作用[17,18].
本研究采用的质粒pAcGFP1-N1为真核表达载体, 可确保插入目的基因与pAcGFP1共同转录, 为提供下一步细胞转染奠定基础. 目前人特定cDNA片段可通过购买商品化的cDNA克隆或RT-PCR两种方法获得, 考虑到RT-PCR扩增的保真性受模板、引物、循环次数以及DNA聚合酶等多种因素的影响[19], 因此我们选择了商品化的人FOXQ1基因cDNA克隆, 以此为PCR模板扩增出了人FOXQ1基因的cDNA片段, 并进一步构建了真核表达载体pAcGFP1-N1-FOXQ1, 经测序证实无误, 此方法简化了实验步骤, 提高了实验的准确性及真核表达载体构建的效率和成功率.
本实验中构建的pAcGFP1-N1-FOXQ1真核表达载体一个重要特点是含有绿色荧光蛋白(green fluorescent protein, GFP). GFP来源于海洋生物水母, 是近年来在分子生物学中应用最广泛的标记性蛋白质之一. GFP的cDNA约为740 bp, 编码238个氨基酸残基, 在合适波长的激光下, GFP肽链内部第65-67位的丝氨酸-酪氨酸-甘氨酸通过自身环化和氧化形成一个发色基团, 可以发射易于观察的绿色荧光[20,21]. 本实验成功构建了pAcGFP1-N1-FOXQ1真核表达载体, 经Lipofectamine 2000转染大肠癌细胞系Colo-320后, 通过荧光显微镜监测GFP的表达、通过Wertern blot检测证实了目的基因FOXQ1在大肠癌Colo-320细胞中的表达增高, 并且在翻译起始点的5'上游加入Kozak序列有助于增强基因的表达水平.
本实验成功构建了表达FOXQ1基因的真核表达质粒pAcGFP1-N1-FOXQ1, 为后续研究FOXQ1基因在肿瘤发生发展中的功能和分子机制、发现FOXQ1基因参与的信号通路和下游靶分子、寻找新的肿瘤治疗靶点奠定了坚实的实验基础.
FOXQ1(homo sapiens forkhead box Q1)基因是一转录因子, 在大肠癌组织中高表达, 在抗细胞凋亡和血管生成中发挥作用, FOXQ1基因表达异常增高可促进肿瘤细胞的转移及浸润.
刘丽江, 教授, 江汉大学医学院病理学
FOXQ1基因在肿瘤发生发展中的重要作用在近年的研究中逐渐凸显, 其表达改变与肿瘤的转移密切相关, 但该基因在大肠癌中的表达改变及其功能研究鲜见报道. 大肠癌的发病率和死亡率逐年上升, 为大肠癌基因治疗提供新的分子靶点是大肠癌研究的一个重要方向.
Kaneda、Myatt、郭强及唐慧等分别研究了FOXQ1基因在大肠癌组织中的表达, 结果表明FOXQ1基因在大肠癌组织中高表达, 并且与肿瘤转移密切相关.
本文首次成功构建了FOXQ1真核表达载体, Western blot证实FOXQ1蛋白在大肠癌细胞系中的成功表达.
本文成功构建了FOXQ1真核表达载体, 并成功转染大肠癌细胞系, 为后续研究FOXQ1基因在大肠癌发生发展中的功能、分子机制等的研究奠定了坚实的实验基础.
本文实验设计具有一定得科学性, 可读性较好, 具有较好的实验研究参考价值.
| 1. | Kaestner KH, Knochel W, Martinez DE. Unified nomenclature for the winged helix/forkhead transcription factors. Genes Dev. 2000;14:142-146. [PubMed] |
| 2. | Kaufmann E, Knöchel W. Five years on the wings of fork head. Mech Dev. 1996;57:3-20. [PubMed] [DOI] |
| 3. | Myatt SS, Lam EW. The emerging roles of forkhead box (Fox) proteins in cancer. Nat Rev Cancer. 2007;7:847-859. [PubMed] [DOI] |
| 4. | Katoh M, Katoh M. Human FOX gene family (Review). Int J Oncol. 2004;25:1495-1500. [PubMed] |
| 5. | Hong HK, Noveroske JK, Headon DJ, Liu T, Sy MS, Justice MJ, Chakravarti A. The winged helix/forkhead transcription factor Foxq1 regulates differentiation of hair in satin mice. Genesis. 2001;29:163-171. [PubMed] [DOI] |
| 6. | Hoggatt AM, Kriegel AM, Smith AF, Herring BP. Hepatocyte nuclear factor-3 homologue 1 (HFH-1) represses transcription of smooth muscle-specific genes. J Biol Chem. 2000;275:31162-31170. [PubMed] [DOI] |
| 7. | Jensen EH, Lewis JM, McLoughlin JM, Alvarado MD, Daud A, Messina J, Enkemann S, Yeatman TJ, Sondak VK, Riker AI. Down-regulation of pro-apoptotic genes is an early event in the progression of malignant melanoma. Ann Surg Oncol. 2007;14:1416-1423. [PubMed] [DOI] |
| 9. | Kaneda H, Arao T, Tanaka K, Tamura D, Aomatsu K, Kudo K, Sakai K, De Velasco MA, Matsumoto K, Fujita Y. FOXQ1 is overexpressed in colorectal cancer and enhances tumorigenicity and tumor growth. Cancer Res. 2010;70:2053-2063. [PubMed] [DOI] |
| 10. | Zhang H, Meng F, Liu G, Zhang B, Zhu J, Wu F, Ethier SP, Miller F, Wu G. Forkhead transcription factor foxq1 promotes epithelial-mesenchymal transition and breast cancer metastasis. Cancer Res. 2011;71:1292-1301. [PubMed] [DOI] |
| 11. | Yu J, Ebert MP, Miehlke S, Rost H, Lendeckel U, Leodolter A, Stolte M, Bayerdörffer E, Malfertheiner P. alpha-catenin expression is decreased in human gastric cancers and in the gastric mucosa of first degree relatives. Gut. 2000;46:639-644. [PubMed] [DOI] |
| 12. | Byrne AM, Bouchier-Hayes DJ, Harmey JH. Angiogenic and cell survival functions of vascular endothelial growth factor (VEGF). J Cell Mol Med. 2005;9:777-794. [PubMed] [DOI] |
| 13. | Chen K, Rajewsky N. The evolution of gene regulation by transcription factors and microRNAs. Nat Rev Genet. 2007;8:93-103. [PubMed] [DOI] |
| 14. | Hannenhalli S, Kaestner KH. The evolution of Fox genes and their role in development and disease. Nat Rev Genet. 2009;10:233-240. [PubMed] [DOI] |
| 16. | Tang H, Guo Q, Zhang C, Zhu J, Yang H, Zou YL, Yan Y, Hong D, Sou T, Yan XM. Identification of an intermediate signature that marks the initial phases of the colorectal adenoma-carcinoma transition. Int J Mol Med. 2010;26:631-641. [PubMed] |
| 18. | 唐 慧, 董 虹, 寿 涛, 何 旭, 邹 云莲, 李 丽, 严 新民, 郭 强. 参与大肠腺瘤癌变过程的信号通路初探. 中华临床医师杂志(电子版). 2010;4:28-34. |
| 19. | 陈 松建, 徐 锡金, 霍 霞, 张 宝, 梁 晓, 陈 刚建. 真核表达载体pIRES-EGFP-PDGF-B的构建及在293T细胞中的表达. 实用医学杂志. 2008;24:3813-3815. |
| 20. | Yin HY, Zhou X, Wu HF, Li B, Zhang YF. Baculovirus vector-mediated transfer of NIS gene into colon tumor cells for radionuclide therapy. World J Gastroenterol. 2010;16:5367-5374. [PubMed] [DOI] |
| 21. | Ou XL, Chen HJ, Sun WH, Hang C, Yang L, Guan YY, Yan F, Chen BA. Effects of angiopoietin-1 on attachment and metastasis of human gastric cancer cell line BGC-823. World J Gastroenterol. 2009;15:5432-5441. [PubMed] [DOI] |