修回日期: 2013-05-17
接受日期: 2013-06-05
在线出版日期: 2013-07-08
目的: 探讨胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)中白血病抑制因子(leukaemia inhibitory factor, LIF)表达相关性及其临床病理学意义.
方法: 应用免疫组织化学方法检测53对配对的PDAC及癌旁组织石蜡标本LIF蛋白表达水平, 并分析LIF表达与患者临床病理学各项指标的关系, 再以Western法检测14对配对冷冻保存的新鲜PDAC和癌旁组织中LIF表达水平.
结果: 免疫组织化学结果显示LIF在癌组织中表达明显高于配对的癌旁组织(66.0% vs 35.8%; t = 3.031, P = 0.004); LIF表达与肿瘤TNM分期(χ2 = 3.635, P = 0.057)、浸润深度(χ2 = 3.726, P = 0.054)接近统计学意义. 单因素分析发现LIF可能是影响胰腺癌患者预后的一个相关危险因素(χ2 = 3.233, P = 0.072)接近统计学意义. LIF在14例PDAC中表达水平同样高于癌旁组织(t = 5.283, P<0.01).
结论: LIF在胰腺癌高表达可能参与胰腺癌的发生进展, LIF表达可能有助于判断胰腺癌患者预后.
核心提示: 白血病抑制因子(leukaemia inhibitory factor, LIF)在胰腺癌高表达可能参与胰腺癌的发生进展, LIF表达可能有助于判断胰腺癌患者的预后, 基于此研究结果, 未来很有可能通过检测胰腺癌组织LIF表达作为评价患者预后的参考指标, 或许也能为胰腺癌的靶向治疗及个体化治疗提供了参考依据.
引文著录: 彭飞, 周建平, 盛伟伟, 张丹华, 董明. 胰腺癌中LIF的表达及其临床病理学意义. 世界华人消化杂志 2013; 21(19): 1877-1881
Revised: May 17, 2013
Accepted: June 5, 2013
Published online: July 8, 2013
AIM: To examine the expression of leukaemia inhibitory factor (LIF) in human pancreatic ductal adenocarcinoma (PDAC) and to analyze its clinicopathological significance.
METHODS: The expression of LIF protein was detected by immunohistochemistry in 53 paraffin-embedded PDAC specimens and matched tumor-adjacent non-cancerous pancreatic tissue specimens. The relationship between LIF protein expression and clinicopathological parameters of PDAC was analyzed. Western bolt was used to examine the expression of LIF in 14 fresh PDAC specimens and matched tumor-adjacent non-cancerous pancreatic tissues.
RESULTS: The positive rate of LIF expression was increased in 53 cases of PDAC compared to matched normal tissues (66.0% vs 35.8%; t = 3.031, P = 0.004). LIF expression was positively associated with tumor TNM stage (χ2 = 3.635, P = 0.057) and invasion depth (χ2 = 3.726, P = 0.054). Univariate analysis revealed that LIF expression may be an adverse prognostic factor for patients with PDAC (χ2 = 3.233, P = 0.072). LIF expression was much higher in 14 cases of PDAC than in tumor-adjacent normal pancreatic tissues (t = 5.283, P < 0.01).
CONCLUSION: Overexpression of LIF may contribute to the development and progression of PDAC. Expression of LIF may be used to predict the prognosis of PDAC.
- Citation: Peng F, Zhou JP, Sheng WW, Zhang DH, Dong M. Clinicopathological significance of expression of leukaemia inhibitory factor in human pancreatic ductal adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(19): 1877-1881
- URL: https://www.wjgnet.com/1009-3079/full/v21/i19/1877.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i19.1877
胰腺癌作为恶性程度最高的致死性肿瘤之一, 其位居美国肿瘤死亡第5位, 国内有逐年增加趋势, 居恶性肿瘤死亡原因的第4位[1,2]. 这些年来, 尽管随着诊断技术和治疗手段不断提高, 但其5年生存率仅为5%左右[3]. 其主要原因是胰腺癌早期诊断困难, 较早发生血液或淋巴转移. 因此探寻有助于早期诊断及判断预后的分子标志物对胰腺癌的诊断和治疗有重大意义.
白血病抑制因子(leukaemia inhibitory factor, LIF)现已证实属于白介素-6(interleukin-6, IL-6)细胞因子家族中的一员. 在恶性血液病、胶质母细胞瘤、乳腺癌、甲状腺癌、子宫内膜癌等肿瘤组织和细胞中都发现LIF不同程度的表达[4-8], 但在胰腺癌研究中少有报道, 本文采用免疫组织化学和Western印迹法检测胰腺癌中LIF的表达, 并结合患者的临床病例资料进行分析, 旨在探讨LIF在胰腺癌中的表达特点其临床病理学意义.
收集2005-01/2012-12我院具有完整临床资料的胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)手术切除标本53例, 均有癌旁组织作为对照. 另有14例PDAC及配对的癌旁新鲜标本, 置液氮中冷冻保存. 53例患者术后病理证实为导管腺癌, 患者中男34例, 女19例, 年龄33-81岁, 中位年龄57岁, 根据2010年UICC的TNM分期指南, 将胰腺癌患者分为Ⅰ(ⅠA+ⅠB)、ⅡA、ⅡB和Ⅲ期(无Ⅳ期患者). 每个患者均有完整随访资料. LIF抗体购自美国RD公司. SP法免疫组织化学试剂盒、DAB显色液购自福州迈新公司. 蛋白裂解液、蛋白酶抑制剂、上样缓冲液、BCA定量及ECL发光试剂盒均购自上海碧云天生物公司.
1.2.1 免疫组织化学SP法: 所有组织标本均经10%福尔马林固定, 常规石蜡包埋, 4 μm厚连续切片, 以二甲苯脱蜡、梯度乙醇水化. PBS清洗后, 置于pH 6.0的柠檬酸缓冲液高压热抗原修复2 min, 自然冷却. 3%过氧化氢室温15 min去除内源性过氧化酶. 血清室温封闭20 min后滴加一抗, 4 ℃孵育过夜. 次日依次滴加二抗及霉菌抗生物素蛋白-过氧化物酶37 ℃ 20 min, PBS清洗, DAB显色, 苏木素复染. 盐酸乙醇分化后常规脱水、透明, 封片后于光学显微镜下观察结果.
1.2.2 Western印迹: 提取冷冻保存的癌和癌旁正常组织, 经BCA定量试剂盒测定蛋白浓度, 样品均定量为5 μg/μL, 每泳道上样50 μg, 经10%十二烷基磺酸钠-聚丙烯胺凝胶电泳, 转膜(聚偏二氟乙烯PVDF), 封闭缓冲液(0.1 mmol/L三羟甲基氨基甲烷缓冲液盐水TBS, 5%脱脂奶粉, 0.1%吐温)封闭, 加入一抗4 ℃孵育过夜, 二抗室温孵育2 h, TBST洗净后, ECL发光并以凝胶显像仪(MF-chemibis 3.2 DNR, 以色列)显像.
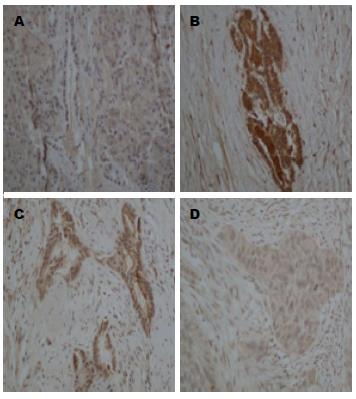
1.2.3 阳性结果判定: LIF为胞浆着色为阳性反应. 阳性结果判定: 参考Yokoyama等[9]文献评分方法: 每张切片400倍显微镜下随机选取5个视野: (1)阳性细胞数: 计算5个视野的阳性细胞的平均百分数分为4级: 阳性细胞数1%-24%为1分; 25%-49%为2分; 50%-74%为3分; >75%为4分; (2)染色强度: 无着色0分; 浅黄色1分; 黄或深黄色2分; 褐或棕褐色3分, 上述两项相乘为分级标准: ≥6分定义为高表达. Western印迹结果运用quantity one软件, 根据ECL发光成像后条带和电泳条带的面积和密度计算每个条带的灰度值.
统计学处理 采用SPSS19.0统计软件, 配对的癌与癌旁组织蛋白和LIF表达水平比较采用配对t检验. LIF蛋白表达相关性及与患者临床病理学参数的关系采用χ2检验. Kaplan-Meier单因素分析计算累积生存率; Log-Rank进行生存时间差异检验; Cox多因素分析评估影响预后的独立因素. Western印迹结果取目的蛋白在癌或癌旁组织条带灰度(吸光度)/GAPDH灰度值(吸光度值)得对数值, 使其呈正态分布, 配对t检验进行统计学分析. 以P<0.05为差异有统计学意义.
LIF在PDAC中表达率66.0%(35/53), 在癌旁组织中表达率35.8%(19/53); LIF在癌组织中表达明显高于配对的癌旁组织(t = 3.031, P = 0.004). LIF阳性染色均定位于胰腺导管细胞浆和胞核, 呈棕黄色颗粒, 其表达呈明显异质性. 少量表达于胰腺正常腺泡细胞, 胰岛细胞无表达(图1).
LIF蛋白表达水平与胰腺PDAC患者性别(χ2 = 2.373, P = 0.123)、年龄(χ2 = 0.002, P = 0.965)、肿瘤部位(χ2 = 2.628, P = 0.105)、分化程度(χ2 = 0.484, P = 0.487)、浸润深度(χ2 = 3.726, P = 0.054)、TNM分期(χ2 = 3.635, P = 0.057)及淋巴结转移(χ2 = 0.231, P = 0.631)等指标均无明显统计学意义(P>0.05), 但LIF的表达与肿瘤TNM分期(χ2 = 3.635, P = 0.057)、浸润深度(χ2 = 3.726, P = 0.054)接近统计学意义(表1).
| 参数 | n | LIF蛋白表达 | χ2 | P值 | |
| 阴性 | 阳性 | ||||
| n | 53 | 18 | 35 | ||
| 年龄(岁) | 0.002 | 0.965 | |||
| ≤65 | 44 | 15 | 29 | ||
| >65 | 9 | 3 | 6 | ||
| 性别 | 2.373 | 0.123 | |||
| 男 | 34 | 9 | 25 | ||
| 女 | 19 | 9 | 10 | ||
| 肿瘤部位 | 2.628 | 0.105 | |||
| 胰头 | 37 | 10 | 27 | ||
| 胰体尾 | 16 | 8 | 8 | ||
| 肿瘤大小(cm) | 0.810 | 0.776 | |||
| <2.5 | 28 | 10 | 18 | ||
| ≥2.5 | 25 | 8 | 17 | ||
| 分化程度 | 0.484 | 0.487 | |||
| 中低分化 | 30 | 9 | 21 | ||
| 高分化 | 23 | 9 | 14 | ||
| 浸润深度 | 3.726 | 0.054 | |||
| T1+T2 | 10 | 6 | 4 | ||
| T3+T4 | 43 | 12 | 31 | ||
| TNM分期1 | 3.635 | 0.057 | |||
| I+IIA | 35 | 15 | 20 | ||
| IIB+III | 18 | 3 | 15 | ||
| 术前CA19-9水平(U/mL) | 0.496 | 0.481 | |||
| <37 | 15 | 4 | 11 | ||
| ≥37 | 38 | 14 | 24 | ||
| 淋巴结转移 | 0.231 | 0.631 | |||
| N0(阴性) | 36 | 13 | 23 | ||
| N1(阳性) | 17 | 5 | 12 | ||
| 术后肝转移 | 0.247 | 0.620 | |||
| 无 | 39 | 14 | 25 | ||
| 有 | 14 | 4 | 10 | ||
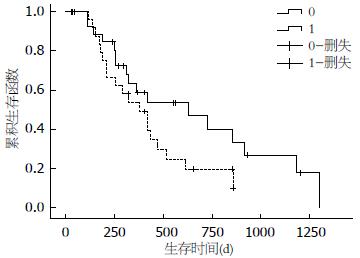
单因素分析发现: 胰腺癌患者预后年龄(P = 0.800, 中位生存时间: ≤65岁者418 d vs >65岁者420 d)、性别(P = 0.674, 中位生存时间: 男性患者432 d vs 女性患者365 d)、肿瘤部位(P = 0.150, 中位生存时间: 胰头者291 d vs 胰体尾者432 d)、浸润深度(P = 0.752, 中位生存时间: T1+T2者615 d vs T3+T4者380 d)、TNM分期(P = 0.162, 中位生存时间: Ⅰ+ⅡA者468 d vs ⅡB+Ⅲ者257 d)等相关的因素都无明显的统计学意义. 但低表达LIF的胰腺癌患者术后中位生存时间为468 d, 高表达LIF的胰腺癌患者中位生存时间为365 d, 两者比较接近统计学意义(χ2 = 3.233, P = 0.072, 图2).
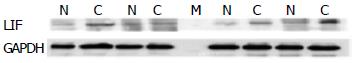
Western印迹显示癌旁胰腺组织黏膜LIF/GAPDH灰度比为0.066±0.022, 癌组织为0.210±0.071, 两者之间有明显统计学差异(t = 5.283, P<0.01)(图3).
LIF是上世纪80年代首次发现并命名一个多功能的新细胞因子, 现已证实属于IL-6细胞因子家族中一个新成员, LIF广泛存在于不同种属的多种组织中, 现已在活化的T细胞、单核细胞、肝成纤维细胞、胚胎干细胞、胸腺上皮细胞、骨髓基质细胞等多种细胞发现有LIF的表达[10]. 正常情况下组织和外周血循环中LIF的表达量极低[11]. 首次发现LIF基因在白血病中低表达, 并与肿瘤的发生发展关系密切, 此后的一些研究表明, LIF基因在子宫内膜癌、乳腺癌、脑胶质瘤等恶性肿瘤中存在高表达, 推测该因子对多数实体肿瘤表现出促进作用[5,8,12,13], 而对大多数非实体肿瘤具有抑制其增殖作用[4,14].
本实验采用免疫组织化学法检测53例PDAC及癌旁正常胰腺组织中LIF蛋白表达水平, 结果显示: 胰腺癌组织中LIF阳性表达率为66.0%(35/53例), 而在癌旁非肿瘤性胰腺癌导管中阳性表达率为35.8%(19/53例), 并且LIF蛋白表达在PDAC中较癌旁正常胰腺组织有较明显升高(P<0.05), 再结合患者临床病理资料分析发现. LIF过表达与患者性别、年龄、肿瘤部位、肿瘤大小、肿瘤分化程度、浸润深度、TNM分期、术前CA199水平、远处转移无相关性(P>0.05), 但LIF的表达与肿瘤TNM分期(χ2 = 3.635, P = 0.057)、浸润深度(χ2 = 3.726, P = 0.054)达到边缘统计学意义. 这可能是由于样本量不足, 我们将通过增加样本量, 进一步明确LIF和肿瘤TNM分期及浸润深度的关系. 本研究通过单因素分析发现: 胰腺癌的预后与患者性别、年龄、肿瘤部位、肿瘤大小、肿瘤分化程度、浸润深度、TNM分期等相关的因素都无明显的统计学意义(P>0.05), 但高表达LIF的胰腺PDAC患者比低表达LIF患者术后中位生存时间明显缩短, 两者比较接近统计学意义(χ2 = 3.233, P = 0.072). 这可能是由于样本量不足、随访时间不完善所致. 我们将通过增加样本量, 完善随访, 进一步证实LIF和预后的关系. 最后本研究通过Western印迹进一步验证了LIF蛋白在癌和癌旁组织表达有明显差异(t = 5.283, P<0.01).
LIF在胰腺癌组织中的研究较少, 鲜有报道, Kamohara等[15]研究发现LIF在体外培养的情况下可促进胰腺癌Hs-766T细胞和Hs-700T细胞增殖. 提示LIF可能影响肿瘤的发生发展, 但具体机制仍有待于进一步研究, 总之, 通过检测胰腺癌组织LIF表达有着重要的临床意义, LIF有可能作为评价患者预后的参考指标, 同时也为胰腺癌的靶向治疗及个体化治疗提供了参考依据, 从而为提高患者疗效, 延长患者生存期具有重要意义.
总之, LIF在胰腺癌中高表达可能参与胰腺癌的发生进展, LIF表达可能有助于判断胰腺癌患者预后.
目前白血病抑制因子(leukemia inhibitory factor, LIF)在白血病、子宫内膜癌、乳腺癌、脑胶质瘤等肿瘤中研究很热, 基于此, LIF与胰腺癌的关系方面的研究成为研究热点.
朴龙镇, 副教授, 延边大学附属医院肿瘤科; 魏继福, 研究员, 江苏省人民医院
LIF在胰腺癌高表达可能共同参与胰腺癌的发生进展, LIF表达有助于判断胰腺癌患者的预后.
Kamohara等通过运用MTT实验检测LIF对7株胰腺癌细胞株增殖的影响, 结果发现LIF在体外培养的情况下可促进胰腺癌Hs-766T细胞和Hs-700T细胞增殖. 然而LIF在胰腺癌组织中的研究鲜有报道.
本文研究LIF在胰腺癌组织表达的同时, 将LIF表达与各临床参数间的关系作了详细分析, 发现LIF的表达与肿瘤TNM分期、浸润深度都达到边缘统计学意义.
本文探讨LIF与胰腺癌的关系, 研究内容新颖, 对临床有一定指导意义.
| 1. | Günzburg WH, Salmons B. Novel clinical strategies for the treatment of pancreatic carcinoma. Trends Mol Med. 2001;7:30-37. [PubMed] [DOI] |
| 2. | Ohuchida K, Mizumoto K, Murakami M, Qian LW, Sato N, Nagai E, Matsumoto K, Nakamura T, Tanaka M. Radiation to stromal fibroblasts increases invasiveness of pancreatic cancer cells through tumor-stromal interactions. Cancer Res. 2004;64:3215-3222. [PubMed] [DOI] |
| 3. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 4. | Iwamoto T, Senga T, Adachi K, Hamaguchi M. Stat3-dependent induction of interleukin-3 receptor expression in leukemia inhibitory factor-stimulated M1 mouse leukemia cells. Cytokine. 2004;25:136-139. [PubMed] [DOI] |
| 5. | Peñuelas S, Anido J, Prieto-Sánchez RM, Folch G, Barba I, Cuartas I, García-Dorado D, Poca MA, Sahuquillo J, Baselga J. TGF-beta increases glioma-initiating cell self-renewal through the induction of LIF in human glioblastoma. Cancer Cell. 2009;15:315-327. [PubMed] [DOI] |
| 6. | Rhee DK, Park SH, Jang YK. Molecular signatures associated with transformation and progression to breast cancer in the isogenic MCF10 model. Genomics. 2008;92:419-428. [PubMed] [DOI] |
| 7. | Arthan D, Hong SK, Park JI. Leukemia inhibitory factor can mediate Ras/Raf/MEK/ERK-induced growth inhibitory signaling in medullary thyroid cancer cells. Cancer Lett. 2010;297:31-41. [PubMed] [DOI] |
| 8. | Mylonas I, Makovitzky J, Shabani N, Richter DU, Kuhn C, Jeschke U, Briese V, Friese K. Leukaemia inhibitory factor (LIF) is immunohistochemically expressed in normal, hyperplastic and malignant endometrial tissue. Eur J Obstet Gynecol Reprod Biol. 2005;118:101-108. [PubMed] [DOI] |
| 9. | Yokoyama M, Yamanaka Y, Friess H, Buchler M, Korc M. p53 expression in human pancreatic cancer correlates with enhanced biological aggressiveness. Anticancer Res. 1994;14:2477-2483. [PubMed] |
| 10. | Hisaka T, Desmoulière A, Taupin JL, Daburon S, Neaud V, Senant N, Blanc JF, Moreau JF, Rosenbaum J. Expression of leukemia inhibitory factor (LIF) and its receptor gp190 in human liver and in cultured human liver myofibroblasts. Cloning of new isoforms of LIF mRNA. Comp Hepatol. 2004;3:10. [PubMed] [DOI] |
| 11. | Brown MA, Metcalf D, Gough NM. Leukaemia inhibitory factor and interleukin 6 are expressed at very low levels in the normal adult mouse and are induced by inflammation. Cytokine. 1994;6:300-309. [PubMed] |
| 12. | García-Tuñón I, Ricote M, Ruiz A, Fraile B, Paniagua R, Royuela M. OSM, LIF, its receptors, and its relationship with the malignance in human breast carcinoma (in situ and in infiltrative). Cancer Invest. 2008;26:222-229. [PubMed] [DOI] |
| 13. | Shin JE, Park SH, Jang YK. Epigenetic up-regulation of leukemia inhibitory factor (LIF) gene during the progression to breast cancer. Mol Cells. 2011;31:181-189. [PubMed] [DOI] |
| 14. | Tanuma N, Nakamura K, Shima H, Kikuchi K. Protein-tyrosine phosphatase PTPepsilon C inhibits Jak-STAT signaling and differentiation induced by interleukin-6 and leukemia inhibitory factor in M1 leukemia cells. J Biol Chem. 2000;275:28216-28221. [PubMed] |
| 15. | Kamohara H, Ogawa M, Ishiko T, Sakamoto K, Baba H. Leukemia inhibitory factor functions as a growth factor in pancreas carcinoma cells: Involvement of regulation of LIF and its receptor expression. Int J Oncol. 2007;30:977-983. [PubMed] |