修回日期: 2013-03-28
接受日期: 2013-06-05
在线出版日期: 2013-07-08
目的: 研究光动力疗法(photodynamic therapy, PDT)对人胆管癌细胞QBC939凋亡的影响.
方法: 体外培养人胆管癌QBC939细胞株, 用不同浓度血卟啉衍生物(hematoporphyrin derivative, HPD)处理, 并用半导体激光治疗仪不同强度光照后, 采用CCK8法检测PDT对QBC939细胞的相对抑制率; 应用流式细胞仪检测PDT作用前后QBC939细胞的凋亡率; RT-PCR检测PDT作用前后QBC939细胞中增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)基因表达情况; SP免疫细胞化学法测定PDT作用前后QBC939细胞核中PCNA的表达情况.
结果: CCK8检测结果显示PDT在体外能够抑制胆管癌QBC939细胞生长, 8 mg/L HPD经5 J/cm2光照时实验组吸光度(A)值(0.403±0.027)与对照组A值(2.028±0.013)有统计学差异(P<0.05), 细胞生长抑制率达80%, 继续增加药物浓度或光照强度, 细胞生长抑制率升高不明显, 差异无统计学意义; 流式细胞技术检测显示PDT能够明显促进胆管癌QBC939细胞的早期凋亡(74.6%±1.5%); RT-PCR检测显示PDT能够明显抑制胆管癌QBC939细胞中PCNA基因表达(0.68±0.06); SP免疫细胞化学结果显示PDT能够明显抑制胆管癌QBC939细胞核中PCNA蛋白表达(4.5%±1.4%).
结论: PDT能够抑制胆管癌QBC939细胞生长, 促进QBC939细胞的早期凋亡. PDT对QBC939细胞生长的抑制作用可能是通过抑制QBC939细胞的PCNA基因和蛋白水平的表达, 从而促进其早期凋亡实现的.
核心提示: 光动力疗法(photodynamic therapy, PDT)能够抑制胆管癌QBC939细胞生长, 促进QBC939细胞的早期凋亡. PDT对QBC939细胞生长的抑制作用可能是通过抑制QBC939细胞的增殖细胞核抗原(proliferating cell nuclear antigen)基因和蛋白水平的表达, 从而促进其早期凋亡实现.
引文著录: 姜海涛, 曹景玉, 韩瑞, 王云玲, 范友杰, 李衍彦, 隋爱华. 光动力疗法促进胆管癌细胞QBC939的凋亡. 世界华人消化杂志 2013; 21(19): 1853-1858
Revised: March 28, 2013
Accepted: June 5, 2013
Published online: July 8, 2013
AIM: To investigate the effect of photodynamic therapy on cholangiocarcinoma QBC939 cell apoptosis.
METHODS: Cultured cholangiocarcinoma QBC939 cells were given different concentrations of hematoporphyrin derivatives and different light intensity. The relative growth inhibition rate of QBC939 cells was detected by the CCK8 method. Flow cytometry assays were applied to determine the rate of QBC939 cell apoptosis. RT-PCR was used to detect transcriptional changes of proliferating cell nuclear antigen (PCNA). Immunocytochemistry was used to measure the changes in protein expression of PCNA.
RESULTS: PDT inhibited QBC939 cell growth in vitro, and significant different A values between the PDT group and control group was observed (0.403 ± 0.027 vs 2.028 ± 0.013, P < 0.05). When the concentration of HPD was 8 mg/L and the light irradiation was 5 J/cm2, the relative growth inhibition rate of QBC939 cells was 80%. The increase in drug concentration or light dose did not significantly increase the growth inhibition rate. Flow cytometry assays showed that PDT could promote early apoptosis of QBC939 cells (74.6% ± 1.5%). PDT could reduce the transcriptional changes of PCNA (0.68 ± 0.06) and down-regulated the expression of PCNA protein in QBC939 cell nuclei (4.5% ± 1.4%).
CONCLUSION: PDT could inhibit QBC939 cell growth and promote early apoptosis of QBC939 cells. PDT induces QBC939 cell growth inhibition possibly by inhibiting PCNA gene and protein expression and promoting early apoptosis.
- Citation: Jiang HT, Cao JY, Han R, Wang YL, Fan YJ, Li YY, Sui AH. Photodynamic therapy promotes apoptosis of cholangiocarcinoma QBC939 cells. Shijie Huaren Xiaohua Zazhi 2013; 21(19): 1853-1858
- URL: https://www.wjgnet.com/1009-3079/full/v21/i19/1853.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i19.1853
光动力疗法(photodynamic therapy, PDT)是目前用于恶性肿瘤辅助治疗的一种新方法, PDT过程中存在大量的信号调节分子, 其具体机制尚不明确[1,2]. 近年来研究显示其作用机制与抑制肿瘤细胞增殖、诱导细胞凋亡有关, 但其诱导细胞凋亡的确切机制目前尚未完全阐明. 增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)是目前应用最广的用于检测肿瘤细胞增殖活性的指标, 能与DNA多聚酶辅助蛋白结合, 调控并参与细胞DNA的复制, 其表达水平与肿瘤细胞增殖、浸润、转移等有关, 已经在肝癌、胃肠道肿瘤等组织中得到证实[3,4]. 有研究证实, 抑制PCNA的表达能够抑制肿瘤细胞的增殖, 提高凋亡指数[5], 促进肿瘤细胞的凋亡. 本实验通过PDT检测对人胆管癌细胞QBC939凋亡的影响, 并通过RT-PCR和免疫细胞化学检测PDT前后人胆管癌QBC939细胞中PCNA的表达变化情况, 以期为PDT的临床应用提供理论依据.
人胆管癌细胞系QBC939由第三军医大学西南医院王曙光教授建系, 购自上海中科院细胞库; 半导体激光治疗仪; 倒置显微镜(型号IX50, 品牌Olympus); 流式细胞仪; PCR仪(型号EP384, 生产厂家Eppendorf); 低温冷冻离心机(型号3K30, 生产厂家Sigma); 凝胶成像系统(生产厂家Vilber Lourmat); 酶标测试仪; 血卟啉衍生物购自重庆华鼎现代生物制药公司; RPMI 1640培养基、胰蛋白酶购自Gibco公司(美国); 胎牛血清购自Hyclone公司(美国); CCK8试剂盒购自同仁化学研究所(日本); 凋亡试剂盒购自Invitrogen公司(美国); PCNA、hGAPDH引物购自生工生物工程(上海)股份有限公司; RT-PCR试剂盒购自宝生物工程(大连)有限公司; 兔抗人PCNA多克隆抗体购自abcam公司(美国); 免疫组织化学染色试剂盒、DAB染色试剂盒购自北京博奥森生物技术有限公司; 改良型苏木素购自康为世纪公司.
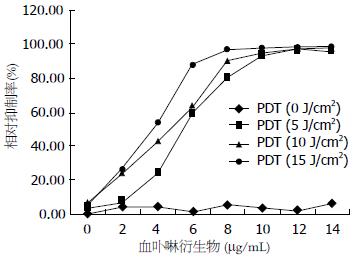
1.2.1 细胞培养和CCK8实验: 胆管癌QBC939细胞贴壁生长于完全型RPMI 1640培养基(含10%胎牛血清, 青霉素100 U/mL, 链霉素100 mg/mL)中, 于37 ℃、5%CO2饱和湿度恒温培养箱中培养传代, 每48-72 h传代1次, 选取对数生长期的胆管癌QBC939细胞进行CCK8实验, 约6×103/孔接种于96孔板, 24 h后弃细胞培养上清液并分组. 用不同强度的光照和不同浓度的血卟啉衍生物(hematoporphyrin derivative, HPD)联合作用于胆管癌细胞进行实验, 分别加入含0、2、4、6、8、10、12、14 μg/mL HPD浓度的培养液, 每个HPD浓度设3个复孔, 24 h后分别选取0、5、10、15 J/cm2的光照强度给予光照, 光波长630 nm, 更换含有10%胎牛血清的培养液培养48 h后进行CCK8实验, 在波长450 nm的分光光度仪中检测各组细胞的A值, 观察PDT对胆管癌QBC939细胞生长的抑制作用, 并计算各组细胞的生长抑制率 = (A空白-A实验)/A空白×100%.
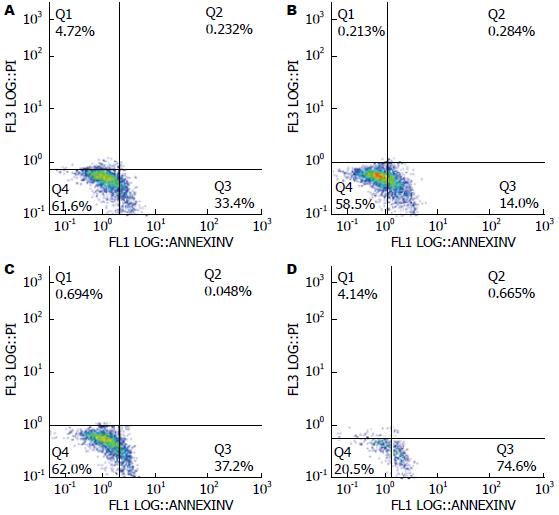
1.2.2 流式细胞仪检测细胞凋亡率: 选取对数生长期的胆管癌QBC939细胞制成细胞悬液后, 约2×105/孔接种于6孔板, 培养12 h后分组, 选取CCK8实验中的最佳HPD-PDT参数做为实验组, 另设单纯光照射组、单纯光敏剂组和空白对照组, 更换不含血清的培养液培养24 h, 给予光照后更换含有10%胎牛血清的培养液再继续培养24 h, 用胰酶消化后离心制成细胞悬液, 调整细胞浓度约1×105/mL, 样品管中加入100 μL的AnnexinV Binding buffer细胞悬液; 再加入5 μL Alexa Fluor 488 av混匀后, 加入1 μL Propidium Iodide, 混匀, 避光, 室温反应15 min, 使其充分染色, 再加入400 μL AnnexinV Binding buffer, 1 h内上机检测细胞凋亡率.
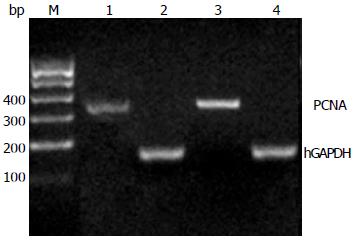
1.2.3 RT-PCR半定量测定PCNA mRNA表达: 依据上述实验的分组, 以2.0×105/孔接种于6孔板进行细胞培养, 实验处理后分别提取各组细胞的mRNA, 逆转录的cDNA作为模板, PCNA上游引物序列为5'-AAGCACCAAACCAGGAGAAAGT-3'; 下游引物序列为5'-ACCGTTGAAGAGAGTGGAGTG-3'. hGAPDH基因上游引物序列为5'-AACAGCCTCAAGATCATCAGCAA-3'; 下游引物序列为5'-GACTGTGGTCATGAGTCCTTCCA-3'. 模板cDNA 1 μL, 上下游引物各1 μL, Premix 11.5 μL, 双蒸水5.5 μL构建20 μL体系分别进行PCR扩增, PCNA反应链为: 95 ℃ 5 min预变性, 98 ℃ 10 s变性, 63.9 ℃ 30 s退火, 72 ℃ 30 s延伸, 72 ℃ 10 min终止延伸, 30个循环. 将扩增的产物在2%琼脂糖凝胶、0.5×TAE缓冲液中电泳, 电压120 V, 时间约30 min, 紫外凝胶成像系统拍照, 图像分析软件分析电泳条带灰度值, 计算各组mRNA表达的相对强度 = 目的条带灰度值/hGAPDH条带灰
度值.
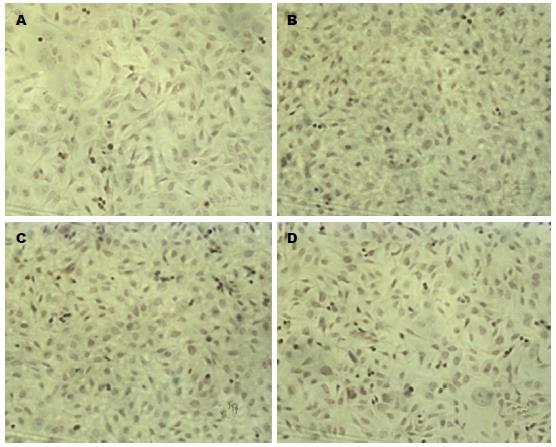
1.2.4 SP法免疫细胞化学染色测定PCNA在细胞核中的表达: 依据上述实验的分组进行细胞爬片, 将细胞悬液按2.0×105/孔的细胞数接种于6孔板进行细胞培养, 经PDT实验处理后, 用4%中性甲醛固定, 依次加入兔抗人PCNA多克隆抗体和含有辣根过氧化物酶标记的山羊抗兔抗体, DAB染色3-10 min后再用苏木素复染, 倒置显微镜拍照后分析, 结果判定标准: 细胞核中出现棕黄色颗粒为阳性, 以着色强度和阳性细胞数所占比例综合判定: 无色或阳性细胞数<5%为(-), 浅黄色或阳性细胞数5%-25%为(+), 棕黄色或阳性细胞数25%-50%为(++), 棕色或阳性细胞数50%-75%(+++), 深棕色或阳性细胞数>75%为(++++).
统计学处理 所得计量资料均用mean±SD表示, 数据使用SPSS17.0统计学软件进行单因素方差分析, 组间比较采用LSD t检验, 以P<0.05认为差异有显著性.
不同HPD浓度和光照强度下各组QBC939细胞的吸光度见表1, 对各组细胞生长抑制率的影响见图1, 当光照剂量达到5 J/cm2, HPD浓度达到4 μg/mL时, 差异有统计学意义(P<0.05), 但细胞生长抑制率仅24%. 当光照剂量达到5 J/cm2, HPD浓度达到8 μg/mL时, 细胞生长抑制率达到80%, 继续增加药物浓度或光照剂量, 差异无显著性, 细胞存活率降低不明显. 因此, 我们将HPD 8 μg/mL、激光剂量5 J/cm2作为本实验的最佳参数.
| 血卟啉衍生物(μg/mL) | 光照强度(J/cm2) | |||
| 0 | 5 | 10 | 15 | |
| 0 | 2.028±0.013 | 1.966±0.016 | 1.899±0.029 | 1.946±0.008 |
| 2 | 1.944±0.023 | 1.879±0.047 | 1.531±0.034a | 1.486±0.060b |
| 4 | 1.946±0.086 | 1.542±0.021a | 1.157±0.038b | 0.926±0.025b |
| 6 | 1.994±0.020 | 0.828±0.032b | 0.728±0.041b | 0.248±0.036b |
| 8 | 1.912±0.012 | 0.403±0.027b | 0.191±0.026b | 0.061±0.020b |
| 10 | 1.958±0.023 | 0.133±0.012b | 0.091±0.011b | 0.046±0.018b |
| 12 | 1.991±0.018 | 0.071±0.022b | 0.043±0.024b | 0.037±0.019b |
| 14 | 1.909±0.013 | 0.072±0.060b | 0.036±0.020b | 0.029±0.032b |
流式细胞仪检测结果见图2, 空白对照组、单纯光敏剂组和单纯光照射组凋亡发生率分别为33.4%±1.4%、41.0%±1.6%、37.2%±2.1%, 各组之间差异无统计学意义(P>0.05). 光动力实验组凋亡发生率为74.6%±1.5%, 与其余3组比较均有统计学差异(P<0.05).
各组细胞提取的总mRNA在紫外分光光度计中检测, A260/280的比值均在1.8-2.0之间. 图3表明PCNA mRNA在人胆管癌QBC939细胞中的相对表达强度为0.95±0.08. 在8 mg/LHPD经5 J/cm2光照后, PCNA mRNA在人胆管癌QBC939细胞中的相对表达强度明显下降为0.68±0.06. 光动力实验组与空白对照组PCNA mRNA相对表达强度差异具有统计学意义(P<0.05).
各组细胞核中出现黄色颗粒为阳性, 由图4可见光动力实验组、单纯光照射组、单纯光敏剂组和空白对照组的PCNA染色强度分别为4.5%±1.4%(-)、30.5%±1.6%(++)、47.7%±1.2%(++)、52.5%±1.3%(+++), 光动力实验组与空白对照组中PCNA的表达量有明显统计学差异(P<0.05).
PDT是近年来肿瘤治疗领域中一项新技术, 是一种无创或微创性、非产热性、利用光化学反应引起靶组织和靶细胞破坏的临床辅助治疗方法. 利用肿瘤组织对光敏剂的选择性摄入和浓集, 给予特定波长光照射激活肿瘤组织中的光敏剂而产生活性氧簇, 这些物质与肿瘤细胞中的分子和结构发生氧化反应而杀伤肿瘤细胞[6-8], 而在正常组织中能迅速代谢, 在杀灭肿瘤细胞的同时减少对正常组织的损伤.
目前研究已知, PDT在体内抑制肿瘤生长的机制包括: 信号转导与诱导肿瘤细胞凋亡和坏死以及与自噬相关的细胞死亡、对肿瘤微血管的破坏和激发免疫及炎症反应等[9,10]. PDT在体外也能够显著抑制肿瘤细胞生长[11], 但其抑制胆管癌细胞生长的机制尚不清楚. 本研究结果显示, PDT在体外能够抑制胆管癌QBC939细胞生长, 不同HPD-PDT参数影响不同, 当PDT达到5 J/cm2, HPD达到8 μg/mL以上时能显著抑制QBC939细胞生长, 细胞生长抑制率达到80%以上, 并能明显促进QBC939细胞早期凋亡, 早期凋亡率为74.6%. 本实验表明, PDT能够通过诱导胆管癌细胞凋亡抑制细胞生长.
PCNA又称周期蛋白, 存在于细胞核内, 是DNA聚合酶δ、ε的辅酶, 合成及表达与细胞增殖密切相关, 是反映细胞增殖的主要生物学指标[12,13], 在许多肿瘤组织中高表达, 肿瘤细胞增殖越活跃, PCNA表达越高[14,15], 还可用于判断肿瘤的恶性程度及预后[16,17]. 他协调DNA前导链和随从链的合成, 在细胞内的含量具有周期性, 在G0期细胞内含量很少, G1晚期开始增加, S期达高峰, G2、M期明显下降, 在DNA复制、细胞增殖及细胞周期调控中发挥重要作用, PCNA的周期性变化与细胞增殖过程有关, 而肿瘤的发生与细胞凋亡受阻、过度增殖有关[18,19], PCNA会和DNA多聚酶结合, 促进细胞进入S期, 使细胞过度增殖及癌变.
本实验从RT-PCR和免疫细胞化学层面检测PDT前后QBC939细胞中PCNA的表达变化情况, 结果显示PCNA在基因和蛋白水平相对表达量均明显降低, 表明PDT能够抑制PCNA表达, 可能进而诱导QBC939细胞凋亡, 起到抑制胆管癌QBC939细胞生长的作用. 有研究表明, 抑制PCNA的表达, 可延缓肿瘤细胞由G1期向S期的过渡, 从而减少S期细胞含量, 具体机制是PCNA-P21可以和多种CDK/cyclin形成四聚体[14], 当PCNA表达被抑制时, CDK活性被抑制, 从而影响RB蛋白磷酸化和与之结合的转录因子的释放, 导致细胞不能通过G1期检验点进入S期, 进而诱导细胞凋亡, 抑制细胞增殖. PCNA作为检测细胞凋亡的一个良好指标,在肿瘤细胞凋亡过程中表达受到明显抑制[20]. 本研究显示PDT抑制了PCNA的表达, 推测PDT是通过干扰细胞周期诱导QBC939细胞凋亡. 光动力作用促进胆管癌细胞QBC939凋亡是一个多基因参与调控的过程, 其确切机制较为复杂, 仍有待进一步研究.
光动力疗法(photodynamic therapy, PDT)是目前用于恶性肿瘤辅助治疗的一种新方法, 近年来研究显示其作用机制与抑制肿瘤细胞增殖、诱导细胞凋亡有关, 但其诱导细胞凋亡的确切机制目前尚未完全阐明.
葛海燕, 教授, 同济大学附属第十人民医院普通外科
PDT的分子机制是当前研究的热点. PCNA在许多肿瘤组织中高表达, 肿瘤细胞增殖越活跃, PCNA表达越高. 抑制PCNA的表达可能是肿瘤治疗的一种有效的方法.
有研究证实, PCNA能与DNA多聚酶辅助蛋白结合, 调控并参与细胞DNA的复制, 其表达水平与肿瘤细胞增殖、浸润、转移等有关, 已经在肝癌、胃肠道肿瘤等组织中得到证实, 抑制PCNA的表达能够抑制肿瘤细胞的增殖, 提高凋亡指数, 促进肿瘤细胞的凋亡.
本研究主要基于CCK8和流式细胞技术检测了PDT对QBC939细胞生长增殖的影响, 并通过RT-PCR和免疫细胞化学检测PDT对PCNA的表达的影响.
针对PDT的进一步研究, 可能成为胆管癌治疗的一种新方法, 对于改善胆管癌患者的预后具有重要的意义.
本文创新性较好, 实验结果达到论文设计的要求, 对结果的解释恰当、合理, 具有一定指导意义.
| 1. | Wainwright M. Photodynamic therapy: the development of new photosensitisers. Anticancer Agents Med Chem. 2008;8:280-291. [PubMed] [DOI] |
| 2. | Chekulayeva LV, Chekulayev VA, Shevchuk IN. Active oxygen intermediates in the degradation of hematoporphyrin derivative in tumor cells subjected to photodynamic therapy. J Photochem Photobiol B. 2008;93:94-107. [PubMed] [DOI] |
| 3. | Shen LJ, Zhang HX, Zhang ZJ, Li JY, Chen MQ, Yang WB, Huang R. Detection of HBV, PCNA and GST-pi in hepatocellular carcinoma and chronic liver diseases. World J Gastroenterol. 2003;9:459-462. [PubMed] |
| 4. | Wang ZH, Wang CY, Liu XJ, Wang LG, Li M, Chen CZ. [Relationship between recurrence and metastasis of gastric cancer and expression of EGFR, IL-6R, PCNA, and DI]. Ai Zheng. 2002;21:785-789. [PubMed] |
| 6. | Dolmans DE, Fukumura D, Jain RK. Photodynamic therapy for cancer. Nat Rev Cancer. 2003;3:380-387. [PubMed] [DOI] |
| 7. | Dougherty TJ, Gomer CJ, Henderson BW, Jori G, Kessel D, Korbelik M, Moan J, Peng Q. Photodynamic therapy. J Natl Cancer Inst. 1998;90:889-905. [PubMed] [DOI] |
| 8. | Henderson BW, Dougherty TJ. How does photodynamic therapy work? Photochem Photobiol. 1992;55:145-157. [PubMed] [DOI] |
| 9. | 徐 畅, 姜 小清. 光动力学原理及其在胆管癌治疗的应用. 中华普通外科学文献(电子版). 2012;6:249-253. |
| 11. | Ferrario A, Fisher AM, Rucker N, Gomer CJ. Celecoxib and NS-398 enhance photodynamic therapy by increasing in vitro apoptosis and decreasing in vivo inflammatory and angiogenic factors. Cancer Res. 2005;65:9473-9478. [PubMed] [DOI] |
| 12. | Zhang T, Wang SS, Hong L, Wang XL, Qi QH. Arsenic trioxide induces apoptosis of rat hepatocellular carcinoma cells in vivo. J Exp Clin Cancer Res. 2003;22:61-68. [PubMed] |
| 13. | Wang SS, Zhang T, Wang XL, Hong L, Qi QH. Effect of arsenic trioxide on rat hepatocellular carcinoma and its renal cytotoxity. World J Gastroenterol. 2003;9:930-935. [PubMed] |
| 14. | Maga G, Hubscher U. Proliferating cell nuclear antigen (PCNA): a dancer with many partners. J Cell Sci. 2003;116:3051-3060. [PubMed] [DOI] |
| 15. | Astudillo H, Lopez T, Castillo S, Gariglio P, Benitez L. p53, Bcl-2, PCNA expression, and apoptotic rates during cervical tumorigenesis. Ann N Y Acad Sci. 2003;1010:771-774. [PubMed] [DOI] |
| 16. | Stroescu C, Dragnea A, Ivanov B, Pechianu C, Herlea V, Sgarbura O, Popescu A, Popescu I. Expression of p53, Bcl-2, VEGF, Ki67 and PCNA and prognostic significance in hepatocellular carcinoma. J Gastrointestin Liver Dis. 2008;17:411-417. [PubMed] |
| 17. | Liu WG, Gu WZ, Zhou YB, Tang HF, Li MJ, Ma WX. The prognostic relevance of preoperative transcatheter arterial chemoembolization (TACE) and PCNA/VEGF expression in patients with Wilms' tumour. Eur J Clin Invest. 2008;38:931-938. [PubMed] [DOI] |
| 18. | 沈 云芳, 庄 蕙, 沈 健伟, 陈 士葆. 细胞凋亡与肿瘤. 世界华人消化杂志. 1999;7:267-268 Available from: http://www.wjgnet.com/1009-3079/7/267.pdf. |
| 19. | 华 杰松. 幽门螺杆菌, 细胞增殖和细胞凋亡在胃癌发生中的作用. 世界华人消化杂志. 1999;7:647-648 Available from: http://www.wjgnet.com/1009-3079/7/647.pdf. |