修回日期: 2013-05-19
接受日期: 2013-05-25
在线出版日期: 2013-07-08
目的: 探讨超声检查对于胰腺实性假乳头状瘤(solid-pseudopapillary tumor of the pancreas, SPTs)的诊断价值.
方法: 回顾性分析经病理证实的30例胰SPTs的超声及超声造影(contrast enhanced ultrasonography, CEUS)表现. 将病例分为常规超声组和超声造影两组, 利用SPSS18.0软件, 用两独立样本χ2检验的Fisher确切概率法, 计算两组方法是否有统计学差异.
结果: 30例患者中, 男性1例, 女性29例, 年龄30.5岁, 其中肿块位于胰头有14例、胰体有4例、胰尾有12例, 肿物大小约1.5 cm×1.1 cm×1.8 cm-21 cm×11 cm×15 cm. 常规超声组诊断17例, 漏诊1例, 误诊为胰腺其他肿瘤8例. 超声造影组诊断4例, 误诊为胰腺其他肿瘤1例. 诊断符合率方面: 常规超声组65.4%(17/26); 超声造影组75%(3/4). 两组数据统计结果: P = 0.593, 说明两种方法之间还不具有统计学差异.
结论: SPTs具有一定的声像图定特点及临床特点, 特别是CEUS后, 了解这些能提高超声对SPTs的诊断水平.
核心提示: 超声检查是胰腺实性假乳头状瘤(solid-pseudopapillary tumor of the pancreas, SPTs)的最为常规的方法. 对于定性诊断方面, 通过超声造影(contrast enhanced ultrasonography, CEUS)可以发现SPTs的造影模式呈现出"快进快出"的特点, 这与其病理结构是有一定关系的. CEUS能够给超声医生带来更多的有关病灶的影像及灌注信息和提高诊断的信心, 对其定性诊断有一定帮助, 是一种有效、方便、安全的检查手段.
引文著录: 蔡迪明, 李永忠, 马步云, 凌文武, 姜勇, 张凌燕, 钟晓绯, 张静漪, 宋彬. 超声检查对于胰腺实性假乳头状瘤诊断的价值. 世界华人消化杂志 2013; 21(19): 1803-1810
Revised: May 19, 2013
Accepted: May 25, 2013
Published online: July 8, 2013
AIM: To investigate the diagnostic value of ultrasound in the detection of solid pseudopapillary tumor of the pancreas (SPTs).
METHODS: The data of ultrasound and contrast-enhanced ultrasound for 30 patients with pathologically confirmed SPTs were retrospectively analyzed. The rates of detection of SPTs by the two methods were compared using the χ2 test or Fisher's exact test.
RESULTS: Of 30 patients, 1 was male and the others were female. Their mean age was 30.5 years, ranging from 13 to 58 years. Fourteen tumors were located in the head of the pancreas, 4 in the body of the pancreas and 12 in the tail of the pancreas. The size of tumors ranged from 1.5 cm × 1.1 cm × 1.8 cm to 21 cm × 11 cm × 15 cm. Of 26 cases examined by ultrasound, 17 were correctly diagnosed, 1 had missed diagnosis, and 8 were diagnosed with other tumors of the pancreas. Of 4 cases examined by contrast-enhanced ultrasonography, 3 were correctly diagnosed and 1 was diagnosed with other tumor of the pancreas. There was no significant difference in the diagnostic accuracy between the two methods (64% vs 75%, P = 0.593).
CONCLUSION: SPTs exhibit some special ultrasound features, which may be helpful to diagnose this type of tumor.
- Citation: Cai DM, Li YZ, Ma BY, Ling WW, Jiang Y, Zhang LY, Zhong XF, Zhang JY, Song B. Diagnostic value of ultrasound in detection of solid pseudopapillary tumor of the pancreas. Shijie Huaren Xiaohua Zazhi 2013; 21(19): 1803-1810
- URL: https://www.wjgnet.com/1009-3079/full/v21/i19/1803.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i19.1803
胰腺实性假乳头状瘤(solid-pseudopapillary tumor of the pancreas, SPTs), 1959年由Frantz首次报道[1], 约占全部胰腺肿瘤的1%-2%[2-4], 是一种罕见的并逐渐被认识的低度恶性胰腺肿瘤. 超声是检查胰腺肿瘤的最为常规的筛查手段之一, 但对于SPTs缺乏足够的声像图特点[5,6]. 超声造影(contrast enhanced ultrasonography, CEUS)是一种新兴的超声技术, 已经广泛应用于胰腺炎和胰腺肿瘤的诊断[7-11], 由D'Onofrio等[12,13]率先报道应用. 我们采用CEUS方法用于SPTs的检查中, 分析其是否对于SPTs的诊断有所帮助. 本文回顾分析经我院证实的30例SPTs的超声及CEUS表现, 分析其声像图特点, 以提高超声对该病的诊断水平.
选取2010-01/2013-04经我院收治30例患者, 其中男1例, 女29例, 年龄13-58岁, 平均年龄为30.5岁. 本组患者术前多为发现上腹部隐痛、不适, 或因发现胰腺肿块、上腹部肿块前来就诊. 所有病例均经手术治疗, 术前均进行超声检查, 术后标本均经病理证实. 采用PHILPS IU22型、GE LOGIQ E9、PHILIPS HD11型等彩超仪, 2-5 MHz宽频探头, 选用腹部条件设置, 彩色增益调至刚出现噪音之前为止.
用二维超声连续横切及纵切观察胰腺大小、形态、包膜、内部回声、血流分布; 对病变组织记录胰腺肿块的部位、大小、形态、边界、内部回声等征象; 测量肿块内部和或周边动脉收缩期最大血流速度、舒张末期血流速度、阻力指数和静脉平均血流速度等参数, 取样时使声束与血流夹角<60度. 检查胰腺周围有无淋巴结肿大, 肝脏及其他脏器有无转移病灶. 造影组病例造影剂使用声洛维, 5 mL生理盐水溶解以后, 经肘正中静脉团注, 2.0-2.4 mL/次, 采用低机械指数造影剂谐波成像软件, 记录肿块造影增强模式及特点.
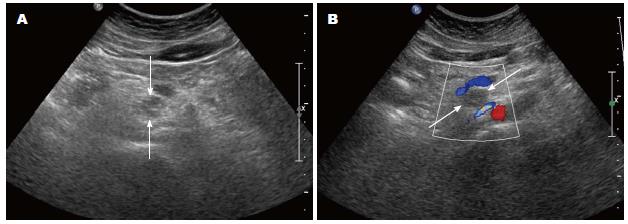
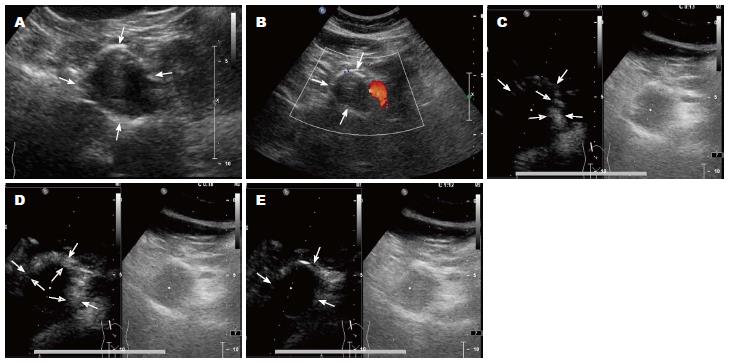
所有胰腺SPTs均经手术与病理证实. 胰腺肿块大小约1.5 cm×1.1 cm×1.8 cm-21 cm×10 cm×15 cm, 其中直径<3 cm病例数共5例(图1), 占总数16.7%(5/30). 超声诊断29例, 漏诊1例. 肿块位于胰头14例、胰体4例、胰尾12例. 肿物中包膜完整28例, 2例呈浸润生长或转移, 其中1例伴肝脏多灶转移, 1例伴有胰腺实质浸润. 术后病理证实4例肿瘤细胞具有倾向恶性倾向或低度恶性. 本组病例肿块均见于胰腺边缘, 肿块大部位于胰腺外, 故虽然肿块较大, 主胰管因受压迫出现扩张仅1例(图2). 肝脏多灶转移病灶, 最大约9.0 cm×4.5 cm×5.7 cm(图3).
将本组病例分为两组, 26例行常规检查, 4例行CEUS检查. 常规超声组诊断17例, 漏诊1例, 误诊为胰腺其他肿瘤8例. 超声造影组诊断4例, 误诊为胰腺其他肿瘤1例. 诊断符合率, 常规超声组65.4%(17/26); 超声造影组75%(3/4). 使用两独立样本χ2检验的Fisher确切概率法, 比较两者之间差异是否有统计学意义, 结果P = 0.593(表1), 说明二者之间还不具有统计学差异.
| 正确诊断 | 误诊及漏诊 | 合计 | |
| 常规超声 | 17 | 9 | 26 |
| 超声造影 | 3 | 1 | 4 |
| 合计 | 20 | 10 | 30 |
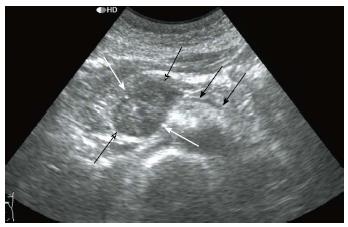
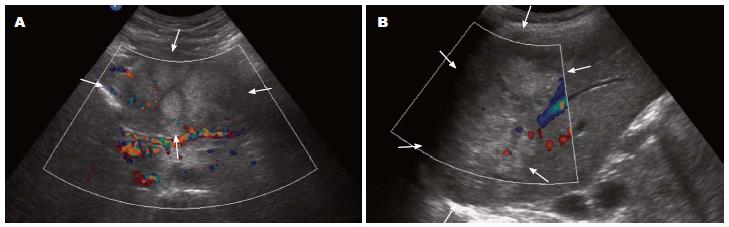
本组SPTs中, 减弱回声27例, 占90%(27/30), 稍强回声1例, 等回声1例, 无回声1例, 各占3.3%(1/30). 团块边界清楚26例, 占83.3%(26/30), 边界不清4例, 占16.7%(4/30)(表2). 团块形态规则24例, 占80%(24/30), 团块形态不规则6例, 占20%(6/30). 团块内部回声不均匀23例, 占76.7%(23/30), 内部均匀7例, 占23.3%(7/30). 团块内回声呈实性6例, 占20%(6/30), 团块内部呈囊实性23例(图4), 占76.7%(23/30), 团块内部呈囊性1例, 占3.3%(1/30); 团块内查见片状强回声(钙化)6例, 占20%(6/30). 团块内无血流信号24例, 占80%(24/30), 内部可见点状血流信号6例, 占20%(6/30).
| 肿块性质 | 病例数(n) | 发生率(%) |
| 边界 | ||
| 清楚 | 26 | 66.7 |
| 不清楚 | 4 | 33.3 |
| 形态 | ||
| 规则 | 24 | 80 |
| 不规则 | 6 | 20 |
| 病灶回声 | ||
| 稍强回声 | 1 | 3.3 |
| 等回声 | 1 | 3.3 |
| 弱回声 | 27 | 90 |
| 无回声 | 1 | 3.3 |
| 病灶均匀与否 | ||
| 均匀 | 7 | 23.3 |
| 不均匀 | 23 | 76.7 |
| 病灶回声性质 | ||
| 实性 | 6 | 20 |
| 囊实性 | 23 | 76.7 |
| 囊性 | 1 | 3.3 |
| 病灶是否钙化 | ||
| 有钙化 | 6 | 20 |
| 无钙化 | 24 | 80 |
| 主胰管 | ||
| 有扩张 | 1 | 3.3 |
| 无扩张 | 29 | 96.7 |
| 病灶内血流 | ||
| 有血流 | 6 | 20 |
| 无血流 | 24 | 80 |
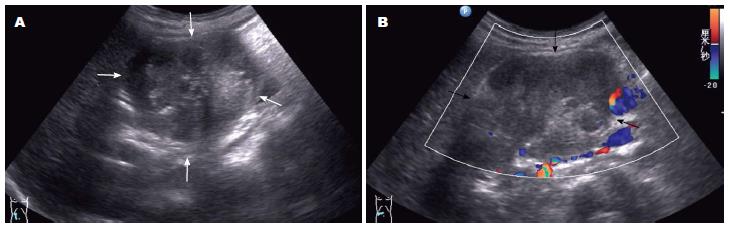
CEUS表现, 动脉期肿块边缘及内壁实性成分呈厚壁样高增强, 肿块内可见大片无增强区域, 表现为厚壁囊性增强, 实质期肿块内壁实性成分快速廓清, 表现为厚壁转变为薄壁, 肿块内无增强区域面积较动脉期明显扩大, 实质晚期肿块边缘囊壁逐步廓清, 呈低增强(图5).
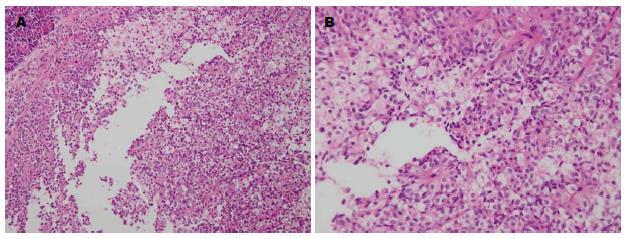
2.2.1 巨检: 30例SPTs有完整包膜28例, 肿瘤切面呈棕褐色肿块, 呈圆形、椭圆形, 外有完整或不完整的纤维薄膜, 其表面血管丰富. 2例包膜不完整且与周围界限不清, 与周围组织部分粘连. 肿瘤切面呈囊实性, 内壁常附有松软暗红色絮状物, 囊性区呈多房状, 实性区域与囊性区域以不同比例的混合, 囊性区内含暗褐色粘稠液体, 实性区域呈灰褐色, 6例瘤体内部可见钙化.
2.2.2 镜检: 组织学上, 所有病例表现相似: 均可见实性区, 假乳头样结构和囊性区. 实性区瘤细胞呈圆或椭圆形、片状或巢状排列, 内有纤细中小血管分隔, 其呈胞质浅淡或透明状, 核呈卵圆形或卵圆形, 核仁不明显, 罕有核分裂象. 假乳头状区显示特征性分支状乳头, 内含有纤维血管轴心, 肿瘤细胞在乳头表面排列整齐, 形成假小梁, 乳头轴心内胶原纤维部分黏液样变性. 其间有大量薄壁血管或血窦. 间质内可见泡沫组织细胞聚集及胆固醇裂隙. 囊性区内常常可见出血、坏死(图6).
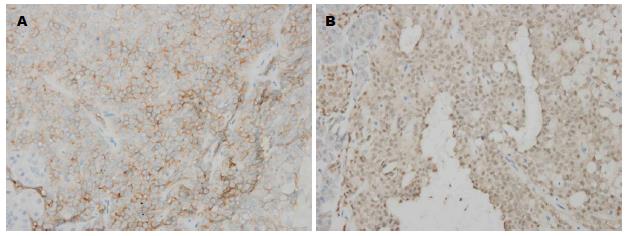
2.2.3 免疫组织化学: 30例SPTP 中18例CD56(+), 26例CD10(+), 15例Syn(+), 18例β-Catenin(+), 5例Vim(+), 4例Ki-67(+), 3例CK8(+), 2例CK18(+), 3例CgA(+), 3例PR(+)(图7).
SPTs是一种较为罕见的胰腺低度恶性肿瘤, 好发于青春期或年轻女性, 本组病例中女29例, 占96.7%(29/30), 年龄13-58岁, 平均年龄为30.5岁. 由于其发病与性别、年龄有密切联系, 因而在诊断时要注意这些特点, 对于SPTs的诊断有一定的帮助[6,14].
SPTs属于低度恶性肿瘤, 较少出现浸润或转移. 本组病例中1例出现肝脏多灶转移者, 病灶也是最大的, 大小约21 cm×10 cm×15 cm, 肝内查见多个囊实混合性及稍强回声团, 最大约9.0 cm×4.5 cm, 边界清楚, 形态不规则, 内血流信号不丰富. 从声像图表现可以看出肝内转移灶的表现与SPTs的是相似的. 本组病例中还有1例, 术中发现SPTs对于胰腺实质浸润, 病灶大小为4.0 cm×3.7 cm×3.5 cm, 术后病理证实肿瘤浸润胰腺实质. 由此可见SPTs出现转移或浸润, 与其病灶大小并无直接关系, 而与肿瘤的生物学特性密切相关. 本组病例术中取得数个淋巴结标本, 经病理检查均未发现淋巴结受累, 也证实了SPTs是一种低度恶性肿瘤, 淋巴结转移罕见[15].
SPTs往往位于胰腺边缘, 呈膨胀性向外生长, 因而胰管罕有因肿块压迫梗阻而出现扩张的表现, 本组病例中仅1例出现主胰管扩张, 主胰管无扩张29例, 占总病例96.7%. 而胰腺恶性肿瘤往往因呈浸润性生长, 胰管会因肿块压迫梗阻而出现扩张的表现. 这也是STPs与胰腺恶性肿瘤鉴别的鉴别要点. SPTs内部回声以弱回声为主, 常常表现为囊实混合回声, 本组病例中弱回声27例, 而囊实混合回声亦有23例, 分别占总数90.0%和76.7%. 钙化灶在SPTs中亦是常见, 本组病例中6例出现钙化, 占总病例20%. 由于SPTs内部以液性成分为主, 可以出现内见乳头状隆起, 而由于生长速度过快而出现出血、液化、出血以及机化等病理改变[16]. 而SPTs中, 乳头状隆起中, 血供较为丰富, 但由于出现坏死, 因而多普勒超声往往不能检查出其血流状况, 或仅见较为稀疏的血流信号. 本组病例中, 病灶内均未测出血流信号24例, 占总数80%.
CEUS的表现, 根据有关研究[17-22], 将胰腺造影的动脉期和实质期以30 s为界进行划分, SPTs总体表现为乏血供, 动脉早期肿块边缘及内部实性成分表现为高增强, 而实性成分间则表现为无增强, 进入实质期后, 团块实性成分增强模式快速廓清, 呈低增强, 包膜廓清较内部实性成分慢, 表现为逐步低增强, 实质晚期则较周围实质表现为低增强, 因此SPTs的造影模式表现为"快进快出", 与本组SPTs的CEUS的表现一致. 根据病理学特征及CT、MRI的影响表现[23,24], 结合CEUS的原理, 我们认为形成以上征象的病理基础是: SPTs瘤细胞常排列成巢状、片状, 其间被小血管分隔, 肿瘤组织包绕血管形成类似"假菊团", 肿瘤组织之间存在广泛的血窦, CEUS后, 超声造影剂的动脉期出现在血窦内, 出现肿瘤内实性成分及内壁实性成分的快速高增强表现. 而远离血管的肿瘤细胞容易产生退行性变, 表现内囊性成分, 为不同程度的液化、坏死和出血, 故而内部表现为造影后无增强的表现. 由于血窦内血流速度快, 造影剂不能长时间停留, 实质期是该区域内造影剂廓清而表现为低增强, 从而形成CEUS"快进快出"的表现[25,26].
根据Baek等研究[27], SPTs的直径<3 cm, 其CT或MRI的表现异于SPTs直径>3 cm组, 被认为是SPTs的"不典型表现". 本组病例中, 直径<3 cm病例数共5例, 占总数16.7%(5/30). 分析这些声像图特点: 由于肿块体积较小, 肿块内部以实性成分为主, 回声较为均匀, 没有出现明显液化成分, 回声有等回声、弱回声及无回声, 无明显血流信号, 边缘清晰, 形态规则. 而SPTs直径>3 cm组共计25例, 占总数83.3%(24/30). 肿块内可见明显的囊实性成分, 回声也以弱回声为主, 无明显血流信号, 边缘清楚, 形态欠规则. 可以可见, 体积的大小与声像图的表现有一定联系, 与该文献报道一致. SPTs通常体积较大, 本组病例中直径>5 cm的肿块24例, 占总数的80%(24/30). 当然, 对于直径超过10 cm巨大肿块, 超声在确定肿块来源于胰腺与否方面还存在一定的困难[28]. SPTs需要与其他胰腺肿瘤鉴别, 如胰腺囊腺瘤、无功能性神经内分泌肿瘤. 胰腺囊腺瘤表现为低回声, 内部也以囊实混合回声为主, 好发于中老年女性, 能引起主胰管的扩张, CEUS的增强模式以乏血供表现为主, 内部仅是分隔及实性成分出可见增强, 但病灶边界不清, 常常浸润实质而使病灶形态不规整、边界不清楚. 无功能性神经内分泌肿瘤多以等回声为主, 内部以实性为主, 较少出现液性暗区, 且内部血流信号丰富, CEUS的增强模式以富血供表现为主, 表现为动脉期病灶内部高增强, 较SPTs的增强快, 而廓清较SPTs慢[29,30]. 诊断要点: 年轻女性, 腹痛不明显或肿块大小与体征不对称, 超声表现为胰腺肿块体积较大, 肿块以弱回声为主, 内部回声以囊实性成分为主, 边界清楚, 形态规则, 可见点、片状钙化强回声, 内部罕有血流信号, 主胰管无扩张. 特别要注意的是对于直径<3 cm的SPTs, 要注意声像图表现的"不典型"性, 减少误诊的发生. CUES表现为动脉期肿块边缘高增强, 内部实性成分呈高增强, 液性成分呈无增强, 实质期表现为内部实性成分快速廓清, 呈低增强或稍低增强, 边缘呈稍高增强.
本组病例中, 两组病例进行统计分析后, 发现结果P>0.05, 说明两种方法没有统计学意义. 我们认为最主要的原因是造影组病例太少(n = 4), 在以后的工作中, 提高造影组病例数是进行统计分析的基础. 本组病例中, 超声造影组的诊断准确率要高于普通超声检查组(5.0% vs 65.4%), 在一定程度上说明CEUS对于SPTs的诊断当中是有一定帮助的. 通过CUES能够对检查者更多的诊断依据和诊断信心, 特别是对于传统超声难以鉴别时, 如胰腺囊腺瘤、神经内分泌肿瘤等, CUES能带来肿物更多的信息和提高检查者的诊断信心.
总之, 对于SPTs诊断, 超声及CUES能够提供安全、准确的诊断, 是胰腺肿瘤检查的重要影像学手段之一. 随着CUES的开展和不断成熟, 我们相信能够在胰腺肿瘤的诊断和鉴别中发挥更加重要的作用.
胰腺实性假乳头状瘤(solid-pseudopapillary tumor of the pancreas, SPTs)是一种罕见的胰腺交界性肿瘤, 常规超声在定性诊断时由于缺乏特异性声像图特点而常常发生误诊, 为了提高超声对于该肿瘤诊断的准确性, 我们提出利用超声造影(contrast enhanced ultrasonography, CEUS)的方法对该肿瘤进行检查, 并取得了一定的效果.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
CEUS早已不再单纯应用于肝脏的肿瘤, 对胰腺炎、胰腺肿瘤也有广泛的应用. SPTs由于发病率低, CEUS方面的报道也较胰腺其他肿瘤少.
D'Onofrio等于2004年率先报道CEUS应用于胰腺疾病的研究, 并得到的广泛的影响, 对CEUS技术应用于胰腺肿瘤诊断方面具有开创性的意义.
本文收集了较大样本的SPTs病例, 比较详尽地描述了常规超声和CEUS对SPTs的各自超声声图像的表现和特点, 对超声医生了解该病和定性诊断都有较大的帮助.
本文对于SPTs的CEUS病例数较少, 因而统计方面还没有显示出与常规超声有明显的差异. 我们相信随着造影病例的增加, CEUS会在诊断方面体现应有的价值.
SPTs少见, 作者能收集30例, 实属不易, 尽管国内有关常规超声检查对于其诊断价值报道较多, 但与CEUS对比观察的报道较少, 对临床应用有一定参考价值.
编辑: 田滢 电编:鲁亚静
| 1. | Fratz VK. Tumors of the pancreas. Anonymous atlas of tumor pathology. Washington DC: Armed Forces Institute of Pathology 1959; 32-33. |
| 2. | Bektas H, Werner U, Kaaden S, Philippou S, Klöppel G, Klempnauer J. Solid-pseudopapillary tumor of the pancreas--a rare and frequently misdiagnosed neoplasm. Langenbecks Arch Surg. 1999;384:39-43. [PubMed] [DOI] |
| 3. | Matsunou H, Konishi F. Papillary-cystic neoplasm of the pancreas. A clinicopathologic study concerning the tumor aging and malignancy of nine cases. Cancer. 1990;65:283-291. [PubMed] [DOI] |
| 4. | Martin RC, Klimstra DS, Brennan MF, Conlon KC. Solid-pseudopapillary tumor of the pancreas: a surgical enigma? Ann Surg Oncol. 2002;9:35-40. [PubMed] [DOI] |
| 5. | Buetow PC, Buck JL, Pantongrag-Brown L, Beck KG, Ros PR, Adair CF. Solid and papillary epithelial neoplasm of the pancreas: imaging-pathologic correlation on 56 cases. Radiology. 1996;199:707-711. [PubMed] |
| 6. | Vtyurin BV, Chekmaryova IA, Dubova EA, Podgornova MN, Shchegolev AI. Ultrastructural characteristics of solid pseudopapillary tumors of the pancreas. Bull Exp Biol Med. 2011;151:230-233. [PubMed] [DOI] |
| 7. | Rickes S, Mönkemüller K, Malfertheiner P. Acute severe pancreatitis: contrast-enhanced sonography. Abdom Imaging. 2007;32:362-364. [PubMed] [DOI] |
| 8. | Rickes S, Uhle C, Kahl S, Kolfenbach S, Monkemuller K, Effenberger O, Malfertheiner P. Echo enhanced ultrasound: a new valid initial imaging approach for severe acute pancreatitis. Gut. 2006;55:74-78. [PubMed] [DOI] |
| 9. | D'Onofrio M, Gallotti A, Principe F, Mucelli RP. Contrast-enhanced ultrasound of the pancreas. World J Radiol. 2010;2:97-102. [PubMed] [DOI] |
| 10. | Rickes S, Rauh P, Uhle C, Ensberg D, Mönkemüller K, Malfertheiner P. Contrast-enhanced sonography in pancreatic diseases. Eur J Radiol. 2007;64:183-188. [PubMed] [DOI] |
| 11. | Rennert J, Farkas S, Georgieva M, Loss M, Dornia C, Jung W, Stroszczynski C, Jung EM. Identification of early complications following pancreas and renal transplantation using contrast enhanced ultrasound (CEUS) - first results. Clin Hemorheol Microcirc. 2013; Feb 4. [Epub ahead of print]. [PubMed] |
| 12. | D'Onofrio M, Caffarri S, Zamboni G, Falconi M, Mansueto G. Contrast-enhanced ultrasonography in the characterization of pancreatic mucinous cystadenoma. J Ultrasound Med. 2004;23:1125-1129. [PubMed] |
| 13. | D'Onofrio M, Mansueto G, Falconi M, Procacci C. Neuroendocrine pancreatic tumor: value of contrast enhanced ultrasonography. Abdom Imaging. 2004;29:246-258. [PubMed] [DOI] |
| 14. | Ohtsuka T, Tsutsumi K, Ideno N, Takahata S, Nakamura M, Tanaka M. [Pancreatic tumor: progress in diagnosis and treatment. Topics: III. Pancreatic endocrine tumor; 2. Current status of the treatment of pancreatic neuroendocrine tumors]. Nihon Naika Gakkai Zasshi. 2012;101:109-115. [PubMed] |
| 15. | Li JX, Wu H, Huang JW, Prasoon P, Zeng Y. Synchronous intraoperative radiofrequency ablation for multiple liver metastasis and resection of giant solid pseudopapillary tumors of the pancreas. Chin Med J (Engl). 2012;125:1661-1663. [PubMed] |
| 16. | The challenge of combination antiretroviral therapy. Proceedings of a symposium. June 20, 1990, San Francisco, California. Am J Med. 1991;90:1S-30S. [PubMed] |
| 17. | Tang SS, Huang LP, Wang Y, Ma Y. Solid pseudopapillary tumors of the pancreas: contrast-enhanced sonographic features. J Ultrasound Med. 2012;31:257-263. [PubMed] |
| 18. | Napoleon B, Alvarez-Sanchez MV, Gincoul R, Pujol B, Lefort C, Lepilliez V, Labadie M, Souquet JC, Queneau PE, Scoazec JY. Contrast-enhanced harmonic endoscopic ultrasound in solid lesions of the pancreas: results of a pilot study. Endoscopy. 2010;42:564-570. [PubMed] [DOI] |
| 19. | Xie XY, Xu EJ, Xu HX, Xu ZF, Liu GJ, Zheng YL, Liang JY, Huang B, Lü MD. [Role of contrast-enhanced ultrasound in the differentiation of solid focal lesions of pancreas]. Zhongguo Yixue Kexueyuan Xuebao. 2008;30:35-39. [PubMed] |
| 20. | Grossjohann HS, Bachmann Nielsen M, Nielsen KR, Hansen CP, Svendsen LB, Stadil F. Evaluation of contrast-enhanced ultrasound of the pancreas combined with concurrent hormone stimulation. Ultraschall Med. 2008;29:520-524. [PubMed] [DOI] |
| 21. | Yao X, Ji Y, Zeng M, Rao S, Yang B. Solid pseudopapillary tumor of the pancreas: cross-sectional imaging and pathologic correlation. Pancreas. 2010;39:486-491. [PubMed] [DOI] |
| 22. | Badea R, Seicean A, Diaconu B, Stan-Iuga R, Sparchez Z, Tantau M, Socaciu M. Contrast-enhanced ultrasound of the pancreas--a method beyond its potential or a new diagnostic standard? J Gastrointestin Liver Dis. 2009;18:237-242. [PubMed] |
| 23. | Kawamoto S, Scudiere J, Hruban RH, Wolfgang CL, Cameron JL, Fishman EK. Solid-pseudopapillary neoplasm of the pancreas: spectrum of findings on multidetector CT. Clin Imaging. 2011;35:21-28. [PubMed] [DOI] |
| 24. | Cantisani V, Mortele KJ, Levy A, Glickman JN, Ricci P, Passariello R, Ros PR, Silverman SG. MR imaging features of solid pseudopapillary tumor of the pancreas in adult and pediatric patients. AJR Am J Roentgenol. 2003;181:395-401. [PubMed] [DOI] |
| 26. | 杨 世平, 鲁 昌立, 黄 子星, 宋 彬, 吴 苾. 胰腺实性假乳头状瘤的CT表现与病理对照(附8例分析). 中国普外基础与临床杂志. 2011;85-88. |
| 27. | Baek JH, Lee JM, Kim SH, Kim SJ, Kim SH, Lee JY, Han JK, Choi BI. Small (& lt; or=3 cm) solid pseudopapillary tumors of the pancreas at multiphasic multidetector CT. Radiology. 2010;257:97-106. [PubMed] [DOI] |
| 29. | Sahara S, Kawai N, Sato M, Ikoma A, Minamiguchi H, Nakai M, Sanda H, Nakata K, Takeuchi T, Tanaka T. Differentiation of pancreatic serous cystadenoma from endocrine tumor and intraductal papillary mucinous neoplasm based on washout pattern on multiphase CT. J Comput Assist Tomogr. 2012;36:231-236. [PubMed] [DOI] |
| 30. | Hayashi K, Fujimitsu R, Ida M, Sakamoto K, Higashihara H, Hamada Y, Yoshimitsu K. CT differentiation of solid serous cystadenoma vs endocrine tumor of the pancreas. Eur J Radiol. 2012;81:e203-e208. [PubMed] [DOI] |