修回日期: 2013-05-15
接受日期: 2013-05-25
在线出版日期: 2013-06-28
目的: 研究miR495、miR551a干扰质粒对SGC7901胃癌细胞中促肝细胞再生磷酸酶-3(phosphatase of regenerating liver-3, PRL-3)表达的影响, 探讨基因干扰在胃癌治疗中的价值.
方法: 分别体外培养稳定转染后的SGC7901细胞系及未经处理的SGC7901细胞系, 取对数生长期瘤细胞, 0.5 mL(1×107/mL)细胞悬液接种于Balb/ca(nu/nu)裸鼠腹腔内, 在SPF条件下饲养1 mo后处死, 观察裸鼠成瘤率、瘤体生长情况及腹膜转移等情况, 并行组织病理学检查. 取各组部分移植瘤行荧光定量PCR检测, 对比各组miR495、miR551a及PRL-3mRNA的相对表达水平.
结果: 各组裸鼠成瘤率均100%, 其中两实验组裸鼠一般情况及生存期均好于对照组. 取各组移植瘤行荧光定量PCR检测显示, 两实验组裸鼠miRNA表达量显著高于对照组, PRL-3 mRNA表达量低于对照组. 转染质粒组胃癌迁移能力明显减弱.
结论: 转染靶向干扰PRL-3表达的miR495、mi551a真核质粒可以明显抑制胃癌细胞体内转移侵袭能力.
核心提示: 促肝细胞再生磷酸酶-3(phosphatase of regenerating liver-3, PRL-3)在胃癌细胞转移侵袭中起着重要的作用, 通过miR495、miR551a质粒靶向干扰PRL-3表达的下调可以抑制PRL-3 mRNA的表达, 可以降低胃癌细胞在裸鼠体内转移侵袭的能力.
引文著录: 许牧, 曹毅, 蒋蒙蒙, 揭志刚, 李正荣. miR495、miR551a靶向干扰PRL-3表达抑制胃癌腹膜转移. 世界华人消化杂志 2013; 21(18): 1693-1700
Revised: May 15, 2013
Accepted: May 25, 2013
Published online: June 28, 2013
AIM: To investigate the effect of miR495 and miR551 on PRL-3 expression in gastric cancer SGC7901 cells to explore gene interference therapies for gastric cancer.
METHODS: SGC7901 cells stably transfected with miR495 or miR551a and non-transfected SGC7901 cells were inoculated intraperitoneally in BALB/CA (nu/nu) nude mice. One month after inoculation, the mice were killed to observe the rate of tumor formation, tumor growth and migration. Real-time PCR was performed to quantify mRNA levels of miR495, miR551a and PRL-3.
RESULTS: Compared to nude mice inoculated with non-transfected cells, miR495 and miR551a levels were increased, PRL-3 level was decreased, and migration of gastric cancer was suppressed in mice inoculated with SGC7901 cells stably transfected with miR495 or miR551a.
CONCLUSION: MiR495 and miR551a can suppress the migration of gastric cancer by inhibiting PRL-3 expression in mice.
- Citation: Xu M, Cao Y, Jiang MM, Jie ZG, Li ZR. MiR495- and miR551a-mediated down-regulation of PRL-3 expression inhibits peritoneal metastasis in a mouse model of gastric cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(18): 1693-1700
- URL: https://www.wjgnet.com/1009-3079/full/v21/i18/1693.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i18.1693
胃癌是对人类健康威胁极大的恶性肿瘤, 其仍是世界上第4大常见肿瘤及肿瘤相关死亡的第2大原因[1]. 尽管现代医学诊断有着显著的进步, 但临床上诊治的胃癌多为中、晚期. 接受一期手术及术后放化疗的患者预后仍不理想, 术后胃癌腹膜转移是最重要、最常见的死亡原因[2]. 伴有腹膜转移的晚期胃癌患者5年生存率仅为15.3%[3]. 因此, 从分子水平探索胃癌腹膜转移发生、发展的机制, 为胃癌诊断和治疗提供新的理论和依据. microRNA(miRNA)是一类内源性非蛋白编码的单链小分子RNA, 其广泛参与调控基因表达、细胞增殖、分化及凋亡等多种生物过程. miRNA的发现为研究肿瘤转移的基因表达调控机制提供了新的视角, 为诊断和治疗癌症提供了一个强大的工具[4]. 促肝细胞再生磷酸酶-3(phosphatase of regenerating liver-3, PRL-3)是新近发现的与肿瘤转移密切相关的蛋白酪氨酸磷酸酶. 已有报道证实其在胃癌中呈高表达[5]. 我们的前期研究中发现PRL-3在腹膜转移灶中有高表达[6,7]并发现miR495和miR551a在胃癌组织中呈明显低表达. 进一步体外实验中我们构建了miR495和miR551a的真核表达载体, 转染胃癌SGC7901细胞, 并证实其抑制胃癌SGC7901细胞PRL-3基因的表达[8]. 在此次的研究中, 我们构建了miR495、miR551a靶向干扰SGC7901细胞PRL-3基因裸鼠胃癌转移瘤模型, 观察裸鼠成瘤率、瘤体生长及腹膜转移等情况, 并行组织病理学检查, 进一步在体内实验中证实miR495、miR551a靶向干扰效果.
胃癌细胞株SGC7901购自上海中科院细胞库. 在我们的前期研究中成功构建并稳定转染miR495、miR551a及无关序列质粒的胃癌细胞SCG7901[9]. 胃癌细胞株均使用DMEM+10%胎牛血清培养液, 置于36.5 ℃、5%CO2恒温孵育箱中培养. 取生长对数期细胞进行实验, 用0.25%胰酶消化细胞, 制成细胞悬液并计数. 台盼蓝染色测试细胞活性>98%, 调整细胞浓度1×107个/mL. 4-6 wk裸鼠(Balb/ca nu/nu), 共48只, 雌雄各半, 体质量17-20 g, 购自湖南斯莱克景达实验动物有限公司[实验动物许可证号SCXK(湘)2011-0003]. 所有裸鼠均在无特殊病原体(specific pathogen free, SPF)条件下饲养. 温度25 ℃左右, 空气流速为20 cm3/s, 空气相对湿度为55%. 所用食物和水均灭菌处理. 将48只裸鼠随机分成4组: miR495实验组为接种稳定转染miR495真核表达载体的胃癌SGC7901细胞, 共12只; miR551a实验组为接种稳定转染miR551a真核表达载体的胃癌SGC7901细胞, 共12只; 空白对照组为接种转染无关序列质粒的SGC7901细胞, 共12只; 阴性对照组为接种未经处理的胃癌SGC7901细胞, 共12只.
1.2.1 移植瘤模型的建立: 所有裸鼠用1%的戊巴比妥钠50 mg/kg剂量腹腔注射进行麻醉. 于裸鼠腹部正中作一0.1 cm大小的切口, 按以上分组将(1×107/mL)0.5 mL未处理胃癌SGC7901及稳定转染miR495、miR551a、无关序列质粒的胃癌细胞SCG7901悬浮液注入裸鼠腹腔内, 关腹.
1.2.2 裸鼠生长和腹腔内成瘤情况的观察: 观察裸鼠精神状态、活动、饮食等情况. 在SPF条件下饲养30 d后各组处死6只裸鼠, 观察裸鼠腹腔内成瘤率、瘤体生长及腹膜转移等情况, 切取部分瘤体行组织病理学染色. 各组剩余裸鼠继续饲养观察其生存周期.
1.2.3 实时荧光定量PCR检测转移瘤中miR495、miR551a及PRL-3在mRNA的表达水平: 实时荧光定量PCR试剂TRIzol试剂盒(购自Invitrogen公司); RevertAidTM First Strand cDNA Synthesis Kit(购自Fermentas公司); Real-time SYBR Premix Ex Taq试剂盒(购自TaKaRa公司). miRNA茎环逆转录引物及PRL-3 mRNA实时荧光定量PCR引物设计见表1, 2. 第30天处死裸鼠, 各组取部分肿瘤组织, 采用TRIzol试剂盒提取组织总RNA, RevertAidTM First Strand cDNA Synthesis Kit反转录获取cDNA, 引物设计如下: 实时荧光定量PCR反应选用Real-time SYBR Premix Ex Taq试剂盒. PCR扩增反应条件: 95 ℃ 4 min; 95 ℃ 20 s, 60 ℃ 30 s, 70 ℃ 30 s, 共循环35次, 采用U6 snRNA及β-actin分别作为两组miRNA及PRL-3基因的内参照, 绘制PCR扩增曲线. 通过对比miR495、miR551a与U6 snRNA及PRL-3与β-actin基因的循环阈(Ct)值,评价miR495、miR551a及PRL-3 mRNA相对表达水平. 用相对定量方法(2-△△Ct)分析PCR检测结果.
| 引物名称 | 引物序列 |
| RT: 5'- GCGCGTGAGCAGGCTGGAGAAATTAACCACGCGCAAGAAG-3' | |
| miR495 | F: 5'-AAACAAACATGGTGCA-3' |
| R: 5'-GAGCAGGCTGGAGAA-3' | |
| RT: 5'-GCGCGTGAGCAGGCTGGAGAAATTAACCACGCGCTGGAAAC-3' | |
| miR551a | F: 5'-GCGACCCACTCTTG-3' |
| R: 5'-GAGCAGGCTGGAGAA-3' | |
| RT: 5'-CGCTTCACGAATTTGCGTGTCAT-3' | |
| U6 | F: 5'- CTCGCTTCGGCAGCACATA-3' |
| R: 5'- CGCTTCACGAATTTGCGTG-3' |
| 引物名称 | 引物序列 |
| PRL-3 | F: 5'- GGGACTTCTCAGGTCGTGTC-3' |
| R: 5'- AGCCCCGTACTTCTTCAGGT-3' | |
| β-actin | F: 5'- TCATCACCATTGGCAATGAG-3' |
| R: 5'- CACTGTGTTGGCGTACAGGT-3' |
统计学处理 实验数据均采用mean±SD表示, 采用SPSS13.0统计软件. 计量资料采用单因素方差分析. 设P<0.05为差异有统计学意义.
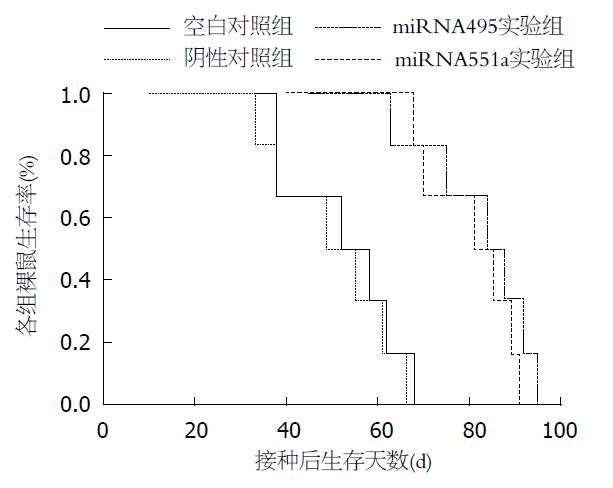
各组裸鼠成瘤率均为100%(12/12). 裸鼠接种后7 d一般情况无明显异常. 接种14 d后两对照组裸鼠出现精神萎靡、食欲差、畏寒、行动迟缓. 实验组裸鼠一般情况良好. 其中, miR495实验组、miR551a实验组与空白对照组、阴性对照组裸鼠中位生存期分别为84、81 d及52、49 d. 表明两实验组裸鼠生存周期明显长于对照组(图1).
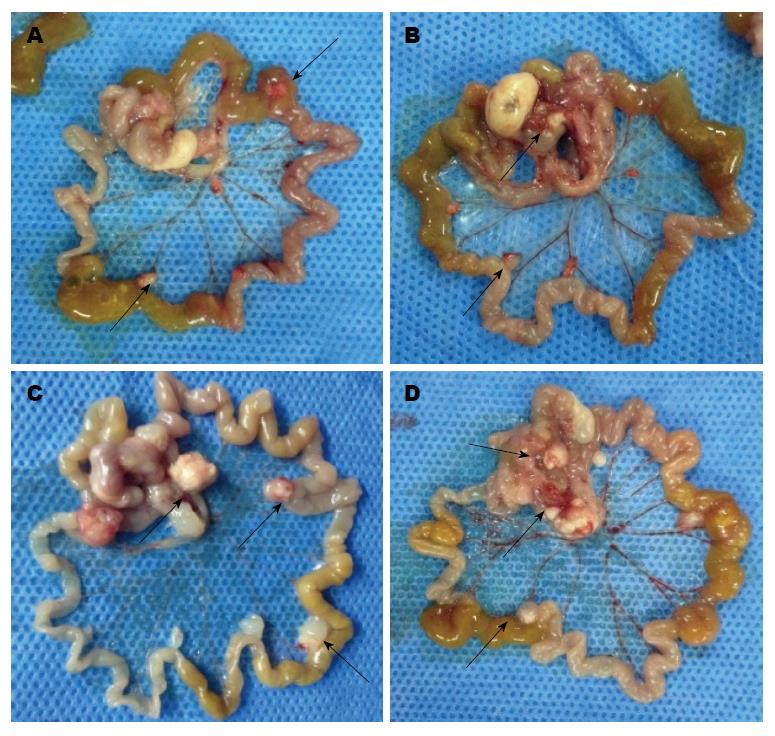
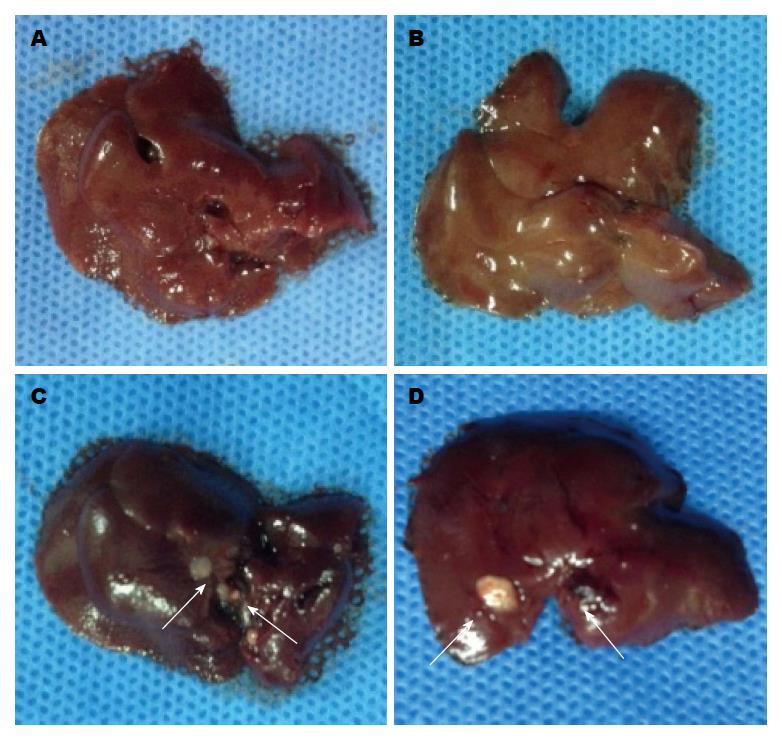
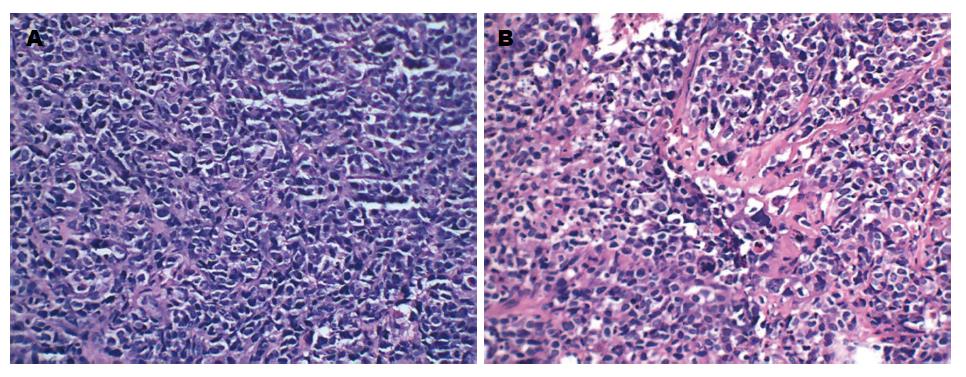
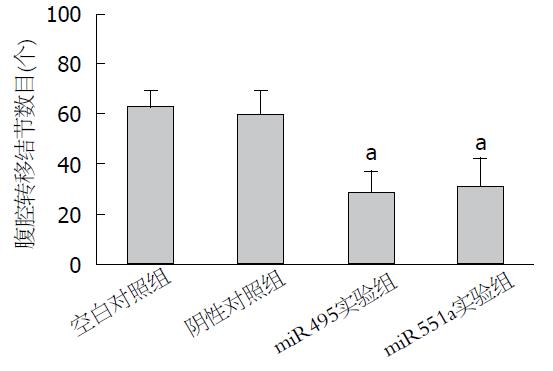
在SPF条件下饲养30 d后处死各组裸鼠6只观察移植瘤生长情况, 其中miR495实验组及miR551a实验组可见大网膜、肠系膜有散在转移结节, 结节呈灰白色, 大小不一, 质地较硬. 与两对照组比较而言, 两组实验组转移结节相对较少, 体积较小, 其中两对照组肝脏均有灰白色转移结节(图2, 3). 切取部分结节HE染色可见癌细胞呈巢状或条锁状分布, 肿瘤细胞大小不一, 核大, 深染, 可见较多核分裂像(图4). 同时, 我们统计了各组腹膜转移结节的数目, 其中miR495实验组和miR551a实验组分别为28.1个±6.9个和30.3个±8.4个, 而空白对照组及阴性对照组分别为62.1个±11.9个、59.3个±9.1个. 两实验组显著少于两对照组(P<0.05)(图5).
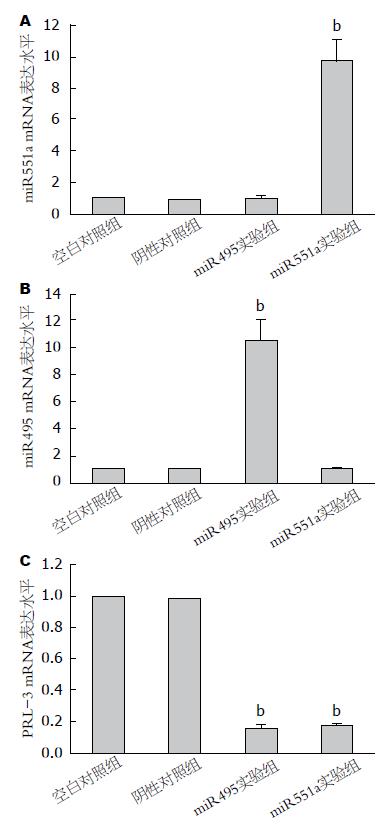
依据Ct值间的比较, 通过2-△△Ct法分别计算各组送检肿瘤组织样品中miRNA及PRL-3表达变化比率. 我们发现miR495实验组送检肿瘤组织中, miR495表达量显著高于其余3组(P<0.05). miR551a实验组送检肿瘤组织中, miR551a表达量显著高于其余3组(P<0.01). miR495实验组和miR551a实验组PRL-3 mRNA表达量显著低于两对照组(P<0.01)(图6).
肿瘤的发生发展是一个复杂的过程, 包括癌细胞的恶性转化、增殖、侵袭、转移. 其中肿瘤细胞的侵袭和转移是癌症患者死亡的主要原因, 约90%的癌症患者死于肿瘤的转移扩散[10]. 尽管现代医学治疗胃癌以根治性手术及术后放、化疗为主, 但术后胃癌腹膜转移率仍令人堪忧. Moon等[11]调查了500例接受胃癌根治术及淋巴结清扫术的胃癌患者, 发现51.7%的患者术后5年发生胃癌腹膜转移. 此外Sakuramoto等[12]调查了530例接受高度标准化根治性胃大部切除术的胃癌患者, 发现其中15.8%的患者在术后3年内发生胃癌腹膜转移. 而患者术后一旦发生胃癌腹膜转移, 治疗手段较乏力, 且患者预后较差. 目前, 对于胃癌腹膜转移的治疗方式很多, 近年来有学者[13]采用腹腔化疗(intraperitoneal chemotherapy, IPC)及其衍生的腹腔内温热化疗(hyperthermic intraperitoneal chemotherapy, HIPEC)、低渗透压腹腔内化疗(hypotonicintraperitonealchemotherapy, HIC), 但是总体的治疗效果尚不能令人能满意. 因此在分子水平寻求胃癌腹膜转移的机制, 为诊断、治疗胃癌腹膜转移提供有力的依据已迫在眉睫.
PRL-3因其在肿瘤生长、侵袭、转移等过程中发挥重要作用而受到国内外学者的关注. 自2001年Saha等[14]发现PRL-3与结肠癌细胞的转移密切相关以来, 人们对其的研究也愈加深入, 现已有报道证实其在肠癌[15-17]、胃癌[18,19]、肺癌[20]、乳腺癌[21]、口腔癌[22]等多种癌症中呈高表达. Miskad等[23]研究发现PRL-3高表达在胃癌患者中淋巴结转移占55.6%, 无淋巴结转移占10%, 表明PRL-3的高表达可能参与胃癌的发展和转移. Zeng等[24]在仓鼠卵巢癌细胞(Chinese hamster ovary cell, CHO)研究中, 发现高表达的PRL-3能促进CHO的迁移和侵袭能力. 这表明PRL-3在肿瘤转移中起着重要的作用. 尽管PRL-3促进肿瘤细胞转移的机制尚不完全清楚, 但其有可能成为肿瘤治疗的靶点、肿瘤临床诊断的标志物及预后评估的指标. Sun等[25]培养SGC7901细胞株, 分别并加入大黄素(15、30、45、60 μmol/L). 观测其抑制细胞生长及侵袭能力, 同时检测PRL-3的表达. 结果显示PRL-3的表达下调参与了大黄素诱导SGC -7901细胞株的增殖抑制和凋亡诱导. 可见降低PRL-3的表达可能成为治疗胃癌腹膜转移一个新的途径.
miRNA是一种调控编码基因的RNA, 通过其可以调控肿瘤基因, 在人类癌症的发生和发展中起关键作用. miRNA因其具有良好的组织特异性、在肿瘤及正常组织表达差异性, 其可能成为一个潜在的新的肿瘤标志物. Zhang等[26]发现miR-21、miR-17及miR-19a诱导PRL-3基因的表达促进结肠癌增殖及侵袭. 此外, Tsujiura等[27]通过对比34名胃癌患者与15名正常人血浆中miRNA的浓度, 发现胃癌患者miR-106a、miR-106b血浆浓度显著高于正常人. Zhang等[28]分析了30例胃癌患者的标本, 发现其中miR-21呈明显的高表达, 且与胃癌的分化程度呈明显的正相关. 进一步研究发现miR-21表达下调使胃癌细胞侵袭性明显下降. 可见通过miRNA表达的改变抑制肿瘤细胞转移及侵袭有望成为未来治疗胃癌腹膜转移一种新的手段.
尽管本课题组之前的体外试验研究中已证实miR495、miR551a可以调控PRL-3基因表达下调, 但肿瘤细胞的生长、侵袭及转移与肿瘤的微环境密不可分[29]. 因此, 建立胃癌裸鼠腹膜转移瘤模型, 进一步在体内实验中证实miR495、miR551a靶向干扰效果显得尤为重要. 裸鼠腹腔转移瘤模型是一种实用、操作简单、成瘤率高、且容易形成转移结节的实验动物模型. Ding等[30]通过腹腔注射MKN45胃癌细胞研究阿米洛利抑制胃癌细胞生长. Mori等[31]用荧光蛋白质粒转染胃癌细胞株MKN45, 随后注入Balb/c裸鼠腹腔内构建胃癌腹膜转移模型, 同时注入5-FU及抗肿瘤新药TS-1, 利用荧光显微镜观察腹膜转移瘤生长情况, 同时对比裸鼠的生存率, 以此评估新药疗效. 这一经典的动物模型已被广泛应用, 在研究胃癌转移生物学特性及机制, 新药评估等提供了理想的途径. 在此次试验中, 我们利用两组分别转染miR495、miR551a真核表达载体的SGC7901胃癌细胞成功构建了裸鼠腹腔移植瘤. 并观察了其中两实验组裸鼠一般情况、生存期及腹腔移植瘤生长情况均好于两对照组. 实时荧光定量PCR检测显示, 两实验组裸鼠miRNA表达量显著高于对照组, PRL-3 mRNA表达量低于对照组.
总之, PRL-3在胃癌细胞转移侵袭中起着重要作用, 转染靶向干扰PRL-3表达的miRNA质粒可以明显抑制PRL-3 mRNA的表达, 降低胃癌细胞体内转移侵袭能力. 这为进一步探寻miR495、miR551a及PRL-3在胃癌发生发展过程中的作用机制提供了较好的实验依据.
胃癌是消化系最常见的肿瘤, 治疗方式多为手术切除, 但患者术后胃癌腹膜转移率较高, 且一旦患者术后发生胃癌腹膜转移, 预后较差. 因此从分子水平探寻胃癌腹膜转移的机制, 为诊断、治疗胃癌腹膜转移提供有力的依据已迫在眉睫.
刘颖斌, 主任医师, 上海交通大学医学院附属新华医院
促肝细胞再生磷酸酶-3(phosphatase of regenerating liver-3, PRL-3)是近年来发现的属于蛋白酪氨酸磷酸酶PTPs(protein tyrosine phosphatases)家族的成员, 研究表明PRL-3与肿瘤的转移密切相关. 通过干扰PRL-3表达的下调, 达到抑制肿瘤转移的目的.
目前, 已有研究表明PRL-3在多种肿瘤组织中呈高表达, 且抑制肿瘤细胞中PRL-3的表达可以降低肿瘤的转移性, 但PRL-3在肿瘤转移过程中所发挥的机制尚不清楚, 有待进一步的研究.
通过腹腔注入胃癌细胞构建裸鼠腹腔转移瘤模型是一种实用、操作简单、成瘤率高、且容易形成转移灶的实验动物模型. 在此基础上,我们通过microRNA质粒靶向干扰PRL的表达, 并以此评估PRL-3表达的下调抑制胃癌腹膜转移的效果.
本研究发现通过microRNA质粒靶向干扰PRL-3表达的下调, 可以抑制裸鼠腹膜转移瘤, 这为进一步探寻miRNA495、miRNA551a及PRL-3在胃癌腹膜转移中的作用机制提供了较好的实验依据, 值得进一步研究和开发, 有一定的临床应用前景.
本文应用实验动物模型及实时荧光定量PCR研究PRL-3表达的下调抑制胃癌腹膜转移的效果, 实验设计合理, 实验结果客观, 具有一定的科学意义.
编辑: 黄新珍 电编:闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Li JK, Zheng M, Miao CW, Zhang JH, Ding GH, Wu WS. Peritoneal lavage cytology and carcinoembryonic antigen determination in predicting peritoneal metastasis and prognosis of gastric cancer. World J Gastroenterol. 2005;11:7374-7377. [PubMed] |
| 3. | Saito H, Kihara K, Kuroda H, Matsunaga T, Tatebe S, Ikeguchi M. Surgical outcomes for gastric cancer patients with intraperitoneal free cancer cell, but no macroscopic peritoneal metastasis. J Surg Oncol. 2011;104:534-537. [PubMed] [DOI] |
| 4. | Liu X, Liu L, Xu Q, Wu P, Zuo X, Ji A. MicroRNA as a novel drug target for cancer therapy. Expert Opin Biol Ther. 2012;12:573-580. [PubMed] [DOI] |
| 5. | Miskad UA, Semba S, Kato H, Yokozaki H. Expression of PRL-3 phosphatase in human gastric carcinomas: close correlation with invasion and metastasis. Pathobiology. 2004;71:176-184. [PubMed] [DOI] |
| 7. | Li ZR, Wang Z, Zhu BH, He YL, Peng JS, Cai SR, Ma JP, Zhan WH. Association of tyrosine PRL-3 phosphatase protein expression with peritoneal metastasis of gastric carcinoma and prognosis. Surg Today. 2007;37:646-651. [PubMed] [DOI] |
| 8. | Li Z, Cao Y, Jie Z, Liu Y, Li Y, Li J, Zhu G, Liu Z, Tu Y, Peng G. miR-495 and miR-551a inhibit the migration and invasion of human gastric cancer cells by directly interacting with PRL-3. Cancer Lett. 2012;323:41-47. [PubMed] [DOI] |
| 11. | Moon YW, Jeung HC, Rha SY, Yoo NC, Roh JK, Noh SH, Kim BS, Chung HC. Changing patterns of prognosticators during 15-year follow-up of advanced gastric cancer after radical gastrectomy and adjuvant chemotherapy: a 15-year follow-up study at a single korean institute. Ann Surg Oncol. 2007;14:2730-2737. [PubMed] [DOI] |
| 12. | Sakuramoto S, Sasako M, Yamaguchi T, Kinoshita T, Fujii M, Nashimoto A, Furukawa H, Nakajima T, Ohashi Y, Imamura H. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. N Engl J Med. 2007;357:1810-1820. [PubMed] [DOI] |
| 13. | Zhibing W, Qinghua D, Shenglin M, Ke Z, Kan W, Xiadong L, Pengjun Z, Ruzhen Z. Clinical study of cisplatin hyperthermic intraperitoneal perfusion chemotherapy in combination with docetaxel, 5-flourouracil and leucovorin intravenous chemotherapy for the treatment of advanced-stage gastric carcinoma. Hepatogastroenterology. 2013; May 10. [Epub ahead of print]. [PubMed] [DOI] |
| 14. | Saha S, Bardelli A, Buckhaults P, Velculescu VE, Rago C, St Croix B, Romans KE, Choti MA, Lengauer C, Kinzler KW. A phosphatase associated with metastasis of colorectal cancer. Science. 2001;294:1343-1346. [PubMed] [DOI] |
| 15. | Lee SK, Han YM, Yun J, Lee CW, Shin DS, Ha YR, Kim J, Koh JS, Hong SH, Han DC. Phosphatase of regenerating liver-3 promotes migration and invasion by upregulating matrix metalloproteinases-7 in human colorectal cancer cells. Int J Cancer. 2012;131:E190-E203. [PubMed] [DOI] |
| 16. | Tamagawa H, Oshima T, Yoshihara K, Watanabe T, Numata M, Yamamoto N, Tuschida K, Shiozawa M, Morinaga S, Akaike M. The expression of the phosphatase regenerating liver 3 gene is associated with outcome in patients with colorectal cancer. Hepatogastroenterology. 2012;59:2122-2126. [PubMed] |
| 17. | Kim NW, Chu CW, Ahn TS, Kim CJ, Jung DJ, Son MW, Bae SH, Lee MS, Kim CH, Baek MJ. Correlation between Liver Metastases and the Level of PRL-3 mRNA Expression in Patients with Primary Colorectal Cancer. J Korean Soc Coloproctol. 2011;27:231-236. [PubMed] [DOI] |
| 18. | Dai N, Lu AP, Shou CC, Li JY. Expression of phosphatase regenerating liver 3 is an independent prognostic indicator for gastric cancer. World J Gastroenterol. 2009;15:1499-1505. [PubMed] [DOI] |
| 19. | Wang Z, He YL, Cai SR, Zhan WH, Li ZR, Zhu BH, Chen CQ, Ma JP, Chen ZX, Li W. Expression and prognostic impact of PRL-3 in lymph node metastasis of gastric cancer: its molecular mechanism was investigated using artificial microRNA interference. Int J Cancer. 2008;123:1439-1447. [PubMed] [DOI] |
| 20. | Jian M, Nan L, Guocheng J, Qingfu Z, Xueshan Q, Enhua W. Downregulating PRL-3 inhibit migration and invasion of lung cancer cell via RhoA and mDia1. Tumori. 2012;98:370-376. [PubMed] [DOI] |
| 21. | Ustaalioglu BB, Bilici A, Barisik NO, Aliustaoglu M, Vardar FA, Yilmaz BE, Seker M, Gumus M. Clinical importance of phosphatase of regenerating liver-3 expression in breast cancer. Clin Transl Oncol. 2012;14:911-922. [PubMed] [DOI] |
| 22. | Hassan NM, Hamada J, Kameyama T, Tada M, Nakagawa K, Yoshida S, Kashiwazaki H, Yamazaki Y, Suzuki Y, Sasaki A. Increased expression of the PRL-3 gene in human oral squamous cell carcinoma and dysplasia tissues. Asian Pac J Cancer Prev. 2011;12:947-951. [PubMed] |
| 23. | Miskad UA, Semba S, Kato H, Matsukawa Y, Kodama Y, Mizuuchi E, Maeda N, Yanagihara K, Yokozaki H. High PRL-3 expression in human gastric cancer is a marker of metastasis and grades of malignancies: an in situ hybridization study. Virchows Arch. 2007;450:303-310. [PubMed] [DOI] |
| 24. | Zeng Q, Dong JM, Guo K, Li J, Tan HX, Koh V, Pallen CJ, Manser E, Hong W. PRL-3 and PRL-1 promote cell migration, invasion, and metastasis. Cancer Res. 2003;63:2716-2722. [PubMed] |
| 25. | Sun ZH, Bu P. Downregulation of phosphatase of regenerating liver-3 is involved in the inhibition of proliferation and apoptosis induced by emodin in the SGC-7901 human gastric carcinoma cell line. Exp Ther Med. 2012;3:1077-1081. [PubMed] |
| 26. | Zhang J, Xiao Z, Lai D, Sun J, He C, Chu Z, Ye H, Chen S, Wang J. miR-21, miR-17 and miR-19a induced by phosphatase of regenerating liver-3 promote the proliferation and metastasis of colon cancer. Br J Cancer. 2012;107:352-359. [PubMed] [DOI] |
| 27. | Tsujiura M, Ichikawa D, Komatsu S, Shiozaki A, Takeshita H, Kosuga T, Konishi H, Morimura R, Deguchi K, Fujiwara H. Circulating microRNAs in plasma of patients with gastric cancers. Br J Cancer. 2010;102:1174-1179. [PubMed] [DOI] |
| 28. | Zhang BG, Li JF, Yu BQ, Zhu ZG, Liu BY, Yan M. microRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN. Oncol Rep. 2012;27:1019-1026. [PubMed] [DOI] |
| 29. | Jing Y, Han Z, Zhang S, Liu Y, Wei L. Epithelial-Mesenchymal Transition in tumor microenvironment. Cell Biosci. 2011;1:29. [PubMed] [DOI] |
| 30. | Ding Y, Zhang H, Zhou Z, Zhong M, Chen Q, Wang X, Zhu Z. u-PA inhibitor amiloride suppresses peritoneal metastasis in gastric cancer. World J Surg Oncol. 2012;10:270. [PubMed] [DOI] |
| 31. | Mori T, Fujiwara Y, Yano M, Tamura S, Yasuda T, Takiguchi S, Monden M. Experimental study to evaluate the usefulness of S-1 in a model of peritoneal dissemination of gastric cancer. Gastric Cancer. 2003;6 Suppl 1:13-18. [PubMed] |