修回日期: 2013-04-25
接受日期: 2013-05-12
在线出版日期: 2013-06-18
目的: 观察梗阻性黄疸患者肠黏膜形态学及超微结构的变化, 探讨白细胞介素-6(interleukin-6, IL-6)、核因子κB(nuclear factor κB, NF-κB)、细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)与梗阻性黄疸患者肠黏膜损伤的关系.
方法: 应用光镜及电镜观察梗阻性黄疸患者肠黏膜形态学及超微结构的改变, 采用免疫组织化学方法检测肠黏膜IL-6、NF-κB和ICAM-1的表达情况.
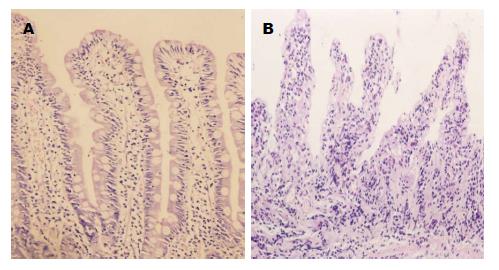
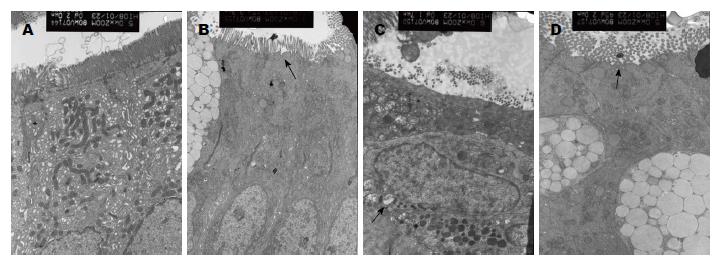
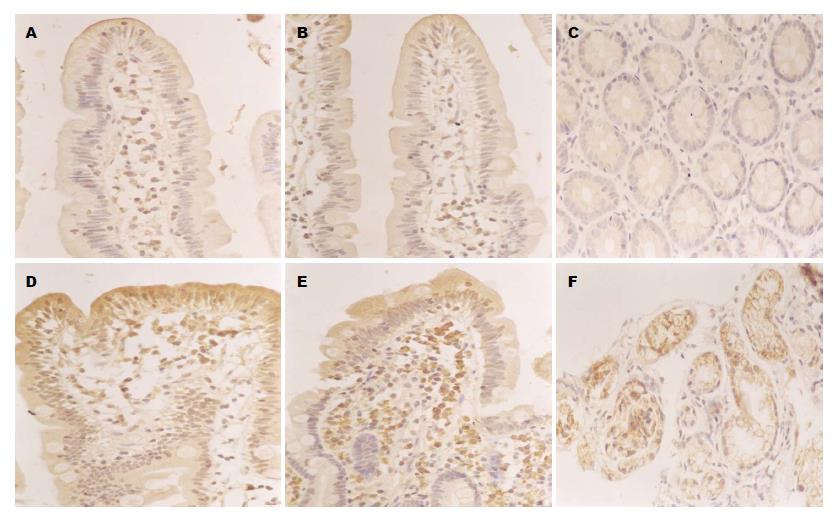
结果: 梗阻性黄疸组肠黏膜光镜下表现为绒毛排列紊乱, 变短或缺失, 绒毛间距变宽, 并可见上皮细胞及腺体坏死. 电镜下表现为连接复合体尚完整, 但微绒毛明显稀疏, 上皮柱状细胞扁平, 线粒体肿胀、嵴断裂、甚至空泡样变, 并可见细菌黏附在黏膜表面. 免疫组织化学结果显示与无黄疸组相比, 梗阻性黄疸组肠黏膜IL-6、NF-κB、ICAM-1的阳性表达明显增高, 其平均光密度值分别为(IL-6: 0.18±0.02, 0.13±0.01, P<0.05; NF-κB: 0.23±0.01, 0.19±0.03, P<0.05; ICAM-1: 0.17±0.01, 0.13±0.02, P<0.05).
结论: 梗阻性黄疸患者肠黏膜IL-6、NF-κB和ICAM-1表达增加与其肠黏膜损伤机制相关.
核心提示: 本文对梗阻性黄疸患者小肠黏膜的大体形态和超微结构进行观察, 证实梗阻性黄疸患者肠黏膜存在损伤, 应用免疫组织化学方法检测发现肠黏膜白细胞介素-6(interleukin-6)、核因子κB(nuclear factor κB)、细胞间黏附分子-1(intercellular adhesion molecule-1)的表达增加, 说明其与肠黏膜损伤机制相关.
引文著录: 纪晨光, 姜慧卿. 梗阻性黄疸患者肠黏膜损伤与肠黏膜IL-6、NF-κB、ICAM-1高表达的相关性. 世界华人消化杂志 2013; 21(17): 1670-1675
Revised: April 25, 2013
Accepted: May 12, 2013
Published online: June 18, 2013
AIM: To observe the morphology and ultrastructure changes in the intestinal mucosa in patients with obstructive jaundice, and to investigate the relationship between the expression of interleukin-6 (IL-6), nuclear factor κB (NF-κB) and intercellular adhesion molecule-1 (ICAM-1) and intestinal mucosal injury.
METHODS: TThe morphology and ultrastructure changes in the intestinal mucosa in patients with obstructive jaundice were observed by light microscopy and electron microscopy, respectively. The expression of IL-6, NF-κB and ICAM-1 in the intestinal mucosa was detected using immunohistochemistry.
RESULTS: Light microscopy analysis revealed that, in patients with obstructive jaundice, the intestinal villi were arranged disorderly and became shorter or absent, the intervals of villi were widened, and necrosis of the enterocytes and glands were visible. Electron microscopy analysis showed that, although the junctional complexes appeared intact, the microvilli were loose, the enterocytes became flat, the mitochondria swelled up and even become vacuolated, and the mitochondrial cristae collapsed. In addition, it could be seen that bacteria were attached to the mucosa surface. The expression of IL-6, NF-κB and ICAM-1 in patients with obstructive jaundice was increased significantly compared with controls (IL-6: 0.18 ± 0.02, vs 0.13 ± 0.01, P < 0.05; NF-κB: 0.23 ± 0.01 vs 0.19 ± 0.03, P < 0.05; ICAM-1: 0.17 ± 0.01 vs 0.13 ± 0.02, P < 0.05).
CONCLUSION: Intestinal mucosal injury in patients with obstructive jaundice is associated with high expression of IL-6, NF-κB and ICAM-1.
- Citation: Ji CG, Jiang HQ. High expression of IL-6, NF-κB and ICAM-1 in the intestinal mucosa is associated with intestinal mucosal injury in patients with obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2013; 21(17): 1670-1675
- URL: https://www.wjgnet.com/1009-3079/full/v21/i17/1670.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i17.1670
梗阻性黄疸患者可发生一系列严重并发症, 诸如败血症和肾功能衰竭等. 尽管缓解黄疸的外科手术和内镜治疗水平有很大提高, 但仍有较高的病死率, 其主要原因系患者肠黏膜屏障损伤, 肠道内细菌和内毒素通过受损肠黏膜进入血液循环, 产生一系列并发症. 目前对梗阻性黄疸时肠黏膜损伤的机制已有研究[1,2], 但其确切机制尚不完全清楚. 白介素-6(interleukin-6, IL-6)、核因子κB(nuclear factor κB, NF-κB)、细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)是重要的炎性介质, 直接或间接地介导炎症反应. 本研究通过观察梗阻性黄疸患者肠黏膜形态学及超微结构的变化, 检测肠黏膜IL-6、NF-κB和ICAM-1的表达, 探讨其与肠黏膜损伤的关系, 为梗阻性黄疸患者肠黏膜损伤的机制提供理论依据.
收集河北医科大学第二医院消化科行经内镜逆行胰胆管造影(encoscopic retrograde cholangiopancreatography, ERCP)检查或治疗的胆道梗阻性患者30例, 其中有黄疸者15例, 男9例, 女6例, 年龄35-80岁, 血清总胆红素(total bilirubin, TB)88.2-384.2 μmol/L; 其中胆总管结石患者9例, 胆管癌患者6例. 无黄疸者15例, 男8例, 女7例, 年龄40-78岁, 血清总胆红素(total bilirubin, TB)7.5-20.3 μmol/L; 其中胆总管结石患者11例, 胆管癌患者4例. 本研究已报请伦理委员会批准, 所有患者均签署知情同意书. 黄疸患者纳入标准: (1)血清TB、碱性磷酸酶(alkaline phosphatase, ALP)及γ谷氨酰基转移酶(γ-glutamyltransferase, γ-GT)升高; (2)血清TB>43 μmol/L(正常范围高限的2倍); (3)ERCP、B型超声或CT等影像学检查结果显示有胆管梗阻的表现. 无黄疸者纳入标准: ERCP、B型超声或CT等影像学检查结果显示有胆管梗阻的表现但血清TB≤21.5 μmol/L. 排除标准: (1)曾行ERCP检查者(无论是否行支架置入术); (2)胆管炎、病毒性肝炎或肝硬化患者; (3)血、尿淀粉酶升高者, 消化系內镜检查中有其他病理发现, 如炎症性肠病等; (4)患有其他引起免疫抑制的系统性疾病, 如糖尿病, 风湿病, 血液病等. 实验试剂与仪器: 兔抗人IL-6、NF-κB、ICAM-1多克隆抗体、SP 9001试剂盒和DAB显色剂均购自北京中山生物技术有限公司. 肠黏膜形态学及超微结构标本的制作和观察, 应用德国莱卡公司的LEICA RM 2125石蜡切片机及UTC超薄切片机, 日本Olympus公司的CHK2-F-GS显微镜和日立公司的H750透射电镜.
1.2.1 标本留取与处理: ERCP时于十二指肠乳头远端2-5 cm处, 用活检钳钳取肠黏膜组织4块. 其中2块组织10%福尔马林液固定, 常规梯度酒精脱水, 二甲苯透明, 石蜡包埋, 保存同批测定. 实验时将石蜡包埋组织块连续切片, 厚度约为4 μm, 取4片蜡带裱普通载玻片上. 切片常规脱腊至水, 苏木精染色, 1%盐酸乙醇分化, 氨水促进切片蓝化, 伊红染色, 常规梯度乙醇脱水, 中性树胶封片. 光镜下观察肠黏膜形态学变化. 另钳取2块肠黏膜组织, 用生理盐水将黏膜冲洗干净, 新双面刀片将组织修成大小约1 mm×1 mm×2 mm的组织块, 将组织块固定于4%戊二醛, 并置于4 ℃冰箱中, 固定时间在2 h以上; 1/15 mol/L磷酸缓冲液浸洗3次以上或过夜, 然后用1%四氧化锇固定1-2 h, 1/15 mol/L磷酸缓冲液浸洗2次, 每次20 min. 随后应用50%、70%、80%、90%、100%丙酮Ⅰ、100%丙酮Ⅱ逐级脱水, 每次10-15 min. 将组织块置于纯丙酮和包埋剂按1:1配成的混合液中1 h; 再将组织块置于纯丙酮和包埋剂按1:3配成的混合液中3 h以上或过夜; 然后将组织块置于纯包埋剂中浸透5 h以上. 将组织块置于包埋剂中, 放入37 ℃温箱中12 h, 然后放入60 ℃烤箱中36-48 h. 应用UTC超薄切片机进行切片, 厚度约为50 nm, 应用醋酸双氧轴和枸橼酸铝双重染色. 在H750透射电镜下观察肠黏膜的超微结构.
1.2.2 肠黏膜IL-6、NF-κB和ICAM-1的测定: 应用免疫组织化学方法检验IL-6、NF-κB和ICAM-1表达, 阴性对照用PBS代替第一抗体, 同法进行染色. 免疫组织化学染色有棕黄色颗粒为阳性表达. 均用Motic Med 6.0数码医学图像分析系统在相同放大倍数下进行图像分析, 每个切片计数10个视野, 以阳性细胞染色的平均光密度值表示抗原表达量.
统计学处理 IL-6、NF-κB和ICAM-1的抗原表达量用mean±SD表示. 应用SPSS13.0统计软件进行t检验, P<0.05认为有统计学意义.
无黄疸组肠黏膜绒毛及上皮细胞排列整齐, 绒毛高度一致;梗阻性黄疸组肠黏膜绒毛排列紊乱, 变短或缺失, 绒毛间距变宽, 上皮细胞肿胀、排列紊乱, 并可见上皮细胞及腺体坏死(图1).
无黄疸组肠黏膜微绒毛排列密集, 连接复合体完整; 梗阻性黄疸组连接复合体尚完整, 但微绒毛明显稀疏, 上皮柱状细胞变扁平, 线粒体肿胀、嵴断裂甚至空泡样变, 并可见细菌黏附在黏膜表面(图2).
IL-6阳性表达为细胞核及细胞浆呈棕黄色, 阳性细胞主要为炎性细胞、血管内皮细胞及上皮细胞. NF-κB主要在细胞核及细胞浆表达, 阳性细胞主要为中性粒细胞、血管内皮细胞及上皮细胞. ICAM-1主要定位于炎性细胞及腺体细胞的胞浆, 细胞浆呈棕黄色为阳性表达(图3). 采用Motic Med 6.0数码医学图像分析系统分析, 梗阻性黄疸组肠黏膜IL-6、NF-κB和ICAM-1平均光密度值分别为0.18±0.02、0.23±0.01、0.17±0.01, 高于无黄疸组0.13±0.01、0.19±0.03、0.13±0.02, 差异有统计学意义(P<0.05).
肠黏膜除具消化吸收等功能外, 在防止感染方面也发挥重要作用. 正常情况下肠腔内细菌不能透过肠壁进入组织脏器, 这有赖于完善的肠道屏障功能. 临床上, 肠源性感染及内毒素血症是梗阻性黄疸患者的重要死因, 而肠黏膜屏障功能损害则是其发生的关键.
有研究表明胆汁对肠黏膜有营养作用, 其可增加小肠绒毛密度及黏膜层厚度[3,4]. 胆汁中的免疫球蛋白A(immunoglobulin A, IgA)及许多特异或非特异抗体, 能抑制细菌黏附于肠黏膜, 阻止细菌进入肠上皮细胞[5]. 最近的研究表明胆汁对维持肠上皮细胞间紧密连接的完整性至关重要[6,7]. 因此, 梗阻性黄疸时肠道内胆汁缺乏, 可使肠黏膜屏障防御功能下降, 通透性增高, 侵袭因素增加, 导致肠黏膜损伤.
本研究于光镜下观察梗阻性黄疸组肠黏膜, 可见绒毛排列紊乱, 变短或缺失, 绒毛间距变宽, 上皮细胞肿胀、排列紊乱, 并可见上皮细胞及腺体坏死. 电镜下发现梗阻性黄疸患者小肠黏膜微绒毛明显稀疏, 上皮柱状细胞变扁平, 线粒体肿胀、嵴断裂甚至空泡样变, 并可见细菌黏附在黏膜表面. 通过对梗阻性黄疸患者小肠黏膜的大体形态和超微结构的观察, 证实了梗阻性黄疸时肠黏膜的损伤, 虽然电镜下未发现连接复合体的明显破坏, 但肠黏膜微绒毛和线粒体已经可见明显的损伤, 从而引起肠黏膜屏障功能障碍. 另外, 电镜下可见细菌黏附在肠黏膜表面, 为细菌转移奠定了基础, 进一步导致全身炎症反应综合征、内毒素血症等并发症.
NF-κB是促炎基因表达的枢纽之一, 激活后可促进多种炎症介质如细胞因子、黏附分子和趋化因子等基因转录, 在炎症反应中起重要作用. 急性胰腺炎或梗阻性黄疸时肠黏膜NF-κB表达增高, 可能与肠黏膜损伤有关[8-11]. IL-6系单核-巨噬细胞产生的糖蛋白, 是一种重要炎症介质. 有研究发现, 梗阻性黄疸大鼠内毒素刺激免疫细胞分泌IL-6增加, 后者可致其他细胞因子形成瀑布样激活[12]. ICAM-1是细胞间黏附分子的一种, 在炎症细胞黏附、聚集中起重要作用, 梗阻性黄疸大鼠肠黏膜及炎症性肠病患者的血清中均明显增加, 且与组织的炎症程度密切相关[12-15].
本研究结果显示, 梗阻性黄疸患者肠黏膜IL-6、NF-κB和ICAM-1表达均显著高于对照组. 说明三者参与了梗阻性黄疸患者肠黏膜的炎症反应, 可能介导了肠黏膜的损伤. 这些炎性介质和细胞因子可以相互促进. NF-κB激活后从基因转录水平调控ICAM-1表达增加, 诱导肿瘤坏死因子、IL-1、IL-6和干扰素-γ等炎性细胞因子释放; 这些炎性细胞因子又激活NF-κB, 形成恶性循环. 这些炎性细胞因子均具有细胞毒性作用, 可直接引起肠黏膜组织水肿及破坏, 诱导肠上皮细胞凋亡并破坏肠黏膜紧密连接, 减弱肠黏膜屏障的功能[16-18]. 肠黏膜屏障功能的衰竭为细菌、内毒素和炎性细胞因子的易位提供了便利条件.
本研究通过对梗阻性黄疸患者肠黏膜的大体形态和超微结构的观察, 证实了梗阻性黄疸时肠黏膜存在损伤. 梗阻性黄疸患者肠黏膜IL-6、NF-κB和ICAM-1表达增加, 说明其与肠黏膜损伤机制相关. 其增加的机制可能与细菌过度繁殖、内毒素释放增多导致这些炎性因子的释放有关, 这些增多的炎性因子引起肠黏膜的炎症反应, 破坏肠黏膜上皮的完整, 导致肠黏膜损伤, 通透性增加. 而血中升高的胆红素水平可导致皮肤、巩膜黄染, 是否会引起肠黏膜损伤, 目前没有相关的报道, 还需进一步研究. 另外梗阻性黄疸时还可通过氧化应激反应、细胞凋亡与增殖失衡和紧密连接破坏等因素导致肠黏膜损伤. 因此, 梗阻性黄疸时肠黏膜损伤是多因素相互作用的结果, 其损伤机制尚需进一步研究, 从而可以通过肠黏膜保护性干预降低相关并发症.
梗阻性黄疸是临床常见病, 尽管外科手术和内镜治疗水平有很大提高, 但是梗阻性黄疸的并发症及病死率并未明显下降. 梗阻性黄疸可导致肠黏膜屏障损伤, 引起肠道内细菌和内毒素易位, 从而引起一系列严重并发症.
袁建业, 副研究员, 上海中医药大学附属龙华医院/脾胃病研究所
对梗阻性黄疸所致肠黏膜损伤具体机制及预防策略仍是当前研究的重点.
王娜等通过测定恶性梗阻性黄疸患者肠黏膜紧密连接蛋白ZO-1、occludin及claudin-1的表达, 证实了恶性梗阻性黄疸患者小肠上皮紧密连接的破坏, 从而增加了肠黏膜通透性.
本研究观察梗阻性黄疸患者肠黏膜的大体形态和超微结构, 证实了梗阻性黄疸患者存在肠黏膜损伤, 通过检测梗阻性黄疸患者肠黏膜白介素-6、核因子κB、细胞间黏附分子-1的表达, 说明炎症反应可能介导了梗阻性黄疸导致的肠黏膜损伤.
梗阻性黄疸患者肠黏膜存在损伤, 其损伤机制可能是多因素相互作用的结果, 并且尚需进一步研究, 在临床工作中可通过保护肠黏膜预防并发症, 降低病死率.
本文通过光镜和电镜观察, 比较胆道梗阻有黄疸患者和胆道梗阻无黄疸患者肠黏膜损伤的情况, 具有很好的科学价值
编辑: 田滢 电编:鲁亚静
| 1. | Parks RW, Halliday MI, McCrory DC, Erwin P, Smye M, Diamond T, Rowlands BJ. Host immune responses and intestinal permeability in patients with jaundice. Br J Surg. 2003;90:239-245. [PubMed] [DOI] |
| 2. | Wang N, Yu H, Ma J, Wu W, Zhao D, Shi X, Tian H, Jiang H. Evidence for tight junction protein disruption in intestinal mucosa of malignant obstructive jaundice patients. Scand J Gastroenterol. 2010;45:191-199. [PubMed] [DOI] |
| 3. | Assimakopoulos SF, Vagianos CE, Patsoukis N, Georgiou C, Nikolopoulou V, Scopa CD. Evidence for intestinal oxidative stress in obstructive jaundice-induced gut barrier dysfunction in rats. Acta Physiol Scand. 2004;180:177-185. [PubMed] [DOI] |
| 4. | Parks RW, Stuart Cameron CH, Gannon CD, Pope C, Diamond T, Rowlands BJ. Changes in gastrointestinal morphology associated with obstructive jaundice. J Pathol. 2000;192:526-532. [PubMed] [DOI] |
| 5. | Wells CL, Jechorek RP, Erlandsen SL. Inhibitory effect of bile on bacterial invasion of enterocytes: possible mechanism for increased translocation associated with obstructive jaundice. Crit Care Med. 1995;23:301-307. [PubMed] [DOI] |
| 6. | Yang R, Harada T, Li J, Uchiyama T, Han Y, Englert JA, Fink MP. Bile modulates intestinal epithelial barrier function via an extracellular signal related kinase 1/2 dependent mechanism. Intensive Care Med. 2005;31:709-717. [PubMed] [DOI] |
| 7. | Assimakopoulos SF, Scopa CD, Charonis A, Spiliopoulou I, Georgiou C, Nikolopoulou V, Vagianos CE. Experimental obstructive jaundice disrupts intestinal mucosal barrier by altering occludin expression: beneficial effect of bombesin and neurotensin. J Am Coll Surg. 2004;198:748-757. [PubMed] [DOI] |
| 8. | Rakonczay Z, Hegyi P, Takács T, McCarroll J, Saluja AK. The role of NF-kappaB activation in the pathogenesis of acute pancreatitis. Gut. 2008;57:259-267. [PubMed] [DOI] |
| 9. | Zhang XP, Jiang J, Yu YP, Cheng QH, Chen B. Effect of Danshen on apoptosis and NF-κB protein expression of the intestinal mucosa of rats with severe acute pancreatitis or obstructive jaundice. Hepatobiliary Pancreat Dis Int. 2010;9:537-546. [PubMed] |
| 10. | Zhang X, Chen L, Zhang J, Tian H, Zhang X, Zhou Y, Wang Z, Wang K. Effect of salvia miltiorrhizae on apoptosis and NF-kappaB p65 expression in the liver of rats with severe acute pancreatitis or obstructive jaundice. J Gastroenterol Hepatol. 2009;24:841-852. [PubMed] [DOI] |
| 11. | Xiping Z, Dijiong W, Jianfeng L, Qihui C, Jing Y, Penghui J, Meijuan Y, Ninni Z. Effects of Salvia miltiorrhizae on ICAM-1, TLR4, NF-kappaB and Bax proteins expression in multiple organs of rats with severe acute pancreatitis or obstructive jaundice. Inflammation. 2009;32:218-232. [PubMed] [DOI] |
| 12. | Badger SA, Jones C, McCaigue M, Clements BW, Parks RW, Diamond T, McCallion K, Taylor MA. Cytokine response to portal endotoxaemia and neutrophil stimulation in obstructive jaundice. Eur J Gastroenterol Hepatol. 2012;24:25-32. [PubMed] [DOI] |
| 13. | Akyürek N, Salman B, Irkörücü O, Tezcaner T, Azili C, Erdem O, Akca G, Akin O, Tatlicioglu E. The effect of platelet activating factor antagonist BN 52021 on bacterial translocation and ICAM-I expression in experimental obstructive jaundice. J Invest Surg. 2005;18:247-256. [PubMed] [DOI] |
| 14. | Adamska I, Czerwionka-Szaflarska M, Kulwas A, Mierzwa G, Bała G, Rość D. [Adhesion molecules of immunoglobin super family in children and youth with inflammatory bowel disease]. Pol Merkur Lekarski. 2009;26:101-104. [PubMed] |
| 15. | Song WB, Lv YH, Zhang ZS, Li YN, Xiao LP, Yu XP, Wang YY, Ji HL, Ma L. Soluble intercellular adhesion molecule-1, D-lactate and diamine oxidase in patients with inflammatory bowel disease. World J Gastroenterol. 2009;15:3916-3919. [PubMed] [DOI] |
| 16. | Rao RK, Basuroy S, Rao VU, Karnaky Jr KJ, Gupta A. Tyrosine phosphorylation and dissociation of occludin-ZO-1 and E-cadherin-beta-catenin complexes from the cytoskeleton by oxidative stress. Biochem J. 2002;368:471-481. [PubMed] [DOI] |
| 17. | Mankertz J, Amasheh M, Krug SM, Fromm A, Amasheh S, Hillenbrand B, Tavalali S, Fromm M, Schulzke JD. TNFalpha up-regulates claudin-2 expression in epithelial HT-29/B6 cells via phosphatidylinositol-3-kinase signaling. Cell Tissue Res. 2009;336:67-77. [PubMed] [DOI] |
| 18. | Heller F, Florian P, Bojarski C, Richter J, Christ M, Hillenbrand B, Mankertz J, Gitter AH, Bürgel N, Fromm M. Interleukin-13 is the key effector Th2 cytokine in ulcerative colitis that affects epithelial tight junctions, apoptosis, and cell restitution. Gastroenterology. 2005;129:550-564. [PubMed] [DOI] |