修回日期: 2013-05-14
接受日期: 2013-05-19
在线出版日期: 2013-06-18
目的: 利用重组慢病毒介导的E2F-1基因沉默载体感染人胃癌MGC-803细胞, 观察其对中药人参黄芪复方药物敏感性的影响.
方法: 将胃癌MGC-803细胞接种于培养板中分为4组: 正常组(正常培养基)、空白对照组(中药培养基)、阴性对照LV-RNAi组(中药培养基+感染空载体慢病毒颗粒2.0×109 TU/mL)、E2F-1-RNAi-LV组(中药培养基+感染E2F-1基因重组慢病毒颗粒2.0×109 TU/mL), 分别采用半定量逆转录-聚合酶链反应(RT-PCR)和Western blot检测E2F-1 mRNA及蛋白表达; MTT方法检测细胞的增殖抑制率; Giemsa染色检测细胞的克隆形成; 流式细胞仪检测细胞的凋亡; 细胞划痕实验检测细胞迁移能力.
结果: E2F-1基因沉默蛋白及mRNA表达水平均明显下降, 差异有统计学意义(0.384±0.036 vs 0.883±0.051和0.923±0.049, 0.220±0.056 vs 0.729±0.021和0.712±0.037, P<0.05). 中药人参黄芪复方能抑制人胃癌MGC-803细胞生长、诱导胃癌细胞凋亡、抑制细胞克隆形成及迁移; 与空白对照组及阴性对照组相比较, E2F-1基因沉默组MGC-803细胞增殖抑制率、细胞凋亡率显著提高, 其细胞克隆形成、细胞迁移面积显著降低, 差异均有统计学意义(0.789±0.013 vs 0.484±0.060和0.454±0.006, 0.383±0.027 vs 0.114±0.038和0.089±0.051, 0.024±0.003 vs 0.036±0.004和0.052±0.002, 0.553±0.038 vs 0.897±0.020和0.928±0.051, P<0.05).
结论: 重组慢病毒载体介导的E2F-1基因沉默能有效增强中药人参黄芪复方对人胃癌MGC-803细胞的药物敏感性.
核心提示: 慢病毒介导E2F-1基因沉默转染人胃癌MGC803细胞, 可提高胃癌细胞对中药人参黄芪复方的敏感性, 这极有可能通过E2F-1基因沉默增加Caspase 3、PTEN的表达, 抑制细胞内药物外排介质P-糖蛋白(P-glycoprotein)及细胞内药物外排转运蛋白MRP1的表达, 间接使药物泵出细胞外减少, 使细胞内的药物有效浓度提高, 从而提高人胃癌细胞对中药人参黄芪复方敏感性.
引文著录: 罗文, 吴锟, 王晓通, 谢玉波, 肖强. 慢病毒介导的E2F-1沉默对人胃癌细胞MGC803中药人参黄芪复方药物敏感性的影响. 世界华人消化杂志 2013; 21(17): 1636-1641
Revised: May 14, 2013
Accepted: May 19, 2013
Published online: June 18, 2013
AIM: To observe the effect of recombinant lentivirus-mediated E2F-1 gene silencing on sensitivity of gastric carcinoma MGC-803 cells to compound ginseng and astragalus.
METHODS: MGC-803 cells were plated and divided into four groups: a normal control group (medicine medium), a blank control group, a negative LV-RNAi control group (medicine medium + infection with empty lentiviral vector particles 2.0 × 109 TU/mL) and an E2F-1-RNAi-LV group (medicine medium + infection with recombinant E2F-1 lentiviral particles 2.0 × 109 TU/mL). The mRNA and protein expression levels of E2F1 were detected by RT-PCR and Western blot. Cell proliferation was detected by MTT assay. Cell colony formation was detected by Giemsa staining. Cell apoptosis was observed by flow cytometry, and cell migration was detected by cell scratch assay.
RESULTS: Infection with the recombinant lentiviral vector significantly decreased the protein and mRNA expression levels of E2F-1 compared to the two control groups (0.384 ± 0.036 vs 0.883 ± 0.051 and 0.923 ± 0.049, 0.220 ± 0.056 vs 0.729 ± 0.021 and 0.712 ± 0.037, P < 0.05). Compound ginseng and astragalus inhibited MGC-803 cell growth, induced cell apoptosis, and reduced cell colony formation and migration. Compared to the two control groups, the rates of reduced cell colony formation and cell apoptosis were significantly increased and the areas of cell colony formation and migration were significantly decreased in the E2F-1 gene silencing group (0.789 ± 0.013 vs 0.484 ± 0.060 and 0.454 ± 0.006, 0.383 ± 0.027 vs 0.114 ± 0.038 and 0.089 ± 0.051, 0.024 ± 0.003 vs 0.036 ± 0.004 and 0.052 ± 0.002, 0.553 ± 0.038 vs 0.897 ± 0.020 and 0.928 ± 0.051, P < 0.05).
CONCLUSION: Recombinant lentivirus-mediated E2F-1 gene silencing effectively enhances the sensitivity of MGC-803 cells to compound ginseng and astragalus.
- Citation: Luo W, Wu K, Wang XT, Xie YB, Xiao Q. Lentivirus-mediated E2F-1 gene silencing enhances sensitivity of gastric carcinoma MGC-803 cells to compound ginseng and astragalus. Shijie Huaren Xiaohua Zazhi 2013; 21(17): 1636-1641
- URL: https://www.wjgnet.com/1009-3079/full/v21/i17/1636.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i17.1636
人参、黄芪是被证实有明确抗肿瘤作用的传统中药, 因其具有不良反应少、不易产生耐药性、提高机体免疫力等优点而备受关注, 但在临床治疗中, 中药对肿瘤细胞的杀灭作用远不及传统化疗药物, 因而限制了其在临床的广泛应用. 如何提高肿瘤对中药的敏感性业已成为目前研究的热点. 近年研究发现, 凋亡抑制是肿瘤多药耐药的重要机制之一, 通过调控凋亡相关基因的表达可直接影响肿瘤细胞对化疗药物的敏感性[1]. 我们前期研究显示, E2F-1基因沉默可调控PTEN、NF-κB、Caspase 3、Caspase 9等多种凋亡相关基因的表达, 并明显诱导胃癌细胞凋亡[2], 但有关E2F-1基因沉默与胃癌细胞对中药药物敏感性的关系未见相关报道. 因此本实验通过慢病毒介导E2F-1基因沉默, 观察E2F-1基因沉默后对人胃癌细胞株MGC803中药人参黄芪复方敏感性的影响.
人胃癌细胞MGC-803购自中国科学院细胞库(上海); 重组慢病毒载体(E2F-1-RNAi-LV)由上海Genechem公司构建; DMEM培养基(Hyclone公司); 胰蛋白酶和胎牛血清(杭州四季青公司); 人参、黄芪、木镘头、当归、白芍、鳖甲、桃仁、贝母(湖北金贵中药饮片有限公司, 生产批号: 100301、100102、101101、100302、110201、107001、110401、110301).
1.2.1 细胞培养: MGC-803细胞用含10%胎牛血清的DMEM培养基, 在37 ℃、5%CO2、饱和湿度条件下传代培养, 选用对数生长期细胞进行实验.
1.2.2 中药人参黄芪复方配方: 人参、黄芪、木镘头各3 g, 当归18 g, 白芍、鳖甲、桃仁、贝母各2 g. 共35 g. 双蒸水漂洗2次, 加1000 mL双蒸水文火煎煮30 min, 再加1000 mL双蒸水继续煎煮, 最后定容50 mL, 双层纱布过滤去渣, 浓度得700 mg/mL, 10000 r/min离心10 min去除难溶细杂质, 0.45 μmol/L滤器过滤除菌. 4 ℃保存, 临用前用DMEM培养液配成所需浓度.
1.2.3 慢病毒颗粒转染人胃癌MGC-803细胞: 取对数生长期人胃癌MGC-803细胞按3×104个/孔接种于6孔板, 用无抗生素10%胎牛血清的DMEM培养基, 培养至细胞密度达50%左右, 然后按照慢病毒使用说明书进行转染, 慢病毒颗粒用量为7.5 μL/孔. 转染后6 h将培养液更换为无抗生素20%胎牛血清的DMEM培养基, 转染后24 h常规换液继续培养, 待细胞长满6孔板, 用胰酶消化下来, 进行后续实验.
1.2.4 Western blot检测E2F-1蛋白的表达: 细胞裂解, 收集蛋白, BCA法测定细胞蛋白质含量. 蛋白变性后每孔上样30 ng, 经10%SDS聚丙烯酰胺凝胶电泳后转移至PVDF膜上, 用含5%牛血清白蛋白的TBST(TrisHCl 20 mmol/L, NaCl 37 mmol/L, 0.1%Tween20)封闭1 h, 用Cdx2、GAPDH两张膜一抗4 ℃孵育过夜, TBST洗3次, 5min/次, 相应的二抗孵育1 h, TBST洗3次, 5 min/次, ECL化学发光检测蛋白质印迹, 将暗夹夹紧压片, 显影、定影、水冲洗胶片晾干后保存.
1.2.5 半定量RT-PCR检测E2F-1 mRNA的表达: 根据Genebank人类的E2F-1的cDNA序列, 用引物设计软件设计引物, 上海生物技术有限公司合成. 引物在使用前先离心3-5 s, 使黏附在管壁 上的Oligo DNA集中于管底, 用TE-buffer溶解为10 pmol/μL, -20 ℃贮存. 各引物序列如表1, PCR仪扩增及产物电泳, 将凝胶放入凝胶成像分析系统扫描电泳图像.
| 基因名称 | 序列 | PCR产物(bp) |
| GAPDH | Sense: 5'-ACCACAGTCCATGCCATCAC-3'; | |
| Antisense: 5'-TCACCACCCTGTTGCTGTA-3'; | 450 | |
| E2F-1 | Sense: 5'-CTGCCTGCTGCTTCCACC-3'; | |
| Antisense: 5'-CCACCCCACCCACCTACC-3'; | 275 |
1.2.6 细胞增殖抑制实验: 取对数生长期细胞悬液, 以每孔5×103个/100 μL分别相应的接种到96孔板中. 37 ℃孵育24 h. 然后按实验设计, 每组设8个复孔. 培养48 h后, 每孔加5 mg/mL LMTT试剂10 μL, 继续孵育4 h, 弃培养液, 各孔加DMSO 150 μL, 振荡10 min. 用酶标仪测定每孔吸光度(A)值. 实验重复3次, 取平均值进行统计学分析. 按下列公式计算肿瘤抑制率, 抑制率(%) = (1-实验孔A均值/对照组A均值)×100%.
1.2.7 Giemsa染色检测各组细胞的克隆形成: 取对数生长期细胞重悬, 将4组细胞以500个/孔接种于6孔板, 每组设3个复孔, 各处理组所加药物浓度为MTT法计算所得0.1×IC50. 37 ℃孵育7 d, 当6孔板中出现肉眼可见克隆时即终止培养, 弃培养液, PBS浸洗细胞2次, 甲醇固定5 min, Giemsa染色30 min, 冲去染色液, 室温下干燥. 在显微镜下计数含50个细胞以上的细胞克隆数. 克隆形成率 = (每孔克隆数/每孔接种细胞数)×100%
1.2.8 流式细胞仪检测细胞的凋亡: 取对数生长期细胞重悬, 将4组细胞以每孔5×104个/1 mL接种于6孔板, 每组细胞设3个复孔. 然后按实验设计, 加入不同浓度的药物. 各处理组所加药物浓度为MTT法计算所得0.1×IC50. 37 ℃孵育48 h后, 采用Annexin V-FITC法检测癌细胞凋亡, 消化各实验组细胞, 收集于EP管中, PBS洗涤, 离心收集细胞, 进行流式细胞分析.
1.2.9 划痕实验检测药物对细胞迁移能力的影响: 取对数生长期细胞重悬, 将4组细胞以5×104个/孔接种于6孔板, 37 ℃孵育24 h, 用20 μL移液器枪头于培养板底部划"一"字痕, PBS冲洗2遍, 彻底洗脱悬浮细胞. 然后按实验设计, 每孔加入不同浓度的无血清药物. 各处理组所加药物浓度为MTT法计算所得0.1×IC50. 分别于培养至12、24、36 h应用相差显微镜拍摄划痕边缘进展情况, 应用NIH图像处理软件分析细胞迁移程度.
统计学处理 应用SPSS16.0软件进行统计学分析, 计量资料数据以mean±SD表示, 组间比较采用单因素方差分析, 率的比较采用χ2检验, P<0.05为差异有统计学意义.
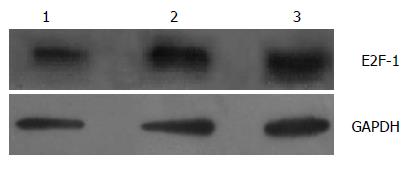
以GAPDH为内参照, E2F-1-RNAi-LV组蛋白相对表达量相比对照组和正常组蛋白相对表达量分别减少了56.3%和58.5%(图1)(P<0.05), 差异有统计学意义.
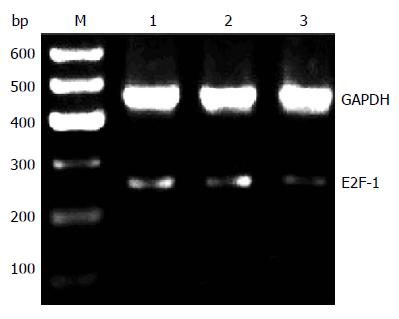
以GAPDH为内参照, E2F-1-RNAi-LV组mRNA相对表达量与对照组及正常组mRNA相对表达量相比抑制率均达到73%以上(图2)(P<0.05), 差异有统计学意义.
MTT法检测结果表明, 阴性对照组与E2F-1-RNAi-LV组均对MGC-803细胞有抑制作用, E2F-1-RNAi-LV组对细胞增殖抑制率明显高于阴性对照组和空白对照组(P<0.05), 差异有统计学意义; 阴性对照组与空白对照组比较(P>0.05), 差异无统计学意义(表2).
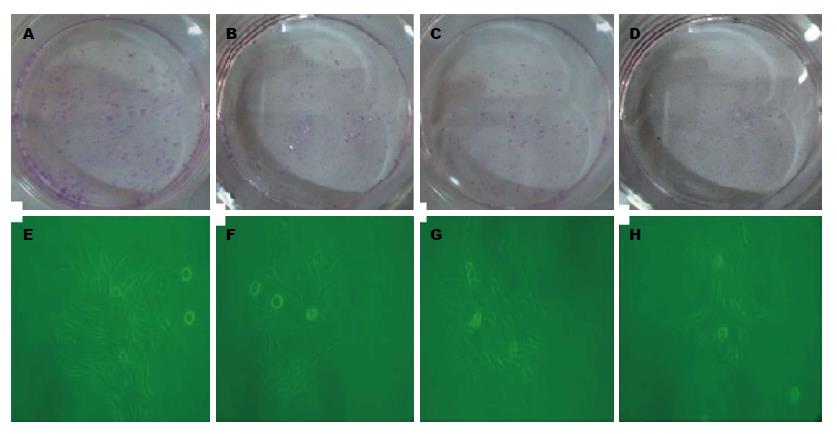
Giemsa染色法检测结果表明, 空白对照组、阴性对照组及E2F-1-RNAi-LV组均可抑制胃癌细胞克隆形成, 但各组细胞克隆形成数不相等, 经药物处理7 d后, E2F-1-RNAi-LV组的克隆形成率(2.40%±0.31%)与空白对照组(3.60%±0.43%)、阴性对照组(5.20%±0.24%)及正常组(5.20%±0.24%)比较, 差异有统计学意义(P<0.05); 空白对照组与阴性对照组比较(P>0.05), 差异无统计学意义(图3).
流式细胞仪检测结果表明, 空白对照组、阴性对照组及E2F-1-RNAi-LV组均可促进胃癌细胞凋亡, 经药物处理48 h后, E2F-1-RNAi-LV组的细胞凋亡率(38.32%)与空白对照组(11.39%)、阴性对照组(8.97%)比较, 差异有统计学意义(P<0.05); 空白对照组与阴性对照组比较(P>0.05), 差异无统计学意义.
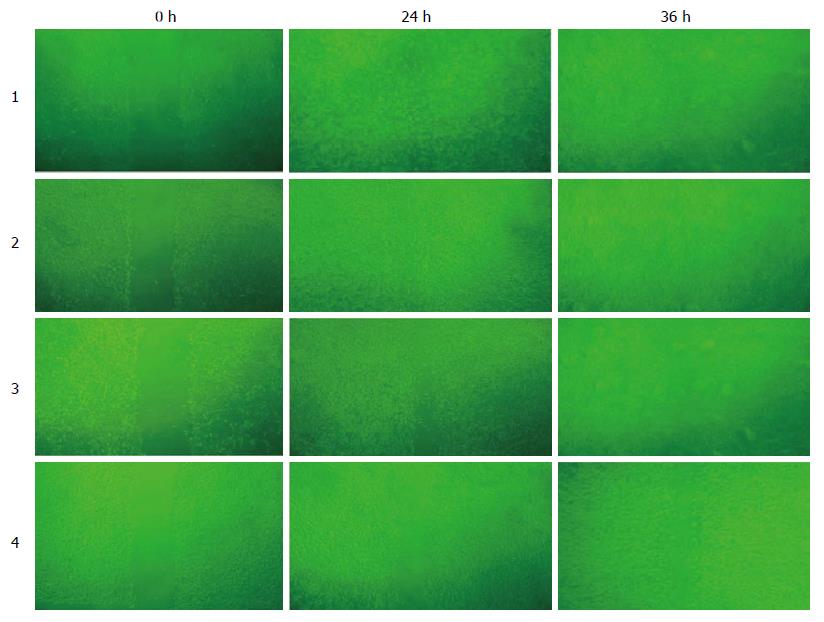
划痕实验检测结果表明, 空白对照组、阴性对照组及E2F-1-RNAi-LV组对细胞的迁移能力均有抑制作用; 经药物处理24、36 h后, E2F-1-RNAi-LV组细胞愈合率与同期空白对照组及阴性对照组比较(P<0.05), 差异有统计学意义; 空白对照组与阴性对照组比较(P>0.05), 差异无统计学意义(图4).
人参、黄芪、当归作为传统中药已有上千年的历史. 目前诸多中药里, 人参、黄芪、当归被证实对恶性肿瘤治疗有较明确的效果[3-5], 其作用机制可能与自身内部活性成分有关: (1)人参能通过Caspase 3介导促进细胞凋亡, 激活抑癌基因p21和p27的表达, 使细胞周期阻滞在G0/G1期[6]. 同时, 人参还可以明显促进Bax、Caspase 3 mRNA在细胞内的表达, 从而诱导凋亡, 抑制肿瘤细胞的生长[7,8]; (2)黄芪多糖可下调凋亡相关基因Bcl-2蛋白表达, 同时上调Bax蛋白表达, 从而诱导肿瘤细胞凋亡, 最终将细胞周期阻滞于G0/G1期[9]; (3)当归的丙酮提取物(AE-AS)有显著抗增殖作用, 其抗增殖机制主要是通过抑制凋亡相关基因Bcl-2以及周期蛋白依赖性激酶CDK4的表达, 使肿瘤细胞阻滞在细胞周期的R限制点, 不能进入S期, 最终促进肿瘤细胞的凋亡[10]. 以上提示中药人参黄芪复方可通过诱导凋亡相关基因的表达, 从而达到杀伤肿瘤细胞的作用.
本研究结果显示, 单独应用中药人参黄芪复方药物可以抑制胃癌细胞增殖、克隆形成及迁移, 促进胃癌细胞凋亡. E2F-1基因沉默后再经中药人参黄芪复方处理, 其抑制细胞增殖、克隆形成、促进细胞凋亡和抑制细胞迁移能力显著提高. 提示E2F-1基因沉默可以明显提高胃癌细胞对中药人参黄芪复方药物抗肿瘤的敏感性, 但其机制有待进一步明确.
我们前期研究显示: E2F-1沉默可使凋亡相关基因PTEN、Caspase 3、Caspase 9表达上调, 从而在体内及体外环境下均可明显抑制胃癌细胞生长, 使细胞周期阻滞于G0/G1期, 凋亡率显著提高, 胃癌细胞迁移、侵袭能力明显减弱[11,12]. 同时最新研究还发现, Caspase 3、PTEN基因表达上调可明显抑制细胞内药物外排介质P-糖蛋白(P-glycoprotein, P-gp)及细胞内药物外排转运蛋白MRP1的表达, 减少细胞内药物外排, 提高细胞内化疗药物浓度, 从而增加肿瘤对化疗药物的敏感性[13,14]. 而Caspase 3、Caspase 9等相关凋亡基因的表达上调也是中药人参黄芪复方抗肿瘤作用机制之一[6,15]. 提示E2F-1基因沉默提高胃癌细胞对中药人参黄芪复方的敏感性可能是通过E2F-1基因沉默增加Caspase 3、PTEN的表达, 间接使药物泵出细胞外减少, 使细胞内的药物有效浓度提高, 从而增强人胃癌细胞对中药人参黄芪复方药物敏感性.
总之, E2F-1基因下调和中药人参黄芪复方抗肿瘤两者具有协同作用, 沉默E2F-1可有效增强中药抗肿瘤活性成分的药理作用, 从而提高人胃癌细胞对中药人参黄芪复方药物敏感性, 但其具体机制尚不明确. 我们将会在未来的研究中进一步探讨其可能的作用机制.
人参黄芪中的多糖等重要成分具有明显的抗肿瘤作用, 以其不良反应小、无骨髓抑制等特点而倍受关注. 与常规化疗药物相比, 中药抗肿瘤的疗效一般. 因此, 研究如何提高肿瘤对中药抗肿瘤的敏感性具有重意义.
唐文富, 副教授, 四川大学华西医院中西医结合科
RNA干扰技术(RNA interference, RNAi)是指由双链RNA引发的转录后基因沉默机制, 具有序列特异性和高效性, RNAi作为一门新的基因阻断技术, 是一种有广阔应用前景的抗肿瘤基因治疗方法, 近年来受到人们的广泛关注.
本实验应用现代RNA干扰技术与传统中药相结合, 探讨慢病毒介导E2F-1基因沉默对胃癌MGC803细胞中药人参黄芪复方药物敏感性有影响.
E2F-1基因沉默后, 人胃癌细胞对中药人参黄芪复方的敏感性显著增加, 诱导肿瘤细胞凋亡、抑制细胞增殖、抑制细胞克隆形成并抑制细胞迁移能力, 提示E2F-1基因沉默提高胃癌对中药抗肿瘤成分的药物敏感性具有一定价值, 但其具体机制尚不清楚. 因此, 我们将进一步的深入研究探讨其可能的作用机制.
本文有助于阐明中药治疗肿瘤的减毒增效的机理, 具有重要的理论和临床借鉴意义.
编辑: 田滢 电编:鲁亚静
| 1. | 檀 碧波, 李 勇, 范 立侨, 赵 群, 刘 羽, 赵 雪峰. 胃癌凋亡相关蛋白Surivivn、B淋巴细胞/白血病-2、bax表达与肿瘤细胞体外化疗敏感性的关系. 中华实验外科杂志. 2012;29:1315-1317. |
| 6. | Liu WK, Xu SX, Che CT. Anti-proliferative effect of ginseng saponins on human prostate cancer cell line. Life Sci. 2000;67:1297-1306. [PubMed] [DOI] |
| 7. | Li B, Wang CZ, He TC, Yuan CS, Du W. Antioxidants potentiate American ginseng-induced killing of colorectal cancer cells. Cancer Lett. 2010;289:62-70. [PubMed] [DOI] |
| 8. | 赵 保胜, 刘 洋, 徐 暾海. 人参皂苷Rg1对人胃癌BGC-823的抑制作用研究. 中国临床药理学与治疗学. 2011;6:361-365. |
| 10. | Cheng YL, Chang WL, Lee SC, Liu YG, Chen CJ, Lin SZ, Tsai NM, Yu DS, Yen CY, Harn HJ. Acetone extract of Angelica sinensis inhibits proliferation of human cancer cells via inducing cell cycle arrest and apoptosis. Life Sci. 2004;75:1579-1594. [PubMed] [DOI] |
| 11. | Xie Y, Yin Y, Li L, Ma Y, Xiao Q. Short interfering RNA directed against the E2F-1 gene suppressing gastric cancer progression in vitro. Oncol Rep. 2009;21:1345-1353. [PubMed] [DOI] |
| 12. | Wang XT, Xie YB, Xiao Q. Lentivirus-mediated RNA interference targeting E2F-1 inhibits human gastric cancer MGC-803 cell growth in vivo. Exp Mol Med. 2011;43:638-645. [PubMed] [DOI] |
| 13. | Cappellini A, Chiarini F, Ognibene A, McCubrey JA, Martelli AM. The cyclin-dependent kinase inhibitor roscovitine and the nucleoside analog sangivamycin induce apoptosis in caspase-3 deficient breast cancer cells independent of caspase mediated P-glycoprotein cleavage: implications for therapy of drug resistant breast cancers. Cell Cycle. 2009;8:1421-1425. [PubMed] [DOI] |
| 14. | Sherbakova EA, Stromskaia TP, Rybalkina EIu, Kalita OV, Stavrovskaia AA. [Role of PTEN protein in multidrug resistance of prostate cancer cells]. Mol Biol (Mosk). 2008;42:487-493. [PubMed] |
| 15. | Cho SH, Chung KS, Choi JH, Kim DH, Lee KT. Compound K, a metabolite of ginseng saponin, induces apoptosis via caspase-8-dependent pathway in HL-60 human leukemia cells. BMC Cancer. 2009;9:449. [PubMed] [DOI] |