修回日期: 2013-04-24
接受日期: 2013-04-27
在线出版日期: 2013-06-18
目的: 探索射频消融(radiofrequency ablation, RFA)干预下肝癌细胞凋亡及周围肝组织病理学变化规律, 为在临床治疗中实现病理性完全消融(pathological complete ablation, PCA)提供病理学基础.
方法: 采用肿瘤细胞悬液肝内注入法构建兔肝VX2肿瘤模型, 在直视定位下行肝VX2肿瘤单电极射频消融术, 由消融中心依次逐层取材, 采用HE染色观察肿瘤以及周围肝组织各个类型细胞的病理学变化, 同时应用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TdT mediated-dUTP nick end labeling)法检测各部位细胞凋亡情况.
结果: RFA术后, 以电极为中心的周围肿瘤组织依次出现凝固性坏死区、坏死与细胞凋亡混合区、细胞凋亡区. 其中凝固性坏死区、坏死与细胞凋亡混合区可见大量炎细胞浸润, 单纯细胞凋亡区未见炎性细胞浸润. 在坏死与细胞凋亡混合区、细胞凋亡区域可见残余存活的肝癌细胞; 在肿瘤周围的肝细胞有部分坏死肝细胞, 但以细胞凋亡为主, 中央静脉、汇管区血管内皮细胞以及肝内小胆管上皮可见部分肝细胞凋亡.
结论: 通过对兔肝脏VX2肿瘤射频消融后的病理表现, 为临床治疗中进一步提高射频消融清除癌灶的能力和效率提供理论基础.
核心提示: 在本研究中把射频消融(radiofrequency ablation)术后的肿瘤组织依次分为凝固性坏死区、坏死与细胞凋亡混合区、细胞凋亡区. 其中凝固性坏死区、坏死与细胞凋亡混合区可见大量炎细胞浸润, 单纯细胞凋亡区未见炎性细胞浸润. 在坏死与细胞凋亡混合区、细胞凋亡区域可见残余存活的肝癌细胞; 在肿瘤周围的肝细胞有部分坏死肝细胞, 但以细胞凋亡为主, 中心静脉、汇管区血管内皮细胞以及肝内小胆管上皮可见部分肝细胞凋亡.
引文著录: 张振华, 邝晓聪, 杨红, 彭金波, 覃肖溪, 赵国志. 射频消融干预下兔VX2肿瘤病理学与凋亡的评估. 世界华人消化杂志 2013; 21(17): 1602-1606
Revised: April 24, 2013
Accepted: April 27, 2013
Published online: June 18, 2013
AIM: To examine pathological changes and cell apoptosis in rabbit VX2 liver tumors after radiofrequency ablation (RFA) to provide a theoretical basis for clinical treatment of liver cancer by RFA.
METHODS: A rabbit model of VX2 liver tumors was induced by injection of VX2 carcinoma cell suspension, and hepatic VX2 tumors were then treated by radiofrequency ablation. After treatment, tissue samples were taken to examine pathological changes in tumor tissue by light microscopy after HE staining, and to detect apoptosis by TdT-mediated dUTP nick end labeling assay.
RESULTS: After RFA, tumor tissues surrounding the ablation electrode showed sequential changes of necrotis, mixed necrosis and apoptosis, and apoptosis. Inflammatory cell invasion occurred in the necrotic area and mixed necrotic and apoptotic area. Residual living tumor cells were visible in the mixed necrotic and apoptotic area. Hepatocytes surrounding tumor cells showed apoptosis and occasionally necrosis. Apoptosis was also visible in vascular endothelial cells in the central vein and portal area and epithelial cells in the intrahepatic bile duct.
CONCLUSION: Assessment of pathological changes and cell apoptosis in rabbit VX2 liver tumors after RFA provides a theoretical basis for clinical treatment of liver cancer by RFA.
- Citation: Zhang ZH, Kuang XC, Yang H, Peng JB, Qin XX, Zhao GZ. Pathological changes and cell apoptosis in rabbit VX2 liver tumors after radiofrequency ablation. Shijie Huaren Xiaohua Zazhi 2013; 21(17): 1602-1606
- URL: https://www.wjgnet.com/1009-3079/full/v21/i17/1602.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i17.1602
射频消融(radiofrequency ablation, RFA)作为一种微创治疗方法, 在肝脏肿瘤治疗中日趋广泛, 尤其是在治疗无法手术切除的肝癌, 部分能够手术切除的小肝癌、早期肝癌等[1-3], 其基本原理是将电能转化成热能从而杀灭肿瘤细胞, 是一种局部肿瘤热疗方法. 目前临床RFA治疗后获得的通常只是影像学完全消融(imaging complete ablation, ICA), 影像学消融常常伴有肿瘤的残留, 因此肿瘤常出现复发与转移. 只有实现病理性完全消融(pathological complete ablation, PCA), 才能最大程度地减少肿瘤复发与转移, 这也是射频消融治疗的难题. 由于临床射频消融术后难以取材进行形态学观察, 因此, 本研究通过建立兔肝内VX2肿瘤模型, 并对其进行RFA干预处理, 观察肝肿瘤与肝组织细胞凋亡、坏死的病理学变化情况, 并进行区域划分, 进一步明确RFA治疗肝癌术后复发与转移的病理学机制, 为临床治疗中实现PCA提供理论基础.
新西兰大白兔22只, 雌雄不限, 体质量2.5-3.5 kg, 3-4月龄, VX2瘤株与新西兰大白兔由中山大学中山医学院医学实验动物中心提供. RF-2000型射频治疗仪(美国); LOGIQ9型超声诊断仪(GE公司); 末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TdT mediated-dUTP nick end labeling, TUNEL)染色原位细胞凋亡检测试剂盒(美国Roche公司); 双目显微镜(OLYMPUS公司).
1.2.1 VX2瘤株模型的制作: 将冰冻VX2癌细胞株常规细胞培养法复苏后, 接种于新西兰兔后腿肌肉或皮下, 制备成荷瘤种兔, 待瘤体长大后, 取生长旺盛的瘤体边缘组织, 制成组织块悬液, 在超声引导下将VX2瘤粒接种于已麻醉成功的实验兔肝脏内, 约14 d左右, B超检查证实瘤体生长到直径2 cm左右, 即可用于射频消融干预处理.
1.2.2 RFA干预处理: 实验动物术前12 h内禁食不禁水, 采用2%戊巴比妥钠(5.0 mL/kg)耳沿静脉注射麻醉, 采取腹正中切口开腹, 在直视下将射频治疗针单根电极插入肿瘤中心部位, 射频治疗参数: 能量由小到大序贯使用, 以功率10 W起, 以后每分钟升高10 W, 直至阻抗上升到顶部后停止消融.
1.2.3 取材: 治疗结束后, 实验动物采用耳缘静脉空气栓塞法处死, 切取消融肝脏组织, 由消融中心依次逐层取材, 并测量消融灶切面的直径大小.
1.2.4 兔肝组织HE染色: 切取的肝组织标本立即在10%甲醛固定液中固定, 固定后的组织经脱水、透明、包埋制成蜡块后, 切片, HE染色, 观察肿瘤以及周围肝组织各个类型细胞的病理学变化.
1.2.5 兔肝VX2肿瘤与肝组织细胞凋亡检测: TUNEL法检测细胞凋亡情况, 按Roche公司提供的原位细胞凋亡检测试剂盒操作, 以细胞核染成黄褐色为凋亡细胞.
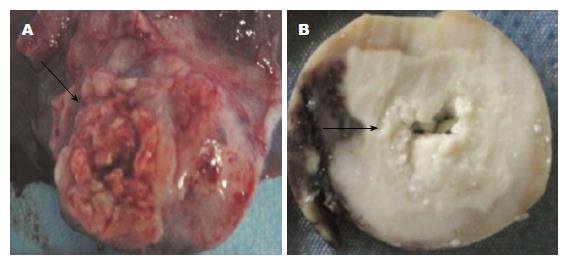
兔肝内VX2肿瘤是位于肝叶结节样包块, 无包膜, 呈鱼肉样, 表面灰白色, 质地偏硬, 直径大小为2.5-3.5 cm, 与周围肝组织分界清楚; RFA术后, 以射频消融针为中心, 依次出现灰白色、暗红色、红色等不规则环状分层区域性变化, 其中心部位质地变脆, 有一定硬度, 为凝固性坏死, 约3.5 cm, 瘤体与周围组织分界依然清楚(图1), 有薄纤维膜形成.
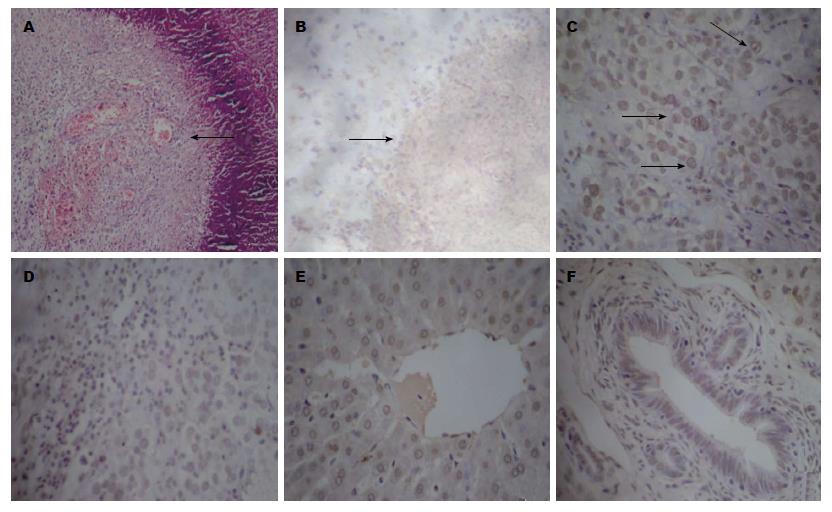
兔肝内VX2肿瘤RFA后病理学表现: 低倍镜下未见典型的肝索结构而出现聚集癌细胞群, 细胞排列紊乱, 但与周围肝组织分界较明显, 高倍镜下可见体积较大的不规则形态肿瘤细胞, 细胞核大, 可见核分裂像, 核浆比例大. RFA术后, 以电极为中心的周围肿瘤组织依次出现凝固性坏死区、坏死与细胞凋亡混合区、细胞凋亡区, 其中凝固性坏死区、坏死与细胞凋亡混合区可见大量炎细胞浸润, 单纯细胞凋亡区则未见炎性细胞浸润, 在坏死与细胞凋亡混合区、细胞凋亡区域则出现残余存活的肝癌细胞; 在肿瘤周围的肝细胞有部分坏死肝细胞, 但以细胞凋亡为主, 中央静脉、汇管区血管内皮细胞以及肝内小胆管上皮可见凋亡(表1, 图2).
| 区域 | 病理学改变与细胞凋亡 |
| 凝固性坏死区 | 射频消融中心区, 组织黄染, 细胞结构破坏, 出现凝固性坏死, 大量中性粒细胞、单核巨噬细胞浸润, 充血、出血明显 |
| 坏死与细胞凋亡混合区 | 围绕消融中心区, 可见灶性肿瘤细胞坏死, 有中性粒细胞、单核-巨噬细胞等炎细胞浸润, 固缩, 而TUNEL染色则表现为细胞核染黄褐色, 凋亡细胞周围则少见炎细胞, 其间偶见存活的癌细胞 |
| 细胞凋亡区 | 位于射频消融区的外缘, 与肝组织有混杂, 出现大量的细胞核染黄褐色, 凋亡细胞, 包含癌细胞和肝细胞; 未见炎细胞浸润; 间杂存活肿瘤细胞 |
| 肝小叶 | 位于肿瘤周围的肝小叶出现肝细胞灶性和单个细胞死亡, 表现为坏死或细胞凋亡, 可见少量中性粒细胞、单核-巨噬细胞等炎性细胞浸润 |
| 中央静脉 | 中央静脉上皮细胞多见细胞凋亡 |
| 汇管区 | 可见小动脉充血, 动脉与静脉内皮细胞以及肝内胆管上皮细胞凋亡 |
RFA可有效治疗肝脏肿瘤, 也可联合手术进行治疗, 拓宽肝癌治疗的适应证, 是目前发展肝脏肿瘤非手术治疗新技术. 但临床的病例总结发现, 由于肝肿瘤本身以及RFA治疗的方式不同, 其复发率在1.2%-40.0%[4-9]间波动, 与复发相关的因素众多, 诸如肝肿瘤大小、位置、RFA治疗方式与治疗效果等, 而本次动物实验研究则专注于RFA引发的肝肿瘤与肝组织基本改变, 并进行区域划分, 以此诠释其疗效的病理学基础.
RFA治疗后的病理形态学改变与其作用原理密切相关, 主要通过电极发射中高频电磁波, 引发电极周围细胞中极性分子产生高速共振, 将电磁能转化为热能, 使电极附近组织温度短时间内高达70 ℃-100 ℃, 导致肿瘤组织发生凝固性坏死[10]. 由于热传导的衰减性, 很多学者把RFA的区域分为针道碳化区、热凝固区、充血出血带区等3个区域, 即: (1)针道碳化区域, 针道周围组织呈炭化或汽化空泡改变; (2)热凝固区, 主要为消融灶区, 凝固苍白状; (3)充血出血带区, 位于坏死组织周围的残存活体组织, 表现为充血、出血、水肿和炎性细胞浸润也因此有研究相对应分为中心凝固坏死区、交界区、周边肿瘤残留区[11,12]. 本研究在HE染色的基础上, 联合细胞凋亡的观察, 则专注于病理学改变, 将其分为凝固性坏死区、坏死与细胞凋亡混合区、细胞凋亡区, 分析区域包含肝脏肿瘤与瘤体周围肝组织, 以获取更多的病理学信息. 本研究发现, 由于RFA的热效应在组织中的衰减, 距离电极近的肿瘤组织细胞多出现凝固性坏死, 而远离电极区域则出现细胞凋亡, 提示RFA的杀伤效应包括坏死与细胞凋亡, 这与王笛乐等[13]和Curley等[14]以及刘力等[15]研究的结果相同. 但本研究特别关注瘤体周围肝组织的病理学改变, 发现部分肝小叶中央静脉上皮细胞凋亡, 汇管区的动脉与静脉内皮细胞以及肝内胆管部分上皮细胞凋亡, 提示射频热效应已经波及瘤体周围肝组织. 尤其是发现血管内皮有部分细胞凋亡, 表明射频热效应可以通过损毁血管及其内皮细胞, 甚至包括瘤体周围的汇管区血管, 从而阻断肿瘤的血液供应, 还可能阻断肿瘤的转移途径. 但消融术的局限性导致术后残留癌的存在, 在本研究中发现坏死与细胞凋亡混合区以及细胞凋亡区中有残留存活的肿瘤细胞, 这可能与消融射频的热效应在组织中的衰减和组织类型差异性有关, 因此, 很难达到PCA也是肿瘤复发的重要生物学基础. 此外也有研究提出部分存活的肿瘤细胞实际为"鬼影细胞(ghost cell)"[16-18], 即在热凝固区的温度迅速升高, 细胞未发生自溶而被瞬间凝固, 组织细胞无活性, 但形态结构保存完好, 经HE染色后, 在形态上与存活细胞非常相似, 但经过数周后, 该类细胞就不存在了, 而本研究在非坏死区域的细胞凋亡区也发现了残留存活的肿瘤细胞, 并且在该区不存在凝固性坏死的作用条件, 因此可以明确其应该是存活的肿瘤细胞, 而非"鬼影细胞", 加之该区域的细胞凋亡并未引起炎性细胞浸润, 也使之避免了肿瘤细胞遭受免疫细胞的攻击, 所以提示本研究在凋亡区中残存的肿瘤细胞很可能是引起复发的"种子"细胞. 上述现象在影像学上有时不显示, 属于癌周微静脉浸润(microvascular invasion, MVI)灶和卫星灶, 并且常呈不规则分布. 通过病理学可以对该区域进行划分, 为RFA治疗肝脏肿瘤术后复发与转移提供理论线索.
总之, 本研究是将RFA术后兔VX2肝脏肿瘤的HE染色联合细胞凋亡进行肝肿瘤RFA效应区域划分, 为今后临床治疗中进一步达到PCA提供理论基础.
在我国, 肝癌是一种发病率高、危害大的疾病. 常规手术治疗虽能获得较好疗效, 但存在诸多缺陷, 而射频消融(radiofrequency ablation, RFA)作为一种局部消融治疗方法, 具有创伤小, 易操作, 费用低, 并可有效灭活肿瘤. 本研究通过建立兔肝内VX2肿瘤模型, 并对其进行RFA干预处理, 观察肝肿瘤与肝组织细胞凋亡、坏死的病理学变化情况, 并进行区域划分.
程树群, 副教授, 中国人民解放军第二军医大学东方肝胆外科医院综合治疗三科
RFA技术在肝脏肿瘤治疗中日趋广泛, 尤其是在治疗无法手术切除的中晚期肝癌, 部分能够手术切除的小肝癌, 早期肝癌, 术后复发肝癌等. 但目前临床RFA治疗后获得的通常只是影像学完全消融(imaging complete ablation, ICA), ICA常常伴有肿瘤的残留, RFA治疗后存在一定的转移和复发, 如何提高射频消融治疗效率, 降低RFA治疗后的复发和转移率是目前的难题.
RFA治疗不可避免残留癌灶, 研究证明对于直径3-5 cm和直径>5 cm者, RFA后癌灶残留率分别为17.5%-38.7%和50.0%-76.1%. 对此, 很多学者把RFA后的病灶区分为针道碳化区、热凝固区、充血出血带区, 以更进一步明确消融治疗效果.
由于临床RFA术后难以取材进行形态学观察, 因此, 本研究通过建立兔VX2肝癌动物模型, 进行基础实验研究, 把RFA治疗后以电极为中心的周围肿瘤组织依次分为凝固性坏死区、坏死与细胞凋亡混合区、细胞凋亡区, 并详细描述各区域的病理表现与凋亡情况, 为临床治疗中进一步提高RFA清除癌灶的能力和效率提供理论基础.
本研究中, 对RFA治疗后癌灶的区域划分和病理学描述, 更进一步使人们树立完全消融理念, 为今后临床治疗中进一步达到PCA提供理论基础. 提高RFA的疗效, 最大程度降低RFA治疗后的复发与转移.
射频消融: 一种肿瘤微创局部治疗方法, 主要通过电极发射中高频电磁波, 引发电极周围细胞中极性分子产生高速共振, 将电磁能转化为热能, 使电极附近组织温度短时间内高达70 ℃-100 ℃, 导致肿瘤组织发生凝固性坏死.
本文为临床治疗中提高射频消融清除癌灶的能力和效率提供理论基础, 结论可靠, 对临床有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Hong K, Georgiades CS, Geschwind JF. Technology insight: Image-guided therapies for hepatocellular carcinoma--intra-arterial and ablative techniques. Nat Clin Pract Oncol. 2006;3:315-324. [PubMed] [DOI] |
| 2. | Choi D, Lim HK, Rhim H, Kim YS, Lee WJ, Paik SW, Koh KC, Lee JH, Choi MS, Yoo BC. Percutaneous radiofrequency ablation for early-stage hepatocellular carcinoma as a first-line treatment: long-term results and prognostic factors in a large single-institution series. Eur Radiol. 2007;17:684-692. [PubMed] [DOI] |
| 3. | 陈 敏山, 张 耀军, 李 锦清, 梁 惠宏, 张 亚奇, 林 小军, 郑 云, 徐 立, 刘 允怡. 射频消融治疗肝脏恶性肿瘤803例分析. 中华外科杂志. 2007;45:1469-1471. |
| 4. | Livraghi T, Goldberg SN, Lazzaroni S, Meloni F, Ierace T, Solbiati L, Gazelle GS. Hepatocellular carcinoma: radio-frequency ablation of medium and large lesions. Radiology. 2000;214:761-768. [PubMed] |
| 5. | Scaife CL, Curley SA. Complication, local recurrence, and survival rates after radiofrequency ablation for hepatic malignancies. Surg Oncol Clin N Am. 2003;12:243-255. [PubMed] |
| 6. | Yu HC, Cheng JS, Lai KH, Lin CP, Lo GH, Lin CK, Hsu PI, Chan HH, Lo CC, Tsai WL. Factors for early tumor recurrence of single small hepatocellular carcinoma after percutaneous radiofrequency ablation therapy. World J Gastroenterol. 2005;11:1439-1444. [PubMed] |
| 7. | Hori T, Nagata K, Hasuike S, Onaga M, Motoda M, Moriuchi A, Iwakiri H, Uto H, Kato J, Ido A. Risk factors for the local recurrence of hepatocellular carcinoma after a single session of percutaneous radiofrequency ablation. J Gastroenterol. 2003;38:977-981. [PubMed] [DOI] |
| 8. | Kosari K, Gomes M, Hunter D, Hess DJ, Greeno E, Sielaff TD. Local, intrahepatic, and systemic recurrence patterns after radiofrequency ablation of hepatic malignancies. J Gastrointest Surg. 2002;6:255-263. [PubMed] [DOI] |
| 9. | van Duijnhoven FH, Jansen MC, Junggeburt JM, van Hillegersberg R, Rijken AM, van Coevorden F, van der Sijp JR, van Gulik TM, Slooter GD, Klaase JM. Factors influencing the local failure rate of radiofrequency ablation of colorectal liver metastases. Ann Surg Oncol. 2006;13:651-658. [PubMed] [DOI] |
| 11. | Peng ZW, Chen MS, Liang HH, Gao HJ, Zhang YJ, Li JQ, Zhang YQ, Lau WY. A case-control study comparing percutaneous radiofrequency ablation alone or combined with transcatheter arterial chemoembolization for hepatocellular carcinoma. Eur J Surg Oncol. 2010;36:257-263. [PubMed] [DOI] |
| 12. | 杜 端明, 邹 英华, 刘 鹏程, 陈 俊辉, 邹 立秋, 余 宏建, 江 锦赵, 阮 继银. MRI评价兔VX2肝癌射频消融后改变: 与病理对照. 中国医学影像技术. 2010;26:605-608. |
| 14. | Curley SA, Izzo F, Delrio P, Ellis LM, Granchi J, Vallone P, Fiore F, Pignata S, Daniele B, Cremona F. Radiofrequency ablation of unresectable primary and metastatic hepatic malignancies: results in 123 patients. Ann Surg. 1999;230:1-8. [PubMed] |
| 16. | Miao Y, Ni Y, Mulier S, Yu J, De Wever I, Penninckx F, Baert AL, Marchal G. Treatment of VX2 liver tumor in rabbits with "wet" electrode mediated radio-frequency ablation. Eur Radiol. 2000;10:188-194. [PubMed] |
| 17. | Yu T, Fan X, Xiong S, Hu K, Wang Z. Microbubbles assist goat liver ablation by high intensity focused ultrasound. Eur Radiol. 2006;16:1557-1563. [PubMed] [DOI] |
| 18. | Morimoto M, Sugimori K, Shirato K, Kokawa A, Tomita N, Saito T, Tanaka N, Nozawa A, Hara M, Sekihara H. Treatment of hepatocellular carcinoma with radiofrequency ablation: radiologic-histologic correlation during follow-up periods. Hepatology. 2002;35:1467-1475. [PubMed] [DOI] |