修回日期: 2013-04-22
接受日期: 2013-04-27
在线出版日期: 2013-06-08
目的: 研究环巴胺诱导胃癌MKN45细胞凋亡的作用及其对血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)、基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)和基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)表达的影响.
方法: 以胃癌MKN45细胞为研究对象, MTT法检测不同浓度环巴胺作用不同时间对MKN45细胞的增殖抑制作用. 应用流式细胞仪测定细胞凋亡率及细胞周期分布. RT-PCR检测环巴胺对VEGF、MMP-2、MMP-9 mRNA表达的影响.
结果: 不同浓度(7.5、15、30、60、90、120 μmol/L)的环巴胺对人胃癌MKN45细胞均有增殖抑制作用, 且呈时间和剂量依赖性. 30、60、90 μmol/L环巴胺作用MKN45细胞24 h后凋亡率分别为18.45%±0.57%、39.77%±0.61%、68.52%±0.89%, 明显高于阴性对照组的细胞凋亡率2.08%±0.49%, 差异具有统计学意义(P<0.05). 细胞周期分析显示, 随着环巴胺浓度升高, G0/G1期细胞比例逐渐增多, S期细胞比例逐渐减少, 细胞发生G0/G1期阻滞(P<0.05). RT-PCR检测显示环巴胺作用24 h后, VEGF、MMP-2、MMP-9 mRNA的表达明显下降, 且随着药物浓度的增高表达量逐渐减少(P<0.05).
结论: 环巴胺对胃癌细胞MKN45具有明显的增殖抑制及促凋亡作用, 其机制可能与下调肿瘤侵袭转移相关基因VEGF、MMP-2、MMP-9的表达有关.
核心提示: 本研究显示环巴胺对胃癌细胞有抗肿瘤作用, 其机制可能与血管内皮细胞生长因子(vascular endothelial growth factor)、基质金属蛋白酶-2(matrix metalloproteinase-2)和基质金属蛋白酶-9(matrix metalloproteinase-9)的表达有关, 为胃癌的药物治疗提供新思路, 为环巴胺的临床应用提供理论依据.
引文著录: 任雪萍, 张全安, 郑勤. 环巴胺对胃癌MKN45细胞株VEGF、MMP-2、MMP-9基因表达的影响. 世界华人消化杂志 2013; 21(16): 1527-1532
Revised: April 22, 2013
Accepted: April 27, 2013
Published online: June 8, 2013
AIM: To investigate the effect of cyclopamine on cell apoptosis and expression of vascular endothelial growth factor (VEGF), matrix metalloproteinase-2 (MMP-2) and matrix metalloproteinase-9 (MMP-9) in gastric cancer cell line MKN45.
METHODS: After MKN45 cells were treated with different concentrations of cyclopamine (7.5, 15, 30, 60, 90, 120 μmol/L) for different durations, cell proliferation was assessed by MTT assay, cell apoptosis and cell cycle progression were determined by flow cytometry, and expression of VEGF, MMP-2 and MMP-9 mRNAs was detected by RT-PCR.
RESULTS: Cyclopamine inhibited the growth of MKN45 cells in a time- and dose-dependent manner. The apoptosis rates of MKN45 cells treated with 30, 60, 90 μmol/L of cyclopamine for 24 h were significantly higher than that of non-treated cells (18.45% ± 0.57%, 39.77% ± 0.61%, 68.52% ± 0.89% vs 2.08% ± 0.49%, all P < 0.05). The percentage of cells in G0/G1 phase was increased while that in S phase was decreased in cyclopamine-treated cells, and cell cycle was arrested in G0/G1 phase. Treatment with cyclopamine for 24 h decreased the expression levels of VEGF, MMP-2 and MMP-9 mRNA in a dose-dependent manner (all P < 0.05).
CONCLUSION: Cyclopamine inhibits cell proliferation and induces apoptosis in gastric cancer cell line MKN45 via mechanisms possibly associated with down-regulating the expression of tumor invasion-related genes VEGF, MMP-2 and MMP-9.
- Citation: Ren XP, Zhang QA, Zheng Q. Effect of cyclopamine on expression of VEGF, MMP-2 and MMP-9 in gastric cancer cell line MKN45. Shijie Huaren Xiaohua Zazhi 2013; 21(16): 1527-1532
- URL: https://www.wjgnet.com/1009-3079/full/v21/i16/1527.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i16.1527
胃癌是我国最常见的消化系恶性肿瘤之一, 胃癌细胞的侵袭和转移是抗肿瘤治疗失败的重要原因, 血管新生及细胞外基质降解是肿瘤侵袭转移的重要环节[1]. 参与肿瘤血管生成的因子很多, 其中血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)是迄今为止发现的作用最强的促血管生长因子[2]. 基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)和基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)是基质金属蛋白酶(matrix metalloproteinase, MMPs)家族中的重要成员, 能有效降解基底细胞膜及细胞外基质(extracellular matrix, ECM)[3]. 本实验旨在观察环巴胺对胃癌MKN45细胞株的生长抑制作用及其对VEGF、MMP-2、MMP-9基因表达的影响, 探讨其可能的作用机制, 为环巴胺的临床应用提供理论依据.
胃癌MKN45细胞株由中国科学院上海细胞生物学研究所细胞库提供. 环巴胺(cyclopamine)购自Biomol公司产品; RPMI 1640培养基、胎牛血清购自杭州四季青有限公司; 四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT)、二甲基亚砜(dimethyl sulfoxide, DMSO)购自美国Sigma公司; Annexin V/PI凋亡试剂盒、细胞周期试剂盒均购自南京凯基生物科技发展有限公司; TRIzol试剂盒购自Invitrogen公司; RT-PCR试剂盒购自宝生物工程大连有限公司; VEGF、MMP-2、MMP-9基因引物由上海生工生物工程公司合成.
1.2.1 细胞培养: 胃癌MKN45细胞用含100 U/mL青霉素、100 μg/mL链霉素、10%胎牛血清的RPMI 1640培养液, 在37 ℃、5%饱和湿度条件下培养, 1-2 d更换培养液1次, 每2-3 d传代一次, 实验时选用对数生长期细胞.
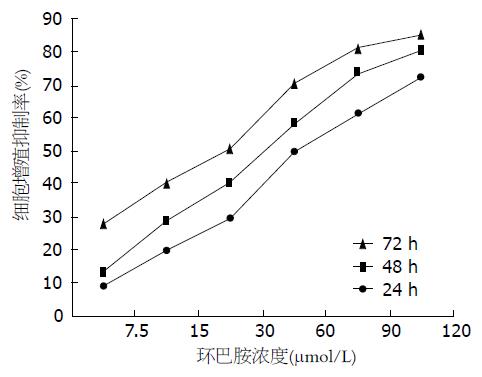
1.2.2 MTT法测定细胞增殖抑制率: 取对数生长期MKN45细胞, 用胰酶消化制成单细胞悬液, 调整细胞浓度为1×105/mL, 接种于96孔板, 每孔200 μL. 分为实验组、空白对照组及阴性对照组, 实验组加入终浓度为7.5、15、30、60、90、120 μmol/L的环巴胺, 空白对照组不含细胞仅加入培养液, 阴性对照组含有细胞并加入等量溶剂; 每组设6个复孔. 分别于加药后24、48和72 h检测, 每孔加入MTT溶液(5 mg/mL)20 μL; 继续孵育4 h, 离心、弃上清液, 每孔加入150 μL DMSO, 摇床混匀充分溶解颗粒; 酶联检测仪于波长540 nm处测定吸光度(A)值. 实验重复3次, 取平均值.
1.2.3 流式细胞术测定细胞凋亡率: 取对数生长期细胞, 以每孔5×106个细胞接种于六孔培养板, 细胞贴壁生长后, 加入终浓度分别为30、60、90 μmol/L的环巴胺, 培养24 h后, 收集各组细胞, 调整细胞浓度为1×106/mL, 取100 μL悬液, 加入5 μL AnnexinV-FITC和10 μL PI, 避光反应15 min, 加入300 μL 1×Annexin-V缓冲液, 流式细胞仪测定细胞凋亡率.
1.2.4 流式细胞术检测细胞周期: 取对数生长期的细胞, 接种于100 mL培养瓶, 培养24 h后, 加入终浓度为30、60、90 μmol/L的环巴胺, 另设阴性对照组, 孵育24 h后, 胰酶消化收集各组细胞, 4 ℃ PBS洗涤2次. 离心后加入预冷的70%乙醇, 固定过夜, 冷PBS洗涤后, 加入RNase和PI, 避光染色30 min, 流式细胞仪分析细胞周期分布. 实验重复3次.
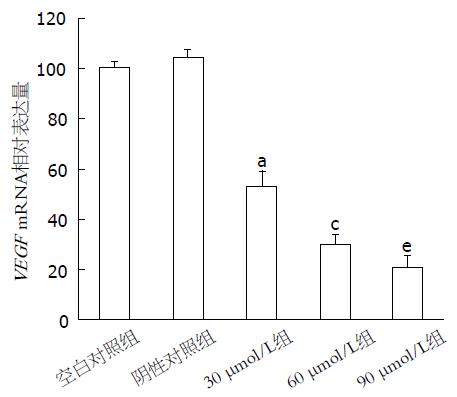
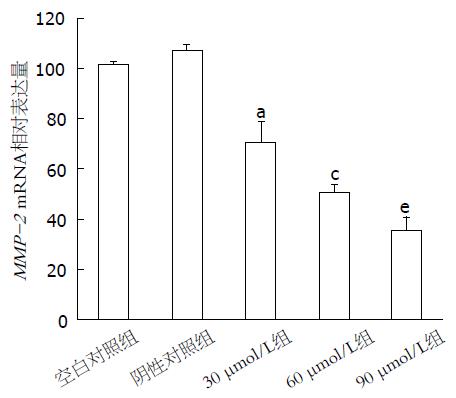
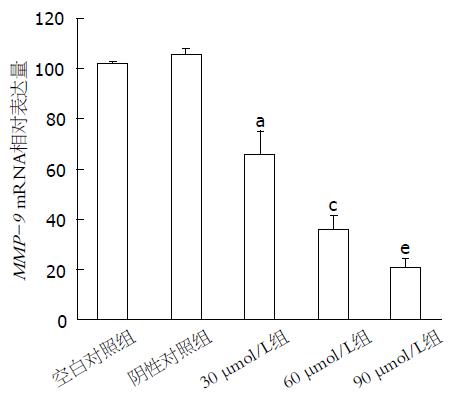
1.2.5 RT-PCR检测VEGF、MMP-2、MMP-9 mRNA表达: 收集30、60、90 μmol/L环巴胺作用24 h后的MKN45细胞, TRIzol法提取总RNA, 逆转录成cDNA, 进行PCR扩增. β-actin: 上游引物为5'-CCAACTAATGTTCAGCGTTA-3', 下游引物5'-TACGATGATAGGAATGGTTG-3', 扩增片段400 bp; VEGF: 上游引物5'-ACTTT- CTGCTGTCTTGGATG-3', 下游引物5'-CTCGGCTTGTCACATCACCG-3', 扩增片段227 bp; MMP-2: 上游引物5'-CTTCCTTCAAGGACCGGTAG-3', 下游引物5'-GTCTGGCTTGGGGTAGGCTA-3', 扩增片段606 bp; MMP-9: 上游引物5'-TGGGAACCAGCTGTGCGGAT-3', 下游引物5'-CGTGTGTACACCCA AGACGC-3', 扩增片段325 bp. PCR反应条件如下: 94 ℃预变性5 min, 随后94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸10 min, 共30个循环. PCR产物行琼脂糖凝胶电泳, 利用凝胶成像系统扫描、拍照, 分析数据. 实验重复3次. 以β-actin作为内参照, 计算VEGF、MMP-2、MMP-9 mRNA的相对表达量.
统计学处理 所得数据采用SPSS13.0软件包进行统计分析. 计量资料以mean±SD表示. 多样本比较采用单因素方差分析; 组间比较采用t检验. P<0.05为差异有统计学意义.
不同浓度(7.5、15、30、60、90、120 μmol/L)的环巴胺作用于MNK45细胞24、48、72 h后, MKN45细胞的生长均受到不同程度抑制, 随着药物浓度的升高及作用时间的延长, 细胞增殖抑制作用逐渐增强, 其增殖抑制率与药物浓度和作用时间呈正相关(P<0.05, 图1).
经30、60、90 μmol/L的环巴胺作用24 h后, MKN45细胞的凋亡率分别为18.45%±0.57%、39.77%±0.61%、68.52%±0.89%, 明显高于阴性对照组的细胞凋亡率2.08%±0.49%, 差异具有统计学意义(P<0.05). 且随着环巴胺药物浓度的逐渐升高, 细胞凋亡率亦逐渐增加, 各浓度组间比较差异有统计学意义(P<0.05).
不同浓度环巴胺作用24 h后细胞周期受到不同程度的影响, 与阴性对照组比较, 环巴胺组G0/G1期比例明显增高, S期细胞比例下降, 且随着药物浓度的增加, G0/G1期细胞比例逐渐升高, S期细胞比例逐渐减少, 细胞发生G0/G1期阻滞, 各组间差异具有统计学意义(P<0.05, 表1).
RT-PCR结果显示, 空白对照组及阴性对照组的基因表达水平无显著差异, 而不同浓度的环巴胺处理胃癌MKN45细胞24 h后, 细胞内VEGF、MMP-2、MMP-7 mRNA的表达明显下降, 与空白对照组及阴性对照组相比, 差异具有统计学意义(P<0.05), 且随着环巴胺药物浓度的增加, 各基因的表达量逐渐减少, 各浓度组间差异亦有统计学意义(P<0.05, 图2-4).
胃癌的发生发展是一个多因素、多步骤的复杂过程, 其预后与分化程度、浸润深度、病理分期、淋巴结转移及远处转移等密切相关[4,5]. 目前胃癌治疗效果差, 且在治疗过程中常出现耐药、复发和转移. 环巴胺是一种藜芦属类固醇植物碱, 并在多种肿瘤细胞中发挥抗肿瘤作用, 但对其研究大多集中在Hedgehog信号通路[6-8], 关于其他方面的研究较少, 其是否通过其他途径发挥抗肿瘤作用尚不明确.
MKN45细胞为低分化细胞株, 恶性程度高, 本研究我们用环巴胺对MKN45进行干预, MTT结果显示环巴胺对胃癌MKN45细胞具有明显的增殖抑制作用. 环巴胺作用于胃癌MKN45细胞24 h后细胞凋亡率显著升高, 与对照组比较, 差异有统计学意义. 细胞周期分析显示环巴胺使MKN45细胞增殖阻滞于G0/G1期.
肿瘤细胞的侵袭转移是一个复杂的过程, 其中包括肿瘤血管新生、细胞外基质降解、细胞增殖改变、细胞黏附改变及细胞迁移等环节[9,10]. 肿瘤血管新生与肿瘤的生长、浸润和转移密切相关, 是肿瘤侵袭转移的必要条件[11,12]. 参与肿瘤血管生成的因子很多, 其中VEGF是迄今为止发现的作用最强、最重要的促血管生长因子. VEGF能特异性地促进血管内皮细胞增殖、分化和迁移, 趋化肿瘤细胞, 诱导肿瘤血管生成, 促进肿瘤生长、侵袭及转移[13,14]. Zhao等[15]采用免疫组织化学法检测107例胃癌组织和31例癌旁正常胃组织, 结果表明, VEGF在正常胃组织中呈低表达或无表达, 在胃癌组织中呈高表达, 且表达水平与肿瘤大小、浸润深度、淋巴结转移和病理分期呈正相关. Liu等[16]进行的一项荟萃分析包括44项研究, 共计4794例胃癌根治术患者, 结果显示, 对于胃癌根治术后患者, VEGF阳性者比阴性者生存率低, 同时VEGF阳性表达者胃癌肿块大, 易浸润, 更易发生血行转移, 分期多为进展期, 多因素分析证实VEGF是独立的预后指标.
肿瘤的侵袭转移亦涉及到ECM的破坏, 细胞外基质的降解是肿瘤浸润和转移的先决条件[17]. MMPs是具有锌指结构的蛋白水解酶, 是降解细胞外基质蛋白最主要的蛋白水解酶, 在肿瘤的浸润和转移中发挥着至关重要的作用[18]. MMP-2和MMP-9是MMPs家族中的重要成员, 能有效降解基底细胞膜及细胞外基质, 促进血管内皮细胞迁移及血管重塑, 并能上调VEGF, 促进肿瘤血管新生, 是启动血管生成的重要因子[19]. Hwang等[20]采用免疫组织化学法检测189例胃癌组织中MMP-2和MMP-9的表达水平, 并分析其与肿瘤的浸润、临床病理特征和临床结果的相关性, 结果表明, MMP-2、MMP-9在正常胃组织黏膜及癌旁组织中呈低表达, 在胃癌组织呈高表达, 且阳性表达程度与肿瘤浸润深度、淋巴结转移及TNM分期呈正相关. MMP-2、MMP-9的异常表达在胃癌的发生发展、浸润转移过程中发挥了重要作用, 可作为判断胃癌患者预后的独立指标.
我们进一步研究发现, 不同浓度的环巴胺作用于MKN45细胞24 h后, VEGF、MMP-2及MMP-9 mRNA的表达水平下降, 且随着药物浓度增高, 表达量逐渐减少. 环巴胺可能通过抑制VEGF、MMP-2及MMP-9的基因表达, 进而减少肿瘤浸润转移, 从而发挥抗肿瘤作用.
总之, 本研究结果表明环巴胺可抑制MKN45细胞的增殖, 并诱导其凋亡, 其机制可能与阻滞细胞周期于G0/G1期以及下调细胞中VEGF、MMP-2及MMP-9基因的表达有关, 为胃癌患者的治疗提供新的途径及理论依据.
胃癌是最常见的消化系恶性肿瘤之一, 其预后与肿瘤分化程度、浸润深度、病理分期、淋巴结转移及远处转移等密切相关. 目前胃癌治疗效果差, 在治疗过程中常出现耐药、复发和转移, 因此寻找高效低毒的药物成为目前研究的热点.
李革, 副教授, 延边大学附属医院
多数胃癌患者确诊时为晚期, 药物治疗是胃癌治疗的基础. 环巴胺是一种藜芦属类固醇植物碱, 研究发现其在多种肿瘤细胞中发挥抗肿瘤的作用, 环巴胺作为一种潜在的抗肿瘤新药在世界范围内掀起了研究热潮.
Zheng等研究发现, 在胃癌组织中VEGF、MMP-2和MMP-9的表达与肿瘤的大小、深度浸润、淋巴和静脉浸润、淋巴结转移和UICC分期呈正相关, MMP-2、MMP-9和VEGF在很大程度上促进胃癌血管生成和胃癌进展, 是胃癌不良预后因素.
目前关于环巴胺的抗肿瘤作用机制尚未明确. 本研究发现环巴胺对胃癌细胞MKN45具有明显的增殖抑制及促凋亡作用, 其机制可能与下调肿瘤侵袭转移相关基因VEGF、MMP-2、MMP-9的表达有关.
本文研究环巴胺诱导胃癌MKN45细胞调亡的作用及其对VEGF、MMP-2、MMP-9基因表达的影响, 有一定的创新性, 条理清晰, 结论可靠, 有科学意义和学术价值.
编辑: 田滢 电编: 鲁亚静
| 1. | Corso G, Seruca R, Roviello F. Gastric cancer carcinogenesis and tumor progression. Ann Ital Chir. 2012;83:172-176. [PubMed] |
| 2. | Pradeep CR, Sunila ES, Kuttan G. Expression of vascular endothelial growth factor (VEGF) and VEGF receptors in tumor angiogenesis and malignancies. Integr Cancer Ther. 2005;4:315-321. [PubMed] [DOI] |
| 3. | Curran S, Murray GI. Matrix metalloproteinases: molecular aspects of their roles in tumour invasion and metastasis. Eur J Cancer. 2000;36:1621-1630. [PubMed] [DOI] |
| 4. | Ayadi S, Daghfous A, Makni A, Fteriche F, Maghrebi H, Rebai W, Bedioui H, Chebbi F, Ksantini R, Ammous A. Prognostic factors in gastric carcinoma after R0 resection with DII lymph node dissection. Tunisian experience. Tunis Med. 2012;90:812-815. [PubMed] |
| 5. | Yang X, Takano Y, Zheng HC. The pathobiological features of gastrointestinal cancers (Review). Oncol Lett. 2012;3:961-969. [PubMed] [DOI] |
| 6. | Gould A, Missailidis S. Targeting the hedgehog pathway: the development of cyclopamine and the development of anti-cancer drugs targeting the hedgehog pathway. Mini Rev Med Chem. 2011;11:200-213. [PubMed] [DOI] |
| 7. | Sheikh A, Alvi AA, Aslam HM, Haseeb A. Hedgehog pathway inhibitors - current status and future prospects. Infect Agent Cancer. 2012;7:29. [PubMed] [DOI] |
| 8. | Wu X, Cai ZD, Lou LM, Chen ZR. The effects of inhibiting hedgehog signaling pathways by using specific antagonist cyclopamine on the chondrogenic differentiation of mesenchymal stem cells. Int J Mol Sci. 2013;14:5966-5977. [PubMed] [DOI] |
| 9. | Nasr Z, Pelletier J. Tumor progression and metastasis: role of translational deregulation. Anticancer Res. 2012;32:3077-3084. [PubMed] |
| 10. | Steeg PS. Tumor metastasis: mechanistic insights and clinical challenges. Nat Med. 2006;12:895-904. [PubMed] [DOI] |
| 11. | Robert J. Biology of cancer metastasis. Bull Cancer. 2013;100:333-342. [PubMed] [DOI] |
| 12. | Gretschel S, Astrosini Ch, Vieth M, Jöns T, Tomov T, Höcker M, Schlag PM, Kemmner W. Markers of tumour angiogenesis and tumour cells in bone marrow in gastric cancer patients. Eur J Surg Oncol. 2008;34:642-647. [PubMed] [DOI] |
| 13. | Roskoski R. Vascular endothelial growth factor (VEGF) signaling in tumor progression. Crit Rev Oncol Hematol. 2007;62:179-213. [PubMed] [DOI] |
| 14. | Wang X, Chen X, Fang J, Yang C. Overexpression of both VEGF-A and VEGF-C in gastric cancer correlates with prognosis, and silencing of both is effective to inhibit cancer growth. Int J Clin Exp Pathol. 2013;6:586-597. [PubMed] |
| 15. | Zhao ZQ, Yang S, Lu HS. Expression of midkine and vascular endothelial growth factor in gastric cancer and the association of high levels with poor prognosis and survival. Mol Med Rep. 2012;5:415-419. [PubMed] [DOI] |
| 16. | Liu L, Ma XL, Xiao ZL, Li M, Cheng SH, Wei YQ. Prognostic value of vascular endothelial growth factor expression in resected gastric cancer. Asian Pac J Cancer Prev. 2012;13:3089-3097. [PubMed] [DOI] |
| 17. | Pathak A, Kumar S. Independent regulation of tumor cell migration by matrix stiffness and confinement. Proc Natl Acad Sci USA. 2012;109:10334-10339. [PubMed] [DOI] |
| 18. | Lukaszewicz-Zając M, Mroczko B, Szmitkowski M. Gastric cancer - The role of matrix metalloproteinases in tumor progression. Clin Chim Acta. 2011;412:1725-1730. [PubMed] [DOI] |
| 19. | Zheng H, Takahashi H, Murai Y, Cui Z, Nomoto K, Niwa H, Tsuneyama K, Takano Y. Expressions of MMP-2, MMP-9 and VEGF are closely linked to growth, invasion, metastasis and angiogenesis of gastric carcinoma. Anticancer Res. 2006;26:3579-3583. [PubMed] |
| 20. | Hwang TL, Lee LY, Wang CC, Liang Y, Huang SF, Wu CM. Claudin-4 expression is associated with tumor invasion, MMP-2 and MMP-9 expression in gastric cancer. Exp Ther Med. 2010;1:789-797. [PubMed] [DOI] |