修回日期: 2013-04-22
接受日期: 2013-05-12
在线出版日期: 2013-06-08
目的: 探讨光敏化姜黄素对人胃腺癌MGC-803细胞的影响及其细胞内的分布情况.
方法: 用MTT法检测细胞株的增殖抑制率, 流式细胞仪检测细胞的凋亡率, 荧光显微镜观察细胞核形态; 激光共聚焦显微镜观察姜黄素在细胞内的分布.
结果: 光敏化姜黄素作用于MGC-803细胞12、24、48 h后, MTT法检测细胞的抑制率分别为35.53%±3.52%、40.17%±2.01%、44.93%±3.61%; 凋亡率分别为20.32%±3.07%、22.46%±1.51%、26.58%±2.67%, 与对照组比较差异有统计学意义(P<0.05). 光敏化姜黄素作用48 h后能见明显的凋亡小体. 激光共聚焦显微镜下观察光敏化姜黄素发出的黄色荧光主要在细胞质膜、核膜呈聚集性分布, 散在分布于其他亚细胞结构, 细胞核分布较少.
结论: 光敏化姜黄素能抑制胃癌细胞的生长及凋亡, 具有显著的光动力学效应, 随作用时间的延长而逐渐增加. 光敏剂主要分布于细胞质膜和核膜, 散在分布于其他亚细胞结构, 细胞核分布较少.
核心提示: 光敏化姜黄素作用于MGC-803细胞后, 具有明显促进细胞抑制和凋亡的作用, 能见明显的凋亡小体. 激光共聚焦显微镜下观察光敏化姜黄素发出的黄色荧光主要在细胞质膜、核膜呈聚集性分布, 散在分布于其他亚细胞结构, 细胞核分布较少.
引文著录: 蓝宇涛, 旷焱平, 陈垦, 何博华, 迟作华, 王林静, 刘革修. 光敏化姜黄素对人胃腺癌MGC-803细胞的影响及其在细胞内的分布. 世界华人消化杂志 2013; 21(16): 1522-1526
Revised: April 22, 2013
Accepted: May 12, 2013
Published online: June 8, 2013
AIM: To investigate the effect of photoactivated curcumin on cell growth and apoptosis in human gastric cancer cell line MGC-803 and to analyze its intracellular distribution.
METHODS: After MGC-803 cells were treated with 5.0 μmol/L of photoactivated curcumin for different durations (12, 24 and 48 h), cell growth was assessed by MTT assay; apoptosis was determined by flow cytometry; nuclear morphological changes were detected by fluorescence microscopy; and the distribution of intracellular curcumin was examined by confocal laser microscopy.
RESULTS: The reduced rates of cell growth were 35.53% ± 3.52%, 40.17% ± 2.01% and 44.93% ± 3.61% in MGC-803 cells treated with photoactivation curcumin for 12, 24 and 48 h, and the apoptosis rates were 20.32% ± 3.07%, 22.46% ± 1.51% and 26.58% ± 2.67%. Compared to the control group, the reduced rates of cell growth were significantly lower and apoptosis rates were significantly higher in the photoactivation curcumin group at all time points (all P < 0.05). Obvious apoptotic bodies were observed after treatment with photoactivated curcumin for 48 hours. Photoactivated curcumin was mainly distributed in the cell membrane and nuclear membrane. Scattered distribution of photoactivated curcumin was noted in other subcellular structures.
CONCLUSION: Photoactivated curcumin can inhibit growth and promote apoptosis of gastric cancer cells in a time-dependent manner. Photoactivated curcumin is mainly located in the plasma membrane and nuclear membrane and sporadically in other subcellular structures.
- Citation: Lan YT, Kuang YP, Chen K, He BH, Chi ZH, Wang LJ, Liu GX. Photoactivaed curcumin inhibits cell growth and promotes apoptosis in human gastric cancer cell line MGC-803. Shijie Huaren Xiaohua Zazhi 2013; 21(16): 1522-1526
- URL: https://www.wjgnet.com/1009-3079/full/v21/i16/1522.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i16.1522
光动力学疗法(photodynamic therapy, PDT)是一种能诱导细胞坏死和凋亡的细胞毒性治疗方法. PDT作用的主要因素包括光敏感物质(光敏剂)、可见光及氧分子. 随着光敏物质、光激活装置和导光系统的发展和进步, PDT与传统治疗联合应用于癌症已逐渐被接受. PDT具有很好的选择性和适用性, 可重复, 协同手术能提高疗效, 还可消灭隐性癌病灶, 同时可保护容貌及重要器官功能. 光敏剂是决定PDT效应的关键因素之一. 本文主要研究光敏化姜黄素对人胃腺癌MGC-803细胞的影响及其在细胞内的分布.
人胃腺癌MGC-803细胞柱(中山大学动物实验中心提供), 姜黄素(Sigma公司), 小牛血清, RPMI-1640(华美公司).
1.2.1 细胞培养及药物处理: 人胃腺癌MGC-803细胞于含10%小牛血清、100 U/mL青霉素及100 U/mL链霉素的RPMI 1640培养液、5%CO2、37 ℃培养传代. 细胞按1-2×105/mL接种, 37 ℃培养24 h后按实验要求加入一定浓度的姜黄素, 对照组加同量的溶剂, 继续培养24 h后即收集细胞. 姜黄素(Sigma公司)0.1842 g先用100 μL DMSO溶解后, 用无水乙醇定容至50 mL, 即为10 mmol/L姜黄素母液, 分装0.5 mL/管, -20 ℃避光冻存. 应用时以细胞培养液稀释至所需浓度.
1.2.2 激光照射: PDT组用姜黄素避光2 h, PBS 3次, 加入培养液, 即刻用激光器照射. 前期研究结果显示姜黄素吸收波长在360-480 nm范围内具有明显的PDT作用[1]. 本研究选择的波长为405 nm.
1.2.3 MTT法检测细胞的抑制率: 细胞分为单纯姜黄素组和PDT组. 前期研究结果显示5.0 μmol/L具有较好的处理效应[1]. 单纯姜黄素组处理因素为5.0 μmol/L姜黄素和避光. PDT组处理因素为5.0 μmol/L姜黄素和激光照射, 分别检测不同培养时间段的抑制率(12、24、48 h).
1.2.4 荧光显微镜观察细胞核形态: 荧光显微镜下观察单纯姜黄素组和PDT组细胞核形态并拍照.
1.2.5 Annexin V-PI 双染测定细胞凋亡: 分别检测单纯姜黄素组和PDT组细胞检测不同培养时间段的凋亡率(12、24、48 h).
1.2.6 激光共焦扫描显微镜观察光敏化姜黄素在胃癌细胞内的分布: 采用Leica TCSS-SP2型激光共聚焦扫描显微镜观察单纯姜黄素组和PDT组细胞内的荧光分布, 利用层析技术断层扫描细胞内部结构, 分析姜黄素在细胞内的分布情况.
统计学处理 应用SPSS15.0统计学软件进行统计. 计量资料采用mean±SD, 用重复测量变量的方差分析进行两两比较, 以P<0.05为差异具有统计学意义.
单纯5.0 μmol/L姜黄素对MGC-803细胞显示有明显的增殖抑制作用, 48 h后细胞增殖抑制率为29.74%±2.30%[1]; 光敏化增强了姜黄素对MGC-803细胞的增殖抑制作用, 培养12 h和24 h后细胞的抑制率分别为35.53%±3.52%、40.17%±2.01%, 培养48 h后, 细胞抑制率增加到44.93%±3.61%, 在一定范围内, 随作用时间的延长而逐渐增加. 不同作用时间, PDT组与单纯姜黄素组比较, 差异有统计学意义(P<0.05)(表1).
| 分组 | 抑制率 | ||
| 12 h | 24 h | 48 h | |
| 空白对照组 | 1.16±0.34 | 1.97±1.65 | 2.85±0.87 |
| 单纯姜黄素组 | 18.94±1.26 | 24.50±4.50 | 29.74±2.30 |
| 光动力学疗法组 | 35.53±3.52 | 40.17±2.01 | 44.93±3.61 |
前期研究表明, 单纯5.0 μmol/L的姜黄素能够影响MGC-803细胞的周期分布, 诱导MGC-803细胞凋亡: G0/G1期细胞明显增多, G2/M期细胞下降. 其细胞凋亡率为(12.54±1.75)%[1]. 光敏化进一步增强了诱导细胞凋亡的作用, 培养12 h和24 h后细胞的凋亡率分别为20.32%±3.07%、22.46%±1.51%, 培养48 h后, 其细胞凋亡率升高为26.58%±2.67%, 在一定范围内, 随作用时间的延长而逐渐增加. 不同作用时间, PDT组与单纯姜黄素组比较差异有统计学意义(P<0.05)(表2).
| 分组 | 凋亡率 | ||
| 12 h | 24 h | 48 h | |
| 空白对照组 | 1.74±1.43 | 2.06±2.56 | 3.34±0.55 |
| 单纯姜黄素组 | 6.04±2.34 | 8.04±1.30 | 12.54±1.75 |
| 光动力学疗法组 | 20.32±3.07 | 22.46±1.51 | 26.58±2.67 |
单纯姜黄素组MGC-803细胞形态规则, 可见部分细胞凋亡. PDT组采用能量密度40.2 J/cm2的405 nm波长的激光照射后, 培养48 h后, 可见明显细胞凋亡[1]. 同时细胞数目减少, 部分细胞体积缩小, 形态不规则, 圆形细胞分解增多, 见凋亡小体, 呈典型凋亡改变.
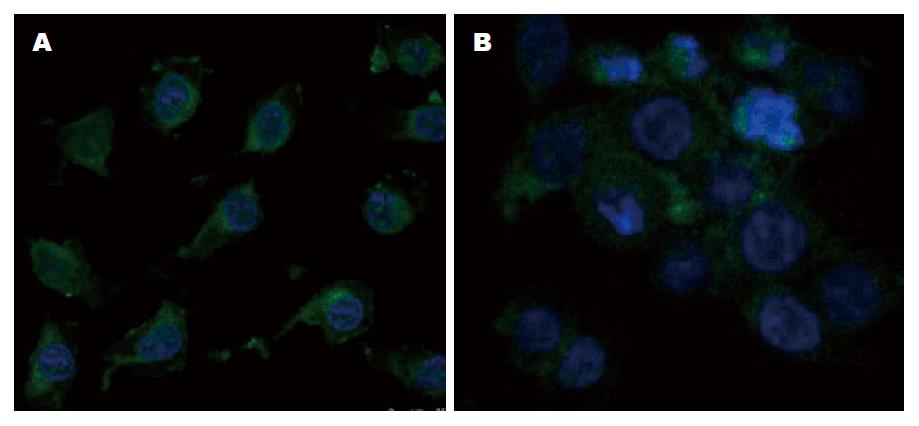
经405 nm, 40.2 J/cm2波长的激光照射后的姜黄素(光敏化姜黄素)本身能发出黄色荧光. 在激光共聚焦显微镜下可以观察到光敏化姜黄素发出的黄色荧光主要在细胞质膜及核膜处呈聚集性分布, 其他细胞结构也有散在分布, 细胞核分布较少(图1).
PDT是一种能诱导细胞凋亡和坏死的细胞毒性治疗方法, 主要因素包括光敏剂、可见光及氧分子. 光敏剂吸收能量后产生对细胞有不良作用的活性氧(reactive oxygen species, ROS). 其中光敏剂是决定PDT效应的关键因素之一. 激光照射可选择性地杀伤肿瘤细胞, 而对正常细胞的影响极小. 这一特点让PDT成为有前景的肿瘤治疗方法, 对不能承受手术, 放疗不敏感的晚期胃癌患者选择PDT治疗效果较好.
姜黄素已在基础研究中显示出其光敏效应强、抗癌作用强、毒性低、用量低等优点, 具有很好的应用前景. Moragoda等[2]研究发现姜黄素能诱导胃癌和结肠癌细胞凋亡. Link等[3]也研究了姜黄素对结肠癌细胞的作用. Bush等[4]发现姜黄素也能诱导恶性黑素瘤凋亡. Wei等[5]和Cheng等[6]最近也研究了姜黄素对前列腺癌细胞的影响. 同时Du等[7]、Masuelli等[8]、Zhang等[9]还研究了姜黄素对肝癌、乳癌和甲状腺癌细胞的抗癌效应, 取得了很好的成果. 姜黄素也开始应用于肿瘤的临床治疗及预防, 如焦广宇等[10]取得了较好的辅助治疗效果. Park等[11]也发现姜黄素具有很好的防癌作用. 本研究探讨了5.0 μmol/L光敏化姜黄素对人胃癌MGC-803细胞的影响, 表明光敏化作用促进姜黄素抑制胃癌MGC-803细胞的增殖, 促进其凋亡, 具有显著的光毒效应. 激光共聚焦显微镜分辨率高、能断层扫描细胞内部结构及观察三维图像, 广泛应用于生物医学领域, 如细胞骨架的研究. 标记有荧光的特异性抗体与亚细胞结构(如细胞膜、线粒体、溶酶体、核膜)结合, 可出现破裂、萎缩、变形等结构变化, 从而确定其作用的靶点[12].
本研究应用激光共聚焦显微镜观察有荧光的姜黄素在胃癌细胞内各层面的光学切片图像, 发现姜黄素主要分布在细胞质膜、核膜, 散在分布于其他细胞结构, 细胞核分布较少. 与国内的研究类似, 戴维德也研究了肺癌细胞内HMME的分布, 认为细胞核周围的细胞质是分布的主要位点, 细胞核较少分布[13]. 郑景存等[14]认为叶绿素衍生物在人膀胱癌细胞主要分布于细胞核周围, 细胞浆内. 我们推测细胞质膜可能是姜黄素在人胃癌MGC-803细胞内首先分布的位点, 其次可能分布到核膜、线粒体或溶酶体. 当聚集于线粒体时, 通过损伤线粒体迅速启动凋亡机制杀伤细胞. 如进入溶酶体时, 可导致溶酶体破裂, 释放出水解酶导致细胞坏死. 光敏剂在细胞内的分布及定位决定了光动力学作用最初损害的位置. 近距离的接触对产生光动力学作用的ROS的能量转移很重要. 汲振余等[15]认为决定定位的因素还与光敏剂的亲脂性、电荷、浓度等理化性质有关, 一般来说, 脂溶性光敏剂易结合到质膜和线粒体膜, 而水溶性光敏剂则主要位于溶酶体和肿瘤间质. 低浓度时主要定位于线粒体, 高浓度时也定位于溶酶体. 具体的定位还有待进一步实验的研究. 尤其是特异性免疫探针染料如经标记的线粒体、蛋白、膜抗体、受体、细胞骨架等定位及定量、空间分布及病变细胞动态观察方面的研究还不足.
总之, 光敏化进一步增强了姜黄素诱导人胃癌MGC-803细胞的凋亡, 我们认为光敏化姜黄素主要分布于细胞质膜和核膜, 其PDT作用还可能与损坏线粒体和溶酶体, 造成细胞的凋亡和坏死有关. 其他凋亡的机制还有待进一步研究.
衷心感谢华南师范大学生命激光研究所魏华江教授及广东药学院心血管病研究所亓翠玲教授等的热心指导和帮助.
手术、化疗和放疗是传统的3大治疗胃癌的方法, 这些方法在杀伤肿瘤细胞的同时, 也会带来严重的并发症. 光动力学疗法(photodynamic therapy, PDT)能选择性地杀伤肿瘤组织, 而对周围组织影响较小, 成为一种新的非常有前景的肿瘤治疗方法.
程英升, 教授, 上海交通大学附属第六人民医院放射科; 侯风刚, 副教授, 副主任医师, 上海中医药大学附属市中医医院肿瘤科
基础研究显示姜黄素治疗肿瘤的效果, 光敏化能进一步促进姜黄素的杀伤肿瘤作用, 但激光的波长和剂量不一, 其效果也不一. 姜黄素在细胞内的具体定位能决定姜黄素给药的最佳剂量. 诱导肿瘤细胞凋亡的机制以及光动力治疗的有效激光作用剂量及激光波长的选择等还有待进一步研究.
戴维德等的研究表明第2代光敏剂HMME在细胞内的亚细胞具体定位, 认为线粒体、溶酶体、内质网和高尔基体均有分布. 汲振余认为光敏剂的亲脂性和所带电荷决定了肿瘤细胞中的亚细胞定位和分布浓度. 其次还与细胞类型或孵育时间有关.
本文研究光敏化姜黄素应用于人胃腺癌MGC-803细胞的增值抑制率、凋亡率及细胞核形态的变化, 并用激光共聚焦显微镜观察细胞内的分布情况. 初步解决姜黄素可作为PDT的光敏剂应用于临床的关键问题, 即光敏化姜黄素对胃癌细胞的PDT作用的主要靶点, 为确定姜黄素的给药剂量做好基础研究. 进一步拓展姜黄素的药用价值和开发利用的前景.
中药姜黄素具有药源广、提取工艺简单、价格低廉的优点, 且姜黄素的无毒性、少不良反应是目前临床所有光敏剂缺乏的优点, 姜黄素本身具有一定的抗癌作用, 能一定程度抑制癌细胞生长, 本研究证实姜黄素本身具有的抗癌作用和其PDT效应产生杀灭癌细胞的叠加效果, 进一步拓展姜黄素的药用价值和开发利用.
光动力学治疗是一种能诱导细胞凋亡和坏死的细胞毒性治疗方法, 主要因素包括光敏剂、可见光及氧分子. 光敏剂吸收能量后产生对细胞有不良作用的活性氧, 其中光敏剂是决定PDT效应的关键因素之一. 姜黄素已在基础研究中显示出其光敏效应强、毒性低、用量低等优点, 具有很好的应用前景.
编辑: 田滢 电编: 闫晋利
| 2. | Moragoda L, Jaszewski R, Majumdar AP. Curcumin induced modulation of cell cycle and apoptosis in gastric and colon cancer cells. Anticancer Res. 2001;21:873-878. [PubMed] |
| 3. | Link A, Balaguer F, Shen Y, Lozano JJ, Leung HC, Boland CR, Goel A. Curcumin modulates DNA methylation in colorectal cancer cells. PLoS One. 2013;8:e57709. [PubMed] [DOI] |
| 4. | Bush JA, Cheung KJ, Li G. Curcumin induces apoptosis in human melanoma cells through a Fas receptor/caspase-8 pathway independent of p53. Exp Cell Res. 2001;271:305-314. [PubMed] |
| 5. | Wei X, Zhou D, Wang H, Ding N, Cui XX, Wang H, Verano M, Zhang K, Conney AH, Zheng X. Effects of pyridine analogs of curcumin on growth, apoptosis and NF-κB activity in prostate cancer PC-3 cells. Anticancer Res. 2013;33:1343-1350. [PubMed] |
| 6. | Cheng TS, Chen WC, Lin YY, Tsai CH, Liao CI, Shyu HY, Ko CJ, Tzeng SF, Huang CY, Yang PC. Curcumin-targeting pericellular serine protease matriptase role in suppression of prostate cancer cell invasion, tumor growth, and metastasis. Cancer Prev Res (Phila). 2013;6:495-505. [PubMed] |
| 7. | Du Q, Hu B, An HM, Shen KP, Xu L, Deng S, Wei MM. Synergistic anticancer effects of curcumin and resveratrol in Hepa1-6 hepatocellular carcinoma cells. Oncol Rep. 2013;29:1851-1858. [PubMed] |
| 8. | Masuelli L, Benvenuto M, Fantini M, Marzocchella L, Sacchetti P, Di Stefano E, Tresoldi I, Izzi V, Bernardini R, Palumbo C. Curcumin induces apoptosis in breast cancer cell lines and delays the growth of mammary tumors in neu transgenic mice. J Biol Regul Homeost Agents. 2013;27:105-119. [PubMed] |
| 9. | Zhang CY, Zhang L, Yu HX, Bao JD, Sun Z, Lu RR. Curcumin inhibits invasion and metastasis in K1 papillary thyroid cancer cells. Food Chem. 2013;139:1021-1028. [PubMed] |
| 11. | Park W, Amin AR, Chen ZG, Shin DM. New perspectives of curcumin in cancer prevention. Cancer Prev Res (Phila). 2013;6:387-400. [PubMed] |