修回日期: 2013-03-13
接受日期: 2013-05-08
在线出版日期: 2013-06-08
目的: 研究葡萄籽寡聚体原花青素(oligomeric proanthocyanidins, OPC)对大鼠酒精性肝损伤及脑功能障碍的保护作用.
方法: 将31只SD大鼠随机分为4组. A组为生理盐水组, B组为OPC组, C组为OPC+酒精组及D组为酒精组. 2次/d灌胃法, 连续灌胃23 d. 观察动物醉酒潜伏期, 血浆天门冬氨酸氨基转氨酶(aspartate aminotransferase, AST)和丙氨酸氨基转氨酶(alanine aminotransferase, ALT)含量以及肝脏和脑组织病理组织学改变.
结果: (1)AST和ALT在A、B及C组之间比较, 差别都没有统计学意义(P>0.05); D组与其他3组比较, AST和ALT都显著升高, 差别有统计学意义(P<0.001); (2)A组及B组肝脏组织均未见明显病理改变. C组及D组大鼠肝脏损伤发生率分别为57.1%及100%; 肝组织损伤面积分别为3.6%±3.2%及63%±28%, 差异有统计学意义(P<0.001); (3)C组比D组大鼠平均醉酒潜伏期时间明显延长(P<0.0001); (4)4组大鼠脑组织在光镜下均未见明显病理改变.
结论: 葡萄籽寡聚体原花青素对大鼠酒精性肝损伤具有明显的保护作用, 还有抗醉酒作用.
核心提示: 葡萄籽寡聚体原花青素(oligomeric proanthocyanidins, OPC)是一种天然药物, 其基本结构单位是儿茶素. OPC中含有儿茶素单体、二聚体和三聚体, 均为水溶性分子, 分子中含有多个酚性羟基. OPC具有很强的抗氧化作用, 还有抗炎症活性、抗突变性及抗氧化性DNA损伤的特性, 癌症化学预防作用, 抗糖尿病作用以及抗微生物活性等. 本研究利用葡萄籽寡聚体原花青素抗脂质过氧化及抗炎症反应等活性作用, 探讨他对酒精性肝损伤及酒精性脑功能障碍的保护作用.
引文著录: 王萌, 马艺萍, 李亚伟, 魏婕, 张峻豪, 何佟, 陈世民. 葡萄籽寡聚体原花青素对大鼠酒精性肝损伤及脑功能障碍的保护作用. 世界华人消化杂志 2013; 21(16): 1480-1486
Revised: March 13, 2013
Accepted: May 8, 2013
Published online: June 8, 2013
AIM: To study the protective effects of oligomeric proanthocyanidins (OPC) from grape seeds against alcohol-induced liver injury and cerebral dysfunction in rats.
METHODS: Thirty-one Sprague-Dawley rats were randomly divided into four groups: A (treated with normal saline), B (treated with OPC), C (treated with OPC and alcohol), and D (treated with alcohol). Groups A and D were administered intragastrically with 0.9% NaCl [10 mL/(kg•d)], while groups B and C were administered with OPC solution [200 mg/(kg•d]. After three hours, groups A and B were intragastrically given 0.9% NaCl [10 mL/(kg•d)], while groups C and D were given 55% alcohol [10 mL/(kg•d)]. After 23 d, blood samples were collected from all animals via the inferior vena cava under general anesthesia, and liver and brain tissue samples were taken and fixed in 10% buffer formaldehyde. The level of aspartate aminotransferase (AST) and alanine aminotransferase (ALT) in the plasma was measured, and the histopathology of the liver and brain was assessed under an optical microscope.
RESULTS: Plasma levels of AST were 110.00 U/L ± 15.55 U/L, 98.38 U/L ± 17.86 U/L, 100.14 U/L ± 14.46 U/L and 176.00 U/L ± 49.60 U/L in groups A, B, C and D, respectively, and those of ALT were 57.25 U/L ± 9.04 U/L, 49.50 U/L ± 6.67 U/L, 50.28 U/L ± 5.37 U/L and 74.50 ± 9.69 in groups A, B, C and D. Both AST and ALT levels did not significantly differ between groups A, B and C (all P > 0.05); however, both AST and ALT levels were significantly elevated in group D compared to groups A, B, and C (all P < 0.001). No significant liver injury was found in groups A and B. The incidence of liver injury in group C was lower than that in group D (57.1% vs 100%, P = 0.077), and the area of injured liver was significantly less in group C than in group D (3.6% ± 3.2% vs 63% ± 28%, P < 0.001). The latent periods from alcohol administration to the onset of drunkenness was significantly longer in group C than in group D (16.43 min ± 2.71 min vs 10.67 min ± 2.38 min, P < 0.0001). No significant brain injury was found in all four groups by optical microscopy.
CONCLUSION: Pretreatment with OPC provides excellent protection against alcohol-induced liver injury and slows the onset of drunkenness in rats.
- Citation: Wang M, Ma YP, Li YW, Wei J, Zhang JH, He T, Chen SM. Oligomeric proanthocyanidins from grape seeds protect against alcohol-induced liver injury and cerebral dysfunction in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(16): 1480-1486
- URL: https://www.wjgnet.com/1009-3079/full/v21/i16/1480.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i16.1480
全球好饮者众多, 衍生许多值得关注的社会及健康问题. 据2011年世界卫生组织报告, 饮酒已经成为人类健康的主要杀手之一, 酒精伤害是超过60多种主要疾病及损伤的病因, 每年导致约250万人死亡[1]. 饮酒后, 酒精很快分布于全身组织, 并快速通过血脑屏障. 经常酗酒可以导致包括肝脏、中枢神经、周围神经、骨骼肌和心肌等多种组织损伤[2]. 急性酒精中毒时, 大鼠肝内超氧化物形成增多, 过高的超氧化物可使脂质过氧化并导致肝细胞损伤, 即酒精性肝损伤[3]. 由于肝脏是氧化性药物代谢的主要器官, 所以活性氧(reactive oxygen species, ROS)增多很容易引起肝脏损伤[4]. 急性酒精中毒还增加了感染的危险性, 同时增加了胃肠道的通透性, 循环中细菌内毒素升高, 激发了巨噬细胞对Toll样受体(toll-like receptor, TLR)配基的炎症反应, 使更多具有细胞毒性的细胞因子大量产生, 引起肝脏损伤[5,6]. 炎症反应中各种介质和细胞因子的相互作用, 也是酒精性肝损伤重要发生机制之一[7]. 简言之, 氧化应激和炎症系统激活是酒精性肝损伤病理生理学的关键因素. 葡萄籽寡聚体原花青素(oligomeric proanthocyanidins, OPC)是一种天然药物, 其基本结构单位是儿茶素. OPC中含有儿茶素单体、二聚体和三聚体, 均为水溶性分子, 分子中含有多个酚性羟基. OPC具有很强的抗氧化作用, 还有抗炎症活性, 抗突变性及抗氧化性DNA损伤的特性, 癌症化学预防作用, 抗糖尿病作用以及抗微生物活性等[8,9]. 本研究利用OPC抗脂质过氧化及抗炎症反应等活性作用, 探讨他对酒精性肝损伤及酒精性脑功能障碍的保护作用.
清洁级SD♂大鼠31只, 体质量195.99 g±19.04 g, 购自中山大学实验动物中心. 12 h光照和黑夜循环, 温度22 ℃±2 ℃, 湿度50%-60%, 标准饲料, 自由饮水. 将动物随机分成4组: A组为生理盐水组(n = 8), B组为OPC组(n = 8), C组为OPC+酒精组(n = 7, 1只在灌胃时意外死亡, 故去除)及D组为酒精组(n = 8). 2次/d灌胃, 首次灌胃前禁食过夜(12 h). A组第1次按10 mL/(kg•d)生理盐水灌胃, 第2次于3 h后按10 mL/(kg•d)生理盐水灌胃; B组第1次按OPC 200 mg/(kg•d)[用生理盐水配成2%的浓度, 10 mL/(kg•d)]灌胃, 第2次于3 h后按10 mL/(kg•d)生理盐水灌胃; C组第1次灌胃按OPC 200 mg/(kg•d)[用生理盐水配成2%的浓度, 10 mL/(kg•d), bw]灌胃, 第2次于3 h后用生理盐水配制酒精浓度为55%, 按10 mL/(kg•d), bw量灌胃; D组第1次按10 mL/(kg•d)生理盐水灌胃, 第2次于3 h后用生理盐水配制酒精浓度为55%, 按10 mL/(kg•d)灌胃. 以上4组连续灌胃23 d. 随后, 全身麻醉, 取血, 分离血浆. 处死所有动物, 取肝脏及脑组织送病理学检查. 贝克曼-库尔特LX-20生化自动分析仪, 用于检测血浆天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)及丙氨酸氨基转移酶(alanine aminotransferase, ALT). AST和ALT试剂盒由广州标佳科技有限公司生产; 红星二锅头酒(62%乙醇)由北京红星股份有限公司生产; 葡萄籽提取物原花青素(又称葡萄多酚), 由青岛海隆达生化科技有限公司生产.
1.2.1 醉酒潜伏期、平均醉酒潜伏期及总平均醉酒潜伏期: 观察C组及D组大鼠每次灌酒后至开始出现醉酒状态的醉酒潜伏期时间. 以翻正反射消失为判断大鼠醉酒的指标. 计算同组所有大鼠同1 d醉酒潜伏期时间的平均数作为平均醉酒潜伏期. 计算同组所有大鼠实验期间内全部醉酒潜伏期时间的平均数作为总平均醉酒潜伏期.
1.2.2 血浆AST及ALT含量: 动物全身麻醉, 剖腹, 暴露下腔静脉, 用注射器直接穿刺取血, 肝素抗凝. 静置后离心, 取血浆送临床生化检验AST及ALT.
1.2.3 组织病理学: 取肝脏组织及脑组织, 立即用10%中性缓冲甲醛固定, 常规脱水, 石蜡包埋切片, HE染色, 由病理学专科医生光镜下观察组织病理学改变并诊断. 大鼠肝损伤发生率 = 发生肝损伤例数/本组动物总数, 肝损伤面积百分率的计算参考文献[10]方法. 考虑到酒精性肝损伤并非匀质, 故改随机固定视野为连续视野全覆盖观察. 用含刻度标尺的目镜观察, 先测量组织切片的面积, 再测量其中损伤肝细胞区域面积, 肝损伤面积百分率 = 损伤肝细胞区域面积/组织切片的面积×100%.
统计学处理 采用SPSS11.0软件进行统计学处理, 计量资料数据以mean±SD表示, 组间比较采用方差分析, 率的比较采用Fisher确切概率法, P<0.05为差异有统计学意义.
测量各组动物实验开始时(第1天)及实验结束时(第23天)的体质量, 各组动物体质量均见明显增加, 差异有统计学意义(P<0.001). 而各组间体质量增加百分率差别没有统计学意义(P>0.05, 表1).
A、B及C组之间比较, 血浆AST及ALT含量差异没有统计学意义(P>0.05). D组与其他3组比较, 血浆AST及ALT含量都显著升高, 差异有统计学意义(P<0.001, 表2).
2.3.1 各组大鼠肝损伤发生率及肝损伤面积百分率的比较: A组及B组肝脏组织均未见明显病理改变. C组及D组大鼠肝脏组织损伤发生率差异没有统计学意义(P = 0.077), 但两组肝组织损伤面积及严重程度的差异有统计学意义(P<0.001, 表3).
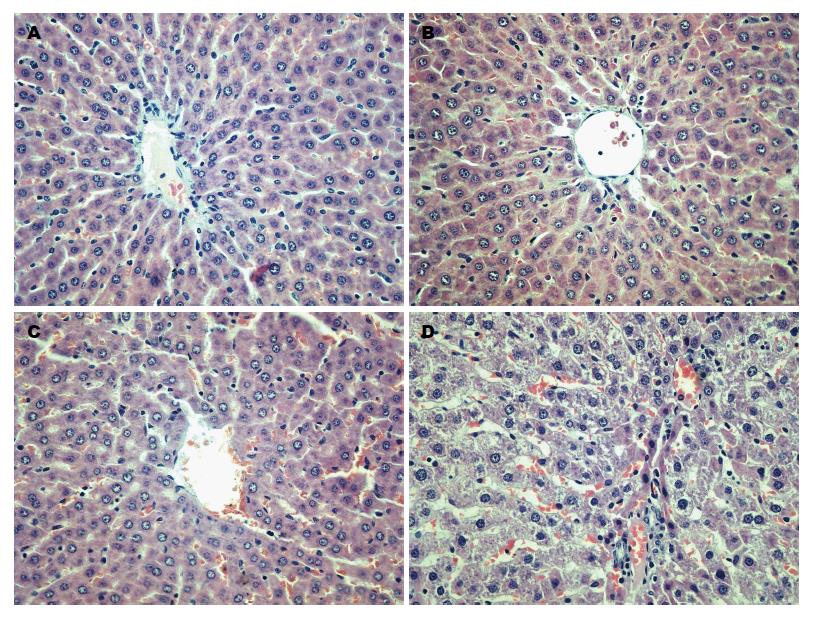
2.3.2 各组大鼠肝组织形态学改变: A组及B组大鼠肝内可见肝小叶结构正常, 以中央静脉为中心呈放射状排列, 肝细胞索排列正常; C组肝小叶结构正常, 仅见局灶少量肝细胞轻微水肿及脂肪变性; D组部分肝小叶结构异常, 可见广泛性水肿变性及脂肪变性肝细胞, 局部有坏死灶并有炎症细胞浸润(图1).
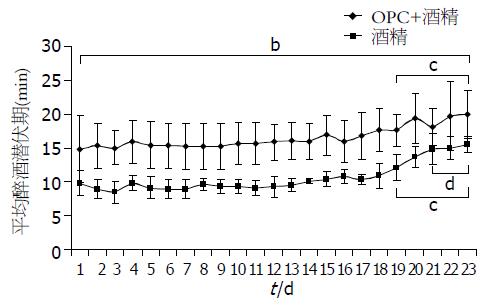
C组及D组大鼠每天灌酒后至发生醉酒的平均醉酒潜伏期时间的动态变化如图2. C组总平均醉酒潜伏期时间为16.43 min±2.71 min, D组总平均醉酒潜伏期时间为10.67 min±2.38 min, 两组差别有统计学意义(P<0.0001). 将同组各天与第1天平均醉酒潜伏期时间比较, 发现C组及D组大鼠均从第19天开始, 比第1天平均醉酒潜伏期时间明显延长, 差别有统计学意义(P<0.05). 将同组第23天与第19天比较, C组发生平均醉酒潜伏期时间差别没有统计学意义(P>0.05), 但D组发生平均醉酒潜伏期时间差别有统计学意义(P<0.05).
4组大鼠脑组织在光镜下均未见明显病理改变. 本实验未检测脑细胞超微结构及分子水平的改变.
酒精在肝脏代谢有3种途径: (1)乙醇脱氢酶(alcohol dehydrogenase, ADH)作用; (2)细胞色素P4502E1(CYP2E1)作用; (3)线粒体催化酶作用. ADH和CYP2E1将乙醇转化为乙醛, 乙醛是损害肝脏的因素之一. 酒精性肝损伤的发病机制非常复杂, 涉及生化、遗传、细胞、免疫及体液性因素等. 其中, 由酒精诱导的CYP2E1引起的氧化应激(H2O2, OH, O2-增多), 同时肝内抗氧化剂不足, 乙醛作用, 许多细胞因子[主要是肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α), 白介素(interleukin, IL)-6, IL-1α/β]平衡改变等, 是酒精引起肝脏损伤的主要机制[11].
本实验表明, D组大鼠血浆AST及ALT含量显著升高, 肝脏损伤发生率为100%, 肝脏损伤面积达63%±28%, 肝组织广泛性明显水肿, 并可见较多脂肪变性细胞. 表明成功复制了酒精性肝损伤模型.
我们将C组预先灌胃OPC 3 h后再灌胃酒精, 发现AST和ALT没有显著升高, 在A、B及C组之间的差别没有统计学意义(P>0.05). A组及B组肝脏组织均未见明显病理改变. C组与D组的实验结果对比, 前者血浆AST及ALT含量明显低于后者(P<0.001), 且肝脏损伤发生率从100%降至57.1%, 肝脏损伤面积从63%±28%降至3.6%±3.2%(P<0.001). 证明OPC对酒精性肝损伤具有明显保护作用.
OPC具有强大的抗氧化应激和细胞保护作用[8,9,12]. OPC的抗自由基能力和抗自由基引起的脂质过氧化及DNA损伤作用, 明显强于维生素C、E及β-胡萝卜素[13]. OPC还有抗炎症活性, 可以减少IL-6和单核细胞趋化蛋白(monocyte chemoattractant protein-1, MCP-1)表达, 提高抗炎介质脂肪因子脂联素产生[14]. 还可以通过抑制NO和前列腺素E2的合成, 抑制iNOS mRNA表达及核转录因子-κB转位, 调节激活的巨噬细胞的炎症反应[15]. 我们认为OPC对酒精性肝损伤的保护作用与其广泛的生物学效应, 如抗氧化应激、抗炎症活性和细胞保护作用有关.
醉酒状态是酒精引起脑功能障碍的重要表现. 实验证明, 醉酒动物运动功能降低与大脑皮层线粒体功能障碍, 导致脑能量代谢障碍有关[16].
给大鼠灌胃酒精10 wk后, 大脑皮层及海马区脂质过氧化物明显升高, 而具有抗氧化特性的还原型谷胱甘肽(reduced glutathione, GSH)、超氧化物歧化酶和过氧化氢酶活性则明显降低. 此外, TNF-α、IL-1b、NFκβ p65亚基及细胞凋亡蛋白酶(caspase-3)在大鼠大脑皮层及海马区也有显著升高[17]. 说明酒精性脑损伤和酒精性肝损伤存在一些共同发病机制, 即均有氧化应激及炎症介质的作用.
在临床研究中, 非创伤性结构成像技术发现慢性酒精中毒患者大脑灰质及白质容量减少, 而戒酒后可部分逆转恢复. 功能影像方法证明酒精中毒患者脑内代谢异常, 如低血糖代谢和神经递质系统平衡破坏等[18].
本实验D组动物灌胃酒精后约10 min即发生脑功能障碍, 表现为醉酒状态. 而C组动物灌胃酒精后约16 min才出现醉酒状态. C组大鼠每天的平均醉酒潜伏期时间均比D组明显延长(P<0.0001), 说明OPC具有抗醉酒功效. 特别是, C组第1天给予OPC 3 h后, 大鼠醉酒潜伏期就明显延长, 说明该药物即用即效, 不需累积生效. 我们认为, OPC抗醉酒作用机制可能与其强大的抗脑组织氧化应激和炎症反应以及改善脑能量代谢和神经元保护有关.
有实验证明, OPC可以增加神经元轴突的密度, 提高血管内皮生长因子受体2(vascular endothelial growth factor receptor-2, VEGFR-2)的磷酸化, 改善早老小鼠的记忆, 减轻认知障碍及减少大脑神经病理学改变等, 提示OPC具有神经保护作用[19-22].
连续灌酒19 d后, C组和D组动物均对酒精产生了适应性, 醉酒潜伏期明显延长(P<0.05). 我们认为, 这主要是大脑对酒精的适应性反应, 而不是肝脏的适应性反应. 因为, 将同组第23天与第19天比较, D组大鼠肝功能已经明显受损情况下, 醉酒潜伏期仍然进一步延长(P<0.05). 这也表明醉酒潜伏期延长并不意味肝脏损害减轻.
本实验各组大鼠脑组织在光镜下均未见明显病理改变. 关于酒精中毒对脑细胞的影响, 以及OPC对脑细胞保护作用的机制, 需要进一步进行细胞超微结构及分子水平的研究.
先灌OPC后灌酒, 可以明显预防或减轻大鼠酒精性肝损伤, 同时还可明显保护脑功能, 对临床应用有很大的启发作用.
本实验结果提示, OPC对大鼠酒精性肝损伤具有明显的保护作用, 同时还具有抗醉酒作用.
本项目在实施过程中得到海南医学院教务部、机能学实验室、病理学教研室及附属医院检验科的大力支持. 在组织病理学检查方面, 得到翁阳教授、张弦老师、薛蓬贵及蓝永洪老师的无私帮助; 在血浆转氨酶检测方面, 得到蔡仁平老师的无私帮助; 在数据统计学处理方面, 得到吴玲老师和赵婵娟老师的无私帮助; 在此一并表示衷心感谢.
葡萄籽寡聚体原花青素(oligomeric proanthocyanidins, OPC)是一种天然药物, 其基本结构单位是儿茶素. OPC中含有儿茶素单体、二聚体和三聚体, 均为水溶性分子, 分子中含有多个酚性羟基. OPC具有很强的抗氧化作用, 还有抗炎症活性、抗突变性及抗氧化性DNA损伤的特性, 癌症化学预防作用, 抗糖尿病作用以及抗微生物活性等. 本研究利用OPC抗脂质过氧化及抗炎症反应等活性作用, 探讨他对酒精性肝损伤及酒精性脑功能障碍的保护作用.
何红伟, 副研究员, 中国医学科学院, 北京协和医学院医药生物技术研究所肿瘤室
酒精对人类健康的危害已成共识. 寻找天然药物预防或治疗酒精性肝损伤及脑功能障碍, 已经成为人们关注的研究要点之一.
OPC具有强大的抗氧化、抗炎症、抗突变性、抗微生物活性、抗糖尿病及癌症化学预防作用等.
本文发现OPC不仅对大鼠酒精性肝损伤具有明显的保护作用, 还有抗醉酒作用.
OPC可护肝护脑, 预防酒精性肝损伤及脑功能障碍.
本文的结论明确, 文字流畅, 统计恰当, 具有一定的科学性, 创新性.
编辑: 李军亮 电编: 闫晋利
| 1. | World Health Organization. Global Status Report on Alcohol and Health 2011. Geneva: WHO Press 2011. Available from: http: //www.who.int/substance_abuse/publications/global_alcohol_report/en/index.html. |
| 2. | Chopra K, Tiwari V. Alcoholic neuropathy: possible mechanisms and future treatment possibilities. Br J Clin Pharmacol. 2012;73:348-362. [PubMed] [DOI] |
| 3. | Adachi M, Ishii H. Role of mitochondria in alcoholic liver injury. Free Radic Biol Med. 2002;32:487-491. [PubMed] |
| 4. | Arteel GE. Oxidants and antioxidants in alcohol-induced liver disease. Gastroenterology. 2003;124:778-790. [PubMed] |
| 5. | Massey VL, Arteel GE. Acute alcohol-induced liver injury. Front Physiol. 2012;3:193. [PubMed] [DOI] |
| 6. | Nolan JP. The role of intestinal endotoxin in liver injury: a long and evolving history. Hepatology. 2010;52:1829-1835. [PubMed] [DOI] |
| 7. | An L, Wang X, Cederbaum AI. Cytokines in alcoholic liver disease. Arch Toxicol. 2012;86:1337-1348. [PubMed] [DOI] |
| 8. | Praphasawat R, Klungsupya P, Muangman T, Laovitthayanggoon S, Arunpairojana V, Himakoun L. Antimutagenicity and antioxidative DNA damage properties of oligomeric proanthocyanidins from Thai grape seeds in TK6 cells. Asian Pac J Cancer Prev. 2011;12:1317-1321. [PubMed] |
| 9. | Xu Z, Du P, Meiser P, Jacob C. Proanthocyanidins: oligomeric structures with unique biochemical properties and great therapeutic promise. Nat Prod Commun. 2012;7:381-388. [PubMed] |
| 11. | Bruha R, Dvorak K, Petrtyl J. Alcoholic liver disease. World J Hepatol. 2012;4:81-90. [PubMed] [DOI] |
| 12. | Kim Y, Choi Y, Ham H, Jeong HS, Lee J. Antioxidant and cytoprotective effects of oligomeric and polymeric procyanidin fractions from defatted grape seed in PC12 cells. J Med Food. 2012;15:490-494. [PubMed] |
| 13. | Bagchi D, Bagchi M, Stohs SJ, Das DK, Ray SD, Kuszynski CA, Joshi SS, Pruess HG. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention. Toxicology. 2000;148:187-197. [PubMed] |
| 14. | Chacón MR, Ceperuelo-Mallafré V, Maymó-Masip E, Mateo-Sanz JM, Arola L, Guitiérrez C, Fernandez-Real JM, Ardèvol A, Simón I, Vendrell J. Grape-seed procyanidins modulate inflammation on human differentiated adipocytes in vitro. Cytokine. 2009;47:137-142. [PubMed] [DOI] |
| 15. | Terra X, Valls J, Vitrac X, Mérrillon JM, Arola L, Ardèvol A, Bladé C, Fernandez-Larrea J, Pujadas G, Salvadó J. Grape-seed procyanidins act as antiinflammatory agents in endotoxin-stimulated RAW 264.7 macrophages by inhibiting NFkB signaling pathway. J Agric Food Chem. 2007;55:4357-4365. [PubMed] |
| 16. | Bustamante J, Karadayian AG, Lores-Arnaiz S, Cutrera RA. Alterations of motor performance and brain cortex mitochondrial function during ethanol hangover. Alcohol. 2012;46:473-479. [PubMed] [DOI] |
| 17. | Tiwari V, Chopra K. Resveratrol abrogates alcohol-induced cognitive deficits by attenuating oxidative-nitrosative stress and inflammatory cascade in the adult rat brain. Neurochem Int. 2013;62:861-869. [PubMed] |
| 18. | Bühler M, Mann K. Alcohol and the human brain: a systematic review of different neuroimaging methods. Alcohol Clin Exp Res. 2011;35:1771-1793. [PubMed] [DOI] |
| 19. | Yokozawa T, Lee YA, Cho EJ, Matsumoto K, Park CH, Shibahara N. Anti-aging effects of oligomeric proanthocyanidins isolated from persimmon fruits. Drug Discov Ther. 2011;5:109-118. [PubMed] |
| 20. | Lee YA, Cho EJ, Yokozawa T. Oligomeric proanthocyanidins improve memory and enhance phosphorylation of vascular endothelial growth factor receptor-2 in senescence-accelerated mouse prone/8. Br J Nutr. 2010;103:479-489. [PubMed] [DOI] |
| 21. | Hartman RE, Shah A, Fagan AM, Schwetye KE, Parsadanian M, Schulman RN, Finn MB, Holtzman DM. Pomegranate juice decreases amyloid load and improves behavior in a mouse model of Alzheimer's disease. Neurobiol Dis. 2006;24:506-515. [PubMed] |
| 22. | Wang J, Ho L, Zhao W, Ono K, Rosensweig C, Chen L, Humala N, Teplow DB, Pasinetti GM. Grape-derived polyphenolics prevent Abeta oligomerization and attenuate cognitive deterioration in a mouse model of Alzheimer's disease. J Neurosci. 2008;28:6388-6392. [PubMed] [DOI] |