修回日期: 2013-03-23
接受日期: 2013-04-12
在线出版日期: 2013-05-28
目的: 探讨双特异性酪氨酸磷酸化调节激酶2(dual-specificity tyrosine phosphorylation-regulated kinase 2, DYRK2)在胰腺癌中的表达及其临床意义.
方法: 应用实时荧光定量PCR、Western blot及免疫组织化学技术检测40例胰腺癌及其癌旁正常组织标本中DYRK2 mRNA和蛋白的表达量, 并结合免疫组织化学结果及胰腺癌患者的临床病理资料进行统计学分析.
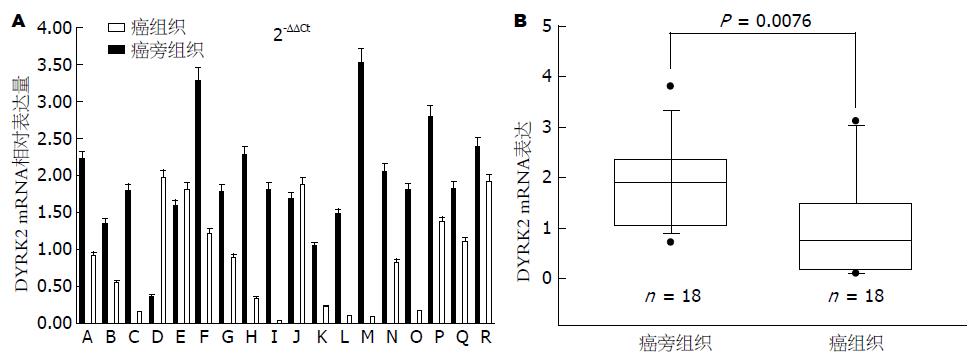
结果: 实时荧光定量PCR检测显示, DYRK2 mRNA在胰腺癌及其癌旁组织中均有表达, 但后者的表达水平明显高于前者(P<0.01); Western blot检测显示, 在88.9%的癌组织中DYRK2蛋白的表达量低于其对应的癌旁组织; 免疫组织化学染色显示, DYRK2在胰腺癌组织中的阳性比例明显低于其癌旁组织(42.5% vs 87.5%, χ2 = 17.802, P<0.01), 且DYRK2的表达与胰腺癌有无淋巴结转移相关(χ2 = 6.32, P<0.05).
结论: DYRK2在胰腺癌组织中表达下调, 可能与胰腺癌的发生发展和淋巴结转移等恶性生物学行为相关.
核心提示: 本研究首次发现双特异性酪氨酸磷酸化调节激酶2(dual-specificity tyrosine phosphorylation-regulated kinase 2, DYRK2)在胰腺癌组织中表达下调, 而这可能是胰腺癌发生发展过程中重要分子生物学事件. 并且, DYRK2与胰腺癌的淋巴结转移情况相关, 其有望成为胰腺癌的一个预后判断指标.
引文著录: 李旭, 王敏, 江建新, 田锐, 石程剑, 秦仁义. DYRK2在胰腺癌中的表达及临床意义. 世界华人消化杂志 2013; 21(15): 1442-1447
Revised: March 23, 2013
Accepted: April 12, 2013
Published online: May 28, 2013
AIM: To investigate the expression of dual-specificity tyrosine phosphorylation-regulated kinase 2 (DYRK2) in human pancreatic cancer and to analyze its clinical significance.
METHODS: The expression of DYRK2 mRNA and protein in 40 human pancreatic cancer tissue samples and matched tumor-adjacent normal tissue samples were detected by real-time quantitative PCR, Western blot and immunohistochemistry. The relationship between DYRK2 expression and clinicopathologic characteristics of pancreatic cancer was then analyzed.
RESULTS: The expression of DYRK2 mRNA in pancreatic cancer was significantly lower than that in tumor-adjacent pancreatic tissue (P < 0.01). The expression of DYRK2 protein in 88.9% of pancreatic cancer tissue samples was lower than that in tumor-adjacent pancreatic tissue samples. The proportion of DYRK2-positive cells in pancreatic cancer was significantly lower than that in tumor-adjacent pancreatic tissue (42.5% vs 87.5%, χ2 = 17.802, P < 0.01). The expression of DYRK2 had a significant correlation with lymph node metastasis (χ2 = 6.32, P < 0.05), but not with other clinicopathologic characteristics.
CONCLUSION: The expression of DYRK2 is down-regulated in pancreatic cancer, and DYRK2 may be involved in the carcinogenesis, development and lymph node metastasis of this malignancy.
- Citation: Li X, Wang M, Jiang JX, Tian R, Shi CJ, Qin RY. Clinical significance of expression of DYRK2 in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(15): 1442-1447
- URL: https://www.wjgnet.com/1009-3079/full/v21/i15/1442.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i15.1442
胰腺癌是恶性程度最高的实体肿瘤之一. 尽管目前临床手术方式和各种综合治疗方法有所改进, 但患者的5年生存率却始终徘徊在5%左右[1]. 究其原因主要是由于胰腺癌具有极为恶性的生物学特征, 其发生隐匿、发展迅速, 绝大部分患者在确诊时已伴有局部或远处脏器肿瘤转移而丧失了手术时机; 同时胰腺癌对传统的化疗、放疗等综合治疗敏感性较差, 致使其生存率仍停滞于较低水平[2]. 因此, 进一步加强对胰腺癌恶性生物学特性的研究, 寻找新的诊断治疗靶点已成为当前研究的重点.
近年来研究发现Hedgehog信号通路在胰腺癌组织或细胞内存在异常表达, 且这种表达与胰腺癌的恶性生物学行为密切相关, 因此也一直是胰腺癌研究中的热点[3,4]. 然而, 目前有关Hedgehog信号通路的研究大多关注于经典的Shh/Smo/Gli信号轴, 对于其旁支通路的研究却较少, 而旁路信号的异常激活可能是导致Hedgehog上游信号阻滞剂阻滞效果不佳的主要原因[5]. 所以, 加强对Hedgehog旁路信号的研究具有十分重要的意义.
双特异性酪氨酸磷酸化调节激酶2(dual-specificity tyrosine phosphorylation-regulated kinase 2, DYRK2)是DYRKs家族的成员之一, 研究发现其同时也是Hedgehog旁路信号中的主要调控分子[6]. 目前关于DYRK2在肿瘤中的研究较少, 而其在胰腺癌中的作用尚未见报道. 本研究检测了胰腺癌及其癌旁组织中DYRK2的表达, 并分析其与胰腺癌临床病理特征之间的关系, 旨在初步探讨DYRK2在胰腺癌中的表达特点及其临床意义.
收集2009-01/2011-06本院接受胰十二指肠切除术的胰腺肿瘤临床标本, 术后经病理确诊为胰腺癌的标本共40例, 所有病例术前均未行放疗或化疗. 其中男19例, 女21例, 年龄36-82岁, 中位年龄56.5岁. 肿瘤位于胰头部28例, 胰体尾部12例. 术后每例标本常规送检淋巴结至少10枚, 经病理证实有淋巴结转移21例, 无淋巴结转移19例, 7例发生远处转移. 肿瘤组织类型以2010年胰腺癌UICC/AJCC TNM分期系统为判断标准, 其中高分化3例, 中分化19例, 低分化18例. 癌旁组织来源于同期肿瘤切除距肿瘤边缘4 cm的组织. 所有标本在手术切除后立即置于液氮中低温保存. 40例标本均常规行石蜡包埋, 另取18例新近收集的组织进行PCR和Western blot检测. TRIzol试剂购自美国Invitrogen公司; 逆转录试剂盒(ReverTra Ace® qPCR RT kit, FSQ-101)、荧光实时定量PCR试剂盒(SYBR® Green Realtime PCR Master Mix, QPK-201)均购自日本TOYOBO公司; 兔抗人DYRK2多克隆抗体购自美国ABGENT公司; 鼠抗人β-actin单克隆抗体购自美国Santa Cruz公司; 免疫组织化学SABC试剂盒购自武汉博士德生物工程有限公司; DYRK2及GAPDH引物序列由Invitrogen公司合成; 其余试剂均为国产分析纯试剂.
1.2.1 样品总RNA的提取和cDNA的合成: 取组织样品约50 mg, 按TRIzol说明书提取其总RNA. 紫外分光光度计(Eppendorf BioPhotometer, 德国)检测总RNA在波长为260 nm和280 nm时的吸光度(A)值, 并计算出RNA的纯度和浓度. 以2 μg总RNA为模板, 按cDNA第一链合成逆转录试剂盒ReverTra Ace® qPCR RT kit说明书二步法合成cDNA, 产物保存于-80 ℃.
1.2.2 实时荧光定量PCR检测mRNA的表达: 按SYBR® Green Real time PCR Master Mix说明书在预热的ABI7300荧光定量PCR仪上进行检测. 预变性95 ℃ 3 min, 变性95 ℃ 15 s, 退火延伸60 ℃ 1 min, 在60 ℃读取数据; 共40次循环. DYRK2上游引物序列为5'-CAGATGACAGATGCCAATGGGAATA-3', 下游引物序列为5'-TTGAGCAAATAAAAACAGGTCTGAGC-3'. GAPDH上游引物序列为5'-GGGTGTGAACCATGAGAAGT-3', 下游引物序列为5'-GGCATGGACTGTGGTCATGA-3'. 以上反应设置3个复孔. 每管中荧光信号达到设定阈值时所经历的循环数即Ct值, 每个样本目的基因的循环阈值与内参基因(GAPDH)循环阈值的差异为∆Ct, 实验样本与对照样本(正常胰腺组织)∆Ct的差异为∆∆CT. 以2-∆∆Ct表示基因的相对表达量.
1.2.3 Western blot检测目的蛋白的表达: 用RIPA裂解液(碧云天)提取组织总蛋白, BCA法蛋白浓度检测试剂盒(碧云天)测定蛋白浓度. 以30 μg蛋白/泳道上样, 12%SDS-PAGE凝胶进行电泳分离, 120 V恒压电泳至溴酚蓝迁移到分离胶底部, 300 mA恒流1 h将蛋白转移至聚偏二氟乙烯(PVDF)膜; 将膜置于5%的脱脂奶粉中室温振荡封闭2 h, 然后加入DYRK2一抗(1:200)和β-actin一抗(1:1000)分别于杂交袋中4 ℃孵育过夜; 次日用TBS-T洗膜15 min/次×3次, 室温孵育二抗(1:3000)1 h; TBS-T洗膜10 min/次×3次; 之后采用增强化学发光(ECL)试剂(美国Pierce公司)于暗室中进行显影、曝光. 结果扫描后, 用图像分析软件Quantity One进行灰度分析; 以目的蛋白与内参照蛋白(β-actin)的相对表达量, 即目的蛋白与内参照蛋白的比值进行半定量分析.
1.2.4 免疫组织化学检测目的蛋白的表达: 全部标本均用中性福尔马林溶液固定, 常规脱水、包埋、连续4 μm厚切片. DYRK2一抗的工作浓度为1:50. 操作步骤按即用型免疫组织化学SABC检测试剂盒说明书进行. 用已知阳性的胰腺癌切片作为阳性对照, 用PBS代替一抗作为阴性对照. 免疫组织化学染色由两位高年资病理科医师在双盲条件下进行观察, 判定标准参照文献[7]. 每张切片随机观察10个高倍视野读取阳性细胞数. 根据细胞阳性百分数的多少及阳性细胞染色程度进行分级: 无细胞染色或胞浆淡染且阳性细胞比例<10%记为0; 胞浆淡染且阳性细胞比例>10%记为+; 胞浆中度染色且细胞比例>10%记为++; 胞浆强阳性染色且比例>10%记为+++. 结果判定: 0或1+染色强度判定为阴性, ++或+++染色强度判定为阳性.
统计学处理 应用SPSS16.0统计软件进行统计分析. DYRK2阳性表达率和临床病理资料之间的相关性分析采用χ2检验; 两个样本均数间比较用Student's t检验. P<0.05表示差异具有统计学意义.
实时荧光定量PCR检测结果显示, DYRK2 mRNA在癌及癌旁组织中均有表达, 但18对组织中有15对(83.3%)癌旁组织的DYRK2 mRNA表达水平高于其对应的癌组织(图1A). 以癌组织和癌旁组织的均值作盒须图, 癌组织(白色)与癌旁组织(黑色)的DYRK2 mRNA表达水平有统计学意义(P<0.01, 图1B).
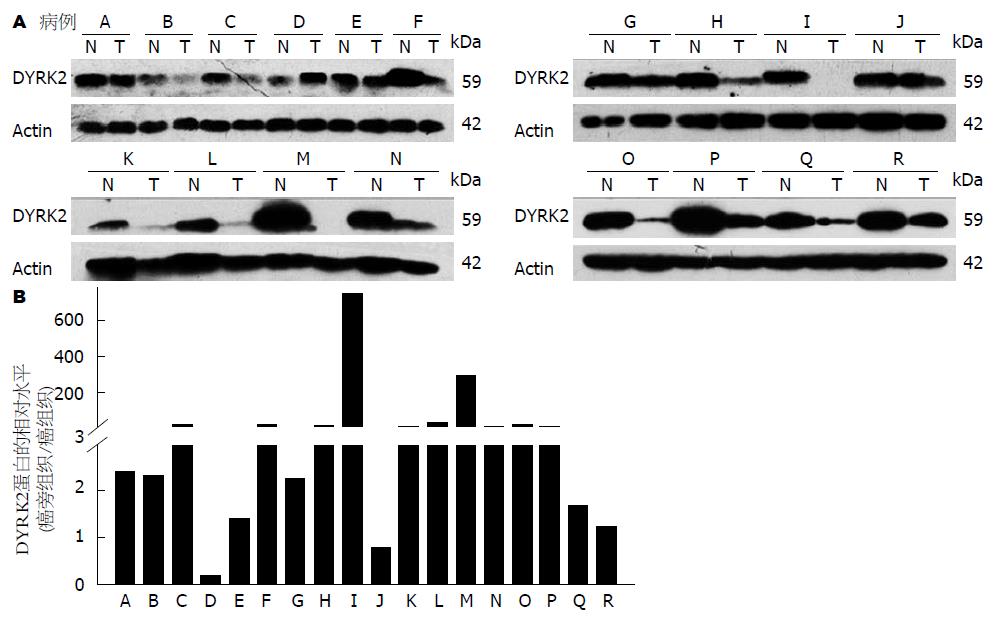
在18对胰腺癌组织中有16对(88.9%)癌旁组织的DYRK2蛋白(59 kDa)表达量高于其对应的癌组织, 差异有统计学意义(P<0.01, 图2).
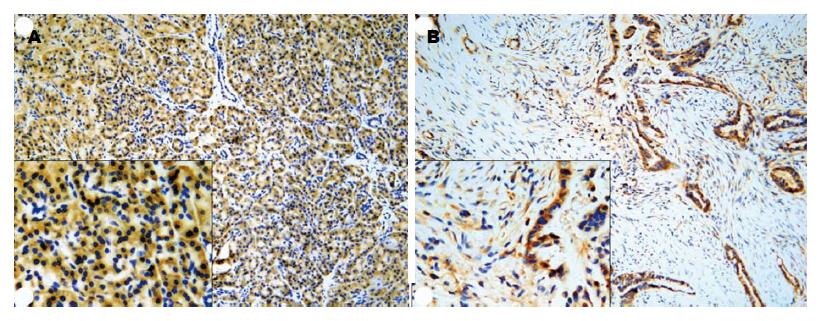
DYRK2在所有癌旁及大部分癌组织中均有表达, 主要定位于胞浆, 呈淡黄色或棕黄色弥漫性分布(图3). 40例胰腺癌组织中DYRK2蛋白阳性表达率为42.5%(17/40), 而其对应的癌旁组织中DYRK2蛋白阳性表达率为87.5%(35/40), 差异有统计学意义(χ2 = 17.802, P<0.01).
经统计学分析发现, DYRK2蛋白的表达与患者的淋巴结转移情况相关(χ2 = 6.32, P = 0.042, 表1); 而与年龄、性别、肿瘤部位、肿瘤大小、肿瘤范围、远处转移情况以及分化程度无关.
| 临床资料 | n | DYRK2蛋白表达 | χ2值 | P值 | |
| 阳性 | 阴性 | ||||
| n | 17 | 23 | |||
| 年龄(岁) | 0.03 | 0.98 | |||
| ≤60 | 30 | 13 | 17 | ||
| >60 | 10 | 4 | 6 | ||
| 性别 | 0.47 | 0.79 | |||
| 男 | 19 | 7 | 12 | ||
| 女 | 21 | 10 | 11 | ||
| 肿瘤部位 | 0.01 | 1.00 | |||
| 胰头 | 28 | 12 | 16 | ||
| 胰体尾 | 12 | 5 | 7 | ||
| 肿瘤大小(cm) | 0.00 | 1.00 | |||
| <4 | 26 | 11 | 15 | ||
| ≥4 | 14 | 6 | 8 | ||
| 肿瘤范围 | 2.82 | 0.24 | |||
| T1-2 | 8 | 6 | 2 | ||
| T3-4 | 32 | 11 | 21 | ||
| 淋巴结转移 | 6.32 | 0.04 | |||
| N0 | 19 | 12 | 7 | ||
| N1 | 21 | 5 | 16 | ||
| 远处转移 | 1.54 | 0.46 | |||
| M0 | 33 | 16 | 17 | ||
| M1 | 7 | 1 | 6 | ||
| 分化程度 | 2.90 | 0.23 | |||
| 高-中分化 | 22 | 12 | 10 | ||
| 低分化 | 18 | 5 | 13 | ||
近年来, 胰腺癌的发病率在国内外均呈明显上升趋势, 但关于其诊治的进展却十分缓慢. 胰腺癌起病隐匿且发展快、手术切除率低、术后易复发转移是导致其诊疗困难的主要原因. 然而目前大量研究表明, 胰腺癌的多种恶性生物学行为可能是由其中一小部分被称为肿瘤干细胞的特殊亚群所决定. 该亚群细胞具有高致瘤能力、耐受放化疗以及自我更新和分化的潜能, 与胰腺癌的恶性生长及复发转移等特性密切相关[8,9]. 因此, 进一步阐明胰腺癌干细胞的分子生物学机制, 并寻找新的诊疗方法成为提高胰腺癌治疗效果的关键[10].
Hedgehog信号通路是维持胰腺癌干细胞恶性生物学行为的关键信号通路之一[11-13]. 但目前有关Hedgehog信号通路的阻滞剂(如Cyclopamine等)均针对其上游Shh/Smo/Gli信号轴, 而对其旁路信号并无阻滞效果. 当Hedgehog信号通路上游分子Shh或Smo被阻滞后, 其还可通过激活丝裂原活化蛋白3激酶10(MAP3K10)等旁路信号, 进而降低DYRK2对效应分子Gli的阻滞作用, 使Gli持续解离并进入细胞核内发挥其生物学功能[6]. 因此, Hedgehog旁路信号的活化可能是胰腺癌干细胞逃逸cyclopamine等阻滞剂杀灭的主要原因, 而DYRK2作为Hedgehog旁路信号中的主要调控分子可能与胰腺癌恶性生物行为密切相关.
DYRK2是DYRKs家族的主要成员之一, 该激酶家族以对酪氨酸和丝氨酸/苏氨酸片段均具有磷酸化活性为主要特点[14]. 有研究表明DYRK2可能在调控细胞凋亡、DNA损伤修复和细胞周期中起重要作用[15,16], 然而关于其在肿瘤中的作用目前仅有少量文献报道. Miller等[17]报道在食管癌和肺腺癌中DYRK2的蛋白和mRNA表达水平较对应的癌旁组织升高. Park等[18]利用抗癌药物8-Cl-cAMP处理神经母细胞瘤细胞后引起DYRK2表达量下降. 而Yamashita等[7]报道DYRK2在肺腺癌中表达下调, 且阴性表达DYRK2的患者预后不良. 国内崔建国等[19]利用蛋白质组学分析发现, 在辐射诱导癌变的人支气管上皮细胞中DYRK2表达量明显下降, 这与Yamashita等的研究结果相似. Taira等[20]最新研究也发现DYRK2在多种人类肿瘤组织中表达下调, 且其在肿瘤细胞中能促进原癌基因c-Jun和c-Myc的泛素化降解, 而下调DYRK2的表达能减少c-Jun和c-Myc的降解并促进细胞增殖, 提示DYRK2在肿瘤中可能起抑制肿瘤生长的作用.
目前关于DYRK2在胰腺癌中的研究尚未见报道. 本研究结果显示, DYRK2 mRNA和蛋白在胰腺癌组织中的表达水平较其对应的癌旁组织明显减少, 提示在胰腺癌中DYRK2的活性受到抑制. 同时我们还发现, DYRK2蛋白的表达与胰腺癌淋巴结转移情况相关, 即有淋巴结转移的胰腺癌组织中DYRK2蛋白的表达水平显著低于无淋巴结转移者; 而DYRK2与其他临床病理特征之间没有显著相关性. 提示DYRK2可能是一个与胰腺癌淋巴结转移相关的指标, 在胰腺癌淋巴结转移中发挥了一定的作用.
总之, 本研究首次发现DYRK2在胰腺癌组织中表达下调, 而这可能是胰腺癌发生、发展过程中的重要分子生物学事件. 并且, DYRK2与胰腺癌的淋巴结转移情况相关, 而是否有淋巴结转移是影响胰腺癌患者预后的重要因素. 因此, DYRK2也可能成为胰腺癌的一个预后判断指标. 目前, 关于DYRK2在肿瘤中所扮演的角色还不明确, 而其在胰腺癌中的作用及详细调控机制还有待于进一步研究.
感谢张春霞、林凡同志在本试验中给予的大力帮助.
Hedgehog信号通路与胰腺癌的恶性生物学行为密切相关. 目前, 关于Hedgehog信号通路的研究大多关注于经典的Shh/Smo/Gli信号轴, 而对其旁支通路的研究却较少. 双特异性酪氨酸磷酸化调节激酶2(dual-specificity tyrosine phosphorylation-regulated kinase 2, DYRK2)是Hedgehog旁路信号中的主要调控分子, 但其在胰腺癌中的研究尚未见报道.
刘亮, 副主任医师, 复旦大学胰腺癌研究所, 复旦大学附属肿瘤医院胰腺肝胆外科
研究表明DYRK2可能在调控细胞凋亡、DNA损伤修复和细胞周期中起重要作用. 然而, 关于其在肿瘤发生、发展中所扮演的角色目前尚未明确.
Miller等报道在食管癌和肺腺癌中DYRK2的表达水平较对应的癌旁组织升高. 而Yamashita等报道DYRK2在肺腺癌中表达下调, 且阴性表达DYRK2的患者预后不良. Taira等最新研究也发现DYRK2在多种人类肿瘤组织中表达下调, 且下调DYRK2的表达能促进肿瘤细胞生长.
关于DYRK2在胰腺癌组织中的表达及其与临床病理特征之间的关系研究尚未见报道, 本实验探讨了DYRK2在胰腺癌组织中的表达特点及其可能的临床意义.
DYRK2是Hedgehog旁路信号中的主要调控分子, 对其深入研究有助于进一步理解胰腺癌恶性生物学行为的分子机制, 并为胰腺癌的早期诊断及治疗提供重要帮助.
本文研究DYRK2在胰腺癌临床患者标本中转录和表达情况, 并发现其与淋巴转移间存在联系, 创新性较好, 具有很高的潜在临床价值.
编辑: 田滢 电编: 鲁亚静
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 2. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] [DOI] |
| 3. | Hidalgo M, Maitra A. The hedgehog pathway and pancreatic cancer. N Engl J Med. 2009;361:2094-2096. [PubMed] [DOI] |
| 4. | Kelleher FC. Hedgehog signaling and therapeutics in pancreatic cancer. Carcinogenesis. 2011;32:445-451. [PubMed] [DOI] |
| 5. | Li Y, Maitah MY, Ahmad A, Kong D, Bao B, Sarkar FH. Targeting the Hedgehog signaling pathway for cancer therapy. Expert Opin Ther Targets. 2012;16:49-66. [PubMed] [DOI] |
| 6. | Varjosalo M, Björklund M, Cheng F, Syvänen H, Kivioja T, Kilpinen S, Sun Z, Kallioniemi O, Stunnenberg HG, He WW. Application of active and kinase-deficient kinome collection for identification of kinases regulating hedgehog signaling. Cell. 2008;133:537-548. [PubMed] [DOI] |
| 7. | Yamashita S, Chujo M, Tokuishi K, Anami K, Miyawaki M, Yamamoto S, Kawahara K. Expression of dual-specificity tyrosine-(Y)-phosphorylation-regulated kinase 2 (DYRK2) can be a favorable prognostic marker in pulmonary adenocarcinoma. J Thorac Cardiovasc Surg. 2009;138:1303-1308. [PubMed] [DOI] |
| 8. | Li C, Heidt DG, Dalerba P, Burant CF, Zhang L, Adsay V, Wicha M, Clarke MF, Simeone DM. Identification of pancreatic cancer stem cells. Cancer Res. 2007;67:1030-1037. [PubMed] |
| 9. | Hermann PC, Huber SL, Herrler T, Aicher A, Ellwart JW, Guba M, Bruns CJ, Heeschen C. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 2007;1:313-323. [PubMed] [DOI] |
| 10. | Penchev VR, Rasheed ZA, Maitra A, Matsui W. Heterogeneity and targeting of pancreatic cancer stem cells. Clin Cancer Res. 2012;18:4277-4284. [PubMed] [DOI] |
| 11. | Huang FT, Zhuan-Sun YX, Zhuang YY, Wei SL, Tang J, Chen WB, Zhang SN. Inhibition of hedgehog signaling depresses self-renewal of pancreatic cancer stem cells and reverses chemoresistance. Int J Oncol. 2012;41:1707-1714. [PubMed] [DOI] |
| 12. | Singh BN, Fu J, Srivastava RK, Shankar S. Hedgehog signaling antagonist GDC-0449 (Vismodegib) inhibits pancreatic cancer stem cell characteristics: molecular mechanisms. PLoS One. 2011;6:e27306. [PubMed] [DOI] |
| 13. | Tang SN, Fu J, Nall D, Rodova M, Shankar S, Srivastava RK. Inhibition of sonic hedgehog pathway and pluripotency maintaining factors regulate human pancreatic cancer stem cell characteristics. Int J Cancer. 2012;131:30-40. [PubMed] [DOI] |
| 14. | Becker W, Joost HG. Structural and functional characteristics of Dyrk, a novel subfamily of protein kinases with dual specificity. Prog Nucleic Acid Res Mol Biol. 1999;62:1-17. [PubMed] |
| 15. | Yoshida K. Role for DYRK family kinases on regulation of apoptosis. Biochem Pharmacol. 2008;76:1389-1394. [PubMed] [DOI] |
| 16. | Becker W. Emerging role of DYRK family protein kinases as regulators of protein stability in cell cycle control. Cell Cycle. 2012;11:3389-3394. [PubMed] [DOI] |
| 17. | Miller CT, Aggarwal S, Lin TK, Dagenais SL, Contreras JI, Orringer MB, Glover TW, Beer DG, Lin L. Amplification and overexpression of the dual-specificity tyrosine-(Y)-phosphorylation regulated kinase 2 (DYRK2) gene in esophageal and lung adenocarcinomas. Cancer Res. 2003;63:4136-4143. [PubMed] |
| 18. | Park GH, Choe J, Choo HJ, Park YG, Sohn J, Kim MK. Genome-wide expression profiling of 8-chloroadenosine- and 8-chloro-cAMP-treated human neuroblastoma cells using radioactive human cDNA microarray. Exp Mol Med. 2002;34:184-193. [PubMed] |
| 20. | Taira N, Mimoto R, Kurata M, Yamaguchi T, Kitagawa M, Miki Y, Yoshida K. DYRK2 priming phosphorylation of c-Jun and c-Myc modulates cell cycle progression in human cancer cells. J Clin Invest. 2012;122:859-872. [PubMed] [DOI] |