修回日期: 2013-04-23
接受日期: 2013-04-27
在线出版日期: 2013-05-28
目的: 观察蜂毒素(melittin)诱导人胃腺癌细胞凋亡及其对线粒体相关蛋白表达的影响.
方法: 4 µg/mL melittin诱导SGC-7901细胞不同时间(0、1、2、4 h), 观察细胞的形态学改变; 免疫荧光法观察活性氧(reactive oxygen species, ROS)、线粒体膜电位(Jc-1)表达; IHC观察胃癌细胞线粒体释放蛋白细胞凋亡诱导因子(apoptosis inducing factor, AIF)、Smac/Diablo、细胞色素C(cytochrome C)、EndoG的表达情况.
结果: melittin能明显诱导SGC-7901细胞凋亡; ROS实验显示, melittin组与对照组比较, 细胞胞浆出现很强的绿色荧光; MPT实验显示, melittin组显示绿色荧光的细胞数占多数(P<0.05), 而阴性对照组, 均表现为红色荧光细胞, 线粒体相关蛋白检测结果显示, melittin组AIF、cytochrome C、EndoG、Smac/Diablo表达率分别为15.99%±1.66%、42.73%±3.48%、62.34%±2.71%、28.58%±2.09%(P<0.05).
结论: melittin可诱导SGC-7901细胞凋亡, 线粒体凋亡相关蛋白可能参与并发挥了重要作用.
核心提示: 本实验进一步观察蜂毒素(melittin)抗胃癌的生物活性及细胞凋亡机制, 以期为melittin作为抗胃癌药物进一步研究和应用提供理论基础, 为melittin抗肿瘤的临床应用, 提供实验依据.
引文著录: 陶文华, 孔桂美, 卜平, 王继军, 胡茂志, 张强. 蜂毒素调节人胃癌细胞线粒体相关蛋白表达. 世界华人消化杂志 2013; 21(15): 1400-1404
Revised: April 23, 2013
Accepted: April 27, 2013
Published online: May 28, 2013
AIM: To observe the effect of melittin on apoptosis and expression of mitochondrial proteins in human gastric cancer cells (SGC-7901) in vitro.
METHODS: SGC-7901 cells were treated with 4 µg/mL of melittin for different durations (0, 1, 2, or 4 h). After treatment, cell morphological changes were observed under an inverted microscope. The levels of reactive oxygen species (ROS) and mitochondrial transmembrane potential (MTP) were detected by fluorescence microscopy. The expression of apoptosis inducing factor (AIF), Smac/Diablo, cytochrome C, and EndoG was examined by immunohistochemistry.
RESULTS: Melittin induced the apoptosis of SGC-7901 cells. ROS experiments showed that compared to the control group, more strong cytoplasmic green fluorescence was observed in the melittin group. MPT experiments showed that the majority of cells in the melittin group exhibited green fluorescence (P < 0.05), while the control group showed red fluorescence. The positive rates of mitochondrial proteins AIF, cytochrome C, EndoG, and Smac/Diablo protein expression were 15.99% ± 1.66%, 44.48% ± 4.85%, 62.34% ± 2.71%, and 28.58% ± 2.09%, significantly different from those in the control group (all P < 0.05).
CONCLUSION: Melittin induces SGC-7901 cell apoptosis possibly by regulating the expression of mitochondrial apoptosis related proteins.
- Citation: Tao WH, Kong GM, Bo P, Wang JJ, Hu MZ, Zhang Q. Melittin regulates mitochondrial protein expression in human gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2013; 21(15): 1400-1404
- URL: https://www.wjgnet.com/1009-3079/full/v21/i15/1400.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i15.1400
胃癌居消化系肿瘤之首[1], 占全世界死亡率第2位[2], 在我国也是最常见的恶性肿瘤之一, 对于失去手术机会的及晚期胃癌患者, 化疗仍是最有效的手段之一. 蜂毒素(melittin)约占蜂毒干质量的50%, 是蜂毒的主要组成及活性成分, 可以抑制肿瘤细胞增殖, 诱导细胞凋亡[3]. 然而, melittin诱导人胃癌细胞凋亡的相关分子机制仍不明确. 本实验为进一步观察melittin抗胃癌的生物活性及细胞凋亡机制, 为melittin抗肿瘤的临床应用, 提供实验依据, 结果报道如下.
人胃腺癌细胞株(SGC-7901)购自中科院细胞库; melittin、trypsin购自sigma公司; 新生小牛血清购自上海洛神生物有限公司; 细胞凋亡线粒体膜电位检测试剂盒(JC-1)购自南京凯基生物科技发展有限公司; 活性氧活性检测试剂盒、cytochrome C抗体、AIF抗体购自碧云天生物科技公司; EndoG抗体购自北京博奥森生物技术有限公司; Smac/Diablo购自cell signaling technology; DAB显色试剂盒购自武汉博士德生物工程有限公司.
1.2.1 细胞培养: SGC-7901细胞在RPMI 1640(含0.1 U/L青霉素、0.1 U/L链霉素, 100 mL/L灭活新生牛血清)完全培养基中于37 ℃, 50 mL/L CO2饱和湿度培养箱常规培养, 2-3 d换液1次, 取对数生长期细胞进行试验.
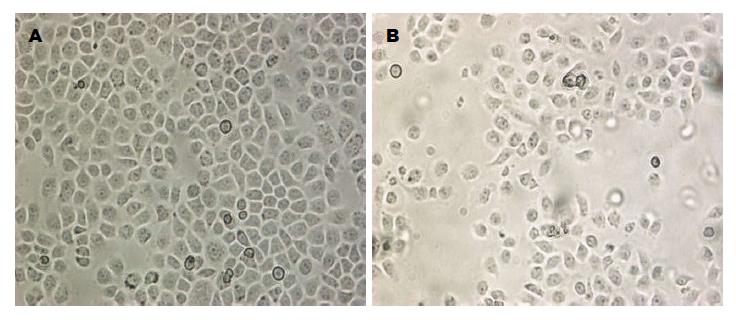
1.2.2 倒置显微镜观察人胃腺癌SGC-7901细胞形态学改变: 4 µg/mL melittin作用于SGC-7901细胞0、1、2和4 h后, 在倒置显微镜下观察细胞形态改变.
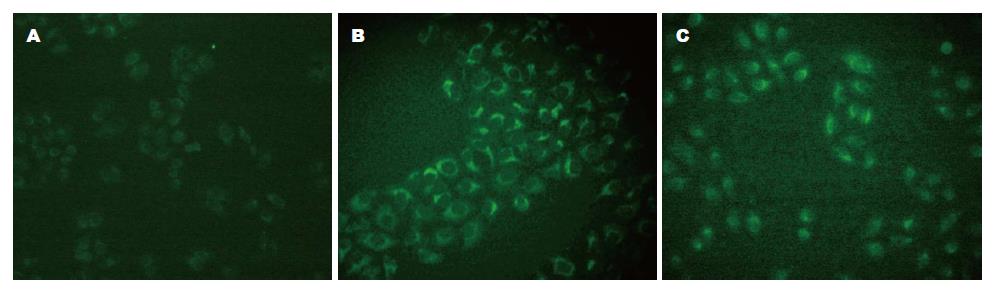
1.2.3 活性氧检测试剂盒检测人胃腺癌SGC-7901细胞内活性氧(reactive oxygen species, ROS)水平: 将细胞以1×106个/孔密度种植于6孔板, 设3个复孔, 4 µg/mL melittin作用于对数生长期细胞(0、1、2、4 h), 阳性对照组Rosup作用30 min(活性氧检测试剂盒提供), PBS洗涤, 加入含5 µmol/L DCFH-DA培养基, 充分混匀后, 37 ℃孵育1 h, 用无血清培养液洗涤3次, 荧光显微镜下观察细胞内ROS荧光强度.
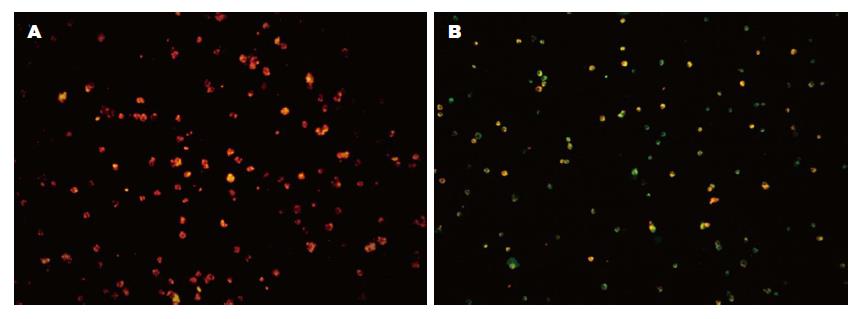
1.2.4 JC-1染色法检测人胃腺癌SGC-7901细胞∆Ψm: 将细胞以1×106个/孔密度种植于6孔板, 同时设3个复孔, 4 µg/mL melittin作用于对数生长期细胞(0、1、2、4 h)后, PBS洗涤, JC-1工作液(10 µg/mL)重悬细胞, 37 ℃孵育20 min, 37 ℃ JC-1缓冲液洗涤2次, 重悬细胞, 荧光显微镜下观察细胞荧光颜色变化.
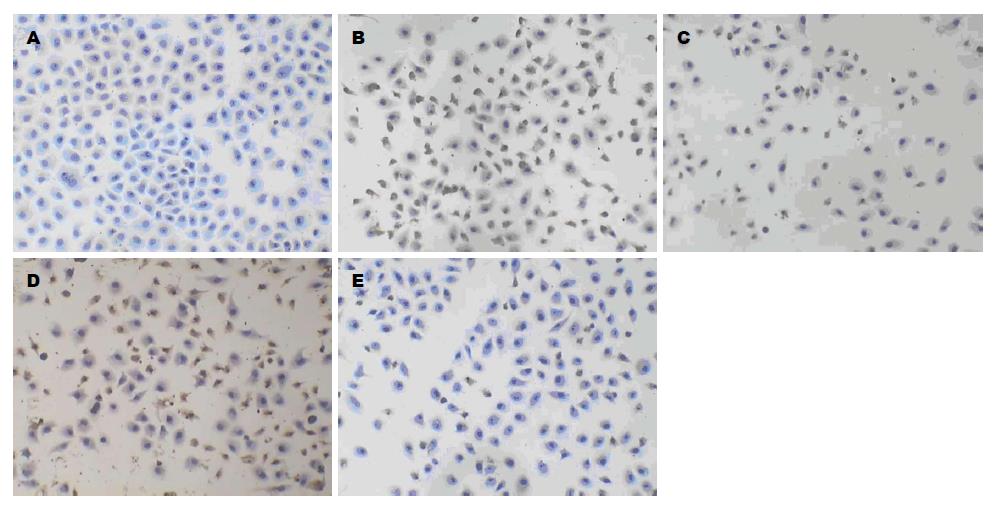
1.2.5 线粒体cytochrome C、EndoG、AIF和Smac/Diablo蛋白的表达: 将盖玻片置于细胞密度为1×106个/孔的6孔板中爬片, 4 µg/mL melittin作用于对数生长期细胞(0、4 h)后, 按照文献方法[4]进行免疫组织化学法, DAB显色, 苏木精复染, 中性树胶封片, 随机取5个视野, 细胞胞浆中出现棕黄色颗粒为阳性表达, 显微镜下计算阳性表达细胞数.
统计学处理 采用SPSS17.0软件进行χ2检验分析, P<0.05为差异有统计学意义.
4 µg/mL melittin体外(0、1 h)诱导人胃癌细胞时细胞形态正常(图1A), 2 h开始出现体积缩小, 细胞变圆, 4 h细胞与周围的细胞脱离, 细胞质密度增加, 贴壁细胞数减少(图1B).
检测结果可以看出, 未经4 µg/mL melittin处理组细胞胞浆荧光较弱(图2A), 随着诱导时间的延长, 荧光显微镜下可以观察细胞胞浆的绿色荧光明显增强, melittin处理4 h与阳性对照组荧光强度一致(图2B, C).
通过荧光显微镜下观察发现, 阴性对照组细胞呈红色荧光(图3A), 随着melittin诱导时间的延长, 细胞胞浆中出现的绿色荧光越来越多(P = 0.04), 4 µg/mL melittin诱导细胞4 h胞浆中绿色荧光表现见图3B.
4 µg/mL诱导肿瘤细胞后, 细胞胞浆中出现棕黄色反应, 表明4 µg/mL melittin诱导细胞后AIF、cytochrome C、EndoG、Smac/Diablo均有所表达(图4), 阳性表达率分别为15.99%±1.66%、42.73%±3.48%、62.34%±2.71%、28.58%±2.09%, 与阴性对照组比较差异显著(P<0.05).
蜂毒治病作为一种民间疗法由来已久, 对于自身免疫性疾病有较好的疗效. 蜂毒首见于《吉林中草药》: "祛风湿, 治风湿性关节炎." 蜂毒性味辛、苦、平; 功效祛风湿、止疼痛、化血瘀. melittin生物学活性很高, 结构明确, 是由26个氨基酸组成的碱性多肽, 是蜂毒中起生物学活性的主要组分. Moon等[5]、Jo等[6]和Kim等[7]相继报道melittin可以通过细胞内不同信号通路发挥抑制肿瘤增殖的作用; Ji等[8]报道胡桃酮可通过线粒体通路诱导人胃腺癌细胞(SGC-7901) 凋亡.
本实验研究结果发现4 µg/mL melittin能明显诱导人SGC-7901细胞凋亡. 活性氧的检测结果显示, 4 µg/mL作用0 h后细胞胞浆中出现微弱的绿色荧光, 随着药物作用时间延长, 细胞胞浆中绿色荧光强度越强, 4 h组的荧光强度与阳性对照组一致; 线粒体膜电位检测结果显示, 阴性对照组细胞胞浆中可见到红色荧光, 而随着4 µg/mL melittin诱导细胞时间的延长, 胞浆中出现绿色荧光的细胞数越多, 这些结果说明4 µg/mL melittin感染细胞后活性氧产生增多, 线粒体膜电位下降, 同时活性氧堆积导致线粒体内膜氧化损伤, 造成内膜脂质的过氧化反应, 影响跨越线粒体膜的质子梯度, 同时, 线粒体的功能障碍又可导致氧自由基产生增多, 又可引起生物膜结构蛋白质和脂质过氧化, 使得线粒体膜通透性转运孔(mitochondrial permeability transition pore, MPTP)不可逆开放[9-11], 当MPTP持续性开放时, 大分子物质可非选择性进入孔道, 此时, 线粒体肿胀、外膜破裂, 从而导致线粒体膜电位下降, 细胞不可逆走向凋亡. 这与Tu等[12]报道的melittin通过激活人黑色素瘤细胞活性氧、降低膜电位, 影响钙离子内流, 激活Caspase-2、-3诱导细胞凋亡结果几乎一致. 同时4 µg/mL melittin作用SGC-7901细胞, melittin处理组线粒体相关蛋白(Smac/Diablo、cytochrome C、AIF、EndoG)阳性表达率分别为44.48%±4.85%、15.99%±1.66%、28.58%±2.09%、62.34%±2.71%, 与未经melittin处理组比较有统计学意义. Smac/Diablo是Stucki等[13]发现的一种基因定位于12q24的促凋亡因子, 成熟Smac蛋白以纯二聚体的形式存在于线粒体膜间腔, 其促凋亡功能的发挥有赖于其从线粒体释放到胞质, 肿瘤细胞胞质内Livin的高表达能减少Smac的释放, cytochrome C释放到胞质中, 形成Apaf-1和procaspase-9凋亡体, 两者进一步与Caspase-3结合而发挥抑凋亡作用, 本实验中发现melittin处理后Smac及cytochrome C蛋白从线粒体中释放, 与Stucki等[13]报道一致. AIF是由Lorenzo等[14]近年来发现的一种凋亡效应分子, 在凋亡信号的刺激下, 对非活性的AIF进行特异性切割, 完成切割后的AIF通过线粒体孔释放入胞浆, 本实验中AIF释放到胞浆, 促进胃癌细胞凋亡. EndoG是一种由核基因编码的存在于真核细胞线粒体膜间区的核酸酶, 主要与线粒体DNA复制有关[15], 在4 µg/mL melittin作用下, 位于线粒体膜间隙的EndoG转位至胞浆, 进而进入胞核, 引起染色体DNA的断裂.
从本研究我们可以推断出melittin可能通过激活活性氧, 降低膜电位, 释放线粒体相关蛋白等机制诱导人胃腺癌SGC-7901细胞凋亡.
感谢廖月霞、吴克艳在本实验过程中给予的大力帮助.
胃癌居消化系肿瘤之首, 对于失去手术机会及晚期胃癌患者, 化疗仍是最有效的手段之一. 蜂毒素(melittin)是迄今为止人类所知的抗炎活性最强的物质之一, 最近研究表明, melittin还具有抑制肿瘤生长的作用, 进一步拓宽了melittin的应用范围.
陆伦根, 教授, 上海交通大学附属第一人民医院消化科
胃癌的治疗目前仍然是医学一大难题, 现有的抗肿瘤药物存在着不良反应大等特点, 需要有作用更显著、不良反应更小的产品替代. melittin作为一种生物单体, 具有细胞毒作用, 能够抑制胃癌、肝癌等肿瘤细胞的生长. 有研究表明melittin可通过线粒体途径诱导肝癌细胞凋亡, melittin是否也通过线粒体诱导胃癌细胞的凋亡是目前亟待研究的问题.
melittin作为一种小分子抗肿瘤蛋白, 其诱导肿瘤凋亡机制是目前研究热点, 本研究通过选用线粒体通路相关蛋白的变化研究蜂毒素诱导胃癌细胞凋亡的相关机制.
线粒体通路: 线粒体产生活性氧、超氧化物等物质使得线粒体膜电位下降, 线粒体通透性转换孔形成, 线粒体蛋白跨膜转运, 调控信息传导通路.
本文观察melittin诱导人胃腺癌细胞凋亡及其对线粒体相关蛋白表达的影响, 具有一定指导意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Corso S, Ghiso E, Cepero V, Sierra JR, Migliore C, Bertotti A, Trusolino L, Comoglio PM, Giordano S. Activation of HER family members in gastric carcinoma cells mediates resistance to MET inhibition. Mol Cancer. 2010;9:121. [PubMed] [DOI] |
| 3. | Russell PJ, Hewish D, Carter T, Sterling-Levis K, Ow K, Hattarki M, Doughty L, Guthrie R, Shapira D, Molloy PL. Cytotoxic properties of immunoconjugates containing melittin-like peptide 101 against prostate cancer: in vitro and in vivo studies. Cancer Immunol Immunother. 2004;53:411-421. [PubMed] |
| 5. | Moon DO, Park SY, Choi YH, Kim ND, Lee C, Kim GY. Melittin induces Bcl-2 and caspase-3-dependent apoptosis through downregulation of Akt phosphorylation in human leukemic U937 cells. Toxicon. 2008;51:112-120. [PubMed] |
| 6. | Jo M, Park MH, Kollipara PS, An BJ, Song HS, Han SB, Kim JH, Song MJ, Hong JT. Anti-cancer effect of bee venom toxin and melittin in ovarian cancer cells through induction of death receptors and inhibition of JAK2/STAT3 pathway. Toxicol Appl Pharmacol. 2012;258:72-81. [PubMed] |
| 7. | Kim SK, Park KY, Yoon WC, Park SH, Park KK, Yoo DH, Choe JY. Melittin enhances apoptosis through suppression of IL-6/sIL-6R complex-induced NF-κB and STAT3 activation and Bcl-2 expression for human fibroblast-like synoviocytes in rheumatoid arthritis. Joint Bone Spine. 2011;78:471-477. [PubMed] [DOI] |
| 8. | Ji YB, Qu ZY, Zou X. Juglone-induced apoptosis in human gastric cancer SGC-7901 cells via the mitochondrial pathway. Exp Toxicol Pathol. 2011;63:69-78. [PubMed] [DOI] |
| 9. | Hail N. Mitochondria: A novel target for the chemoprevention of cancer. Apoptosis. 2005;10:687-705. [PubMed] |
| 10. | Lee MG, Lee KT, Chi SG, Park JH. Costunolide induces apoptosis by ROS-mediated mitochondrial permeability transition and cytochrome C release. Biol Pharm Bull. 2001;24:303-306. [PubMed] |
| 11. | Porter AG, Jänicke RU. Emerging roles of caspase-3 in apoptosis. Cell Death Differ. 1999;6:99-104. [PubMed] |
| 12. | Tu WC, Wu CC, Hsieh HL, Chen CY, Hsu SL. Honeybee venom induces calcium-dependent but caspase-independent apoptotic cell death in human melanoma A2058 cells. Toxicon. 2008;52:318-329. [PubMed] |
| 13. | Stucki JW, Simon HU. Mathematical modeling of the regulation of caspase-3 activation and degradation. J Theor Biol. 2005;234:123-131. [PubMed] |
| 14. | Lorenzo HK, Susin SA. Therapeutic potential of AIF-mediated caspase-independent programmed cell death. Drug Resist Updat. 2007;10:235-255. [PubMed] [DOI] |