修回日期: 2013-04-19
接受日期: 2013-04-27
在线出版日期: 2013-05-28
目的: 探讨去肝交感神经对肝部分切除大鼠肝细胞增殖的影响.
方法: 将84只♂SD大鼠随机分为对照组和实验组, 每组42只. 对照组大鼠行部分肝切除, 实验组大鼠去肝交感神经后进行部分肝切除. 两组大鼠分别在手术后12、24、36、48、72、120和168 h(每个时间点6只大鼠)处死取材, 测量各时间点肝/体质量比; 用银染法显示肝细胞核仁组织区相关嗜银蛋白(argyrophilic nucleolar organizer region-associated proteins, AgNORs); 用免疫组织化学法检测肝细胞增殖细胞核抗原(proliferation cell nuclear antigen, PCNA)的表达.
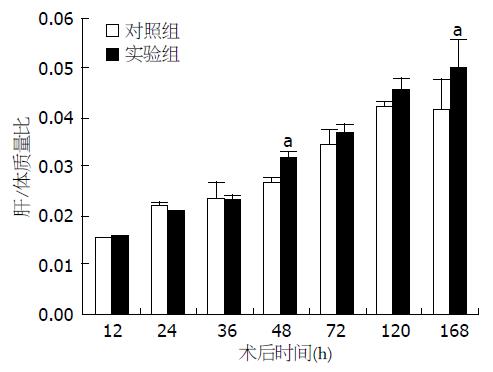
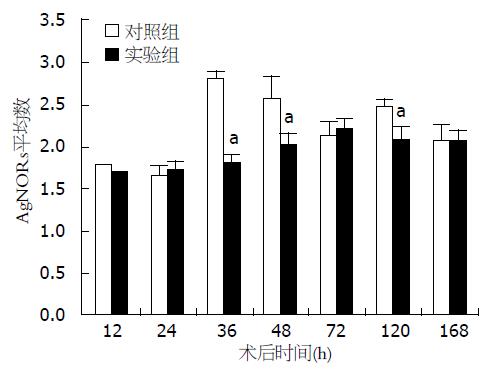
结果: 实验组大鼠的肝/体质量比在术后48、168 h(分别为0.0311±0.0011和0.0500±0.0056)显著高于对照组(分别为0.0267±0.0008和0.0412±0.0061)(P<0.05), 其余各时间点两组间无明显差异; 实验组肝细胞AgNORs颗粒平均数在术后36、48、120 h(分别为1.82±0.10、2.01±0.14和2.08±0.12)显著低于对照组(分别为2.79±0.08、2.57±0.26和2.46±0.07)(P<0.05); 从术后24-168 h实验组肝细胞PCNA的表达显著低于对照组(P<0.05).
结论: 去肝交感神经对肝切除后肝细胞的增殖可能有抑制作用.
核心提示: 去交感神经对肝再生影响方面的研究较少, 报道的结果也不一致. 本研究结果显示, 去肝脏交感神经肝再生过程中, 肝细胞核仁组织区相关嗜银蛋白(argyrophilic nucleolar organizer region-associated proteins)颗粒数和肝细胞增殖细胞核抗原(proliferation cell nuclear antigen)的表达明显降低, 提示去肝交感神经对肝切除后肝细胞的增殖可能有抑制作用.
引文著录: 张新胜, 赵丹丹, 王改平, 徐存拴. 去肝交感神经对部分肝切除大鼠肝细胞增殖的影响. 世界华人消化杂志 2013; 21(15): 1381-1386
Revised: April 19, 2013
Accepted: April 27, 2013
Published online: May 28, 2013
AIM: To investigate the effect of hepatic sympathetic denervation on hepatocyte proliferation in rats after partial hepatectomy.
METHODS: Eighty-four male SD rats were randomly divided into a control group or an experimental group (42 rats for each group). The control group was subjected to partial hepatectomy (PH), and the experimental group underwent hepatic sympathetic denervation followed by PH. Rats in both groups were killed at 12, 24, 36, 48, 72, 120 or 168 h (6 rats at each time point) after surgery. The liver to body weight ratio was measured at each time point, and silver staining and immunohistochemical staining were performed to detect the expression of argyrophilic nucleolar organizer region-associated proteins (AgNORs) and hepatic proliferation cell nuclear antigen (PCNA) at each time point.
RESULTS: At 48 and 168 h after surgery, the liver to body weight ratios in the experimental group increased significantly compared to the control group (0.0311 ± 0.0011 vs 0.0267 ± 0.0008, 0.0500 ± 0.0056 vs 0.0412 ± 0.0061, both P < 0.05). At 36, 48 and 120 h, the average number of hepatocytes containing AgNORs particles was significantly lower in the experimental group than in the control group (1.82 ± 0.10 vs 2.79 ± 0.08, 2.01 ± 0.14 vs 2.57 ± 0.26, 2.08 ± 0.12 vs 2.46 ± 0.07, all P < 0.05). At 24-168 h, PCNA expression in hepatocytes was significantly lower in the experimental group than in the control group (all P < 0.05).
CONCLUSION: Hepatic sympathetic denervation inhibits hepatocyte division and proliferation in rats after partial hepatectomy.
- Citation: Zhang XS, Zhao DD, Wang GP, Xu CS. Effect of hepatic sympathetic denervation on hepatocyte proliferation in rats after partial hepatectomy. Shijie Huaren Xiaohua Zazhi 2013; 21(15): 1381-1386
- URL: https://www.wjgnet.com/1009-3079/full/v21/i15/1381.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i15.1381
哺乳动物肝脏有很强的再生潜能, 而肝再生的过程受到许多因素的影响[1-3]. 有研究发现, 肝交感神经参与肝切除后肝再生过程的调节. Ohtake等[4]的研究发现去肝脏交感神经对肝重没有显著影响, 从而认为去肝脏交感神经对肝再生没有影响. 而Michalopoulos等[5]发现去肝脏交感神经可抑制肝细胞的DNA合成及有丝分裂过程, 因此认为去交感神经可能抑制肝细胞再生. 夏锋等[6]的研究发现去交感神经状态可抑制肝再生的进程. 目前, 去交感神经对肝再生影响方面的研究较少, 报道的结果也不一致. 因此, 本研究中我们以肝/体质量比, 肝细胞内核仁组织区相关嗜银蛋白(argyrophilic nucleolar organizer region-associated proteins, AgNORs)颗粒平均数以及肝细胞增殖细胞核抗原(proliferation cell nuclear antigen, PCNA)的表达为研究指标, 探讨大鼠肝部分切除后去肝交感神经对肝细胞增殖的影响.
成年健康纯系SD♂大鼠84只(河南师范大学实验动物中心提供), 体质量210 g±20 g. 将大鼠随机分为对照组和实验组, 每组42只.
1.2.1 手术方法: 实验组: 按Lautt等[7]的方法处理, 即大鼠行乙醚吸入法麻醉, 固定大鼠于手术板上, 腹部消毒后, 在腹部正中纵行切开3 cm长切口, 显露肝脏, 剥离下腔静脉、门静脉、肝固有动脉和胆总管, 在胆管﹑门静脉﹑肝动脉周围涂以90%苯酚溶液, 去除肝交感神经, 然后采用Higgins等[8]方法进行部分肝切除(partial hepatectomy, PH). 对照组: 在胆管﹑门静脉﹑肝动脉周围涂以生理盐水代替90%苯酚溶液, 然后进行PH. 大鼠手术后常规饲养.
1.2.2 肝/体质量比的计算: 在术后第12、24、36、48、72、120、168小时处死两组大鼠, 分别称取大鼠的体质量、肝质量, 计算各时间点大鼠的肝/体质量之比.
1.2.3 取材与制片: 取两组大鼠各时间点部分肝组织用10%中性缓冲甲醛固定, 常规制作石蜡切片.
1.2.4 银染法显示AgNORs: 按张文学等[9]方法显示AgNORs. 每张切片从肝小叶中央静脉区、门管区和其他部位随机选择5个视野进行图像采集, 然后用Image-pro plus图像分析软件测定每个细胞核内AgNORs颗粒平均数.
1.2.5 免疫组织化学法检测肝细胞PCNA的表达: 参照PV-6002二步法免疫组织化学检测试剂盒步骤检测PCNA的表达. 一抗为PCNA单抗(1:100稀释, 购自武汉博士德公司), 二抗PV-6002(山羊抗小鼠IgG抗体-HRP多聚体工作液, 购自北京中杉公司). 以PBS代替一抗进行阴性对照. 随机采集5个视野的图像, 用Image-pro plus图像分析软件分析肝细胞PCNA的表达, 以每张图片上PCNA的积分吸光度(IA)值表示肝细胞PCNA的表达强度, IA值越大, 表示PCNA的表达越强.
统计学处理 实验所得数据以mean±SD表示, 采用单因素方差分析对数据进行统计学分析.
对照组和实验组大鼠的肝/体质量比在术后都呈现增加趋势(图1). 除术后24 h外, 其余时间点实验组大鼠的肝/体质量比均大于对照组. 其中, 在术后48、168 h实验组大鼠的肝/体质量比(分别为0.0311±0.0011和0.0500±0.0056)显著高于对照组(分别为0.0267±0.0008和0.0412±0.0061)(P<0.05), 其余各时间点两组间无明显差异.
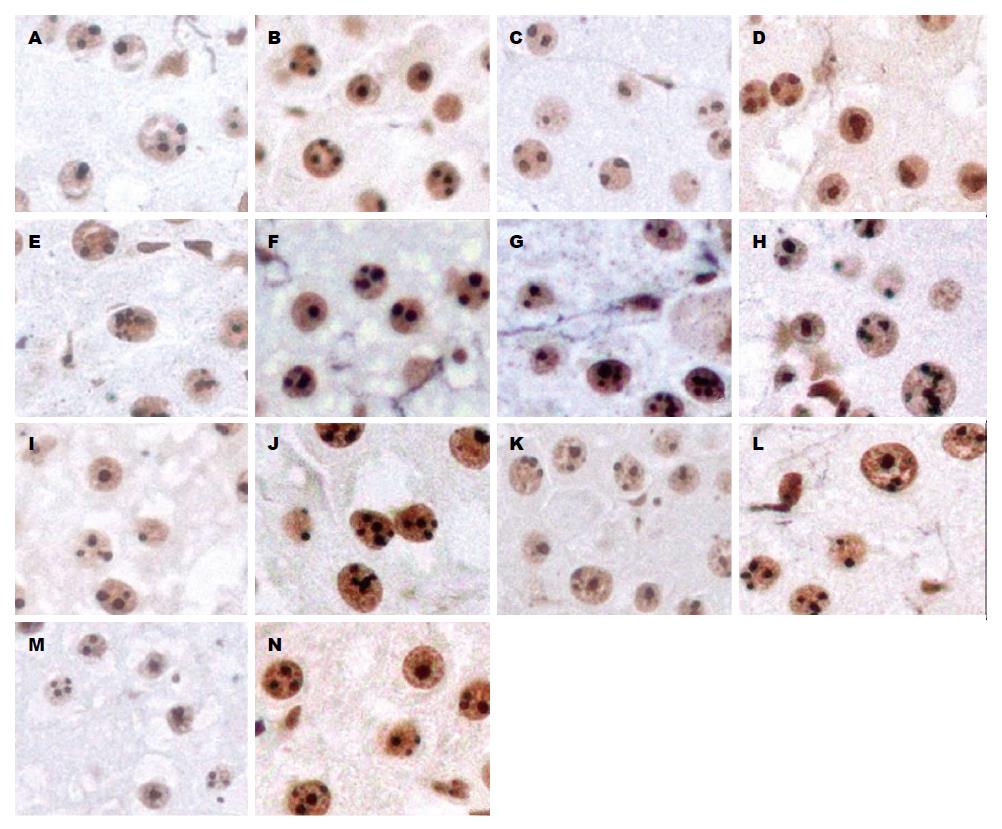
银染法显示, 肝细胞内AgNORs颗粒被染成黑色或黑褐色(图2). 两组大鼠肝细胞内AgNORs颗粒平均数呈现先上升然后下降的趋势. 在术后第36、48和120小时, 实验组肝细胞内AgNORs颗粒平均数(分别为1.82±0.10、2.01±0.14和2.08±0.12)显著低于对照组(分别为2.79±0.08、2.57±0.26和2.46±0.07)(P<0.05), 其他各时间点两组间没有明显差异. 在术后36 h对照组AgNORs颗粒平均数(2.79±0.08)达到峰值, 在术后72 h实验组AgNORs颗粒平均数达到峰值(2.21±0.11)(图3).
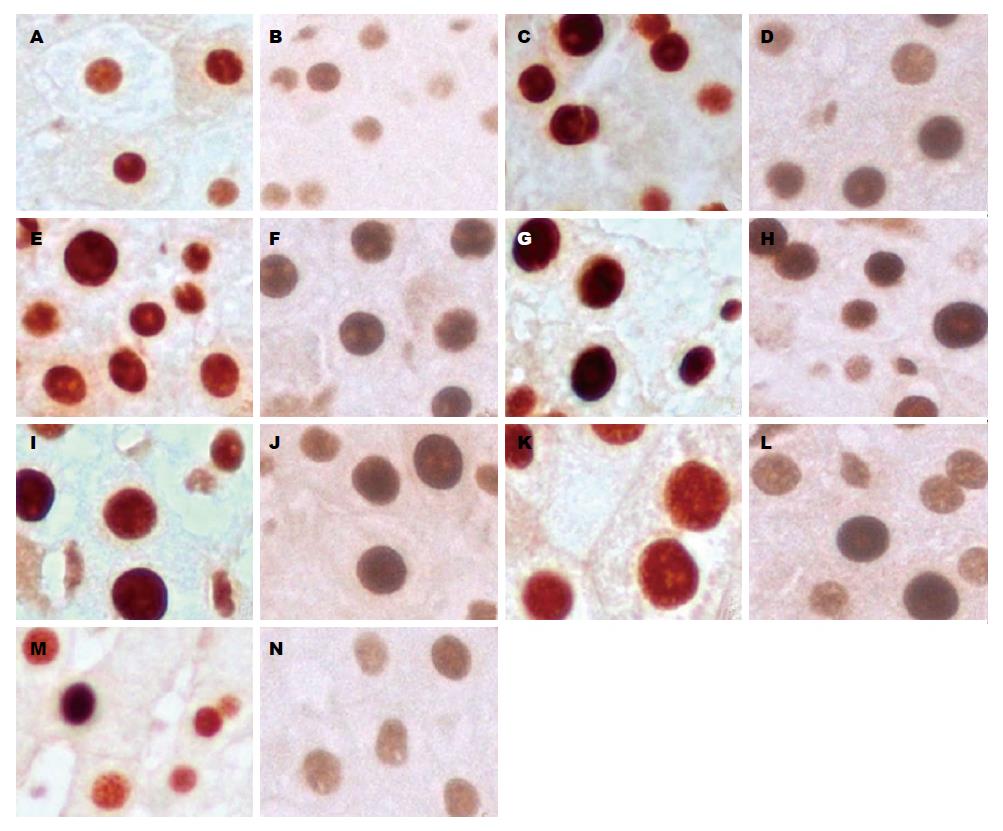
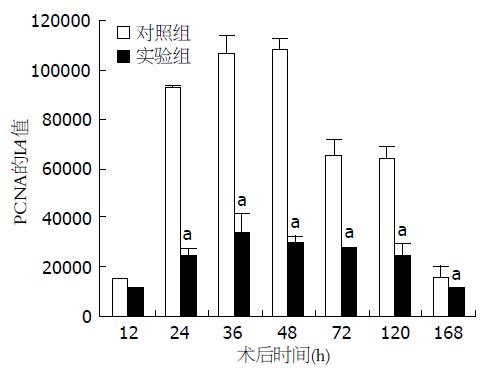
免疫组织化学结果显示, 肝细胞内PCNA阳性表达呈棕色, 染色强度深浅不一(图4). 对照组PCNA表达的峰值处于术后48 h, 实验组PCNA表达的峰值处于术后36 h. 从术后24-168 h, 实验组PCNA的表达(IA分别为25263.16±2105.26、34736.84±7368.42、30526.32±2736.82、28421.05±502.35、25263.16±4736.64、12210.53±312.67)显著低于对照组(IA分别为93894.74±1263.16、107368.42±7578.95、109473.68±4736.83、65263.16±6842.11、64210.53±5263.16、15789.43±5052.63)(P<0.05)(图5).
目前, 关于肝交感神经是否参与肝切除后肝再生过程的调节已有相关报道[4-6]. 从报道的结果看, 这些研究的结论是不一致的. 究其原因, 可能与研究中所用的去肝交感神经的方法有关. 在以往的研究中, 去除交感神经的方法主要有: 化学性切除[6](经肠系膜静脉注入六羟多巴胺6-OHDA)、外科手术切除[4]和肝动脉、门静脉周围施用90%苯酚水溶液切除[7]等. Cucchiaro等[10]比较了上述方法后认为, 在门静脉周围施用90%苯酚水溶液去交感神经最为合适. 基于此, 本研究中我们就采用该方法去除大鼠肝交感神经, 以肝/体质量比、肝细胞内AgNORs颗粒平均数以及肝细胞PCNA的表达为指标, 探讨了大鼠部分肝切除后去交感神经对肝细胞增殖的影响.
肝/体质量比是研究肝再生的一个宏观指标, 该值的大小反映肝再生能力的强弱. AgNORs是核仁组织区内与rDNA转录有关的酸性蛋白, 细胞核内AgNORs颗粒的数量反映rDNA转录活性的水平, AgNORs颗粒越多, 说明细胞的转录活性越高、增殖能力越强[11,12]. 有研究显示, 在大鼠再生肝细胞中AgNORs的量是正常静止肝细胞中的2倍[13], 所以该指标常被用来反映细胞的增殖活性[13-15]. PCNA是一个在进化上非常保守的、与细胞增殖密切相关的核内酸性蛋白质, 通过调节参与DNA复制的DNA多聚酶δ活性参与DNA的合成过程[16,17], 细胞中PCNA的含量和表达强弱的变化与DNA合成及DNA复制的活跃程度相一致[18]. 此外, 其还与其他一些重要的生命过程密切相关, 如DNA修复、细胞周期调控等[19-21]. 以上研究均表明PCNA与细胞增殖是密切相关的. 因此, 把AgNORs和PCNA常作为肝再生研究的微观指标[12,13].
本研究结果显示, 术后两组大鼠的肝/体质量比都呈现增加趋势, 在多数时间点两组大鼠的肝/体质量比没有明显差异, 只是在48和168 h实验组大鼠的肝/体质量比显著大于对照组(P<0.05). 从这项指标的这两个时间点来讲, 去肝交感神经可能促进肝部分切除后肝的再生. 然而我们的结果还发现, 术后36、48和120 h, 实验组大鼠肝细胞内AgNORs颗粒平均数显著减少(P<0.05), 表明实验组大鼠肝细胞的转录活性下降、增殖能力降低. 该结果提示去肝交感神经可能抑制肝部分切除后肝的再生. 另外, 免疫组织化学结果显示, 实验组大鼠肝细胞PCNA的表达从24-168 h均明显低于对照组, 表明实验组大鼠肝细胞DNA的合成能力下降, 该结果也提示去肝交感神经可能抑制肝部分切除后肝的再生. 这与Michalopoulos等[5]和夏锋等[6]的研究结果是一致的. 从本研究中的宏观指标和微观指标的结果分析会导致得出的结论有所分歧, 但从整体的角度来看, 作者更倾向于去肝交感神经可能抑制肝部分切除后肝再生的观点[5,6]. 至于本研究中实验组大鼠肝/体质量比在术后48和168 h显著大于对照组的情况, 可能与大鼠去交感神经后对肝质量没有明显影响[4], 但会影响大鼠饮食下降、体质量下降[6], 从而导致肝/体质量比增大有关. 但具体情况如何有待于进一步研究.
哺乳动物肝脏有很强的再生能力, 而肝再生的过程受到许多因素的影响. 肝脏受交感神经和副交感神经双重支配, 肝脏神经在肝脏功能调控中发挥着重要作用. 因此, 探讨肝脏神经在肝再生中的作用及其机制具有重要意义.
徐迅迪, 教授, 中南大学湘雅二医院肝胆胰外科
肝再生是一个多步骤复杂的过程, 可以分为启动、再生和终止3个阶段. 以往关于肝再生的研究多集中在一些因子或通路对上述3个阶段的作用上. 近年来关于神经在肝再生中的作用越来越受到关注, 所以探讨交感神经在肝再生中的作用非常有意义.
Ohtake等的研究发现去肝脏交感神经对肝重没有显著影响, 故而认为去交感神经对肝再生没有影响.Michalopoulos等的研究发现去肝脏交感神经可抑制肝细胞DNA的合成及有丝分裂过程, 因此认为去交感神经可能抑制肝细胞再生.
本研究以肝/体质量为宏观指标、以肝细胞内核仁组织区相关嗜银蛋白和肝细胞增殖细胞核抗原表达为微观指标, 通过这些指标的变化来探讨肝交感神经在部分肝切除大鼠肝再生中的可能作用.
本研究在去肝交感神经合并部分肝切除大鼠模型上观察去交感神经对肝再生的影响, 探讨交感神经在肝再生中可能的作用, 为肝再生理论的进一步完善提供实验依据.
本文结果提示肝交感神经对肝切除后肝细胞的增殖可能有调节作用, 立题新颖, 设计合理, 具有一定指导意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Fausto N, Campbell JS, Riehle KJ. Liver regeneration. Hepatology. 2006;43:S45-S53. [PubMed] [DOI] |
| 4. | Ohtake M, Sakaguchi T, Yoshida K, Muto T. Hepatic branch vagotomy can suppress liver regeneration in partially hepatectomized rats. HPB Surg. 1993;6:277-286. [PubMed] |
| 7. | Lautt WW, Carroll AM. Evaluation of topical phenol as a means of producing autonomic denervation of the liver. Can J Physiol Pharmacol. 1984;62:849-853. [PubMed] |
| 8. | Higgins GM, Anderson RM. Experimental pathology of the liver: restoration of the liver of the white rat following partial surgical removal. Arch Pathol. 1931;12:186-202. |
| 9. | 张 文学, 荣 换玲, 卢 正, 苗 艳艳, 刘 文玲, 徐 存拴. 枸杞对大鼠肝再生的影响. 河南师范大学学报(自然科学版). 2008;11:105-107. |
| 10. | Cucchiaro G, Yamaguchi Y, Mills E, Kuhn CM, Anthony DC, Branum GD, Epstein R, Meyers WC. Evaluation of selective liver denervation methods. Am J Physiol. 1990;259:G781-G785. [PubMed] |
| 13. | Borzio M, Trerè D, Borzio F, Ferrari AR, Bruno S, Roncalli M, Colloredo G, Leandro G, Oliveri F, Derenzini M. Hepatocyte proliferation rate is a powerful parameter for predicting hepatocellular carcinoma development in liver cirrhosis. Mol Pathol. 1998;51:96-101. [PubMed] |
| 14. | Bukhari MH, Niazi S, Khan SA, Hashmi I, Perveen S, Qureshi SS, Chaudhry NA, Qureshi GR, Hasan M. Modified method of AgNOR staining for tissue and interpretation in histopathology. Int J Exp Pathol. 2007;88:47-53. [PubMed] [DOI] |
| 15. | Lorand-Metze I, Metze K. AgNOR clusters as a parameter of cell kinetics in chronic lymphocytic leukaemia. Clin Mol Pathol. 1996;49:M357-M360. [PubMed] |
| 19. | Maga G, Hubscher U. Proliferating cell nuclear antigen (PCNA): a dancer with many partners. J Cell Sci. 2003;116:3051-3060. [PubMed] [DOI] |
| 20. | Zhu Z, Xing S, Cheng P, Li G, Yang Y, Zeng F, Lu G. The relationship of expression of bcl-2, p53, and proliferating cell nuclear antigen (PCNA) to cell proliferation and apoptosis in renal cell carcinoma. J Huazhong Univ Sci Technolog Med Sci. 2004;24:354-357. [PubMed] [DOI] |