修回日期: 2013-03-18
接受日期: 2013-03-29
在线出版日期: 2013-05-18
目的: 研究核因子κB(nuclear factor κB, NF-κB)信号通路中IKKi蛋白在肝硬化相关肝细胞癌(hepatocellular carcinoma, HCC)中的表达水平及其临床病理意义.
方法: 采用免疫组织化学方法检测66例肝硬化相关HCC IKKi蛋白表达, 同一病例癌旁肝硬化组织作为对照, 收集患者临床病理资料, 分析HCC IKKi蛋白表达水平以及与临床病理参数的关系.
结果: (1)IKKi在HCC与癌旁肝硬化组织表达水平有明显差异性(P = 0.016), IKKi在癌周肝硬化组织表达强度明显强于HCC; (2)IKKi在HCC中的表达水平与肿瘤分化程度呈正相关, 即IKKi表达水平越低, HCC分化程度越低(P = 0.019, r = 0.278); 与肿瘤直径呈负相关, 即IKKi表达水平越低, 肿瘤体积越大(P = 0.011, r = -0.311); (3)IKKi在HCC中的表达水平与年龄(P = 0.034, r= 0.261)、Child-Pugh分级(P = 0.046, r = 0.246)、乙型肝炎家族史(P = 0.017, r = 0.292)呈正相关.
结论: IKKi在HCC表达下调提示IKKi在乙型肝炎病毒感染-病毒性肝炎-肝硬化-HCC的发生中可能起抑制肿瘤形成的作用.
核心提示: IKKi在肝细胞癌(hepatocellular carcinoma, HCC)表达下调提示IKKi在乙型肝炎病毒(hepatitis B virus, HBV)感染-病毒性肝炎-肝硬化-HCC的发生中可能起抑制肿瘤形成的作用, 这对于由HBV感染引起的HCC提供了一个免疫靶向治疗的新方向.
引文著录: 郭颖, 桑伟, 张巍, 范晓棠, 陈兰, 阎道博, 卢畅, 何方平. IKKi在肝硬化相关肝细胞癌中的表达. 世界华人消化杂志 2013; 21(14): 1333-1338
Revised: March 18, 2013
Accepted: March 29, 2013
Published online: May 18, 2013
AIM: To assess the clinical significance of IKKi protein expression in cirrhosis-related hepatocellular carcinoma (HCC).
METHODS: Immunohistochemistry was used to detect IKKi expression in 66 cirrhosis-related HCC specimens and matched tumor-adjacent cirrhosis specimens. The association of IKKi expression with clinical and pathological features of HCC was analyzed.
RESULTS: IKKi expression level was significantly higher in cirrhosis-related HCC than in tumor-adjacent cirrhosis tissue (P = 0.016). IKKi expression in HCC was positively correlated with tumor differentiation (P = 0.019, r = 0.278), age (P = 0.034, r = 0.261), Child - Pugh classification (P = 0.046, r =0 .246) and family history of hepatitis B (P = 0.017, r = 0.292), but was negatively correlated with tumor size (P = 0.011, r = -0.311).
CONCLUSION: Low expression of IKKi in HCC implies that IKKi may prevent the evolution of hepatitis B virus infection-viral hepatitis-cirrhosis-HCC.
- Citation: Guo Y, Sang W, Zhang W, Fan XT, Chen L, Yan DB, Lu C, He FP. Expression of IKKi in cirrhosis-related hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(14): 1333-1338
- URL: https://www.wjgnet.com/1009-3079/full/v21/i14/1333.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i14.1333
近年来多项研究表明, 核因子κB(nuclear factor κB, NF-κB)信号通路是炎症与肿瘤之间的桥梁[1], 认为NF-κB信号通路属于先天性免疫通路, 在清除病原体过程中, 通过诱导炎症发生, 刺激机体产生干扰素, 而达到病原清除[2]. 近年来, NF-κB信号通路中IKKi因子的异常表达在调控炎症与肿瘤发生中发挥着重要作用[3]. IKKi是报道较少的一个NF-κB上游信号通路分子, 作为干扰素前体3、5、7的刺激因子, IKKi高表达有利于病原体的清除, 但在正常生理情况下, IKKi几乎不表达, 肝细胞癌(hepatocellular carcinoma, HCC)发生与肝脏长期慢性炎症密切相关, 有关IKKi在HCC表达的研究文献很少. 本课题组选择的HCC病例均有乙型肝炎病史, 病理提示HCC均在肝硬化基础上发生的肝癌, 我们希望通过分析NF-κB通路相关因子IKKi在HCC表达水平以及与肿瘤分化程度、家族史、肿瘤大小等临床病理参数的相关性, 探讨IKKi在肝硬化基础上发生的HCC中的作用.
2007-2010年新疆医科大学第一附属医院HCC手术切除组织66份, 经病理证实为HCC, 符合肝癌临床诊断标准[4], 每份均含有HCC组织和癌旁肝硬化组织, 癌旁肝硬化符合肝硬化临床诊断金标准[5], 患者均为乙型肝炎肝硬化基础上发生的肝细胞性肝癌, 术前均未接受过生物性治疗及其放化疗. 根据2009年WHO肝脏和肝内胆管肿瘤组织学分类标准, 将HCC分为高分化、中分化和低分化. 免疫组织化学相关试剂购自上海恒菲生物科技有限公司.
1.2.1 免疫组织化学: 所有标本均经4%中性甲醛固定, 常规组织处理, 石蜡包埋, 3 μm厚连续切片, 常规HE染色. 采用Envision法进行IKKi染色, DAB显色, 苏木素复染. 用已知阳性切片作阳性对照, 以磷酸盐缓冲液(PBS)代替一抗作阴性对照. IKKi兔抗人多克隆抗体浓缩液, 稀释度为1:100.
1.2.2 结果判定: 光镜下半定量结果判断的方法. 胞浆呈棕褐色颗粒为阳性结果, 根据Beesley分级方法[6], 按阳性细胞所占百分比并参考着色强度确定分级如下: 每张切片随机选10个高倍视野. 阳性细胞数<10%为阴性(-), 阳性细胞为11%-25%为弱阳性(+), 阳性细胞数为26%-50%为中度阳性(++), 阳性细胞数为>51%为强阳性(+++).
统计学处理 采用SPSS17.0统计软件进行统计学处理. IKKi在肝癌及癌旁肝硬化表达差异性的比较采用秩和检验; IKKi在肝癌及癌旁肝硬化表达程度与临床指标相关性分析采用Spearman等级资料相关性分析. 以P<0.05表示差异有统计学意义.
汉族54例, 维吾尔族4例, 哈萨克族3例, 回族3例; 男54例, 女12例, 男女比例: 4.5:1; 年龄9-74岁, 年龄中位数51岁; 合并高血压者13例, 未合并高血压者53例; 合并糖尿病8例, 未合并糖尿病58例; 有乙型肝炎家族史8例, 无乙型肝炎家族史58例; 有肿瘤家族史9例, 无肿瘤家族史57例; 血清白蛋白<28 g/L 8例, 28-35 g/L 25例, >35g/L 35例; 谷草转氨酶<40 U/L 37例, ≥40 U/L 29例; 谷丙转氨酶<40 U/L 34例, ≥40 U/L 32例; 球蛋白<25 g/L 23例, 25-35 g/L 35例, >35 g/L 8例; 空腹血糖<6.1 mmol/L 52例, ≥6.1 mmol/L 14例; 甲胎蛋白<200 μg/L 32例, ≥200 μg/L 34例; 总胆红素<34 μmol/L 60例, ≥34 μmol/L 66例; 肿瘤直径<5 cm 42例, >5 cm 23例; 肿瘤个数: 1个58例, ≥2个8例; 肝功Child-pugh分级: A级50例, B级16例; 有腹水35例, 无腹水32例; 肝癌分化程度: 低分化30例, 中分化27例, 低分化9例.
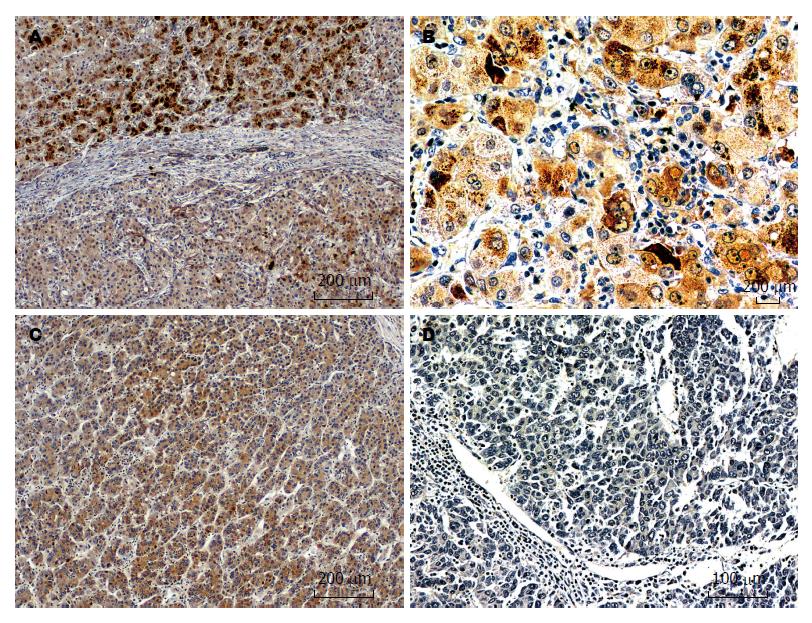
IKKi在HCC和癌周肝硬化组织均有表达, IKKi在HCC表达水平与癌周肝硬化组织表达差异有统计学意义, 表现为IKKi在癌旁肝硬化组织表达水平明显强于HCC组织(图1A), 且在IKKi表达的HCC周围常有炎细胞浸润(图1B), 提示IKKi在介导炎症中发挥着重要作用(表1).
| IKKi在肝细胞癌组织中的表达水平 | 合计 | Z值 | P值 | |||||
| 0 | 1 | 2 | 3 | |||||
| IKKi在癌旁肝硬化组织中的表达水平 | 0 | 0 | 1 | 1 | 4 | 6 | ||
| 1 | 2 | 1 | 0 | 0 | 3 | |||
| 2 | 1 | 0 | 4 | 2 | 7 | |||
| 3 | 10 | 4 | 7 | 29 | 50 | |||
| 合计 | 13 | 6 | 12 | 35 | 66 | -0.2416 | 0.016 | |
评估参数包括: 年龄、性别、族别、高血压、糖尿病、Child-pugh分级、乙型肝炎家族史、谷草转氨酶、谷丙转氨酶、白蛋白、球蛋白、甲胎球蛋白、肿瘤大小、肿瘤个数、腹水和肿瘤病理分级. 结果显示: IKKi表达水平与肝癌分化程度、年龄、Child-pugh评分、患者乙型肝炎家族史呈正相关(P<0.05), 即IKKi在高分化的HCC中高表达, 在低分化的HCC中低表达(图1C, D); IKKi表达水平与肿瘤直径呈负相关性(P<0.05), 以上均提示IKKi在抑制HCC发展方面发挥作用; IKKi表达水平与性别、族别、高血压、糖尿病、白蛋白、球蛋白、胆红素、甲胎球蛋白均无相关性(P>0.05). 具有临床意义(统计学差异)的参数如表2.
| 临床病理因素 | n | IKKI肝癌 | r值 | P值 | |||
| 0 | 1 | 2 | 3 | ||||
| 性别 | -0.16 | 0.199 | |||||
| 男 | 54 | 12 | 3 | 7 | 32 | ||
| 女 | 12 | 1 | 3 | 5 | 3 | ||
| 年龄(岁) | 0.261 | 0.034 | |||||
| <51 | 31 | 6 | 4 | 7 | 12 | ||
| ≥51 | 35 | 5 | 2 | 5 | 23 | ||
| 民族 | 0.033 | 0.795 | |||||
| 汉族 | 52 | 11 | 5 | 11 | 29 | ||
| 维吾尔族 | 4 | 1 | 0 | 0 | 2 | ||
| 哈萨克族 | 3 | 0 | 1 | 1 | 1 | ||
| 回族 | 3 | 1 | 0 | 0 | 3 | ||
| 高血压 | -0.115 | 0.396 | |||||
| 有 | 13 | 2 | 2 | 0 | 9 | ||
| 无 | 53 | 11 | 4 | 12 | 26 | ||
| 糖尿病 | -0.156 | 0.211 | |||||
| 有 | 8 | 1 | 0 | 1 | 6 | ||
| 无 | 58 | 12 | 6 | 11 | 29 | ||
| Child-pugh分级 | 0.246 | 0.046 | |||||
| A级 | 50 | 12 | 6 | 11 | 21 | ||
| B级 | 16 | 1 | 0 | 1 | 14 | ||
| 乙型肝炎家族史 | 0.292 | 0.017 | |||||
| 有 | 8 | 5 | 0 | 1 | 2 | ||
| 无 | 58 | 8 | 6 | 11 | 33 | ||
| 肿瘤家族史 | 0.155 | 0.215 | |||||
| 有 | 9 | 4 | 1 | 0 | 4 | ||
| 无 | 57 | 9 | 5 | 12 | 31 | ||
| 血红蛋白(g/L) | -0.149 | 0.118 | |||||
| <90 | 5 | 0 | 0 | 0 | 3 | ||
| ≥90 | 61 | 13 | 6 | 12 | 32 | ||
| 血小板 | -0.039 | 0.753 | |||||
| <50×109/L | 3 | 1 | 0 | 1 | 3 | ||
| ≥50×109/L | 63 | 12 | 6 | 11 | 32 | ||
| 总胆红素(μmol/L) | 0.154 | 0.216 | |||||
| <34 | 60 | 12 | 6 | 12 | 30 | ||
| ≥34 | 6 | 1 | 0 | 0 | 5 | ||
| PT活动度 | -0.198 | 0.111 | |||||
| <75% | 23 | 0 | 2 | 4 | 17 | ||
| ≥75% | 33 | 13 | 4 | 8 | 18 | ||
| 球蛋白(g/L) | -0.153 | 0.219 | |||||
| <25 | 23 | 7 | 2 | 2 | 12 | ||
| 25-35 | 35 | 6 | 3 | 8 | 18 | ||
| >35 | 8 | 0 | 1 | 2 | 5 | ||
| 空腹血糖(mmol/L) | 0.018 | 0.885 | |||||
| <6.1 | 52 | 10 | 5 | 10 | 27 | ||
| ≥6.1 | 14 | 3 | 1 | 2 | 8 | ||
| 甲胎蛋白(ng/mL) | 0.002 | 0.987 | |||||
| <200 | 32 | 6 | 3 | 7 | 16 | ||
| ≥200 | 34 | 7 | 3 | 5 | 19 | ||
| 肿瘤直径(cm) | -0.311 | 0.011 | |||||
| <5 | 43 | 5 | 5 | 7 | 25 | ||
| ≥5 | 23 | 8 | 1 | 5 | 10 | ||
| 肿瘤个数(个) | 0.134 | 0.282 | |||||
| 1 | 58 | 13 | 5 | 13 | 28 | ||
| ≥2 | 8 | 0 | 1 | 1 | 7 | ||
| 腹水 | 0.113 | 0.368 | |||||
| 有 | 35 | 9 | 3 | 6 | 17 | ||
| 无 | 31 | 4 | 3 | 6 | 18 | ||
| 分化程度 | 0.287 | 0.019 | |||||
| 低分化 | 30 | 8 | 3 | 9 | 10 | ||
| 中分化 | 27 | 3 | 3 | 3 | 18 | ||
| 高分化 | 9 | 2 | 0 | 0 | 7 | ||
尽管100多年以前提出慢性炎症与癌症相关, 但近几年才关注一些通路及因子在两者之间的关系[7]. 引发HCC具有多种因素, 包括高龄、遗传背景、黄曲霉素摄入、病毒感染、大量酗酒, 2型糖尿病和肥胖等, 其中乙型肝炎病毒(hepatitis B virus, HBV)感染-病毒性肝炎-肝硬化-HCC是HCC发生的重要机制之一. 当病毒侵入体内, 可诱发肝内的慢性炎症, 进而释放炎症介质, 激活炎症信号转导通路引起后续大分子物质的致癌致突变作用[8]. 有研究表明, 炎症的发生, 尤其是慢性炎症持续状态可以促进肿瘤的发生和发展, 当机体发生炎症时细胞分泌的大量炎症介质, 彼此激活后能够趋化吸引多种炎症细胞聚集于炎症发生部位, 引发级联反应, 形成发生部位特殊的炎症性微环境, 细胞中固有的修复程序也受到炎症性微环境的影响而混乱失效, 最终导致炎症局部癌变的发生[9]. 本研究结果也符合以上结论, 炎症作用在HCC的发病及进展过程中起到了促进与增强的作用, HCC组织中伴随有大量炎细胞浸润, 相关的炎症信号通路起到了决定性作用.
HBV病毒感染引起慢性活动性肝炎可激活体内的炎症信号转导通路, 进而产生下游的级联反应, 其中包括NF-κB通路的激活, 该通路激活可导致一系列与肿瘤相关基因的异常表达, 从而推动正常细胞转化、抑制细胞凋亡引起HCC的发生[10]. NF-κB信号通路他可以诱导几个关键分子参与清除病原体的过程, 其中一些因子如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、血管内皮生长因子(vascular endothelial growth factor, VEGF)涉及到细胞生存、增殖和血管生长, 因此他们可以与肿瘤形成有关[11-13]. 该通路的激活可导致一系列与肿瘤相关基因的异常表达,从而推动正常细胞转化、抑制肿瘤细胞凋亡、促进肿瘤血管形成和转移等, 直接或间接影响恶性肿瘤的发生和发展. NF-κB通路上生物活性物质的模板基因具有多态性, 在转录和翻译合成蛋白质的过程中可对多肽链中氨基酸的排列顺序产生影响, 使其生物活性和功能发生改变: 这些变化可造成其控制的相关细胞因子转录水平发生改变, 进而影响细胞因子的表达, 此过程中的多种细胞因子及炎症因子有能够进一步激活NF-κB信号通路, 如此反复循环, 形成正反馈放大机制, 通过NF-κB的抑制细胞凋亡促进细胞转化的作用进而选择性的存进癌前期细胞的存活, 只是肝细胞基因受损严重最终发展至HCC.
IKKi是NF-κB通路的配体基因, 他在介导炎症以及微生物的清除过程中起到重要作用[14]. 当病毒和细菌进入机体后, 通过特定受体-配体结合激活IKKi, 激活下游相关因子完成宿主感染细胞的清除. 这些过程包括蛋白转录和细胞周期的关闭, 受损细胞死亡, 血细胞调节(如树突细胞的激活), 特别的是诱导干扰素Ⅰ(interferons Ⅰ, IFNⅠ)的积累[15]. 目前IKKi在HCC中的具体作用机制还不清楚. 我们的研究提示IKKi在肝硬化患者中起到阻止HCC发生的作用. Cyclin D1是NF-κB通路中的一个引起细胞增殖的因子, IKKi突变可诱导Cyclin D1高表达, 说明IKKi在NF-κB通路中抑制细胞增殖, 有实验还显示IKKi可以降低乳腺癌细胞在软琼脂中生长和对基底膜基质的侵犯, 提示IKKi可能是肿瘤抑制因子. 也有研究表明IKKi在乳腺癌过表达, IKKi可以通过磷酸化Thr308和Ser473两个靶点直接激活Akt通路, 提示IKKi在乳腺癌形成中起重要作用[16]. 前列腺癌研究显示IKKi通过诱导IL-6支持炎症和维护肿瘤微环境, 认为IKKi是促进前列腺癌形成的潜在因子.
本实验结果显示正常肝细胞不表达IKKi, 而IKKi在HCC和癌周肝硬化组织中均有表达, 在IKKi表达的HCC周围常有炎细胞浸润, 提示IKKi在介导炎症中发挥着重要作用. 本实验组选取的66例HCC病例均有乙型肝炎病史, 病理提示66例HCC均在肝硬化基础上发生的肝癌, 研究显示癌周肝硬化组织IKKi表达强度明显强于HCC, IKKi在HCC表达下调提示IKKi在HBV感染-病毒性肝炎-肝硬化-HCC的发生中可能起抑制肿瘤形成的作用. IKKi在HCC表达水平与肝癌分化程度呈正相关, 即IKKi表达水平越低, HCC分化程度越低, 这结果更支持IKKi在HCC中的作用, 即IKKi表达越低, 抵抗肿瘤效果越差, 肿瘤分化越差. 临床病理资料分析还显示: IKKi表达水平与肝癌分化程度、年龄、Child-pugh评分、患者乙型肝炎家族史呈正相关, IKKi表达水平与肿瘤直径呈负相关性, 其中IKKi表达水平与肿瘤大小呈负相关性也支持IKKi在抵抗HCC中的作用, 即IKKi表达水平越低, 抵抗肿瘤效果越差, 肿瘤体积越大.
IKKi在HCC中可能起抑制肿瘤形成的作用, 这可能依赖于诱导IFNⅠ发挥效应. IFNⅠ是一种由病毒感染诱导产生, 能够抑制病毒复制的一类高活性糖蛋白. 研究发现, INF具有多种生物活性, 不仅有抗病毒、调节免疫的作用, 还有抗肿瘤的效果. IFN Ⅰ可以有效地抑制肿瘤细胞增生、促进肿瘤细胞凋亡、抑制癌基因表达、抑制肿瘤转移, 目前作为辅助因子与其他抗癌药物一起协同对抗肿瘤. 本实验未检测HCC IFNⅠ的表达水平以及IFNⅠ与IKKi的相关性, 这是本实验一个缺陷, 下一步实验我们将检测HCC IFNⅠ的表达水平以及两者表达的关系, 如两者表达呈正相关, 更好地提示IKKi可能通过诱导IFNⅠ的表达对抗肿瘤. IKKi表达下调, 是由IKKi本身基因学改变引起, 还是IKKi上游基因出现异常导致IKKi蛋白表达失调, 需要进一步实验证实. 尽管IKKi蛋白表达失调机制有待研究, 但本次研究提示IKKi在HBV感染-病毒性肝炎-肝硬化-HCC中可能起抑制肿瘤作用, 这一发现对于由HBV感染引起的HCC提供了一个免疫靶向治疗的新方向.
肝细胞癌(hepatocellular carcinoma, HCC)的发生与慢性炎症长期作用密切相关, 而核因子κB(nuclear factor κB, NF-κB)信号通路中IKKi因子的异常表达在调控炎症与肿瘤发生中发挥着重要作用. IKKi作为干扰素前体的刺激因子, 其高表达有利于病原体的清除, 进一步研究其表达水平为HCC免疫靶向治疗提供新方向.
姚登福, 教授, 南通大学附属医院
目前已有文献研究分析HCC发生过程中炎症相关信号通路机制, 但对于先天性免疫机制在HCC进展过程中的重要作用存在争议, 且目前相关文献报道较少.
Fabregat等提出Cyclin D1在肝癌组的平均表达指数明显高于肝硬化组及正常对照组, 与NF-κB在细胞中的表达呈显著正相关, 提示NF-κB在HCC的发生中主要通过上调细胞增殖调控基因Cyclin D1实现的.
HCC的发生与慢性炎症的持续作用有关, NF-κB信号通路作为炎症与肿瘤的关键桥梁一直是研究热点, 但对于其关键调节因子IKKi的研究较少, 本文就IKKi在HCC的异常表达结合临床病理因素进行分析, 阐述IKKi抑制肿瘤的作用.
IKKi作为先天性免疫信号通路上的关键调节因子, 在正常肝组织中不表达, 在HCC中低表达, 如果在临床中能通过免疫组织化学方法检测其表达水平, 对于HCC的早期诊断及治疗有重要意义.
IKKi: NF-κB通路的配体基因, 属于IκB激酶的一种, 在介导炎症以及微生物的清除过程中起到重要作用.
本文对了解先天性免疫与肿瘤方面的关系具有一定参考价值.
编辑: 田滢 电编: 闫晋利
| 1. | Kim HR, Lee SH, Jung G. The hepatitis B viral X protein activates NF-kappaB signaling pathway through the up-regulation of TBK1. FEBS Lett. 2010;584:525-530. [PubMed] [DOI] |
| 2. | 王 以浪, 姚 登福, 吴 玮, 于 洪波, 赛 文莉, 钱 静, 李 姗姗, 卞 银珠. 肝癌组织核转录因子-κB表达与HBV复制及其临床病理学特征. 世界华人消化杂志. 2009;17:265-269. [DOI] |
| 3. | He G, Karin M. NF-κB and STAT3 - key players in liver inflammation and cancer. Cell Res. 2011;21:159-168. [PubMed] [DOI] |
| 5. | Beesley MF, McLaren KM. Cytokeratin 19 and galectin-3 immunohistochemistry in the differential diagnosis of solitary thyroid nodules. Histopathology. 2002;41:236-243. [PubMed] [DOI] |
| 6. | Narayan C, Kumar A. Constitutive over expression of IL-1β, IL-6, NF-κB, and Stat3 is a potential cause of lung tumorgenesis in urethane (ethyl carbamate) induced Balb/c mice. J Carcinog. 2012;11:9. [PubMed] [DOI] |
| 7. | Vucur M, Roderburg C, Bettermann K, Tacke F, Heikenwalder M, Trautwein C, Luedde T. Mouse models of hepatocarcinogenesis: what can we learn for the prevention of human hepatocellular carcinoma? Oncotarget. 2010;1:373-378. [PubMed] |
| 8. | Lu H, Ouyang W, Huang C. Inflammation, a key event in cancer development. Mol Cancer Res. 2006;4:221-233. [PubMed] [DOI] |
| 9. | Murakami S. Hepatitis B virus X protein: a multifunctional viral regulator. J Gastroenterol. 2001;36:651-660. [PubMed] |
| 10. | Karin M. The IκB kinase - a bridge between inflammation and cancer. Cell Res. 2008;18:334-342. [DOI] |
| 11. | Péant B, Forest V, Trudeau V, Latour M, Mes-Masson AM, Saad F. IκB-Kinase-ε (IKKε/IKKi/IκBKε) expression and localization in prostate cancer tissues. Prostate. 2011;71:1131-1138. [PubMed] [DOI] |
| 12. | Ancrile BB, O'Hayer KM, Counter CM. Oncogenic ras-induced expression of cytokines: a new target of anti-cancer therapeutics. Mol Interv. 2008;8:22-27. [PubMed] |
| 13. | Lee SH, Kim JS, Jun HK, Lee HR, Lee D, Choi BK. The major outer membrane protein of a periodontopathogen induces IFN-beta and IFN-stimulated genes in monocytes via lipid raft and TANK-binding kinase 1/IFN regulatory factor-3. J Immunol. 2009;182:5823-5835. [PubMed] [DOI] |
| 14. | Clément JF, Meloche S, Servant MJ. The IKK-related kinases: from innate immunity to oncogenesis. Cell Res. 2008;18:889-899. [PubMed] [DOI] |
| 15. | Guo JP, Coppola D, Cheng JQ. IKBKE protein activates Akt independent of phosphatidylinositol 3-kinase/PDK1/mTORC2 and the pleckstrin homology domain to sustain malignant transformation. J Biol Chem. 2011;286:37389-37398. [PubMed] [DOI] |