修回日期: 2013-03-29
接受日期: 2013-04-12
在线出版日期: 2013-05-18
目的: 探讨血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)促进肝星状细胞(hepatic stellate cell, HSC)增殖的相关信号机制.
方法: 原代培养HSC, 应用Western blot检测血管紧张素Ⅱ对HSC p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases, p38 MAPK)表达的影响. 并应用p38 MAPK抑制剂SB203580与HSC共培养, 观察p38 MAPK抑制剂对血管紧张素Ⅱ促进HSC分泌转化生长因子-β1(transforming growth factor-β1, TGF-β1)以及增加α1(Ⅰ)、α1(Ⅳ)型胶原(Col)表达的影响.
结果: Western blot结果显示不同浓度的AngⅡ(10-8、10-7、10-6 moL/L)作用24 h后, HSC p38 MAPK的相对含量明显增高(0.45±0.052, 0.61±0.026, 0.87±0.032), 与正常对照组(0.27±0.020)相比具有统计学差异(P<0.0005). 与正常对照组相比, 10-6 moL/L AngⅡ作用24 h后能够明显促进HSC增殖(0.1073±0.0093 vs 0.5233±0.0240, P<0.0005); 促进TGF-β1分泌(10.6 ng/mL±0.98 ng/mL vs 100.8 ng/mL±3.67 ng/mL, P<0.0005); 促进α1(Ⅰ)、α1(Ⅳ)Col mRNA表达(1.13±0.053 vs3.74±0.047; 1.35±0.035 vs 4.07±0.072, P<0.0005). 但当加入SB203580预先阻断p38 MAPK活性后, AngⅡ引起的上述作用明显减弱(0.2033±0.0176 vs 0.5233±0.0240; 21.07 ng/mL±2.08 ng/mL vs 100.8 ng/mL±3.67 ng/mL; 1.16±0.024 vs 3.74±0.047; 1.56±0.075 vs 4.07±0.072, P<0.0005).
结论: AngⅡ通过p38 MAPK通路促进HSC增殖和TGF-β1分泌.
核心提示: 血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)能够促进肝星状细胞(hepatic stellate cell)增殖, 增加转化生长因子-β1(transforming growth factor-β1)以及α1(Ⅰ)、α1(Ⅳ)型胶原表达. p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases, p38 MAPK)抑制剂SB203580能够拮抗AngⅡ的上述作用, 提示p38 MAPK通路是AngⅡ促进肝纤维化发生的重要信号传导通路.
引文著录: 崔巍, 邵臻, 傅宝玉. p38 MAPK介导的血管紧张素Ⅱ的促肝星状细胞增殖作用. 世界华人消化杂志 2013; 21(14): 1309-1314
Revised: March 29, 2013
Accepted: April 12, 2013
Published online: May 18, 2013
AIM: To elucidate the signal transduction mechanism by which angiotensin Ⅱ promotes the proliferation of hepatic stellate cells (HSCs).
METHODS: The influence of angiotensin Ⅱ on p38 MAPK expression in primarily cultured HSCs was detected by Western blot. The p38 MAPK inhibitor SB203580 was incubated with HSCs to observe its effect on angiotensin Ⅱ-induced transforming growth factor-β (TGF-β) secretion and collagen Ⅰ and Ⅳ expression.
RESULTS: Western blot analysis showed that, compared to the normal saline group, treatment with angiotensin Ⅱ (10-8, 10-7, 10-6 moL/L) for 24 h significantly induced p38 MAPK expression (0.45 ± 0.052, 0.61 ± 0.026, 0.87 ± 0.032 vs 0.27 ± 0.020, all P < 0.0005). Compared to the normal saline group, treatment with angiotensin Ⅱ (10-6 moL/L) for 24 h significantly induced HSC proliferation (0.1073 ± 0.0093 vs 0.5233 ± 0.0240, P < 0.0005), promoted incretion of TGF-β1 (10.6 ng/mL ± 0.98 ng/mL vs 100.8 ng/mL ± 3.67 ng/mL, P < 0.0005), and increased the expression of collagen α1(Ⅰ) and α1(Ⅳ) (1.13 ± 0.053 vs3.74 ± 0.047; 1.35 ± 0.035 vs 4.07 ± 0.072; both P < 0.0005). Pre-treatment with SB203580 significantly attenuated the effect of angiotensin Ⅱ on the above parameters in HSCs (0.2033 ± 0.0176 vs 0.5233 ± 0.0240; 21.07 ng/mL ± 2.08 ng/mL vs 100.8 ng/mL ± 3.67 ng/mL; 1.16 ± 0.024 vs 3.74 ± 0.047; 1.56 ± 0.075 vs 4.07 ± 0.072, all P < 0.0005).
CONCLUSION: Angiotensin Ⅱ induces HSC proliferation and increases expression of TGF-β1 via the p38 MAPK pathway.
- Citation: Cui W, Shao Z, Fu BY. p38 MAPK-mediated proliferation-promoting effect of angiotensin Ⅱ on hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2013; 21(14): 1309-1314
- URL: https://www.wjgnet.com/1009-3079/full/v21/i14/1309.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i14.1309
肝星状细胞(hepatic stellate cell, HSC)的活化和增殖是肝纤维化形成的关键环节. 目前研究已证实, 血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)能够刺激HSC活化、增殖, 促进胶原合成, 并且这一作用与转化生长因子-β1(transforming growth factor-β1, TGF-β1)密切相关[1-3], 但是具体的作用机制尚不十分清楚. AngⅡ若想发挥作用, 必须首先与HSC膜上的相应受体结合. AngⅡ的受体主要有AT1R、AT2R2种亚型, 现有研究表明AT1R是介导AngⅡ调控HSC功能的主要受体[4]. 近年来对AT1R介导的信号途径有了一些新的认识, 丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)途径可能发挥重要作用[5]. 为了明确AngⅡ调控HSC功能的受体后信号机制, 我们检测了AngⅡ对HSC细胞内TGF-β1、p38 MAPK表达的影响, 并应用p38 MAPK抑制剂进一步明确该信号通路在AngⅡ调控HSC功能中的作用.
AngⅡ购自美国Sigma公司; TGF-β1与ELISA试剂盒购自上海轩昊科技发展有限公司; 兔抗p38 MAPK多克隆抗体购自美国Promega公司; SB203580购自美国Sigma公司; RT-PCR试剂盒购自大连宝生物工程有限公司; T7体外转录试剂盒购自大连宝生物工程有限公司; Real-time quantitive PCR试剂盒购自大连宝生物工程有限公司; 辣根过氧化物酶标记的羊抗兔IgG抗体购自美国Santa Cruz公司.
1.2.1 HSC细胞分离、培养: 参照宋少刚等[6]报道的方法分离HSC. 大鼠麻醉后行门静脉插管, 连续灌流0.1%链霉蛋白酶(15 min)及0.015%Ⅳ型胶原酶(40 min); 然后取下软化肝脏并剪碎, 用混合酶消化液(含链霉蛋白酶、Ⅳ型胶原酶及DNA酶Ⅰ)消化30 min, 过滤、离心、洗涤后的细胞悬液经18%Nycodenz(按Nycodenz:细胞悬液 = 2:1比例)密度梯度离心(1500 g, 20 min, 4 ℃), 吸取界面处的细胞悬浮于200 mL胎牛血清DMEM培养液中, 以1×106/mL的浓度接种在培养皿里, 在37 ℃、50 mL/L CO2条件下进行培养, 10-14 d形成细胞单层后传代, 在传代过程中弃去贴壁牢固的未消化下来的细胞(多为枯否细胞), 由此纯化HSC. 本次实验采用传2-4代HSC, 待细胞生长融合至70%左右, 加入不同浓度的AngⅡ(0、10-8、10-7、10-6 moL/L)孵育24 h, 然后进行后续实验. 每种实验均选取3组非同代细胞进行.
1.2.2 上清液TGF-β1测定: 采用双抗体夹心ELISA方法进行检测. 细胞接种于96孔培养板内, 待细胞生长融合至70%左右, 换含50 mL/L血清培养液继续培养24 h, 加入含预定浓度的AngⅡ孵育24 h, 收集上清液-20 ℃冰冻保存待检. TGF-β1检测严格按照说明书进行: 简言之于相应反应板孔中加入100 μL标准品或100 μL标本, 37 ℃温育60 min; 洗涤5次; 然后每孔加入100 μL 1×Biotin, 37 ℃温育60 min; 洗涤5次; 再每孔加入100 μL 1×HRP, 37 ℃温育30 min; 洗涤5次; 最后每孔加入100 μL TMB显色液, 37 ℃暗处温育20 min, 加入终止液, 30 min内在全自动酶标仪上450 nm处读取A值.
1.2.3 p38 MAPK Western blot: (1)蛋白定量: 将已加入含预定浓度的AngⅡ孵育24 h后的细胞用冰PBS洗3遍, 加入Western蛋白裂解液(0.5 mL/5×106细胞)冰上裂解细胞20 min, 4 ℃离心12000 g 15 min, 取上清移入Eppendorf管内, 采用BCA法对蛋白样品进行定量; (2)免疫沉淀: 用PBS将定量后样品调成相同蛋白浓度(2 mg/mL); 取0.5 mL细胞裂解产物, 加入100 mL 50%Sepharose-4B protein G, 4 ℃轻摇30 min; 12000 g 4 ℃离心10 min, 取上清加入抗p38 MAPK抗体(1 mg/200 μg蛋白), 4 ℃轻摇孵育过夜; 再加入100 μL 50%Sepharose-4B protein G, 4 ℃轻摇120 min, 12000 g 4 ℃离心5 s收集琼脂糖珠; 向琼脂糖珠中加入洗涤缓冲液800 μL, 4 ℃轻摇20 min; 反复洗涤3次, 离心收集琼脂糖珠, 加入2×SDS蛋白上样缓冲液60 μL, 沸水煮5 min, 离心收集上清; (3)Western blot: 取免疫沉淀后的上清20 μL进行8%SDS-PAGE凝胶电泳, 电压100 V, 150 min; 电泳后将蛋白转至PVDF膜上, 200 mA, 2 h; TBS洗5 min, 脱脂奶粉封闭2 h, TTBS洗5 min×2, 加入多克隆兔抗p38 MAPK抗体(1:1000)4 ℃过夜, TTBS洗5 min×3, 加入辣根过氧化物酶标记的羊抗兔-IgG抗体(1:10000)室温2 h, TTBS洗5 min×3, ECL显色. 结果应用天能图像分析系统进行分析, 以对照组p38 MAPK含量为1, 其他组与之比较.
1.2.4 p38 MAPK抑制剂SB203580对HSC增殖、TGF-β1、α1(Ⅰ)、α1(Ⅳ)型胶原表达的影响: 生长良好的HSC细胞分为3组, 一组加入不含AngⅡ的DMEM培养液; 一组加入含10-6 mol/L AngⅡ的DMEM培养液; 最后一组应用含5 μmol/L SB203580的DMEM培养液孵育30 min后, 再加入10-6 mol/L AngⅡ, 细胞继续培养24 h后, 检测上清液TGF-β1含量, 并应用MTT法检测HSC增殖, 实时定量PCR方法检测HSC细胞内α1(Ⅰ)、α1(Ⅳ)型胶原mRNA的表达情况.
统计学处理 应用SPSS13.0软件进行统计学分析. 所有数据均以mean±SD表示, 采用单因素方差分析(AVONA)的LSD方法对各组间数据进行比较.
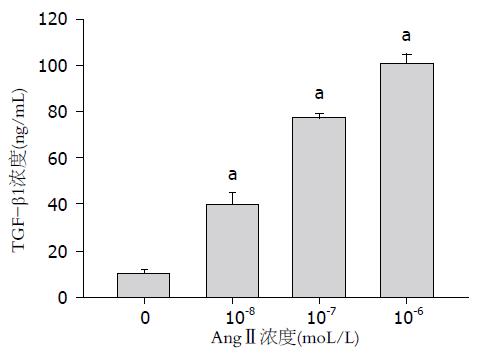
正常情况下, HSC细胞能够分泌较低浓度的TGF-β1(10.6 ng/mL±0.98 ng/mL), 加入10-8、10-7、10-6 moL/L AngⅡ刺激后, TGF-β1浓度明显升高, 分别达(39.8 ng/mL±5.12 ng/mL, 77.4 ng/mL±1.88 ng/mL,100.8 ng/mL±3.67 ng/mL), 与对照组相比差异具有统计学意义(P<0.0005)(图1).
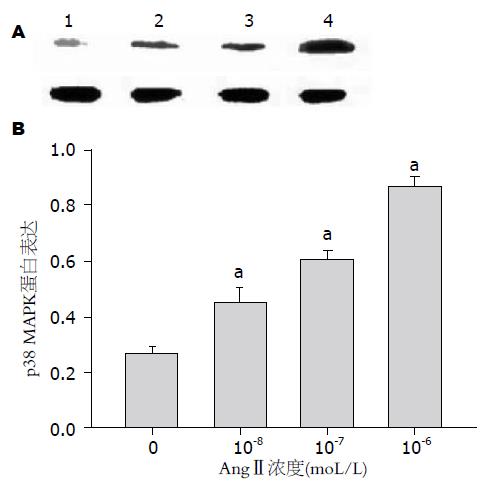
Western blot结果显示p38丝裂原活化蛋白激酶(p38 MAPK)在38 kDa处存在特异性蛋白条带. 对各条带进行半定量分析发现, 10-8、10-7、10-6 moL/L AngⅡ作用24 h后, p38 MAPK蛋白的相对含量分别为(0.45±0.052, 0.61±0.026, 0.87±0.032), 与正常对照组(0.27±0.020)相比具有明显的统计学差异(P<0.0005)(图2).
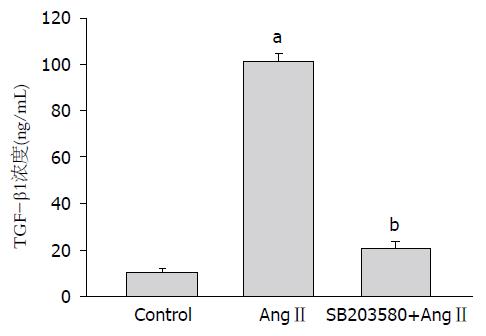
与正常对照组(10.6 ng/mL±0.98 ng/mL)相比, 10-6moL/L AngⅡ作用24 h后能够明显促进HSC细胞分泌TGF-β1(100.8 ng/mL±3.67 ng/mL), 两者相比差异具有统计学意义(P<0.0005); 加入SB203580预先阻断p38 MAPK活性后, AngⅡ引起的HSC分泌TGF-β1浓度明显下降(21.07 ng/mL±2.08 ng/mL), 与未加入SB203580相比差异具有统计学意义(P<0.0005). 说明p38 MAPK是TGF-β1的上游信号分子(图3).
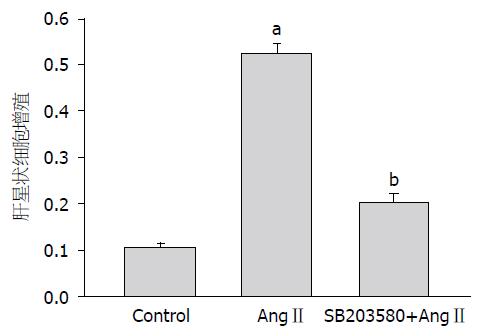
与正常对照组(0.1073±0.0093)相比, 10-6 moL/L AngⅡ作用24 h后能够明显促进HSC增殖(0.5233±0.0240, P<0.0005); 加入SB203580预先阻断p38 MAPK通路后, AngⅡ引起的促HSC增殖作用明显下降(0.2033±0.0176), 与未加入SB203580相比有明显的统计学差异(P<0.0005). 说明AngⅡ的促HSC增殖作用是通过p38 MAPK通路介导的(图4).
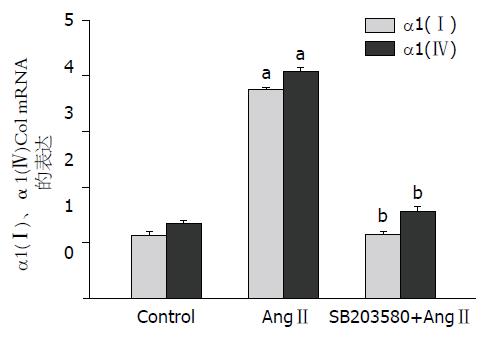
以GAPDH基因为参照物, 对α1(Ⅰ)、α1(Ⅳ)Col基因进行定量分析结果发现: 10-6 moL/L AngⅡ作用24 h后, α1(Ⅰ)、α1(Ⅳ)Col mRNA为(3.74±0.047, 4.07±0.072), 明显高于正常对照组(1.13±0.053,1.35±0.035), 两者比较差异具有统计学意义(P<0.0005); 加入SB203580预先抑制p38 MAPK活性后, α1(Ⅰ)、α1(Ⅳ)Col mRNA为(1.16±0.024, 1.56±0.075), 明显低于未加入SB203580组(P<0.0005). 这些结果提示AngⅡ上调HSCα1(Ⅰ)、α1(Ⅳ)Col mRNA表达需要p38 MAPK的作用(图5).
肝纤维化的形成机制中, HSC活化是公认的中心环节. 其活化后向肌成纤维细胞转变, 可分泌大量细胞外基质成分, 包括Ⅰ、Ⅲ型胶原、透明质酸和层黏连蛋白, 同时使胶原酶活性下降, 胶原降解减少, 造成细胞外基质产生与降解失平衡, 纤维化形成[7]. HSC活化和增殖与多种细胞因子有关, 比较重要的有TGF-β和血小板源性生长因子[8]. 近年来研究表明肝纤维化时血清和肝组织局部的AngⅡ水平明显升高, 与肝纤维化程度密切相关[9], 而且HSC细胞表面表达AngⅡ受体AT1R[10], 这些证据提示AngⅡ具有促进HSC活化和增殖的作用.
我们前期在酒精性肝纤维化的动物实验中亦发现[9], 肝内存在局部肾素-血管紧张素-醛固酮系统, 肝纤维化进程中肝内AngⅡ明显升高, 并且血管紧张素转换酶抑制剂类药物可以阻止酒精性肝纤维化的进展, 这些结果说明AngⅡ是重要的促纤维化因子. 进一步我们发现AngⅡ可以促进离体的HSC活化、增殖, 合成和分泌胶原增加, 提示HSC是AngⅡ作用的靶细胞. 本文中我们进一步明确AngⅡ调控HSC功能的信号通路, 以期为基因治疗提供靶位点.
目前关于AngⅡ调节HSC功能的机制已经有了一定的认识, 认为AngⅡ的促HSC增殖作用依赖于TGF-β1[11-14]. 这一观点有下列证据: (1)AngⅡ可以直接刺激体外培养的血管平滑肌细胞、心肌细胞表达TGF-β1, 给离体肾脏灌注AngⅡ也可以明显增强TGF-β1的产生和活性, 其后发现AngⅡ可以上调TGF-β1的mRNA在HSC内的表达[15]; (2)AngⅡ可以通过PA/PAI系统切掉潜活相关肽, 使潜活TGF-β1变成具有生物活性的TGF-β1; (3)AngⅡ可上调体外培养的血管平滑肌细胞TGF-β1受体的表达; (4)AngⅡ与TGF-β1可互相调节彼此的表达, TGF-β1能引起近肾小球细胞释放肾素, 进一步转化为AngⅡ又可促进TGF-β1的合成, 这是一种正反馈效应. 本实验中我们亦检测了AngⅡ对培养HSC细胞上清液中TGF-β1浓度的影响. 结果表明: 10-8 moL/L AngⅡ即可促进HSC分泌TGF-β1, 10-6 moL/L AngⅡ的这种作用更加明显, 提示TGF-β1是AngⅡ调控HSC细胞功能的下游效应分子.
AngⅡ发挥作用必须首先与HSC细胞膜上的受体结合, 现已证实AT1R为HSC细胞膜上表达的AngⅡ受体. 那么AngⅡ与HSC细胞膜上的AT1R结合后, 是通过哪种信号分子促进HSC合成TGF-β1的尚不清楚. AT1R的受体后信号通路涉及MAPK, 因此我们检测了AngⅡ对体外培养的HSC细胞内p38 MAPK蛋白表达的影响, 并应用p38 MAPK特异性阻断剂SB203580验证p38 MAPK在AngⅡ调节HSC细胞功能中的作用.
结果表明: 10-8 moL/L AngⅡ即可促进HSC细胞表达p38 MAPK蛋白, 10-6 moL/L AngⅡ的这种作用更加明显, 提示p38 MAPK可能在AngⅡ调节HSC细胞功能方面发挥作用. 进一步应用p38 MAPK抑制剂SB203580预先阻断p38 MAPK活性, 结果表明: SB203580能够明显抑制AngⅡ引起的促HSC增殖作用, 降低α1(Ⅰ)、α1(Ⅳ)型胶原mRNA的表达, 并且由AngⅡ引起的促HSC分泌TGF-β1作用亦可被SB203580阻断. 这些结果说明AngⅡ通过p38 MAPK通路促进HSC分泌TGF-β1, 进而增加HSC活化以及细胞外基质合成.
肝星状细胞活化(hepatic stellate cell, HSC)是肝纤维化形成的中心环节. 多种细胞因子参与HSC活化及增殖调节. 近年研究证实血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)作为一种强烈的促有丝分裂原, 也能够刺激HSC的活化与增殖, 但是具体的作用机制尚不十分清楚.
高润平, 教授, 吉林大学第一医院肝胆胰内科; 姚鹏, 副教授, 北京军区总医院全军肝病中心
关于AngⅡ调控HSC增殖的热点主要集中在相应的信号通路研究, 尤其是近年来提出了ACE-AngⅡ-AT1R受体轴与ACE2-Ang(1-7)-Mas受体轴相互拮抗学说. 有哪些信号途径参与了AngⅡ的促纤维化作用, 临床应用AngⅡ及其相关信号分子拮抗剂是否能够阻断肝纤维化的发生, 是目前亟待解决的问题.
杨玲等应用体外培养HSC, 在不同浓度的ANGⅡ作用下, 观察HSC的生长增殖情况以及对细胞迁移的影响. 结果发现ANGⅡ能够促进HSC增殖, 并且诱导HSC迁移, 认为这是ANGⅡ促进肝纤维化发生的主要原因.
目前国内关于AngⅡ促进肝纤维化的研究多缺乏分子水平的深入研究, 国外对AngⅡ促进肝纤维化的受体后信号通路有所涉猎. 本文重点研究了途径在AngⅡ促进HSC活化增殖以及促进转化生长因子-β1(transforming growth factor-β1, TGF-β1)、α1(I)、α1(Ⅳ)型胶原表达中的作用, 为临床抗纤维化治疗提供更多的靶点.
本文发现p38 MAPK是AngⅡ促进HSC活化增殖的重要信号分子. 据此可开发相应信号分子拮抗制剂或基因产品应用于临床, 抑制肝纤维化的形成和进展.
丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases, p38 MAPK): 生物体内重要的信号转导系统之一, 参与介导生长、发育、分裂、分化、死亡以及细胞间的功能同步等多种细胞过程. 在哺乳动物细胞中已发现和克隆了ERK、JNK/SAPK、p38/RK、ERK5/BMK1 4个MAPK亚族. p38 MAPK是MAPK家族的重要组成部分.
本文通过检测AngⅡ对HSC细胞内TGF-β1、p38 MAPK表达的影响, 并应用p38 MAPK抑制剂进一步明确该信号通路在AngⅡ调控HSC功能中的作用, 具有一定的新颖性, 具有一定指导意义.
编辑: 田滢 电编: 闫晋利
| 1. | Grace JA, Herath CB, Mak KY, Burrell LM, Angus PW. Update on new aspects of the renin-angiotensin system in liver disease: clinical implications and new therapeutic options. Clin Sci (Lond). 2012;123:225-239. [PubMed] [DOI] |
| 2. | Pereira RM, dos Santos RA, da Costa Dias FL, Teixeira MM, Simões e Silva AC. Renin-angiotensin system in the pathogenesis of liver fibrosis. World J Gastroenterol. 2009;15:2579-2586. [PubMed] [DOI] |
| 3. | Yu FJ, Dong PH, Fan XF, Lin Z, Chen YP, Li J. Down-regulation of angiotensin II by shRNA reduces collagen synthesis in hepatic stellate cells. Int J Mol Med. 2010;25:801-806. [PubMed] |
| 4. | Kato J, Koda M, Kishina M, Tokunaga S, Matono T, Sugihara T, Ueki M, Murawaki Y. Therapeutic effects of angiotensin II type 1 receptor blocker, irbesartan, on non-alcoholic steatohepatitis using FLS-ob/ob male mice. Int J Mol Med. 2012;30:107-113. [PubMed] [DOI] |
| 5. | Moreno M, Bataller R. Cytokines and renin-angiotensin system signaling in hepatic fibrosis. Clin Liver Dis. 2008;12:825-852, ix. [PubMed] [DOI] |
| 6. | 宋 少刚, 杨 雁, 陈 敏珠. 大鼠肝贮脂细胞、枯否细胞的同时分离和培养. 中国临床药理学与治疗学. 2000;5: 351-353. |
| 7. | Iwaisako K, Brenner DA, Kisseleva T. What's new in liver fibrosis? The origin of myofibroblasts in liver fibrosis. J Gastroenterol Hepatol. 2012;27 Suppl 2:65-68. [PubMed] [DOI] |
| 8. | Wu MS, Liao CW, Du WY, Kao TC, Su KE, Lin YH, Chang CC, Fan CK. Enhanced expression of transforming growth factor-beta 1 in inflammatory cells, alpha-smooth muscle actin in stellate cells, and collagen accumulation in experimental granulomatous hepatitis caused by Toxocara canis in mice. Acta Trop. 2008;105:260-268. [PubMed] [DOI] |
| 10. | Lu P, Liu H, Yin H, Yang L. Expression of angiotensinogen during hepatic fibrogenesis and its effect on hepatic stellate cells. Med Sci Monit. 2011;17:BR248-BR256. [PubMed] [DOI] |
| 11. | Oka T, Komuro I. [Molecular and cellular mechanisms of organ fibrosis]. Nihon Rinsho. 2012;70:1510-1516. [PubMed] |
| 12. | Rosin NL, Falkenham A, Sopel MJ, Lee TD, Légaré JF. Regulation and role of connective tissue growth factor in AngII-induced myocardial fibrosis. Am J Pathol. 2013;182:714-726. [PubMed] [DOI] |
| 13. | Chou CH, Chuang LY, Lu CY, Guh JY. Interaction between TGF-β and ACE2-Ang-(1-7)-Mas pathway in high glucose-cultured NRK-52E cells. Mol Cell Endocrinol. 2013;366:21-30. [PubMed] [DOI] |
| 14. | Hidaka H, Nakazawa T, Shibuya A, Minamino T, Takada J, Tanaka Y, Okuwaki Y, Watanabe M, Koizumi W. Effects of 1-year administration of olmesartan on portal pressure and TGF-beta1 in selected patients with cirrhosis: a randomized controlled trial. J Gastroenterol. 2011;46:1316-1323. [PubMed] [DOI] |
| 15. | Moreno-Alvarez P, Sosa-Garrocho M, Briones-Orta MA, González-Espinosa C, Medina-Tamayo J, Molina-Jijón E, Pedraza-Chaverri J, Macías-Silva M. Angiotensin II increases mRNA levels of all TGF-beta isoforms in quiescent and activated rat hepatic stellate cells. Cell Biol Int. 2010;34:969-978. [PubMed] [DOI] |