修回日期: 2013-03-31
接受日期: 2013-04-12
在线出版日期: 2013-05-18
目的: 通过Raf激酶抑制蛋白(Raf kinase inhibitor protein, RKIP)过表达腺病毒感染肝星状细胞(hepatic stellate cells, HSC), 模拟肝纤维化病理状态下细胞外基质(extracellular matrix, ECM)成分的改变, 探讨RKIP对HSC黏附功能的影响.
方法: 实验共分两组, 分别是RKIP过表达组(RKIP-AD)和阴性对照组(GFP-AD). 首先确定细胞感染病毒的最适感染强度(multiplicity of infection, MOI)值, 在倒置荧光显微镜下观察细胞状态, 计数细胞荧光数, 筛选出最适MOI值. Western blot方法确定病毒感染后验证外源RKIP在细胞内表达情况. 已干预好的细胞稀释成1.0×105/mL的浓度种在盖玻片和已准备好的由matrigel、Ⅰ型胶原及纤维连接蛋白包被的24孔板中, 37 ℃培养1 h后, 甲醛固定, 结晶紫染色. 200×纤维镜下观察并计数黏附的细胞数, 资料数据以mean±SD表示, 采用t检验进行统计分析.
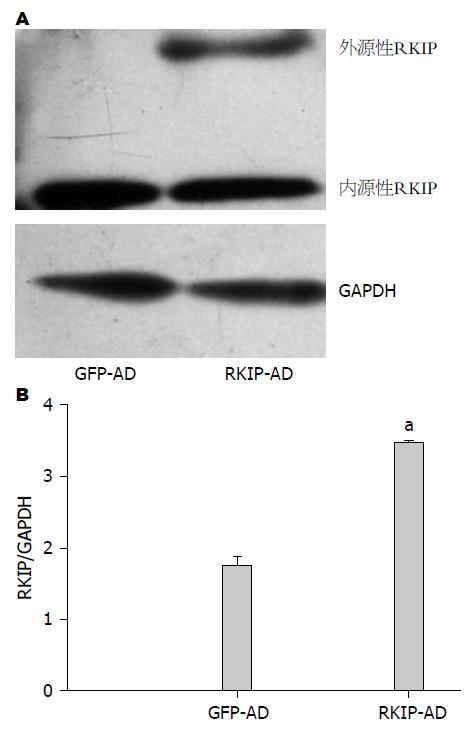
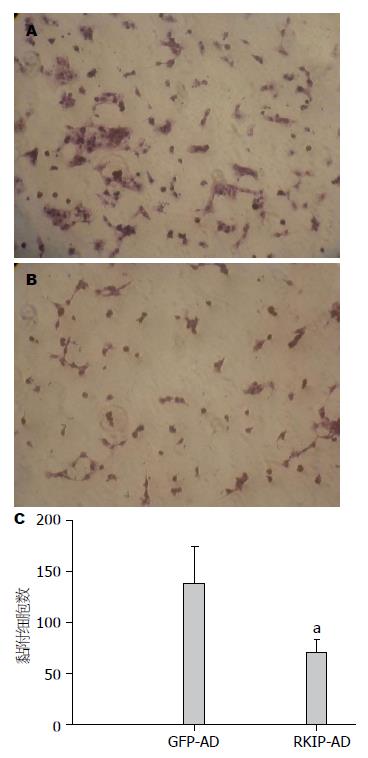
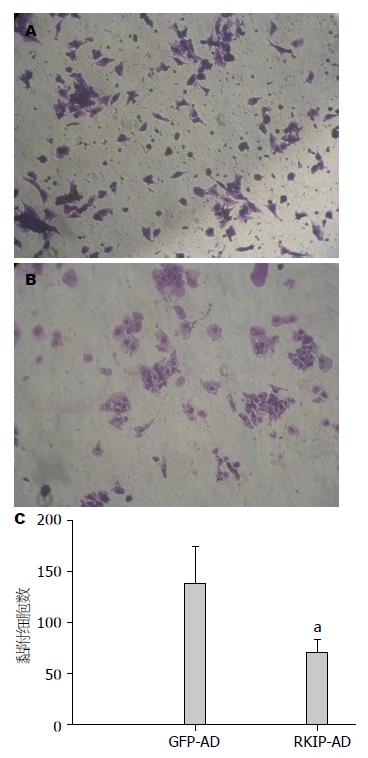
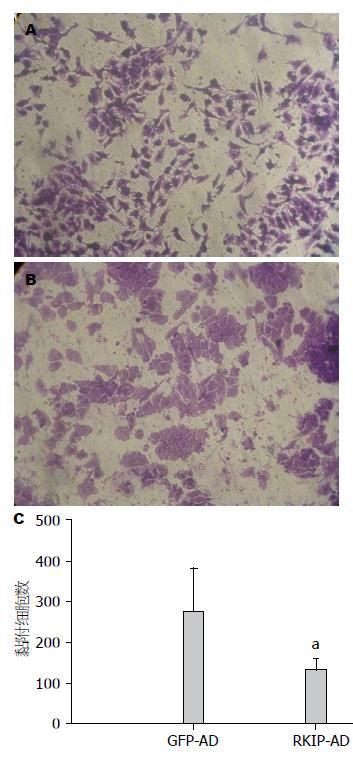
结果: 人源HSC细胞株LX-2的腺病毒载体感染率可达到80%-90%, 适宜的MOI值为5. RKIP过表达组较对照组蛋白表达增多(3.47±0.02 vs 1.74±0.13, P<0.05). 与GFP-AD对照组相比, RKIP在HSC的过表达抑制细胞在matrigel上的黏附(80±14 vs 152±42, P<0.05). 与GFP-AD对照组相比, RKIP在HSC的过表达抑制细胞在Ⅰ型胶原上的黏附(70±13 vs 138±36, P<0.05). 与GFP-AD对照组相比, RKIP在HSC的过表达抑制细胞在纤维连接蛋白上的黏附(133±27 vs 276±106, P<0.05).
结论: 体外过表达RKIP可以抑制HSC在胶原基质上的黏附.
核心提示: 慢性损伤伴随着肝细胞再生及基质重塑, Raf激酶抑制蛋白(Raf kinase inhibitor protein, RKIP)可以明显减少肝星状细胞(hepatic stellate cells, HSC)在细胞外基质matrigel、Ⅰ型胶原和纤维连接蛋白上黏附的细胞数. RKIP过表达后HSC在与细胞外基质黏附能力下降伴其迁移能力增加, 因此慢性肝损伤的部位可以有大量HSC聚集.
引文著录: 马俊骥, 赵慧, 姜慧卿. RKIP过表达对肝星状细胞在细胞外基质上黏附的抑制. 世界华人消化杂志 2013; 21(14): 1303-1308
Revised: March 31, 2013
Accepted: April 12, 2013
Published online: May 18, 2013
AIM: To investigated the role of Raf kinase inhibitor protein (RKIP) in the adhesion of hepatic stellate cells (HSCs) to extracellular matrix (ECM).
METHODS: HSCs (LX-2 cell line) were cultured and infected with an adenovirus vector carrying RKIP (RKIP-AD) or the control adenovirus vector (GFP-AD). Green fluorescence was detected under an inverted fluorescence microscope to assess the infection efficiency. The number of virus particles required was calculated as the cell count × multiplicity of infection (MOI). RKIP protein expression was investigated by Western blot. Infected cells were adjusted to a density of 1×105 cells/mL, plated in dishes cultured with matrigel, type I collagen, and fibronectin. LX-2 cells were cultured for 1 h in a humidified atmosphere of 5% CO2 and 95% air at 37 ℃. The cells were fixed in 4% paraformaldehyde and stained with crystal violet. Cells in each field were viewed under light microscopy and positively stained cells were counted.
RESULTS: The infection efficiency of RKIP-AD or GFP-AD reached 80%-90%. Adenovirus-mediated gene transfection at a MOI of 5 was employed for subsequent experiments. In the RKIP-AD group, RKIP expression was significantly higher than that in the control group (3.47 ± 0.02 vs 1.74 ± 0.13, P < 0.05). RKIP overexpression reduced the number of HSC adhered to matrigel (80 ± 14 vs 152 ± 4, P < 0.05), type I collagen (70 ±13 vs 138 ± 36, P < 0.05) and fibronectin (133 ± 27 vs 276 ± 106, P < 0.05) compared to the control group.
CONCLUSION: RKIP overexpression inhibits HSC adhesion to ECM.
- Citation: Ma JJ, Zhao H, Jiang HQ. RRKIP overexpression inhibits hepatic stellate cell adhesion to extracellular matrix. Shijie Huaren Xiaohua Zazhi 2013; 21(14): 1303-1308
- URL: https://www.wjgnet.com/1009-3079/full/v21/i14/1303.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i14.1303
肝纤维化是各种不同致病因子引起慢性肝病进而发展为肝硬化的共同病理改变, 即肝脏细胞外基质(extracellular matrix, ECM)过度合成与异常沉积[1]. 病毒性肝炎、酒精性脂肪肝、非酒精性脂肪肝、药物损伤、自身免疫性肝炎和原发性胆汁性肝硬化等是引起肝损伤常见原因[2]. 肝星状细胞(hepatic stellate cells, HSC)在正常肝脏占肝脏细胞数量的5%-10%, 定居在Disse间隙, HSC在肝损伤后活化形成成纤维样细胞, 是合成ECM和参与纤维化过程最主要的细胞成分, 他的激活是肝纤维化发生的中心环节[3,4]. 我们前期研究发现Raf激酶抑制蛋白(Raf kinase inhibitor protein, RKIP)在肝脏纤维化组织表达下降, 随着HSC的活化RKIP表达也明显降低, RKIP可以促进HSC迁移[5,6]. 迁移能力与细胞的黏附力是有关的, RKIP究竟在HSC与ECM间黏附过程中起着什么样的作用, 目前尚不清楚.
HSC细胞株人LX-2经美国Friedman教授授权由美国Mount Sinai医科大学惠赠. RKIP-AD为携带RKIP基因并表达绿色荧光蛋白(green fluorescent protein, GFP)的重组腺病毒, GFP-AD是仅表达GFP的腺病毒RKIP-AD作为对照.
1.2.1 细胞培养和病毒感染分组: 将保存于液氮中的LX-2细胞株取出, 立即37 ℃水浴复苏, 于超净工作台中加2 mL的0%DMEM培养基, 1200 g离心5 min, 以10%FBS、100 IU/mL青霉素、100 µg/mL链霉素、4 mmol/L谷氨酰胺及1 mol/L HEPES的DMEM培养基稀释成1×106/mL的浓度接种于75 cm2培养瓶中, 37 ℃、5%CO2条件的培养箱中培养. 当生长至致密单层时, 用0.25%胰蛋白酶消化, 以1:4传代, 24 h换液1次, 72 h再次培养传代. 病毒感染HSC的分组: (1)RKIP-AD重组腺病毒组, 在HSC内表达外源RKIP和GFP基因; (2)GFP-AD对照组, 在HSC内表达外源GFP基因. 将LX-2细胞以每孔3000个接种于96孔板中, 但细胞生长至90%左右时, RKIP-AD重组腺病毒或者GFP-AD腺病毒按最适感染强度(multiplicity of infection, MOI)值分别为5、10、15、20来干预细胞, 每种MOI设10个复孔, 分别于12、24、48 h于荧光显微镜下观察细胞状态, 并计数荧光数.
1.2.2 Western blot: 取腺病毒干预的LX-2细胞, 弃去上清, 冰冷的PBS漂洗两遍, 加入1 mL PBS液, 细胞刮刀将细胞刮下, 移入Eppendorf管中, 4 ℃ 3000 g离心10 min. 弃上清, 加入150 μL改良的RIPA裂解缓冲液, 微型混合器上充分振荡, 冰上静置裂解30 min, 4 ℃ 10000 g离心10 min, 取上清用Braford法测总蛋白含量. 按每孔80 μg计算样品的上样量, 将蛋白样品与上样缓冲液以4:1的比例混匀, 煮沸5 min加在上样孔中, 进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE), 分离胶的浓度为12%. 用0.22 μm PVDF膜进行冰浴转膜, 取出膜用5%脱脂奶粉在室温下封闭4 h. 4 ℃下一抗封闭过夜. 二抗室温封闭2 h. 在暗室中滴加ECL试剂反应3 min, 曝光、显影和定影. 显影条带经香港基因公司G: BOX凝胶成像分析仪采集后, 用美国NIH ImageJ 1.38软件进行定量分析. RKIP以GAPDH作为内参照, 结果以目的条带和内参照的光密度百分比来表示.
1.2.3 黏附试验: (1)matrigel的配制: 用无Ca2+、Mg2+的0%DMEM稀释为50 μg/mL备用, 冰上操作; (2)Ⅰ型胶原的配制: 用无菌10×PBS、dH2O和1N NaOH稀释成50 μg/mL, 冰上操作; (3)纤维连接蛋白: 用无血清、Ca2+、Mg2+的0% DMEM稀释为50 μg/mL备用, 冰上操作; (4)包被孔板: 在超净工作台上, 取配置好的基质胶以200 μL/孔均匀平铺于24板内, 每组设3个复孔, 置于4 ℃冰箱中过夜. 之后用无菌PBS洗去多余的基质胶, 每孔加入0.5%的BSA 200 μL室温孵育30 min, 无菌PBS漂洗3遍备用; (5)将RKIP-AD重组腺病毒或者GFP-AD腺病毒感染的细胞从培养箱中取出, 弃上清, 以0.25%的胰蛋白酶消化至细胞松散后, 弃去消化液, 加入3 mL的0%DMEM培养基, 制成单细胞悬液计数后稀释成1×105/mL的浓度. 将细胞悬液接种在包被好的24孔板内, 每孔接种1 mL, 置于37 ℃、5%CO2培养箱中孵育1 h后取出培养板, 吸去上清, 无菌PBS洗去未黏附的细胞, 4%多聚甲醛固定30 min, PBS漂洗后, 结晶紫染色15 min, 在200倍显微镜下随机选取12个不同视野计数细胞数, 并采集图片.
统计学处理 计量资料数据均以mean±SD表示, 用SPSS13.0软件进行统计分析, 两组间均数差异性比较采用t检验, P<0.05具有统计学意义.
LX-2感染腺病毒12 h后, 荧光显微镜下观察含荧光的细胞数较少. 24 h后MOI值为20的感染细胞几乎全部死亡, 胞体碎裂, MOI值为15的感染细胞折光性较差, 胞质减少, 胞核固缩, 少数细胞碎裂. 48 h后MOI值为10的细胞状态也较差, MOI值为5的细胞折光性强, 胞质饱满, 核质清晰, 计数荧光个数, 荧光感染率在80%-90%左右. 故适宜的MOI值为5, 感染时间为48 h. 与GFP-AD组相比, RKIP-AD组在49 kDa出现一条外源性RKIP条带, 过表达组较对照组RKIP蛋白表达量明显增多(3.47±0.02 vs 1.74±0.13, P<0.05)(图1).
matrigel基质胶是一种可溶性基底膜基质, 在matrigel上培养的细胞有着类似体内环境的良好分化表现, RKIP过表达组和对照组相比, 并没有明显的影响细胞的伸展. 但是与GFP-AD组相比, RKIP-AD感染的LX-2细胞在matrigel上黏附的细胞数明显减少(80±14 vs 152±42, P<0.05)(图2).
Ⅰ型胶原是在肝纤维化时增多最明显的胶原, 属于纤维胶原, 原纤维排列成粗大的束状, 抗张能力强, 与GFP-AD组相比, RKIP-AD感染的LX-2细胞在Ⅰ型胶原上黏附的细胞数明显减少(70±13 vs 138±36, P<0.05)(图3).
肝窦状腺内皮细胞生成的纤维连接蛋白薄片早期变化能够激活HSC, 本研究显示GFP-AD感染的LX-2细胞在纤维连接蛋白上黏附后细胞伸展性较好, RKIP-AD感染的LX-2细胞在纤维连接蛋白上黏附的细胞形态多为圆形. 与GFP-AD组相比, RKIP-AD组黏附的细胞数明显减少(133±27 vs 276±106, P<0.05)(图4).
肝纤维化是很多慢性肝病发展至肝硬化乃至肝癌的必经阶段, 因而肝纤维化的逆转一直是科学研究的永恒主题和终极目标. 20世纪前期认为硬化不是慢性过程, 而是疾病最终结果, 这无疑忽视了伴随慢性损伤而发生的肝细胞再生及基质重塑这一过程. 到1970年, Popper等[7]强调了酶学过程在纤维化逆转中的重要性, 使人们认识到由于慢性肝损伤而产生的纤维瘢痕是可以被吸收的. 到1979年, Pérez-Tamayo[8]在强有力的实验证据和临床证据支持下提出了肝纤维化是可逆转的. 细胞外基质与HSC相互作用的研究将为逆转肝纤维化提供理论依据.
在研究HSC黏附功能时就不得不考虑ECM的影响. 肝纤维化特征性病理改变即是肝脏内ECM异常沉积[9]. ECM主要包括胶原、非胶原糖蛋白和蛋白多糖. 在肝纤维化形成过程中, 已发现非胶原糖蛋白如纤维连接蛋白、层黏连蛋白、腱生蛋白、分层蛋白、巢蛋白和透明质酸表达增加, 而一些蛋白多糖成分如肝素、皮肤素、硫酸软骨素、基底膜蛋白多糖、核心蛋白多糖等过度沉积; 而与肝纤维化关系最密切的是Ⅰ型的沉积, 随着肝纤维化的发生, Ⅰ型胶原从基因表达和蛋白水平上都明显增加[10]. 肝窦状腺内皮细胞和HSC拥有共同的胚胎起源, 由肝窦状腺内皮细胞生成的纤维连接蛋白薄片早期变化能够激活HSC[11]. 细胞外基质过度沉积导致肝脏正常组织结构和功能破坏, 最终导致病理性的异常改变. 在本实验过程中matrigel基质胶用来模拟ECM, Ⅰ型胶原和纤维连接蛋白作为两个代表性的基质组分.
我们前期利用BDL肝纤维化动物模型和HSC体外培养, 采用Western blot方法研究发现, 作为Raf-1/MEK/ERK1,-2信号通路的重要调节分子, RKIP在肝脏纤维化组织表达下降, 随着HSC的活化, RKIP的表达也明显降低. 我们用MTT、transwell和伤口愈合实验方法证明, RKIP可以抑制HSC细胞增殖, 但却促进其迁移[5,6]. 在本次研究中通过RKIP过表达腺病毒载体感染HSC, 感染效率高, 表达稳定. 我们发现RKIP可以明显减少HSC在细胞外基质上的黏附数, 这可能是因为RKIP过表达后HSC与ECM及其相应组分胶原Ⅰ和纤维连接蛋白之间的连接能力而产生的效应. 也有可能是因为RKIP通过调节Raf-1/MEK/ERK和核因子κB(nuclear factor κB, NF-κB)等信号通路进而影响了基质代谢相关酶产生的作用. RKIP的分子量为23 kDa, 具有与磷脂酰乙醇胺结合的特性[12]. 1999年Yeung等[13]利用酵母双杂交法研究发现RKIP可以干扰Raf-1的激活, 进而负向调节Raf/MEK/ERK信号通路. 后续又有大量研究法现RKIP还可以通过G蛋白偶联受体(G protein-coupled receptor, GPCR)介导的信号通路及NF-κB信号通路来发挥其调节作用[14]. 2009年, Dangi-Garimella等[15]又研究发现, RKIP的调节细胞迁移的功能与Let-7有关. 因此结合前期的研究结果, 我们推断RKIP作为多条信号通路调节因子, 在调节HSC迁移黏附过程中也发挥特有的功效.
总之, 我们认为RKIP在肝纤维化形成过程中可以抑制HSC在细胞外基质上的黏附功能. HSC在与细胞外基质黏附能力下降的同时其迁移能力可以相应增加, 此有利于大量HSC在慢性肝损伤部位的迁移、黏附和聚集, 因而RKIP对HSC黏附能力影响的研究可以为阐述肝纤维化形成机制提供新的理论依据, 从而指导肝纤维化的防治工作.
肝纤维化是各种不同致病因子引起慢性肝病进而发展为肝硬化的共同病理改变, 即肝脏细胞外基质(extracellular matrix, ECM)过度合成与异常沉积. 引起慢性肝损伤的常见原因包括病毒性肝炎、酒精性脂肪肝、非酒精性脂肪肝、药物损伤、自身免疫性肝炎和原发性胆汁性肝硬化等.
李涛, 副主任医师, 北京大学人民医院肝胆外科
肝星状细胞(hepatic stellate cells, HSC)在正常肝脏占肝脏细胞数量的5%-10%, 定居在Disse间隙, HSC在肝损伤后活化形成成纤维样细胞, 是合成ECM和参与纤维化过程最主要的细胞成分, 他的激活是肝纤维化发生的中心环节. HSC增殖、凋亡、黏附和迁移等生物活性的研究是此研究领域的热点和重点.
Raf激酶抑制蛋白(Raf kinase inhibitor protein, RKIP)在肝脏纤维化组织表达下降, 随着HSC的活化RKIP表达也明显降低, RKIP可以促进HSC迁移. RKIP可以干扰Raf-1的激活, 进而负向调节Raf/MEK/ERK信号通路, 还可以通过G蛋白偶联受体(G protein-coupled receptor, GPCR)介导的信号通路及核因子κB(nuclear factor κB, NF-κB)信号通路来发挥其调节作用.
本文通过RKIP过表达腺病毒感染肝星状细胞细胞株LX-2, 同时用matrigel、Ⅰ型胶原和纤维连接蛋白模拟肝纤维化病理状态下ECM成分的改变, 研究发现体外过表达RKIP可以抑制HSC在胶原基质上的黏附功能.
结合前期RKIP对HSC迁移功能的影响研究, 我们认为HSC在与细胞外基质黏附能力下降的同时其迁移能力可以相应增加, 此有利于大量HSC在慢性肝损伤部位的迁移、黏附和聚集, 因而RKIP对HSC黏附能力影响的研究可以为阐述肝纤维化形成机制提供新的理论依据, 从而指导肝纤维化的防治工作.
本文设计合理, 方法可行, 结果可信, 讨论恰当, 统计学方法正确, 学术价值较高.
编辑: 田滢 电编: 闫晋利
| 1. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 2. | Wells RG. The role of matrix stiffness in regulating cell behavior. Hepatology. 2008;47:1394-1400. [PubMed] [DOI] |
| 3. | Olsen AL, Bloomer SA, Chan EP, Gaça MD, Georges PC, Sackey B, Uemura M, Janmey PA, Wells RG. Hepatic stellate cells require a stiff environment for myofibroblastic differentiation. Am J Physiol Gastrointest Liver Physiol. 2011;301:G110-G118. [PubMed] [DOI] |
| 6. | Ma J, Li F, Liu L, Cui D, Wu X, Jiang X, Jiang H. Raf kinase inhibitor protein inhibits cell proliferation but promotes cell migration in rat hepatic stellate cells. Liver Int. 2009;29:567-574. [PubMed] [DOI] |
| 7. | Popper H, Uenfriend S. Hepatic fibrosis. Correlation of biochemical and morphologic investigations. Am J Med. 1970;49:707-721. [PubMed] |
| 8. | Pérez-Tamayo R. Cirrhosis of the liver: a reversible disease? Pathol Annu. 1979;14:183-213. [PubMed] |
| 9. | Tarrats N, Moles A, Morales A, García-Ruiz C, Fernández-Checa JC, Marí M. Critical role of tumor necrosis factor receptor 1, but not 2, in hepatic stellate cell proliferation, extracellular matrix remodeling, and liver fibrogenesis. Hepatology. 2011;54:319-327. [PubMed] [DOI] |
| 10. | Dooley S, ten Dijke P. TGF-β in progression of liver disease. Cell Tissue Res. 2012;347:245-256. [PubMed] [DOI] |
| 11. | Jarnagin WR, Rockey DC, Koteliansky VE, Wang SS, Bissell DM. Expression of variant fibronectins in wound healing: cellular source and biological activity of the EIIIA segment in rat hepatic fibrogenesis. J Cell Biol. 1994;127:2037-2048. [PubMed] [DOI] |
| 12. | Bernier I, Tresca JP, Jollès P. Ligand-binding studies with a 23 kDa protein purified from bovine brain cytosol. Biochim Biophys Acta. 1986;871:19-23. [PubMed] [DOI] |
| 13. | Yeung K, Seitz T, Li S, Janosch P, McFerran B, Kaiser C, Fee F, Katsanakis KD, Rose DW, Mischak H. Suppression of Raf-1 kinase activity and MAP kinase signalling by RKIP. Nature. 1999;401:173-177. [PubMed] [DOI] |
| 14. | Klysik J, Theroux SJ, Sedivy JM, Moffit JS, Boekelheide K. Signaling crossroads: the function of Raf kinase inhibitory protein in cancer, the central nervous system and reproduction. Cell Signal. 2008;20:1-9. [PubMed] [DOI] |