修回日期: 2013-03-22
接受日期: 2013-04-12
在线出版日期: 2013-05-08
目的: 研究叶黄素对结肠癌HT29细胞的增殖抑制作用及可能的机制.
方法: 用不同浓度的叶黄素(20、40、80、160 mg/L)和空白对照组(0 mg/L)干预处理培养的HT29细胞24、48、72 h, 采用SRB法检测其对该细胞的增殖抑制作用; 流式细胞仪检测细胞周期; Hoechst33342/PI荧光染色法检测细胞凋亡; Western blot检测磷酸化ERK(phosphorylation of ERK, p-ERK)、磷酸化p38(phosphorylation of p38, p-p38)蛋白表达水平的变化.
结果: 叶黄素能抑制HT29细胞增殖, 且有明显的剂量和时间依赖性. 流式细胞仪检测细胞周期结果显示, 叶黄素(80 mg/L)干预处理HT29细胞48 h后, G0/G1期细胞由58.67%增加至63.23%, 且随药物浓度增加, G0/G1期细胞显著增加, 当叶黄素浓度为160 mg/L时, G0/G1期细胞增加至70.81%, 表明叶黄素可将HT29细胞阻滞在G0/G1期; Hoechst33342/PI荧光染色法检测细胞凋亡结果显示, 叶黄素可诱导HT29细胞凋亡; Western blot 检测结果显示叶黄素可下调p-ERK、上调p-p38蛋白的表达, 有浓度依赖性(P<0.01).
结论: 叶黄素可显著抑制HT29细胞的增殖并诱导其凋亡, 使细胞周期阻滞在G0/G1期; 下调p-ERK蛋白、上调p-p38蛋白的表达可能是其诱导细胞凋亡的重要机制.
核心提示: 叶黄素可显著抑制HT29细胞的增殖并诱导其凋亡, 使细胞周期阻滞在G0/G1期; 下调磷酸化ERK蛋白、上调磷酸化p38蛋白的表达可能是其诱导细胞凋亡的重要机制.
引文著录: 付蕾, 陈晓哲, 张慧娟, 张源渊, 王凌飞, 徐少博, 张玉杰, 王明臣. 叶黄素对人结肠癌HT29细胞增殖的抑制及其机制. 世界华人消化杂志 2013; 21(13): 1239-1244
Revised: March 22, 2013
Accepted: April 12, 2013
Published online: May 8, 2013
AIM: To study the anti-proliferative effect of lutein on human colon cancer HT29 cells and to explore the possible mechanisms involved.
METHODS: HT29 cells were treated with different concentrations of lutein (20, 40, 80, 160 mg/L) for 24, 48 or 72 h. After treatment, cell proliferation was detected by SRB assay, cell cycle progression was analyzed by flow cytometry, cell apoptosis was detected by fluorescence microscopy and Hoechst 33342/PI staining, and the levels of p-ERK and p-p38 proteins were determined by Western blot.
RESULTS: Lutein treatment inhibited the proliferation of HT29 cells in a dose- and time-dependent manner. After treatment of HT29 cells with lutein (80 mg/L) for 48 h, the percentage of cells at G0/G1 phase cells increased from 58.67% to 63.23%, and with the increase in drug concentration, the percentage of cells at G0/G1 phase increased significantly. When the lutein concentration was 160 mg/L, the percentage of cells at G0/G1 phase increased to 70.81%, indicating that lutein arrested HT29 cells in G0/G1 phase. Fluorescence microscopy and Hoechst 33342/PI staining suggested that lutein induced HT29 cell apoptosis in a dose-dependent manner. Western blot analysis showed that lutein down-regulated the expression of p-ERK and up-regulated the expression of p-p38 protein in dose-dependent manner (both P < 0.01).
CONCLUSION: Lutein could significantly inhibit the proliferation of HT29 cells, induce apoptosis, and arrest cell cycle in G0/G1 phase. Down-regulation of p-ERK protein expression and up-regulation of p-p38 protein expression may be important mechanisms responsible for the apoptosis-inducing effect of lutein.
- Citation: Fu L, Chen XZ, Zhang HJ, Zhang YY, Wang LF, Xu SB, Zhang YJ, Wang MC. Mechanisms underlying suppressive effect of lutein on cell proliferation in human colon cancer cell line HT29. Shijie Huaren Xiaohua Zazhi 2013; 21(13): 1239-1244
- URL: https://www.wjgnet.com/1009-3079/full/v21/i13/1239.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i13.1239
结肠癌是一种常见的恶性肿瘤. 随着人们生活方式和膳食结构的改变, 结肠癌的发病率呈逐年上升趋势[1]. 目前结肠癌的主要治疗手段是根治性手术切除, 辅以放疗、化疗等综合治疗, 但是结肠癌手术病例中早期癌比例较低, 术后总体生存率较低, 放疗和化疗会对人体造成一定的不良反应, 而且可能产生化疗耐药性. 因此寻找一种高效低毒的天然植物药物对结肠癌的干预阻断防治具有重要的理论意义和实用价值. 叶黄素(lutein)是存在于膳食中的一种含氧类胡萝卜素, 其作为一种肯定的抗氧化剂, 在预防白内障、黄斑变性、心血管疾病及肿瘤的发生发展等方面有重要的作用[2]. 已有研究表明, 叶黄素对乳腺癌、食管癌、皮肤癌、前列腺癌等多种肿瘤具有抑制作用. 本研究旨在探讨叶黄素对人结肠癌HT29细胞的增殖抑制作用及可能机制, 为叶黄素用于结肠癌的干预防治提供初步的实验依据.
人结肠癌细胞株HT29由郑州大学生物工程系馈赠; 叶黄素由Food Research Program, Agriculture and Agri-Food Canada提供, 用DMSO溶解制成储备液, 使用时稀释到适当浓度; 细胞凋亡荧光Hoechst33342/PI双染试剂盒购自凯基生物公司; complete蛋白酶抑制剂混合片, PhosSTOP磷酸酶抑制剂混合片购自美国Roche公司; β-actin(兔抗人), p-ERK(兔抗人), p-p38(兔抗人)购自Santa Cruz Biotechnology, INC公司.
1.2.1 细胞培养: 将人结肠癌HT29细胞株常规培养于含体积分数为10%灭活小牛血清的RPMI 1640培养基中, 置于37 ℃、5%CO2浓度和饱和湿度的培养箱中培养.
1.2.2 SRB法检测叶黄素对HT29细胞增殖的影响: 取对数生长期的HT29细胞接种于96孔培养板, 调整细胞密度为3×104个/mL, 每孔200 µL, 培养24 h后, 分别加入终浓度为20、40、80、160 mg/L的叶黄素溶液, 同时设DMSO溶剂对照组, 每组6个复孔, 重复3次. 叶黄素分别作用细胞24、48、72 h后SRB染色, 酶标仪515 nm的波长下测得各孔A值. 抑制率(%) = (对照组A值-实验组A值)/对照组A值×100%.
1.2.3 流式细胞仪检测叶黄素对细胞周期的影响: 取对数生长期的HT29细胞, 0.25%胰酶消化分散后, 以1×105个/孔接种于6孔细胞培养板中. 培养24 h贴壁后, 分别加入终浓度为80、160 mg/L的药物, 设DMSO溶剂对照组, 药物作用48 h后, 收集细胞, 1000 r/min离心5 min, PBS洗涤2次, 70%冰乙醇1 mL重悬细胞, 4 ℃固定24 h以上. 依照细胞周期检测试剂盒说明书操作, 12000 r/min离心5 min弃去冰乙醇, PBS洗2次, 加入100 µL 0.1%的Trito X-100, 室温孵育20 min, 20 mg/L Rnase 100 µL, 孵育20 min, 20 mg/L的碘化丙啶(PI) 50 µL, 室温避光标记5 min, 上机检测.
1.2.4 Hoechst33342/PI双染法检测细胞凋亡: 取对数生长期的细胞, 按1×105个/孔接种于6孔培养板中, 常规培养24 h后, 设药物浓度为20、40、80、160 mg/L, DMSO为溶剂对照组, 48 h后, 离心收集细胞, 将105-106个细胞悬浮于1 mL培养基中, 加入10 µL Hoechst 33342染液, 37 ℃孵育10 min, 4 ℃, 1000 r/min离心5 min, 弃上清, 1mL Buffer A悬浮细胞, 加入5 µL PI染液, 室温避光放置10 min后混匀. 荧光显微镜下拍照, 并用尼康NIS-Elements BR图像分析软件进行分析.
1.2.5 Western blot检测p-ERK、p-p38蛋白的表达: 取对数生长期的细胞接种于6孔板中, 次日加入终浓度分别为20、40、80、160 mg/L的叶黄素, 对照组为DMSO溶剂组, 48 h后, 每孔加入90 µL细胞裂解液(RIPA: 磷酸酶抑制剂: 蛋白酶抑制剂 = 100:10:4), 冰上裂解30 min, 然后4 ℃, 12000 r/min离心15 min, 上清液即为总蛋白. BCA蛋白试剂盒定量, 总蛋白与SDS-PAGE蛋白上样缓冲液4:1混合后, 煮沸5 min, 120 V恒压电泳, 300 mA恒流转膜, 一抗(1:2000, 兔抗人p-ERK; 1:1000, 兔抗人p-p38)4 ℃孵育过夜, 二抗(1:10000, HRP标记的羊抗兔抗体), 室温条件下孵育2 h, ECL发光剂发光, 显影, 定影. 并用软件Image proplus 6.0比较条带的积分光密度(integrated optical density, IOD).
统计学处理 实验数据用mean±SD表示, 采用SPSS17.0软件进行统计分析. 多组间比较采用单因素方差分析, 组间比较采用LSD检验, 检验水准α = 0.05, P<0.05为有统计学意义, P<0.01为有显著性差异.
叶黄素(浓度为40、80、160 mg/L)作用HT29细胞72 h后能显著抑制细胞的增殖, 且呈现时间、剂量依赖性(P<0.01, 表1).
| 分组 | 24 h | 48 h | 72 h | |||
| A值 | 抑制率(%) | A值 | 抑制率(%) | A值 | 抑制(%) | |
| 对照组 | 0.217±0.029 | - | 0.341±0.049 | - | 0.658±0.052 | - |
| 20 mg/L组 | 0.214±0.032 | 1.51 | 0.330±0.037 | 3.39 | 0.604±0.071 | 8.14 |
| 40 mg/L组 | 0.206±0.053 | 5.14 | 0.263±0.022a | 22.96 | 0.504±0.075b | 23.35 |
| 80 mg/L组 | 0.152±0.031b | 30.21 | 0.224±0.021b | 34.44 | 0.307±0.039b | 53.36 |
| 160 mg/L组 | 0.124±0.010b | 43.10 | 0.108±0.024b | 68.34 | 0.123±0.019b | 81.37 |
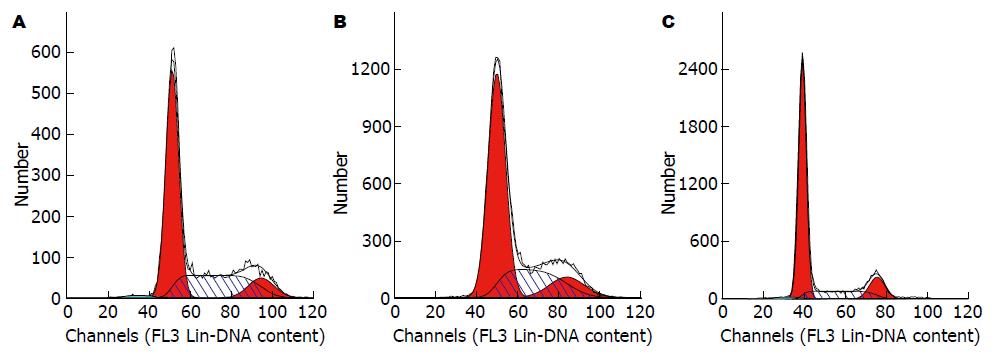
流式细胞术检测结果显示, 当叶黄素(80 mg/L)干预处理HT29细胞48 h后, G0/G1期细胞由58.67%增加至63.23%, 且随药物浓度增加, G0/G1期细胞显著增加, 当叶黄素浓度为160 mg/L时, G0/G1期细胞增加至70.81%, 表现显著的G1期阻滞(P<0.01). 同时, 随叶黄素浓度增加, S期细胞显著减少, G2/M期细胞变化不明显. 结果表明叶黄素可阻滞HT29细胞于G0/G1期(图1, 表2).
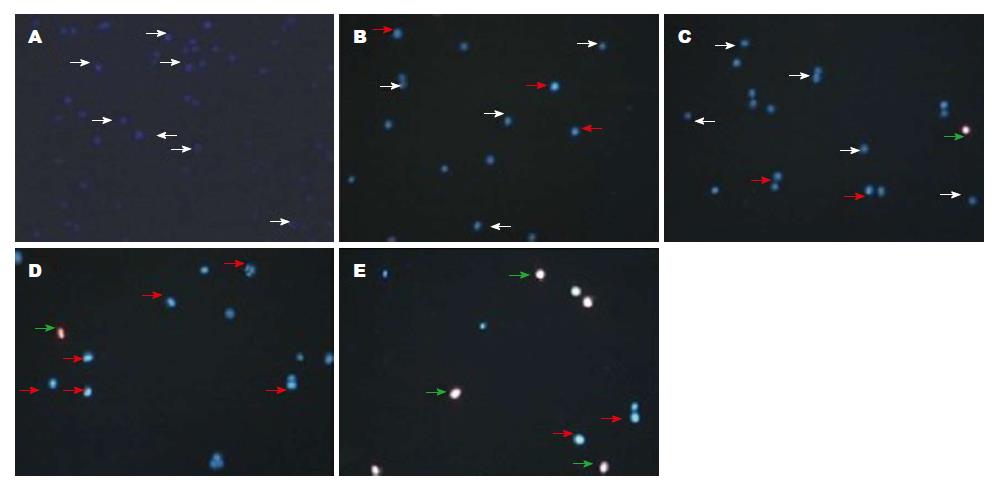
Hoechst33342/PI染色后, 根据细胞被染成不同的颜色分辨出正常细胞、凋亡细胞和坏死细胞, 正常细胞为低蓝光/低红光, 早期凋亡细胞为高蓝光/低红光, 晚期凋亡或坏死细胞为低蓝光/高红光. 由图1和表2结果显示, 对照组显示低蓝光/低红光, 为正常细胞, 当药物浓度为80 mg/L时, 显示高蓝光/低红光, 说明大量细胞凋亡, 坏死细胞不明显, 160 mg/L显示低蓝光/高红光, 说明晚期凋亡和坏死细胞都增多. 随着药物浓度的增加, 荧光强度逐渐增强, 结果表明, 叶黄素可诱导HT29细胞凋亡, 且有剂量依赖性(图2, 表3).
对照组、20、40、80、160 mg/L叶黄素对HT29细胞p-ERK蛋白表达的相对灰度值分别为: 0.912、0.644、0.517、0.361、0.079. p-p38蛋白的相对灰度值分别为: 0.194、0.218、0.386、0.749、0.856. 结果显示, 不同浓度的叶黄素处理HT29细胞48 h后, p-ERK的蛋白水平均显著降低(P<0.01), p-p38蛋白水平升高(P<0.01). 叶黄素可明显抑制ERK的磷酸化和激活p38的磷酸化, 且有良好的剂量依赖关系(图3).
叶黄素是含氧类胡萝卜素. 流行病学调查表明, 饮食中叶黄素的摄入与多种肿瘤的发生呈负相关. Slattery等[3]研究表明叶黄素能降低结肠癌的发病率. 本研究结果亦显示, 叶黄素对结肠癌HT29细胞亦有显著的增殖抑制作用, 且呈时间和剂量依赖性. 进一步对叶黄素的增殖作用机制分析表明, 叶黄素可使HT29细胞周期阻滞在G0/G1期. 近年研究发现, 细胞周期调控异常与肿瘤密切相关[4]. 在细胞增殖周期中, G0/G1期、S期和G2/M期之间存在着影响细胞周期进行的调控点, 而药物可能通过影响这些调控点来影响细胞的增殖, 不同的药物可影响细胞周期的不同阶段[5,6]. 叶黄素对细胞周期的阻滞可能是其对HT29细胞增殖抑制作用的机制之一. 细胞凋亡是由死亡信号诱发的受调控的一种细胞死亡过程, 是一种细胞生理性死亡的方式. 凋亡与增殖密切相关, 细胞的增殖和凋亡调节失控是肿瘤发生的主要原因[7]. 本研究结果显示, 随叶黄素剂量的增加, 细胞凋亡和坏死数目增多, 荧光强度增强, 表明叶黄素可剂量依赖的诱导HT29细胞凋亡, 可能是叶黄素抑制HT29细胞增殖的另一重要机制.
MAPK信号途径介导真核细胞增殖、分化及凋亡等多种生物学反应[8], 是研究较多的蛋白激酶级联通路, 主要有3个成员: ERK、p38和JNK/SAPK. 研究表明, 许多刺激因子, 如表皮生长因子可通过Ras/Raf/MEK/ERK途径磷酸活化ERK, 活化的ERK(p-ERK)将胞浆内信号导入胞核, 作用于c-Jun、c-fos、c-Myc等转录因子, 促进多种癌基因及细胞周期调节相关基因的表达[9]. 病理条件下, ERK信号通路的过渡激活与肿瘤细胞的恶性增殖密切相关, 在乳腺癌、肝癌等多种肿瘤中ERK具有高水平的磷酸化[10]. 本研究表明叶黄素可下调HT29细胞ERK蛋白的磷酸化水平. p38信号通路是MAPK通路的一个重要分支. 在环境应激因子和凋亡等信号作用下, p38通路被激活成磷酸化的p38[11,12]. 研究表明, p38MAPK可通过调节p53、Bax、caspase-9和caspase-3等因子启动抗增殖及凋亡作用[13]. 许多药物包括白藜芦醇[14]、类视黄醇等, 可通过活化p38介导肿瘤细胞的死亡启动过程. 磷酸化的p38MAPK能通过激活p53、ATF-2、CHOP-1和其他转录因子导致细胞周期停滞、凋亡等[15]. 本研究结果表明, 叶黄素可上调HT29细胞的p38蛋白的磷酸化水平, 且有剂量依赖性. 综合上述结果, 叶黄素可显著抑制结肠癌HT29细胞增殖, 阻滞细胞周期在G0/G1期, 并可诱导HT29细胞凋亡, 且其机制可能是通过下调ERK蛋白的磷酸化水平, 上调p38蛋白磷酸化水平而介导的. 但是细胞内凋亡相关的信号通路存在复杂的交叉对话, 叶黄素导致ERK和p38MAPK蛋白表达变化的始动信号以及其下游信号的表达如何, 有待深入研究.
结肠癌是常见的消化系恶性肿瘤, 常规的治疗方法有手术切除, 放疗和化疗, 这些方法治愈率低, 而且给人体造成一定的不良反应和产生化疗药耐性, 因此寻找一种高效低毒的天然植物药物对结肠癌的治疗具有重要的临床意义.
白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科; 周晓武, 副主任医师, 中国人民解放军空军总医院普外科
叶黄素是一种含氧类胡萝卜素, 在抗氧化、预防白内障、延缓动脉硬化以及抗癌等方面有重要作用, 研究表明, 叶黄素对乳腺癌、结肠癌、食管癌、前列腺癌等多种癌症具有抑制作用.
磷酸活化的ERK可介导c-Jun、c-fos、AP-1等转录因子的活化, 参与细胞的增殖、分化、细胞骨架的构建、细胞形态维持和细胞凋亡等多种生物学反应. p38MAPK可通过调节p53、Bax、caspase-9和caspase-3等因子启动抗细胞增殖及凋亡作用.
本文从MAPK信号通路中ERK和p38磷酸化的表达变化, 来观察叶黄素抑制结肠癌HT29细胞增殖及诱导细胞凋亡的作用, 并探讨其可能的分子机制.
下调ERK的磷酸化水平和/或上调p38的磷酸化水平, 可能是叶黄素抑制结肠癌HT29细胞增殖并诱导细胞凋亡的机制之一, 本研究为进一步研究叶黄素抗肿瘤的作用机制提供依据.
本文研究的有关叶黄素与结肠癌关系的研究目前国内报道甚少, 研究本身具有重要的研究意义. 本文设计严密, 结果可靠, 结论可信, 讨论得当.
编辑: 田滢 电编: 鲁亚静
| 2. | Roberts RL, Green J, Lewis B. Lutein and zeaxanthin in eye and skin health. Clin Dermatol. 2009;27:195-201. [PubMed] [DOI] |
| 3. | Slattery ML, Benson J, Curtin K, Ma KN, Schaeffer D, Potter JD. Carotenoids and colon cancer. Am J Clin Nutr. 2000;71:575-582. [PubMed] |
| 4. | Rodriguez-Nieto S, Zhivotovsky B. Role of alterations in the apoptotic machinery in sensitivity of cancer cells to treatment. Curr Pharm Des. 2006;12:4411-4425. [PubMed] [DOI] |
| 7. | Chlapek P, Redova M, Zitterbart K, Hermanova M, Sterba J, Veselska R. Enhancement of ATRA-induced differentiation of neuroblastoma cells with LOX/COX inhibitors: an expression profiling study. J Exp Clin Cancer Res. 2010;29:45. [PubMed] [DOI] |
| 8. | Deng W, Sui H, Wang Q, He N, Duan C, Han L, Li Q, Lu M, Lv S. A Chinese herbal formula, Yi-Qi-Fu-Sheng, inhibits migration/invasion of colorectal cancer by down-regulating MMP-2/9 via inhibiting the activation of ERK/MAPK signaling pathways. BMC Complement Altern Med. 2013;13:65. [PubMed] [DOI] |
| 9. | Cagnol S, Chambard JC. ERK and cell death: mechanisms of ERK-induced cell death--apoptosis, autophagy and senescence. FEBS J. 2010;277:2-21. [PubMed] [DOI] |
| 10. | Meier F, Schittek B, Busch S, Garbe C, Smalley K, Satyamoorthy K, Li G, Herlyn M. The RAS/RAF/MEK/ERK and PI3K/AKT signaling pathways present molecular targets for the effective treatment of advanced melanoma. Front Biosci. 2005;10:2986-3001. [PubMed] |
| 11. | Kim BJ, Ryu SW, Song BJ. JNK- and p38 kinase-mediated phosphorylation of Bax leads to its activation and mitochondrial translocation and to apoptosis of human hepatoma HepG2 cells. J Biol Chem. 2006;281:21256-21265. [PubMed] [DOI] |
| 12. | 李 宁, 陈 娟, 白 研, 白 文元. p38MAPK信号转导通路在EGF诱导食管腺癌SEG-1细胞表达u-PA中的作用. 世界华人消化杂志. 2012;20:1458-1462. [DOI] |
| 13. | Yu E, Ahn YS, Jang SJ, Kim MJ, Yoon HS, Gong G, Choi J. Overexpression of the wip1 gene abrogates the p38 MAPK/p53/Wip1 pathway and silences p16 expression in human breast cancers. Breast Cancer Res Treat. 2007;101:269-278. [PubMed] [DOI] |