修回日期: 2013-04-05
接受日期: 2013-04-12
在线出版日期: 2013-05-08
目的: 观察肠吉泰对腹泻型肠易激综合征(irritable bowel syndrome, IBS)大鼠下丘脑、结肠P物质mRNA表达的影响, 探讨其治疗机制.
方法: ♂SD大鼠60只, 随机分为正常组、模型组、肠吉泰低、中、高剂量组和得舒特组. 除正常组外各组大鼠予束缚应激加大黄泻下及结直肠扩张的造模方法, 并予以相应药物治疗. 实验过程中观察各组大鼠大便性状和次数; 大鼠处死后取下丘脑及结肠标本用RT-PCR半定量检测P物质mRNA的表达.
结果: 与正常组比较, 模型组大鼠的下丘脑、结肠P物质mRNA表达均有升高(0.988±0.192 vs 0.606±0.151, P<0.01; 1.042±0.293 vs 0.768 ±0.116, P>0.05); 与模型组比较, 肠吉泰治疗组大鼠P物质mRNA表达下调(下丘脑: 0.678±0.103, 0.733±0.103 vs 0.988±0.192, P<0.01; 结肠: 0.546±0.278, 0.500±0.260 vs 1.042±0.293, P<0.01; 0.731±0.199 vs 1.042±0.293, P<0.05). 得舒特组、肠吉泰高、中剂量组大便次数及性状明显改善(14、13、17 vs 24, P<0.05), 且肠吉泰与得舒特组比较疗效无显著差异.
结论: 肠吉泰通过调节大鼠下丘脑、结肠P物质mRNA表达量, 改善内脏痛觉敏感状态, 及其对束缚应激反应导致肠动力的紊乱.
核心提示: 肠吉泰治疗腹泻型肠易激综合征(irritable bowel syndrome, IBS)经长期临床验证取得良好疗效, 能有效改善患者腹泻、腹痛症状, 前期实验研究已发现肠吉泰能调节腹泻型IBS大鼠内脏高敏感性. 本文进一步明确肠吉泰对P物质(substance P)、肥大细胞、5-羟色胺(5-hydroxy tryptamine)等内脏敏感性相关指标的影响具有一致性.
引文著录: 丛军, 蔡淦, 林江, 张正利. 肠吉泰对腹泻型肠易激综合征大鼠下丘脑、结肠P物质mRNA表达的影响. 世界华人消化杂志 2013; 21(13): 1234-1238
Revised: April 5, 2013
Accepted: April 12, 2013
Published online: May 8, 2013
AIM: To detect the expression of substance P (SP) mRNA in the colonic mucosa and hypothalamus of rats with diarrhea-predominant irritable bowel syndrome (IBS-D), and to assess the therapeutic effect of traditional Chinese medicine Changjitai decoction on visceral hypersensitivity in rats with IBS-D.
METHODS: Sixty male Sprague-Dawley rats were equally and randomly divided into six groups: normal group, model control group, dicetel group, low-, medium-, and high-dose Changjitai groups. IBS-D was induced by restraint stress for 2 wk combined with intragastric administration of 2 mL of Radix Rhizoma Rhei leachate from the third day in rats of all groups except the normal group. After treatment with corresponding drug for 2 wk, rats in the model group and treatment groups underwent colorectal distention immediately and then killed. The changes in defecation were monitored by measuring fecal pellets. The expression of SP mRNA in the hypothalamus and colon was detected by RT-PCR.
RESULTS: In the model control group, the frequency of defecation increased obviously compared to the normal group, and the characteristics of stools deteriorated simultaneously. The expression of SP mRNA in the hypothalamus and colon was significantly increased in the model group compared to the normal group (0.988 ± 0.192 vs 0.606 ± 0.151, P < 0.01; 1.042 ± 0.293 vs 0.768 ± 0.116, P < 0.05). After treatment with Changjitai decoction or diceter, the frequency of defecation and the characteristics of stools ameliorated significantly (13, 17, 14 vs 24, P < 0.05). There were no significantly differences in the above parameters between the Changjitai groups and dicetel group. SP mRNA levels were significantly reduced in the Changjitai decoction groups compared to the model control group (hypothalamus: 0.678 ± 0.103, 0.733 ± 0.103 vs 0.988 ± 0.192, P < 0.01; colon: 0.546 ± 0.278, 0.500 ± 0.260 vs 1.042 ± 0.293, both P < 0.01; 0.731 ± 0.199 vs 1.042 ± 0.293, P < 0.05).
CONCLUSION: Changjitai decoction relieves diarrhea symptoms, ameliorates the stress state, inhibits bowel motility, and reduces visceral hypersensitivity in rats with IBS-D possibly by modulating the expression of SP mRNA in the hypothalamus and colon.
- Citation: Cong J, Cai G, Lin J, Zhang ZL. Effect of Changjitai decoction on expression of substance P mRNA in the colonic mucosa and hypothalamus of rats with diarrhea-predominant irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2013; 21(13): 1234-1238
- URL: https://www.wjgnet.com/1009-3079/full/v21/i13/1234.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i13.1234
肠易激综合征(irritable bowel syndrome, IBS)是一种常见的胃肠功能紊乱性疾病, 其发病机制目前尚不十分明确, 临床上缺乏有效的针对性药物治疗手段. 上海市名中医蔡淦教授的经验方肠吉泰治疗腹泻型IBS, 经临床验证取得良好疗效, 能有效改善患者的腹泻、腹痛症状. 本研究基于土虚木乘、抑木扶土的中医药理论指导, 以腹泻型IBS肝郁脾虚证模型大鼠为对象, 使用得舒特治疗作对照, 观察不同剂量肠吉泰对模型大鼠下丘脑及结肠P物质(substance P, SP)mRNA表达的影响, 并探讨其机制.
♂SD大鼠60只, SPF级, 体质量200 g±10 g, 由西普尔-必凯实验动物有限公司提供, 许可证号: SCXK(沪)2003-0002, 合格证号: 0023082. 饲养于曙光医院清洁级实验动物房, 恒定温度湿度, 室内温度控制在20 ℃-25 ℃. 饲养期间每日8:00 AM-4:00 PM给予恒定灯光光线照射, 动物自由摄食及饮水. 实验前2 wk动物予以适应实验环境. TRIzol Reagent(Invitrogen), 购自上海普飞生物技术有限公司; RevertAid First Stand CDNA Synthesis Kit及2×PCR Master Mix(Fermentas)购自晶美生物工程有限公司; 溴化乙锭(EB)溶液、Agarose(LowEEO)购自北京秀百生物科技有限公司; 氯仿、异丙醇、无水乙醇(均分析纯级)、DEPC购自上海鼎国生物技术有限公司; 生大黄(产地甘肃)、肠吉泰原药等均购自上海曙光医院中、西药房. 得舒特(匹维溴胺)50 mg/粒(批号: 0020, 法国苏威制药)购自曙光国大药房. 隔水式电热恒温培养箱(PYX-DHS-40×50, 上海跃进医疗器械厂), PCR仪(PTC-200, 美国BIO-RAD DNA Engine); 紫外可见分光光度计(752s, 上海第三分析仪器厂); 电泳仪和电泳槽(DYY-7C, 北京市六一仪器厂); 低温高速离心机(5417R, 德国eppendorf centrifuge); 凝胶成像系统(FR-200, 复日科技紫外与可见光分析装置).
1.2.1 药物制备: 肠吉泰方由陈皮、炒防风、炒白术、炒白芍、炙乌梅等药味组成, 全方生药含量48 g, 按公式换算[1], 煎成浓度分别为2.0 g/mL(大剂量)、1.0 g/mL(中剂量)、0.5 g/mL(小剂量)的药液. 生大黄2 kg以开水浸泡2 h后, 浸出液过滤后经低温旋蒸浓缩成200%的溶液, 每毫升含生药2 g, 过滤备用. 得舒特50 mg/粒, 据大鼠与人有效剂量换算, 制成浓度为3.12 mg/mL混悬液. 以上药物均由曙光医院中药制剂中心(国家中医药管理局三级实验室)制备后冷藏保存.
1.2.2 动物模型制备及分组治疗: 将60只大鼠随机分为6组, 每组10只, 即正常组、模型组、肠吉泰高、中、低剂量治疗组和得舒特组. 正常组和模型组大鼠每日予生理盐水1 mL灌胃1次; 肠吉泰高、中、低剂量治疗组大鼠分别予以相应浓度的肠吉泰煎剂1 mL(生药含量分别为2.0、1.0、0.5 g)灌胃, 1次/d; 得舒特组大鼠每日予得舒特混悬液1 mL(含生药3.12 mg)灌胃1次. 每日灌胃30 min后, 除正常组外各组大鼠均予束缚应激造模, 根据Williams等[2]的方法改良: 用绷带束缚大鼠前肩、前上肢及胸部, 限制前肢搔抓头面部, 但不控制其活动. 每日持续束缚1 h, 共2 wk. 造模第3天[3,4]开始, 大鼠解束缚后予200%生大黄溶液2 mL灌胃, 1次/d. 造模治疗期间记录大鼠的体质量、大便性状及行为学变化. 造模第14天大黄灌胃后, 各组大鼠均予禁食, 20 h后乙醚麻醉; 除正常组外各组大鼠进行结直肠扩张[4,5], 维持压力≥60 mmHg(不超过70 mmHg), 持续60 s, 间断放空球囊2 min, 反复10次. 结直肠扩张结束大鼠脱颈椎处死. 正常组大鼠不经结直肠扩张, 直接脱颈椎处死.
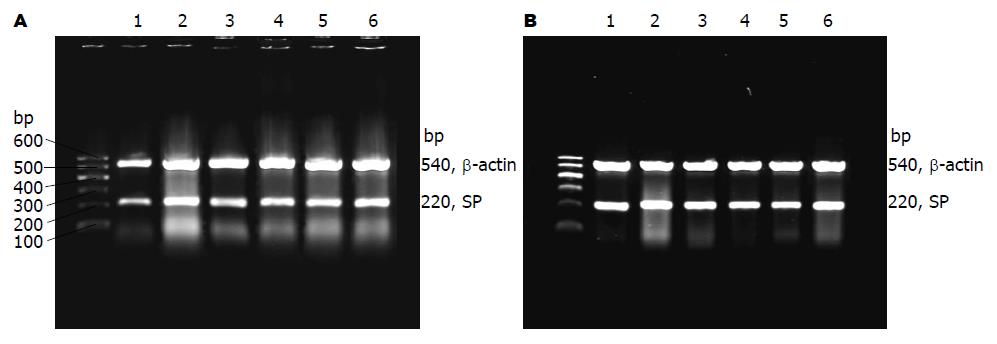
1.2.3 观察指标及检测方法: (1)大鼠行为学、体质量及大便次数、性状观察[6]: 造模期间观察大鼠大便性状及行为学变化. 记录大鼠造模前后体质量变化. 造模结束后, 单只大鼠关入钢丝笼1 h, 笼下垫滤纸, 观察其间大鼠大便次数和性状(成形便、软便、稀便、水样便的频数). 以粪便污染滤纸形成的污迹直径分级. <1 cm为成形便, 1-3 cm为软便, 3-5 cm为稀便, ≥5 cm为水样便; (2)大鼠下丘脑及结肠SP mRNA表达的测定(RT-PCR法): 根据文献报道设计[7], 由上海英骏生物科技有限公司合成引物的DNA序列如下: SP上游引物: 5'-ATGAAAATCCTCGTGGCGGT-3'; SP下游引物: 5'-AATGGGCAAACGGGATGCTG-3'; β-actin上游引物: 5'-GTGGGGCGCCCCAGGCACCA-3'; β-actin下游引物: 5'-CTTCCTTAATGTCACGCACGATTTC-3'. 采用TRIzol Reagent按操作程序提取下丘脑总RNA. 用紫外分光光度计检测260 nm、280 nm波长下的光亮度值, 计算总RNA的浓度及纯度. 将A260/280 = 1.8-2.0的用于实验. 取2 μL RNA据RT试剂盒操作步骤进行RT反应合成cDNA. SP反应体系20 μL, 反应条件: 94 ℃变性, 56 ℃退火、72 ℃延伸, 35 cycles. 扩增片段长度: 220 bp. β-actin基因扩增反应体系25 μL, 反应条件94 ℃变性、55 ℃退火、72 ℃延伸, 循环数35 cycles; 扩增片段长度: 540 bp. PCR产物行2%琼脂糖凝胶电泳, 电压70 V. 凝胶成像系统对电泳条带进行光密度扫描. 以CRH扩增产物的吸光度与β-actin的吸光度的比值作为mRNA水平的参数, 对扩增样品的mRNA表达进行半定量分析.
统计学处理 连续型变量以mean±SD表示, 组间比较采用SPSS13.0单因素方差分析(One-Way ANOVA), 经正态分布检验, 如果方差齐者采用LSD、SNK法, 方差不齐采用Tamhane's T2法. 单项有序变量比较采用秩和检验.
实验前各组动物活动、饮食正常, 造模过程中除正常组外的各组大鼠均出现少动蜷卧、嗜睡、毛色晦暗、进食减少、便溏、体质量减轻等脾虚证表现. 同时表现出对外界刺激兴奋减少、淡漠、情绪不稳定、反应迟缓等肝郁证表现. 以上症状在模型组表现更加突出. 与正常组比较, 模型大鼠1 h内大便次数显著增加、大便性状显著不成形(P<0.01). 与模型组比较得舒特组和肠吉泰高、中剂量组大鼠大便次数显著减少、性状显著改善(P<0.05, 表1).
与正常组比较, 其他各组大鼠下丘脑的SP mRNA表达均有升高, 其中模型组大鼠较正常组有极显著性差异(P<0.01), 肠吉泰低剂量组较正常组有显著差异(P<0.05), 而与模型组比较, 得舒特组和肠吉泰高、中剂量组的SP mRNA表达均降低, 有极显著性差异(P<0.01), 各治疗组之间比较无显著差异(P>0.05, 图1).
大鼠结肠的SP mRNA表达在模型组及得舒特组均有升高趋势, 但与正常组比较无显著差异(P>0.05). 各肠吉泰治疗组大鼠的结肠SP mRNA表达较正常组及模型组均有不同程度的降低, 其中肠吉泰高、中剂量组SP表达量与模型组比较明显降低, 具有显著性差异(P<0.01). 肠吉泰低剂量组与模型组有显著性差异(P<0.05), 并且肠吉泰高、中剂量组结肠SP与得舒特组比较亦有显著降低(P<0.05), 但各治疗组与正常组比较均无显著差异(P>0.05, 表2).
中医学根据临床表现, 将IBS归属于"泄泻"、"腹痛"、"郁证"等范畴, 主要病机是土虚木乘、肝脾不和. 诚如《医方考》所云: "泻责之于脾, 痛责之于肝, 肝责之于实, 脾责之于虚, 脾虚肝实, 故令痛泻". 故而对本病的治疗多从抑肝扶脾着手. 中医药在治疗这一病证中有着悠久的历史, 优势明显, 我院上海市首届名中医蔡淦教授治疗IBS的经验方肠吉泰, 即是从治疗这一病证的经典方剂-痛泻要方发展而来, 根据"痛责之肝; 肝责之实"的理论, 加入甘草、乌梅两味药以柔肝缓急, 甘草配芍药即《伤寒论》止痛名方芍药甘草汤, 而乌梅味酸, 入肝, 合甘草酸甘化阴亦可益肝阴, 全方以柔肝健脾, 缓急止痛为法, 治疗腹泻型IBS取得良好疗效[8].
脑肠肽是一类同时存在于中枢神经系统和肠神经系统的胃肠肽类激素, 对胃肠运动和分泌起重要的调节作用. SP是第一个被发现的脑肠肽, 为速激肽家族中一个具有11个氨基酸的多肽, 主要分布于肠肌间神经丛和黏膜下神经丛, 储存于细的初级传入神经纤维内, 在细纤维受到刺激时可在传入神经的中枢和外周端末梢释放, 一方面参与痛觉信息的传递, 另一方面通过与其高亲和力受体(neurokonin1, NK1)结合对靶细胞发挥生物效应-调节胃肠道动力、腺体的分泌、血管渗透性以及疼痛刺激的敏感性, 因此被认为作为一种神经递质或调质在中枢和外周起作用[9-11]. 目前多数学者认为, SP是第一级伤害性传入纤维末梢释放的兴奋性神经递质, 在神经系统中, SP作为一种神经递质调节因子发挥作用, 对消化系平滑肌有强烈的刺激作用, 可增强胃肠蠕动[12]. 研究表明[13]应用SP和NK1激动剂能显著增加大鼠的内脏敏感性, 促进粪便排泄. 张瑜等[14]发现, SP阳性表达主要集中于结肠的肌肉纤维之间、结肠黏膜下层、腺体周围, 间质中, 胞浆着色, 在IBS患者结肠组织中的SP分布在愈近结肠腺体时愈加丰富、强度增强, 提示SP与结肠分泌功能有关. 本实验发现, 模型组大鼠下丘脑及结肠组织中的SP mRNA的表达量较正常组均有升高趋势(其中下丘脑P<0.05、结肠P>0.05), 而高、中剂量肠吉泰的肠吉泰对其有明显下调作用(P<0.05、P<0.01), 而且这一结果与各组大鼠排便次数及粪便性状的变化一致. 因此推测认为肠吉泰能通过对腹泻型IBS肝郁脾虚证模型大鼠SP表达的调节, 发挥调节神经内分泌及胃肠道运动的作用, 并改善腹泻型IBS的内脏敏感状态. 陈晓敏等[15]研究IBS患者结肠黏膜中与痛觉和内脏高敏感相关的辣椒素受体VR1、SP和肥大细胞的变化,发现IBS患者乙状结肠辣椒素受体VR1、回盲部和乙状结肠SP免疫阳性反应细胞以及回盲部肥大细胞数量显著多于正常对照组, 且腹泻型IBS与便秘型IBS组间无明显差异, 并推测三者可能参与了IBS内脏高敏感的发生机制. 肖亚等[16]认为, SP可激活血小板释放5-羟色胺(5-hydroxy tryptamine, 5-HT), 激活肥大细胞释放组胺, 5-HT和组胺又能促使感觉神经末梢释放SP, 降低疼痛和感觉阈值. SP可能以循环激素的方式作用于乙状结肠平滑肌, 使其运动增强, 引起腹泻. 而我们既往的研究亦表明[17], 肠吉泰能调节腹泻性IBS大鼠结肠黏膜肥大细胞的稳定性, 降低结肠5-HT表达量, 与本实验中SP表达的变化相一致. 国内外研究表明[18-20]内脏高敏感性可能是IBS患者多种症状的原因, 调节IBS患者内脏感觉可能为IBS的治疗带来新途径, 而肠吉泰的药物组成与配伍起到柔肝缓急的作用, 从现代医学研究的角度分析, 正是调节内脏高敏感性的有力佐证.
肠易激综合征(irritable bowel syndrome, IBS)的临床表现为腹痛或腹部不适伴排便习惯改变, 并且常规检查未发现可以解释上述症状的胃肠道功能性疾病, 其发病机制涉及胃肠动力、内脏感觉、炎症、感染、饮食、遗传、脑-肠轴神经内分泌等多个因素.
刘占举, 教授, 同济大学附属上海市第十人民医院; 范恒, 主任医师, 教授, 博士生导师, 华中科技大学同济医学院附属协和医院中西医结合科
近期许多观点认为, 以感觉异常和动力改变为特征的内脏高敏感性成为IBS的特征性指标, 调节IBS患者内脏感觉为IBS的治疗带来新途径.
陈晓敏等研究IBS患者结肠黏膜中与痛觉和内脏高敏感相关的辣椒素受体VR1、P物质(substance P, SP)和肥大细胞的变化, 发现IBS患者乙状结肠辣椒素受体VR1、回盲部和乙状结肠SP免疫阳性反应细胞以及回盲部肥大细胞数量显著多于正常对照组, 且腹泻型IBS与便秘型IBS组间无明显差异, 并推测三者可能参与了IBS内脏高敏感的发生机制.
本课题旨在探索中药复方肠吉泰治疗腹泻型IBS的疗效机制. 结果表明肠吉泰能下调D-IBS大鼠下丘脑、结肠SP mRNA表达量, 改善内脏痛觉敏感状态.
本文研究了肠吉泰中药对腹泻性IBS大鼠模型中SP表达的影响和临床疗效, 为探讨中药的作用机制有重要理论意义.
编辑: 田滢 电编: 鲁亚静
| 1. | 陈 奇. 中药药理研究方法学. 第2版. 北京: 人民卫生出版社 2006; 31. |
| 2. | Williams CL, Villar RG, Peterson JM, Burks TF. Stress-induced changes in intestinal transit in the rat: a model for irritable bowel syndrome. Gastroenterology. 1988;94:611-621. [PubMed] |
| 5. | 郭 玉婷, 李 延青, 左 秀丽, 郭 宾, 张 海燕, 卢 雪峰, 李 君曼. 肠易激综合征内脏感觉过敏动物模型的建立. 胃肠病学和肝病学杂志. 2003;12:332-335. |
| 9. | Holzer P, Holzer-Petsche U. Tachykinin receptors in the gut: physiological and pathological implications. Curr Opin Pharmacol. 2001;1:583-590. [PubMed] |
| 13. | Okano S, Nagaya H, Ikeura Y, Natsugari H, Inatomi N. Effects of TAK-637, a novel neurokinin-1 receptor antagonist, on colonic function in vivo. J Pharmacol Exp Ther. 2001;298:559-564. [PubMed] |